有关Ksp考向的归类解析与方法指导
江苏省响水中学(224600)
李宗来●
有关Ksp考向的归类解析与方法指导
江苏省响水中学(224600)
李宗来●
溶度积Ksp是新课程改革以来高考新增的高频考点,本文就2015年高考中有关Ksp的考向结合最新考纲进行归类解析,并在此基础上总结解题的方法与指导,以期在备战2016年的高考时使我们的复习更有针对性.
一、根据沉淀转化来比较Ksp大小
例1 下列实验中,对应的现象以及结论都正确是( ).
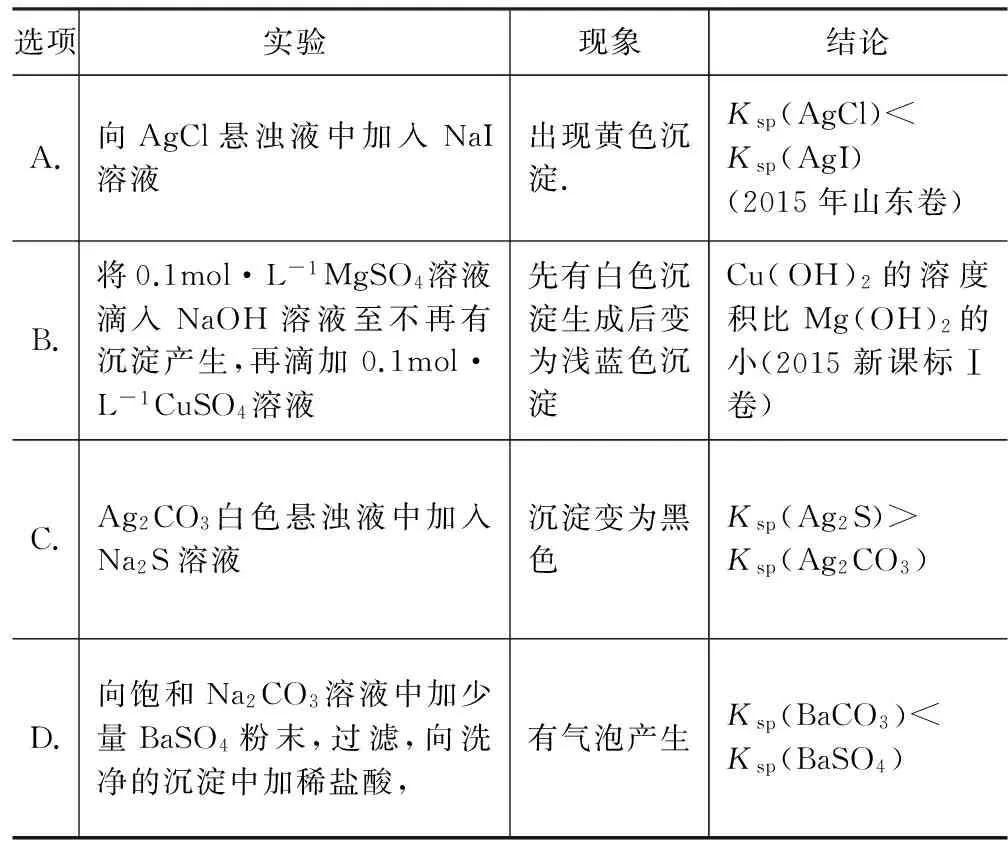
选项实验现象结论A.向AgCl悬浊液中加入NaI溶液出现黄色沉淀.Ksp(AgCl) 解析 向AgCl悬浊液中加入NaI溶液出现黄色沉淀说明沉淀由AgCl转化为AgI,故Ksp(AgI) 变式练习 例2 下列有关说法正确的是( ). A.在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 B.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度 C.碳酸钠溶液显碱性,可用作锅炉除垢时CaSO4沉淀的转化剂 D.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS) 方法指导 对于沉淀的转化,结构类型相同的难溶物Ksp大的易转化为Ksp小的,而且肯定能发生,而相反的过程则有可能实现,这要受到所需试剂浓度是否达到条件的限制.对于分子结构类型相同物质可由Ksp直接比较溶解度大小,一般是Ksp越小溶解度越小,但对于化学式类型不同,Ksp小的溶解度有可能大,要通过计算比较. 例3 (2015全国Ⅱ卷,节选)用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解,铁变为____,若上述过程不加H2O2后果是____,原因是____. 化合物Zn(OH)2Fe(OH)2Fe(OH)3Ksp近似值10-1710-1710-39 解析 加入稀硫酸和双氧水,双氧水具有强氧化性,溶解后铁变为Fe3+.由于Fe(OH)2和Zn(OH)2的溶度积常数接近,因此在沉淀Zn2+的同时Fe2+也沉淀,导致生成的Zn(OH)2不纯,无法分离开Zn2+和Fe2+. 变式练习 例4 (2015山东卷,节选)毒重石的主要成分BaCO3(含Ca2+等杂质),实验室利用毒重石制备BaCl2·2H2O,加入H2C2O4时应避免过量,原因是____. 已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9 解析 根据Ksp(BaC2O4)>Ksp(CaC2O4),故加H2C2O4时Ca2+转化为CaC2O4沉淀,若H2C2O4过量,根据Ksp(BaC2O4)=1.6×10-7,则会产生BaC2O4沉淀,BaCl2·2H2O产品的产量减少. 答案:Fe3+;Mg(OH)2、Ca(OH)2;加入H2C2O4过量,会产生BaC2O4沉淀,BaCl2·2H2O产品的产量将会减少. 方法指导 对于化学式类型相同,Ksp相近的两者物质离子在沉淀过程中极易同时产生沉淀而混合,这样致使制的物质不纯,故在实际操作时,应将杂质离子进行转化,如Fe2+转化为Fe3+,拉大Ksp差值,这样便于除杂同时也防止产品产量的减少. 例5 (2015海南卷,节选)已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为____mol·L-1, 答案:1.8×10-7 变式练习 答案:4.7×10-7 方法指导 对于根据Ksp来计算反应后或者混合后的某离子的浓度或比值,首先要能熟练地写出Ksp的表达式等于各个离子的指数次方的乘积,对于仅混合后某离子浓度的计算要注意溶液体积的变化,因为体积改变离子的浓度也相应的改变,对于混合同时反应的离子浓度计算要注意反应的过量与不足,同时也要注意溶液体积的变化. 例7 (2015广东卷,节选)常温下,若溶液中c(Mg2+)小于5×10-6mol·L-1,则溶液的pH大于____[Mg(OH)2的Ksp=5×10-12]. 解析 根据Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-),c2(OH-) =5×10-12/5×10-6,得c(OH-)= 10-3mol·L-1, pH=11.由于溶液I中c(Mg2+)<5×10-6mol·L-1,所以溶液pH>11;答案:11 变式练习 例8 (2015江苏卷,节选)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为____. 解析 氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)<1×10-6mol·L-1,得出:c(OH-)>1×10-9mol·L-1,c(H+)=Kw/c(OH-)<10-5mol·L-1,pH >5.0,同理计算出Fe(OH)3完全变成沉淀时,pH约为3.5,所以当Al3+完全变成沉淀时Fe3+早已沉淀完全,但要保证Mn2+不能沉淀,故pH范围是:5.0 答案:5.0 方法指导 对于根据Ksp来计算溶液的pH及其范围,如果是酸性溶液首先要计算出溶液中c(H+),因为pH=-lgc(H+),如果是碱性溶液则先算出c(OH-),再由Kw/c(OH-)=c(H+),求出pH值,即“酸算酸c(H+)、碱酸碱c(OH-),再算酸”; 对于由Ksp来计算溶液的pH的范围,要分清某离子开始沉淀与完全沉淀的pH,对于上述几种沉淀,如果碱性越强,c(OH-)越大,则金属离子的浓度就越小,沉淀就越完全. G632 B 1008-0333(2016)31-0083-02
二、根据Ksp来判断沉淀情况以除杂

三、根据Ksp来计算溶液中某离子的浓度
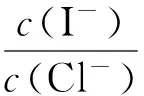
四、根据Ksp来计算溶液的pH及其范围

