例谈等效平衡的构建与应用
江苏师范大学附属实验学校(221011)
吴登运●
例谈等效平衡的构建与应用
江苏师范大学附属实验学校(221011)
吴登运●
等效平衡是基于可逆反应的化学平衡状态,指在一定条件下,化学反应中的正逆反应速率相等.教师可从全同等效平衡和相似等效平衡两个角度对可逆反应的等效平衡进行构建与应用,帮助学生从多方位、多角度全面认识可逆反应的变化机理.
高中化学;等效平衡;变化机理
等效平衡是基于可逆反应的化学平衡状态,指在一定条件下,化学反应中的正逆反应速率相等.从反应物与生成物在不同平衡途径下达到的等效平衡可以分为全同和相似两类,全同即各组织中的各类指标均相同,相似则指上述指标不完全相同的状态.本文将结合等效平衡的实例训练,对可逆反应的等效平衡进行构建与应用,帮助学生从多方位、多角度全面认识可逆反应的变化机理.
一、全同等效平衡
例1 某温度下,将2mol SO2和2mol O2冲入密闭容器,加入催化剂并保持恒温、恒容条件,达到平衡后SO3的体积分数为x.若将amol SO2、bmol O2、cmol SO3冲入容器中,达到平衡后使SO3的体积分数仍为x,则a、b、c之间应满足何种关系?
解析 从可逆反应的平衡移动可知,当增大压强或升高温度,对应的平衡状态就会发生改变.但只要上述反应条件不发生变化,则新反应与原反应必然是全同等效平衡反应.在本题中,由条件“保持恒温恒容”可知,该反应的平衡状态属于全同等效平衡.此时,可以书写出化学方程式,带入化学数据.
t1:0 2mol 2mol 0
t2:0amolbmolcmol
此时,根据全同等效平衡的性质,当t1、t2状态下达到平衡状态时,化学反应中各组分的体积分数、浓度及物质的量均处于相同状态.若要使加入催化剂后的反应达到平衡,且保持SO3的体积分数依然为x,根据起始反应状态,可知a、b、c之间的关系为a+c=2mol、b+c/2=2mol.
全同等效平衡是一种较为容易计算的平衡类型,只需要遵守前后平衡状态完全相同的法则,即反应各组份的物质的量、体积分数、浓度等全部相同.同时,全同等效也较容易判断,温度、压强不发生变化,即可判断出全同等效,是可逆反应等效平衡的一种基础类型.
二、相似等效平衡
1.恒温恒容

A.从反应开始到建立平衡所需时间:t(A)>t(B)
B.平衡时HI的转化率:α(A)=α(B)
C.平衡时I2蒸汽在混合气体中的体积分数:A容器>B容器
D.平衡时A容器中I2的浓度等于B容器中I2的浓度
解析 由于向恒容容器中注入不同体积的HI气体,故对应容器的气体平衡状态必然不同,即是相似等效平衡.已知A容器中的反应物浓度大于B容器,则A容器的反应速度必然大于B容器,且A容器中的压强大,反应平衡会向气体体积减小的方向移动.但由于反应前后的气体计量数都是2,不存在压强导致的平衡移动发生,即压强对反应平衡方向不产生影响.根据等效平衡原理,达到平衡状态时A、B容器中的反应转化率相同.在A容器中注入的HI气体更多,则会有更多的I2生成,致使A容器中的碘蒸汽浓度大于B容器.通过以上分析,不难确定选项B即为正确选项.
恒温恒容条件下的变压可逆平衡反应是相似等效平衡的重要类型.值得注意的是,需要对反应前后的气体计量数进行计算,判断压强是否会对平衡状态产生影响,避免审题上的失误.同时,还需要对反应物与生成物的物理状态进行判断,避免遗漏或多余.
2.恒温恒压
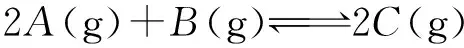
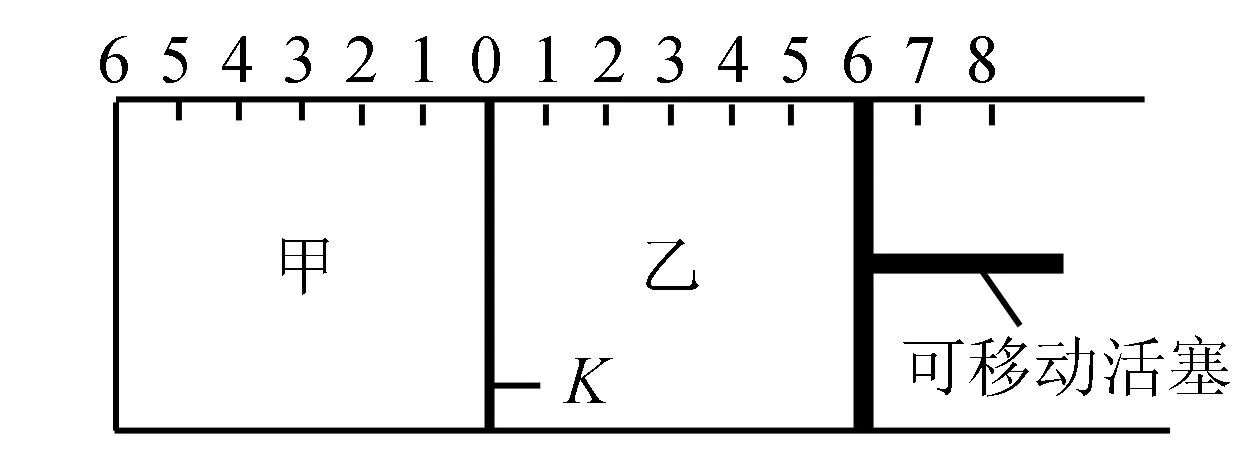
A.达到平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于乙容器中B的物质的量
D.根据隔板K的移动与否可以判断反应是否达到平衡状态
解析 A:甲容器中反应向正方向进行,极限条件下可以生成2molC,故C的物质的量介于0~2mol之间,隔板K的刻度应停留在左侧0~2之间,即A选项正确.B:平衡时,K停留在左侧1处,说明甲容器中气体的物质的量为2.5mol.乙容器中的气体至少比甲容器多1mol,故B选项错误.C:本题属于恒温恒压类型,乙中的等效平衡比甲多1mol,间接的增强了甲的容器压强,平衡向正反应方向移动,即C选项正确.D:从该可逆反应方程式可以看出,反应前后的气体计量数不等,气体体积会产生变化,活塞也会移动.故根据活塞K可以判断反应是否达到平衡.综上可知,本题选择B选项.
活塞的使用是恒压的象征,围绕压强对化学平衡的影响即可判断选项的正确性.值得注意的是,在训练过程中需要帮助学生分清隔板与活塞的差异,对隔板的可滑动性进行判断,避免理解错误.
总之,等效平衡是高中化学可逆反应中的重要考点,在分清等效平衡类型的基础上,对压强、温度、催化剂、反应物浓度等因素进行综合考虑.同时,在等效平衡的构建上,帮助学生掌握好方程式与图形的使用,提高解题效率.
G632
B
1008-0333(2016)31-0090-01

