载脂蛋白J对缺氧/复氧诱导的乳鼠心肌细胞损伤的影响*
李利娟,马彦卓,孔令锋,陈 瑜,王冬梅△
(1.河北北方学院研究生部,河北张家口 075000;2.白求恩国际和平医院心内科,石家庄 050000)
载脂蛋白J对缺氧/复氧诱导的乳鼠心肌细胞损伤的影响*
李利娟1,2,马彦卓2,孔令锋2,陈 瑜2,王冬梅2△
(1.河北北方学院研究生部,河北张家口 075000;2.白求恩国际和平医院心内科,石家庄 050000)
目的 观察载脂蛋白J(ApoJ)对缺氧/复氧(H/R)诱导的乳鼠心室肌细胞损伤的影响及其相关的信号传导通路。方法 用携带ApoJ基因的重组腺病毒感染乳鼠心肌细胞使ApoJ高表达。利用三气培养箱建立H/R模型,SOD类似物Mn(Ⅲ)TBAP和真核细胞翻译起始因子2α(eIF2α)去磷酸化抑制剂Salubrinal提前预处理,将心肌细胞分成对照组、H/R组、ApoJ组、ApoJ+H/R组、Mn(Ⅲ)TBAP+H/R组、Salubrinal+H/R组。利用MTT法检测细胞的存活率;酶联免疫吸附试验(ELISA)测定细胞乳酸脱氢酶(LDH)的漏出量、凋亡蛋白酶半胱天冬酶-3/7(caspase-3/7)及细胞内超氧化物歧化酶(SOD)活性;Western blot检测ApoJ、氧化酶Nox2/gp91phox、内质网特异性凋亡蛋白caspase-12、CHOP的表达及eIF2α的磷酸化水平。结果 ApoJ 基因重组腺病毒转染后,心肌细胞ApoJ蛋白高表达。与对照组相比,H/R组细胞存活率和SOD的活性明显下降,LDH的漏出量及caspase-3/7的活性升高,Nox2/gp91phox、caspase-12、CHOP蛋白的表达明显升高,eIF2α的磷酸化水平升高。与H/R组相比,ApoJ组、Mn(Ⅲ)TBAP组及Salubirnal组LDH的漏出量及caspase-3/7的活性明显降低,ApoJ高表达使细胞存活率和SOD的活性显著升高,Nox2/gp91phox、caspase-12、CHOP蛋白的表达明显下降,而eIF2α的磷酸化水平显著升高。结论 ApoJ通过抗氧化应激及内质网应激的作用,减轻H/R诱导的心肌细胞损伤。
载脂蛋白J;缺氧/复氧;内质网应激;氧化应激;细胞凋亡
心肌缺血/再灌注(MI/R)损伤是心肌组织缺血一段时间后再恢复血流,反而使心肌细胞损伤加重,表现为再灌注后缺血的心肌出现舒缩功能降低、心律失常、心肌能量代谢障碍、超微结构的变化和血管无复流等现象。心肌细胞凋亡是MI/R损伤心肌细胞死亡的主要方式之一。载脂蛋白J(Apolipoprotein-J,ApoJ)又被称为凝集素,是一种新型多功能分泌型糖蛋白,广泛存在于人体大部分组织与体液中[1]。该蛋白参与多种不同的病理生理过程,如膜的再利用、精子成熟、补体防御、脂质运输、抗炎、抗细胞凋亡、组织分化和重构、神经退行性变和肿瘤的形成等[2-3]。ApoJ是急性期反应蛋白,正常生理状态下表达量很少,但在应激的病理状态下表达增多,如急性心肌梗死、动脉粥样硬化、心肌炎和氧化应激等。研究表明当心脏受到损伤时,ApoJ通过高表达发挥抗凋亡的作用[4]。Jun等[5]发现ApoJ通过Akt和GSK-3β的激活保护H9C2心肌细胞对抗由过氧化氢诱导的凋亡。本课题组前期研究发现ApoJ通过高表达对抗由血管紧张素Ⅱ诱导的细胞凋亡[6],但目前针对ApoJ对H/R诱发的心肌细胞损伤影响的研究较少见。本研究通过建立离体乳鼠心肌细胞H/R损伤模型模拟MI/R,观察ApoJ对MI/R诱导的乳鼠心肌细胞损伤的影响及其相关的信号传导通路。
1 材料与方法
1.1 材料 SD大鼠,雌雄不拘,1~3 d龄,由河北医科大学实验动物中心提供。携带ApoJ基因的重组腺病毒购自Invitrogen;ApoJ抗体购自EterLife,Birmingham;CHOP、caspase-12、Nox2/gp91phox抗体购自ABcam;eIF2α、p-eIF2α购自Cell Signaling Technology;GAPDH、tublin抗体购自Sigma;LDH、SOD、caspase-3/7活性测定试剂盒购自Promega公司;PVDF 膜购自Santa Cruz;增强型ECL发光液购自Vazyme;胰蛋白酶、Ⅱ型胶原蛋白酶、高糖DMEM培养基、新生胎牛血清(FBS)购自Gibco;MTT、二甲基亚砜(DMSO)、丙烯酰胺、十二烷基磺酸钠(SDS)、四甲基乙二胺(TEMED)、过硫酸铵(APS)、Tween-20、甘氨酸、三羟甲基氨基甲烷(Tris)均购自美国Sigma公司;RIPA裂解液、PMSF及BCA蛋白定量试剂盒购自碧云天生物技术研究所;其余化学试剂为国产分析纯产品。
1.2 原代心肌细胞培养 参照文献[7]的方法并结合实际改进。在无菌条件下用眼科剪取出心脏置于预先盛有AD液的无菌平皿内。去除心房和大血管,剪成1 mm×1 mm×1 mm左右大小的碎块,加入含有0.06%胰酶和0.025%的Ⅱ型胶原酶的AD液中,37 ℃水浴振荡箱反复消化直至组织块完全消化为止。将含有血清的细胞离心(1 500 r/min,5 min)后弃上清液,加入适量的完全培养液(含高糖DMEM,10%的胎牛血清,1%青链霉素)重悬心肌细胞,接种至100 cm2培养皿。37℃,5%CO2培养箱培养1.5 h以纯化心肌细胞(差速贴壁法),然后平均接种于60 cm2的培养皿中。调整细胞密度后,按5×105/mL接种至24孔板,每组6孔,共6个复组,4×104/mL接种至96孔板,每组6孔,共6个复组。
1.3 Apo J的转染 去除完全培养液,用高糖DMEM冲洗细胞2次,以1∶200的浓度将携带ApoJ基因的腺病毒加入高糖DMEM(加病毒时关风机)混匀,ApoJ转染组加入适量腺病毒和高糖DMEM的混匀液,未携带ApoJ基因的腺病毒作为对照组。37℃ 5%CO2培养箱培养4~6 h后更换为完全培养液,转染36~48 h后提取细胞蛋白进行Western blot检测。
1.4 心肌细胞缺氧/复氧模型的建立及分组 用纯氮(N2)以1 L/min的流速充分饱和不含胎牛血清的DMEM培养基,30 min后换液并置于缺氧培养箱中,同样以1 L/min的流速通入含95%N2和5%CO2的混合气体,缺氧培养4 h后更换正常培养基放回正常含95%空气和5%CO2培养箱中复氧培养12 h,构建乳鼠原代心肌细胞缺氧/复氧模型。实验分组:对照组(在正常含95%空气和5%CO237 ℃培养箱中培养)、H/R组(按上述操作给予缺氧/复氧处理)、ApoJ组(用携带ApoJ基因的重组腺病毒感染乳鼠心肌细胞使ApoJ高表达,在正常含95%空气和5%CO237℃培养箱中培养)、ApoJ+H/R组(用携带ApoJ基因的重组腺病毒感染乳鼠心肌细胞使ApoJ高表达,然后给予缺氧/复氧处理),Mn(Ⅲ)TBAP+H/R组[Mn(Ⅲ)TBAP提前预处理1 h后再给予缺氧/复氧干预],Salubrinal+H/R组(Salubrinal提前预处理1 h后再给予缺氧/复氧干预)。
1.5 MTT检测细胞的存活率 取生长状态良好的乳鼠原代心肌细胞接种于96孔板中,并按照分组分别处理各组细胞,培养结束后在各孔加入20 μL的MTT溶液(5 mg/mL),在摇床上作用1 min,摇匀,在37 ℃下继续正常培养4 h后,弃上清液后各孔加入150 μL的DMSO,加样器吹打均匀(勿出气泡)后在酶标仪上检测570 nm处各孔的吸光度值,每组设置6个复孔。
1.6 ELISA法测定细胞中乳酸脱氢酶(LDH)的漏出量、细胞内超氧化物歧化酶(SOD)活性及caspase-3/7的活性 取生长状态良好的乳鼠原代心肌细胞接种于24孔板中,并按照分组分别处理各组细胞,培养结束后收集各组细胞上清液,3 000 r/min离心15 min,取上清液,按照检测试剂盒的说明步骤,检测各组心肌细胞上清液中LDH的分泌量。同时用PBS冲洗贴壁的细胞2遍,加入胰酶(0.25%)消化3~5 min,显微镜下观察消化程度,加入完全培养液终止消化,将上述液体1 500 r/min离心5 min,弃上清液,PBS清洗1遍后用少量的PBS重悬细胞,利用超声裂解细胞膜(40~60 W,30 s,间隔10 s,重复2次),显微镜下观察细胞已裂解,5 000 r/min离心15 min后取上清液,按照检测试剂盒的说明步骤,检测各组心肌细胞内SOD、caspase-3/7的活性。
1.7 Western blot法检测ApoJ、CHOP、caspase-12、Nox2/gp91phox、eIF2α、p-eIF2α蛋白表达 分别取各组心肌细胞,提取蛋白,用BCA法测定各组样本蛋白质浓度,样本经凝胶电泳、转膜、封闭、加入一抗(ApoJ、CHOP、caspase-12、Nox2/gp91phox、eIF2α、p-eIF2α)和二抗,用GBOX成像,灰度值用Image J软件分析。

2 结 果
2.1 ApoJ对细胞存活率、细胞损伤及凋亡的影响 用携带ApoJ基因的腺病毒感染乳鼠心肌细胞,ApoJ的表达明显升高,见图1A,表明ApoJ高表达模型建立成功。与对照组相比,H/R损伤后心肌细胞存活率明显下降;与H/R组对比,ApoJ高表达可使心肌细胞存活率明显升高(P<0.05),见图1B。与对照组相比,H/R损伤后,心肌细胞上清液LDH的漏出量及caspase-3/7的活性显著升高(P<0.05);与H/R组对比,ApoJ高表达、Mn(Ⅲ)TBAP 和Salubirnal可使细胞上清液LDH的漏出量及caspase-3/7的活性明显下降(P<0.05),见图1C和1D。
2.2 ApoJ通过PERK-eIF2α通路抑制H/R损伤诱导的内质网应激 与对照组相比较,H/R损伤后心肌细胞内质网应激相关凋亡蛋白caspase-12和CHOP的表达明显升高(P<0.05),高表达ApoJ后,与H/R组对比,ApoJ+H/R组心肌细胞凋亡蛋白caspase-12和CHOP的表达显著下降(P<0.05)见图2A和2B。与对照组相比较,H/R损伤后心肌细胞eIF2α的磷酸化水平升高(P<0.05),高表达ApoJ后,与H/R组对比,APOJ+H/R组心肌细胞eIF2α的磷酸化水平进一步升高(P<0.05),见图2C。
2.3 ApoJ抑制H/R诱导的氧化应激 与对照组相比较,H/R损伤后心肌细胞SOD的活性明显下降,Nox2/gp91phox的表达明显升高(P<0.05),ApoJ高表达后,与H/R组对比,ApoJ+H/R组心肌细胞SOD的活性明显升高,Nox2/gp91phox的表达明显下降(P<0.05),见图3。
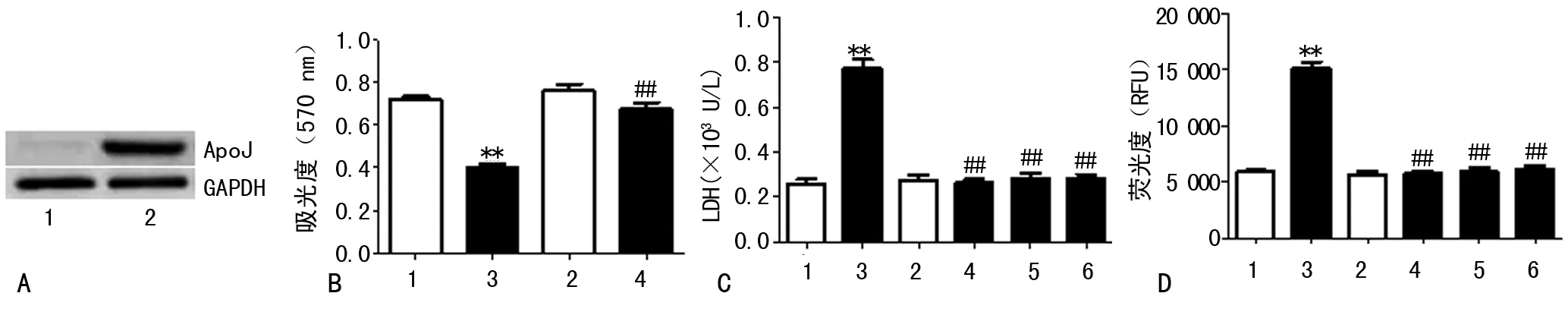
A:通过Western blot的方法观察ApoJ重组腺病毒感染的心肌细胞ApoJ的表达。B:通过MTT检测细胞的活力。C:通过检测培养液中心肌细胞LDH的漏出量来确定心肌细胞的损伤程度。D:通过检测caspase-3/7的活性明确H/R诱导的心肌细胞凋亡。**:P<0.05,与对照组比较,##:P<0.05,与H/R组比较;1:对照组;2:Apo J组;3:H/R组;4:Apo J+H/R组;5:Mn(Ⅲ)TBAP+H/R组;6:SaJubriani+H/R组。
图1 高表达ApoJ减轻H/R诱导的心肌细胞损伤
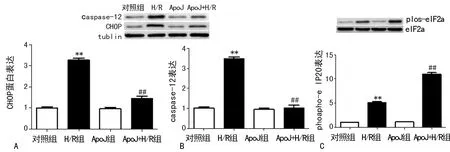
A、B:Western blot检测caspase-12和CHOP的表达。C:Western blot检测eIF2α的磷酸化水平。**:P<0.05,与对照组比较;##:P<0.05,与H/R组比较。
图2 ApoJ通过PERK-eIF2α通路抑制H/R损伤诱导的内质网应激
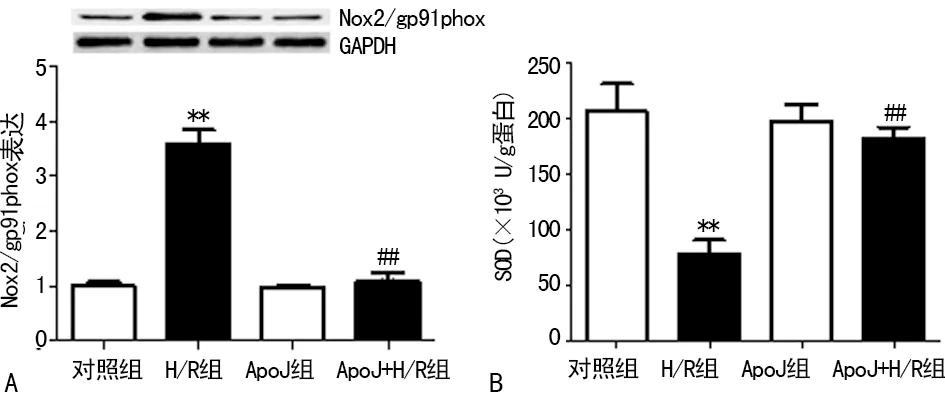
A:Western blot检测心肌细胞Nox2/gp91phox蛋白的表达。B:通过SOD试剂盒检测心肌细胞SOD的活性。**:P<0.05 与对照组比较,##:P<0.05 与H/R组比较。
图3 ApoJ抑制H/R诱导的氧化应激
3 讨 论
目前急性心肌梗死仍是全世界死亡和致残的主要原因之一。尽早开通梗死相关血管,恢复血流可以减少梗死面积、改善临床结果。然而,无论是溶栓或经皮冠状动脉成形术(PCI)治疗,MI/R损伤都是无法回避的问题及难以克服的治疗难点,因此如何减轻MI/R损伤一直是研究热点。
给予缺氧/复氧处理后心肌细胞的存活率明显下降,LDH的漏出量明显升高,表明H/R模型构建成功。ApoJ 基因重组腺病毒转染组ApoJ蛋白的表达明显升高,表明ApoJ高表达模型构建成功。心肌细胞LDH漏出量变化是反映心肌坏死的重要指标。caspase是细胞死亡的关键性中介,而caspase-3是公认的细胞凋亡执行者。本试验测定了心肌细胞的存活率、LDH的漏出量和caspase-3/7的活性,结果显示H/R损伤导致心肌细胞的存活率明显下降,LDH漏出量和caspase-3/7活性升高,ApoJ高表达可显著升高心肌细胞的存活率,降低LDH漏出量和caspase-3/7活性。表明ApoJ可减轻H/R诱导的心肌细胞损伤。
既往研究表明,心肌缺血再灌注损伤可促进活性氧簇(reactive oxygen species,ROS)过度生成,产生强烈的氧化应激,进一步加重心脏病及其并发症的发生、发展[8-9]。在I/R心肌中NADPH氧化酶是最重要的超氧化物酶,Nox2/gp91phox是NADPH氧化酶的关键组成部分。SOD是机体内抗氧化系统的重要组成部分,通过清除自由基而发挥细胞保护作用,SOD活力的高低间接反映了机体清除氧自由基的能力。Jun等[5]研究表明ApoJ能减轻I/R损伤诱导的氧化应激。本研究发现H/R损伤使Nox2/gp91phox的表达明显增高,SOD活性显著下降,而ApoJ高表达可显著降低Nox2/gp91phox的表达,使心肌细胞SOD活性增加。以上结果表明,ApoJ可减少超氧化物的过量产生,减轻H/R损伤诱导的氧化应激。
内质网应激(endoplasmic reticulum stress,ERS)是细胞的内源性自我保护性机制,有利于恢复细胞内环境稳态和维持生存,但过强的或长时间的ERS 反应可以引起细胞的凋亡[10]。既往研究已证实,由H/R损伤诱导的过度ERS可通过下游的凋亡信号分子CHOP、caspase-12或JNK途径激活凋亡机制,进而激活下游的caspase-3等引起细胞凋亡,甚至导致细胞死亡,且caspase-12是内质网应激凋亡通路的特异性蛋白[11-14]。本研究发现H/R损伤导致心肌细胞caspase-12、CHOP的表达明显升高,而ApoJ高表达可降低caspase-12、CHOP的表达,表明ApoJ可通过减轻内质网应激来减少MI/R损伤诱导的细胞凋亡。H/R损伤后,内质网应激通过诱导未折叠蛋白反应(UPR)试图恢复细胞稳态保护细胞,PERK途径是UPR保护性机制中重要的信号通路。PERK通路激活后,真核细胞翻译起始因子2α(eIF2α)发生磷酸化,使细胞内的大多数mRNA的翻译下降,增强内质网对蛋白的折叠功能,阻止错误折叠或未折叠蛋白的进一步聚集,促进内质网稳态的恢复[15-16]。Zhu等[17]研究表明eIF2α的磷酸化水平升高可使大脑缺氧/复氧造成的运动神经元损伤降至最低。本实验结果证实H/R损伤后eIF2α的磷酸化水平升高以减少未折叠蛋白及错误蛋白的合成,ApoJ高表达后eIF2α的磷酸化水平进一步升高使此保护作用增强,提示ApoJ是通过PERK/ eIF2α通路来减轻心肌细胞内质网应激反应。
Salubrinal是一种由细胞合成的,诱导eIF2α磷酸化和抑制其去磷酸化的选择性抑制物,能通过抑制eIF-2α去磷酸化和JNK磷酸化,减轻ERS和细胞凋亡。Mn(Ⅲ)TBAP是SOD的类似物、ROS的清道夫,可通过减少ROS而减轻内质网应激。本研究发现,H/R损伤导致LDH漏出量和caspase-3/7活性明显升高,ApoJ高表达、Mn(Ⅲ)TBAP、Salubrinal可显著降低心肌细胞LDH的漏出量和caspase-3/7活性。表明抑制H/R损伤诱导的氧化应激和内质网应激可减轻细胞损伤和凋亡。以上这些结果为ApoJ减轻H/R损伤诱导的心肌损伤提供了直接证据。
综上所述,ApoJ通过抗氧化应激和抗内质网应激减轻H/R引起的心肌细胞损伤。
[1]Wilson MR,Easterbrook SB.Clusterin is a secreted mammalian chaperone[J].Trends Biochem Sci,2000,25(3):95-98.
[2]Jeong S,Ledee DR,Gordon GM,et al.Interaction of clusterin and matrix metalloproteinase-9 and its implication for epithelial homeostasis and inflammation[J].Am J Pathol,2012,180(5):2028-2039.
[3]Chaiwatanasirikul KA,Sala A.The tumour-suppressive function of CLU is explained by its localisation and interaction with HSP60[J].Cell Death Dis,2011,2(4):e219.
[4]Li Y,Sagar MB,Wassler M,et al.Apolipoprotein-J prevention of fetal cardiac myoblast apoptosis induced by ethanol[J].Biochem Biophys Res Commun,2007,357(1):157-161.
[5]Jun HO,Kim DH,Lee SW,et al.Clusterin protects H9c2 cardiomyocytes from oxidative stress-induced apoptosis via Akt/GSK-3β signaling pathway[J].Exp Mol Med,2011,43(1):53-61.
[6]Ma Y,Kong L,Nan K,et al.Apolipoprotein-J prevents angiotensin Ⅱ-induced apoptosis in neonatal rat ventricular cells[J].Lipids Health Dis,2015(14):114.
[7]庞勇军,孙莉,谢文娟,等.新生大鼠心肌细胞分离、纯化及培养方法的改进[J].上海交通大学学报(医学版),2011,4(4):520-523.
[8]Ji L,Fu F,Zhang L,et al.Insulin attenuates myocardial ischemia/reperfusion injury via reducing oxidative/nitrative stress[J].Am J Physiol Endocrinol Metab,2010,298(4):E871-E880.
[9]Zweier JL,Talukder MA.The role of oxidants and free radicals in reperfusion injury[J].Cardiovasc Res,2006,70(2):181-190.
[10]Schröder M,Sutcliffe L.Consequences of stress in the secretory pathway:The ER stress response and its role in the metabolic syndrome[J].Methods in Moleculor Biology,2010,648:43-62.
[11]Groenendyk J,Sreenivasaiah PK,Kim do H,et al.Biology of endoplasmic reticulum stress in the heart[J].Circ Res,2010,107(10):1185-1197.
[12]Miyazaki Y,Kaikita K,Endo M,et al.C/EBP homologous protein deficiency attenuates myocardial reperfusion injury by inhibiting myocardial apoptosis and inflammation[J].Arterioscler Thromb Vasc Biol,2011,31(5):1124-1132.
[13]Ron D,Walter P.Signal interaction in the endoplasmic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol,2007,8(7):519-529.
[14]Higa A,Chevet E.Redox signaling loops in the unfolded protein response[J].Cell Signal,2012,24(8):1548-1555.
[15]Hetz C.The unfolded protein response:controlling cell fate decisions under ER stress and beyond[J].Nat Rev Mol Cell Biol,2012,13(2):89-102.
[16]Belaidi E,Decorps J,Augeul L,et al.Endoplasmic reticulum stress contributes to heart protection induced by cyclophilin D inhibition[J].Basic Res Cardiol,2013,108(4):363.
[17]Zhu Y,Fenik P,Zhan G,et al.Eif-2a protects brainstem motoneurons in a murine model of sleep apnea[J].J Neurosci,2008,28(9):2168-2178.
Effect of apolipoprotein-J on hypoxia/reoxygenation induced myocardial cells injury in neonatal rat*
LiLijuan1,2,MaYanzhuo2,KongLingfeng2,ChenYu2,WangDongmei2△
(1.DepartmentofPostgraduates,HebeiNorthUniversity,Zhangjiakou,Hebei075000,China; 2.DepartmentofCardiology,BethuneInternationalPeaceHospital,Shijiazhuang,Hebei050000,China)
Objective To evaluate the effects of apolipoprotein-J(ApoJ)on hypoxia/reoxygenation(H/R)induced neonatal rat ventricular cells(NRVCs)injury and its related signaling pathways. Methods ApoJ high expression was achieved by infection with recombinant adenovirus in NRVCs. The three gas incubator was used to establish H/R model,SOD mimetic Mn(Ⅲ)tetrakis(4-benzoic acid)porphyrin chloride and eIF2α dephosphory inhibitor Salubrinal were performed the pretreatment. The NRVCs were divided into four groups:normal control group, H/R, ApoJ group, ApoJ+H/R group, Mn(Ⅲ)TBAP+H/R group and Salubrinal+H/R group. The cell viability was measured by MTT assay; the leakages of LDH, the expression of SOD and caspase-3/7 activity were detected by ELISA. The protein expression levels of ApoJ, Nox2/gp91phox, caspase-12, CHOP, and the phosphorylation level of eukaryotic initiation factor 2α(eIF2α)were determined by Western blot. Results ApoJ protein in myocardial cells was highly expressed after infection by recombinant adenoviru. Compared with the control group, the cell viability and the activity of SOD were significantly decreased, the leakages of LDH and the activity of caspase-3/7 were increased in the H/R group, the protein expression level of Nox2/gp91phox,caspase-12 and CHOP and the phosphorylation level of eIF2α were increased. Compared with the H/R group, the leakages of LDH and the activity of caspase-3/7 in the ApoJ overexpression group, Mn(Ⅲ)TBAP group and Salubirnal group were significantly decreased. ApoJ overexpression significantly increased the cell viability and the activity of SOD. Moreover, the protein expression level of Nox2/gp91phox, caspase-12 and CHOP were significantly decreased, while the phosphorylation level of eIF2α was markedly increased.Conclusion ApoJ alleviates H/R induced myocardial cellular injury by anti- oxidative stress and endoplasmic reticulum stress.
ApoJ;hypoxia/reoxygenation;endoplasmic reticulum stress;oxidative stress;cell apoptosis
��·基础研究
10.3969/j.issn.1671-8348.2016.33.002
河北省应用基础研究计划重点基础研究项目(13967710D)。 作者简介:李利娟(1988-),在读硕士,主要从事心血管内科方面的研究。△
R331
A
1671-8348(2016)33-4612-04
2016-05-18
2016-07-13)
——疾病防治的新靶标

