羟基新戊醛合成工艺及其动力学
刘齐琼,于鹏浩,程 双,张新平
1.上海华谊集团技术研究院,上海 200241;
2.华东理工大学化工学院,上海 200237;
3.上海计算化学与化工工程技术研究中心,上海 200241
羟基新戊醛合成工艺及其动力学
刘齐琼1,2,于鹏浩1,3,程 双1,3,张新平1,3
1.上海华谊集团技术研究院,上海 200241;
2.华东理工大学化工学院,上海 200237;
3.上海计算化学与化工工程技术研究中心,上海 200241
羟基新戊醛是合成多种精细化学品的重要中间体。以叔胺溶液为催化剂,利用正交实验法优化了甲醛异丁醛缩合制备羟基新戊醛的工艺条件,并考察了缩合反应动力学。由正交实验结果得到最佳反应条件为:催化剂的用量为3%质量分数,反应温度75 ℃,甲醛与异丁醛的物质的量之比为1.1:1,反应压力0.3 MPa,反应时间80 min,在此条件下产物收率可达98.33%。动力学的研究结果表明:缩合主副反应的表观活化能分别为40.801 kJ/mol和64.088 kJ/mol;主反应对异丁醛、甲醛反应级数分别为1和1.2,副反应对羟基新戊醛的反应级数为2。通过残差分析和统计检验,表明动力学模型是适定的。
甲醛 异丁醛 羟基新戊醛 缩合反应 动力学
羟基新戊醛(HPA)是2,2-二甲基3-羟基丙醛的俗称,主要用作合成螺二醇、新戊二醇[1]、聚氨酯及聚丙烯酸酯的原料及改性剂,以及合成萃取剂、杀虫剂等[2]的中间体,HPA的衍生物一般具有优良的耐水解性、耐热性、耐紫外线照射和耐化学性。HPA的合成工艺一般采用羟醛缩合的方法合成,即异丁醛和甲醛在一定条件下进行羟醛缩合反应,所选用的催化剂有氢氧化钠[3]、碳酸钠[4]、叔胺[5-8]和弱碱阴离子交换树脂[9]等。目前国内外进行缩合反应动力学的文献较少,梁荣宁等[4]和Tike等[9]分别以碳酸钠、弱碱阴离子交换树脂为催化剂,对缩合动力学进行了研究。本研究以叔胺为催化剂,甲醛、异丁醛为原料合成HPA,通过正交试验设计,对工艺条件进行优化,同时考察其动力学,以期为HPA缩合反应器的设计和工业化生产提供理论依据。
1 实验部分
1.1 实验流程
甲醛异丁醛缩合制羟基新戊醛采用1 L高压釜式反应器。将甲醛(FA)、异丁醛(IBA)按设定配比配料后加入三口烧瓶,搅拌均匀。待反应釜温度达到设定温度后,将催化剂加入三口烧瓶中后立即将混合料液加入缓冲罐,N2置换3次。打开进料阀,充N2加压至设定压力,开搅拌至指定搅拌转速,此刻开始计时,并打开加热带。达到指定停留时间后,釜底取样分析,停止反应。
1.2 反应方程式
甲醛(37%)与异丁醛在催化剂叔胺作用下发生缩合反应生成HPA,同时伴随的主要副反应有:HPA分解生成甲醛和异丁醛、HPA自身缩合生成2,2-二甲基-1,3-丙二醇羟基特戊酯(别名1115酯,HPN)、HPA和异丁醛或甲醛发生康尼查罗反应生成微量新戊二醇。除此之外,反应过程还生成极少量的异丁酸、异丁醇、异丁酸异丁酯、甲酸、甲醇、甲酸甲酯等副产物[10]。
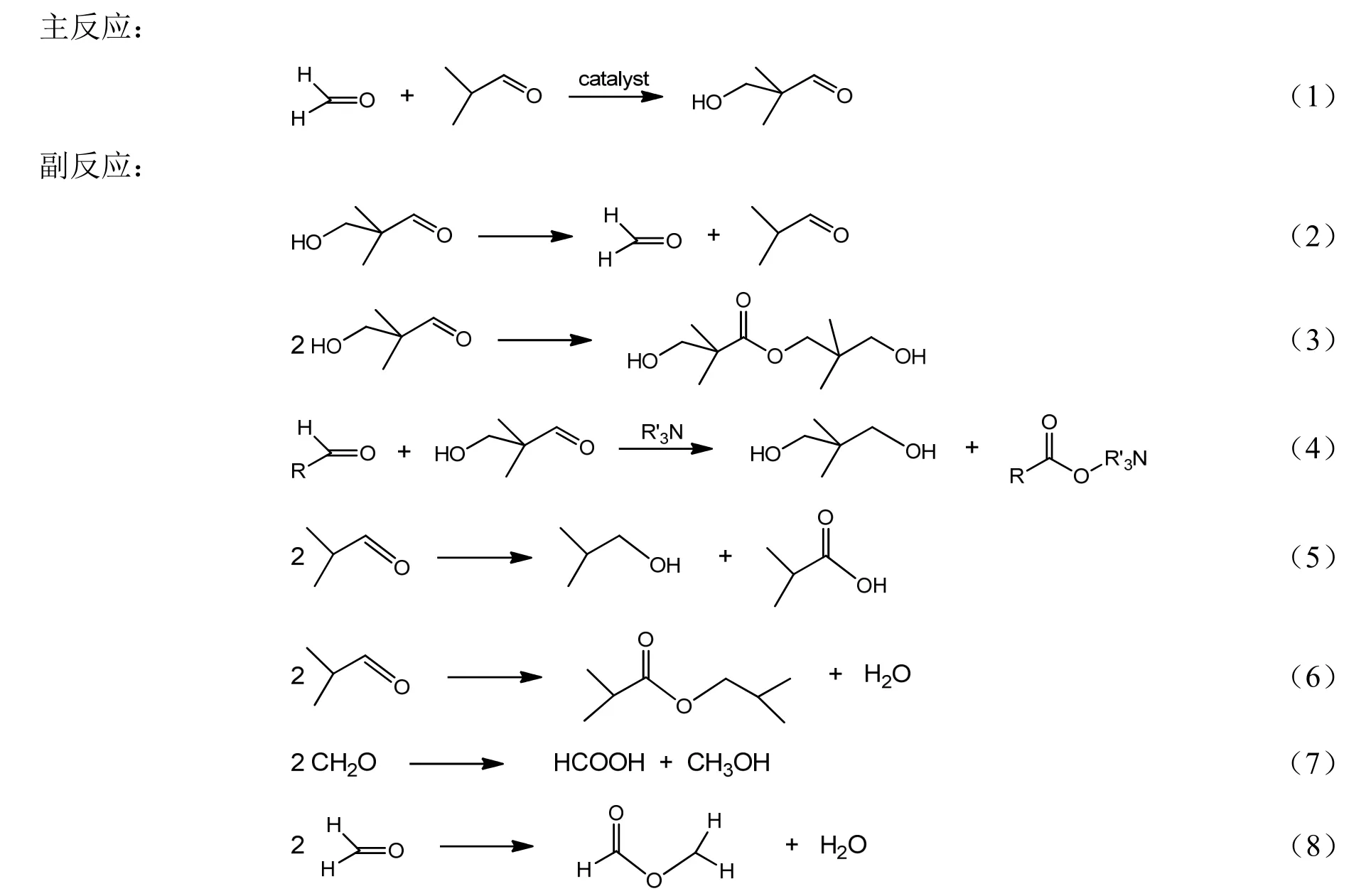
1.3 分析方法
釆用内标法进行缩合产物定量分析,以正丁醇为内标物,乙醇为溶剂,异丁醛与甲醛缩合反应中原料异丁醛、三甲胺、缩合产物HPA、1115酯的分析采用气相色谱进行定量分析。采用Agilent 7890A气相色谱仪,氢火焰(FID)检测器,色谱柱为DB-624(30 m×250 μm×1.8 μm)。程序升温:初始温度60 ℃保持3 min,然后以12 ℃/min升至230 ℃,保持3 min。进样口温度250 ℃,检测器温度250 ℃。异丁醛(IBA)计算反应的转化率,羟基新戊醛(HPA)收率及选择性,计算公式如下:
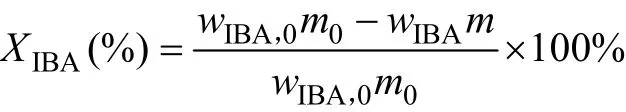
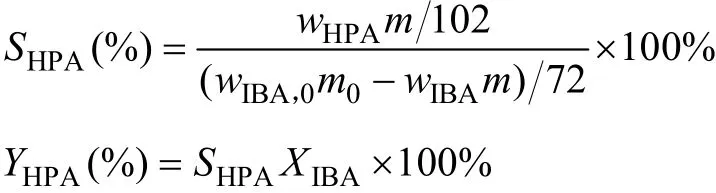
1.4 传质影响排除
在搅拌釜式反应器内,可以通过增大搅拌转速,排除传质对反应的影响。图1为在相同条件下,不同的转速对IBA转化率和HPA选择性的影响。由图可知,当搅拌转速大于400 r/min时,IBA转化率和HPA选择性随搅拌转速基本不变,因此认为反应的传质影响基本消除,传质均匀。
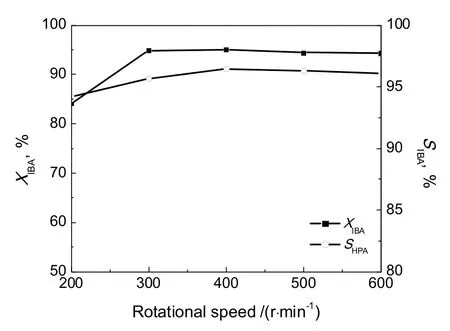
图1 搅拌转速对IBA转化率和HPA选择性的影响Fig.1 Effect of rotational speed on the isobutyraldehyde conversion and the selectivity of HPA
2 结果与讨论
2.1 确定缩合反应优化工艺条件
采用正交表L1645,考察了压力、温度、停留时间、催化剂加入量、甲醛与异丁醛物质的量之比[n(FA):n(IBA)]对反应结果的影响,确定了缩合反应的优化工艺条件。
其因素水平见表1,实验结果见表2。
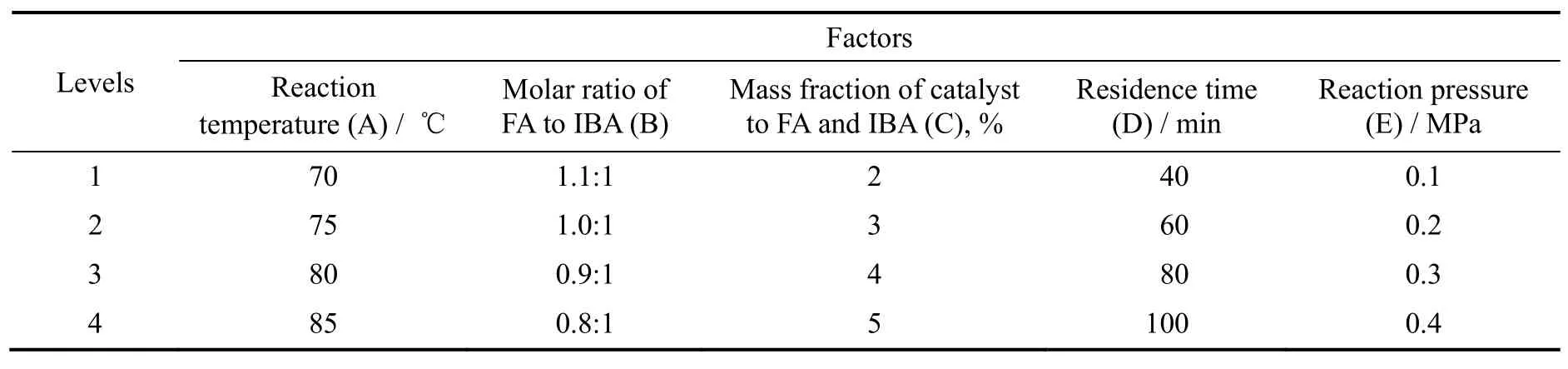
表1 正交实验因素水平表Table 1 The factors and levels of orthogonal experiments
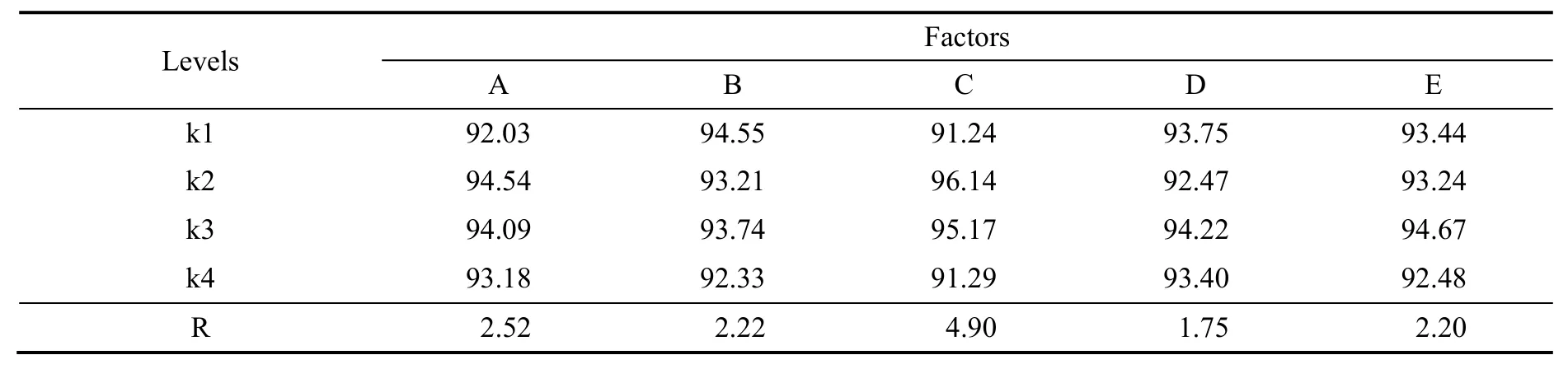
表2 HPA合成反应正交实验结果Table 2 The results of orthogonal experiments of synthesizing HPA
由上表极差计算结果可知:催化剂用量是影响羟醛缩合反应的主要因素,其次为反应温度、反应物配比、反应压力,停留时间对反应结果的影响较小。催化剂的作用是降低反应活化能,催化剂用量与反应速率常数有关,催化剂用量的微小变动,能引起反应速率常数的变化,从而极大改变反应速率。羟醛缩合反应伴随着反应温度、反应物配比、停留时间与反应压力改变时,反应结果也随之改变。由此可以筛选出合成HPA的优选方案为A2B1C2D3E3,即反应温度为75 ℃,原料配比n(FA):n(IBA)为1.1:1,催化剂加入量为3%质量分数,停留时间为80 min,反应压力为0.3 MPa。在此条件下反应,HPA收率可达98.33%。
2.2 不同操作条件下的反应影响
2.2.1 温度的影响
羟醛缩合反应属于放热反应,从热力学角度讲,提高温度对反应不利,同时温度升高副反应增多;但从动力学角度讲,提高温度可加快反应速度。实验考察了相同条件下,温度对缩合反应的影响,结果见图2。由图可知,温度对缩合反应的HPA收率影响不大,即随着温度的升高,HPA收率略有增长,建议在工业化生产中较优的反应温度为75~80 ℃。
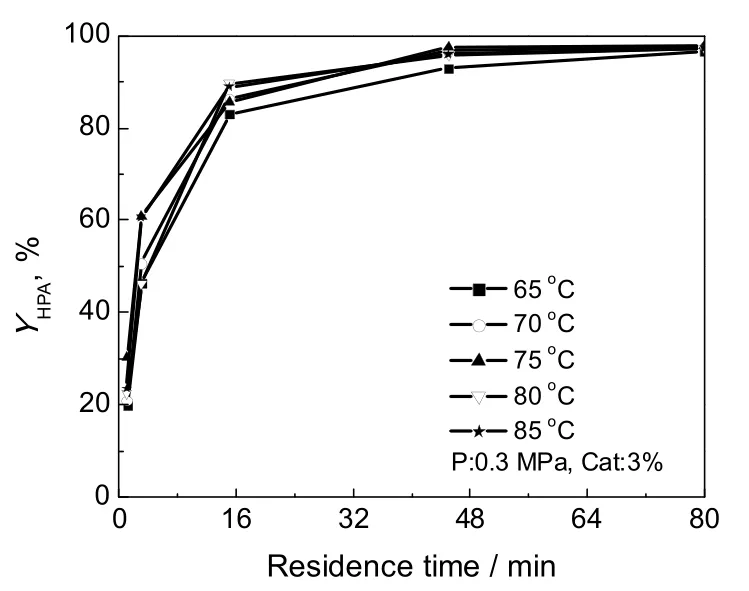
图2 不同反应温度时的HPA收率Fig.2 HPA yield under different temperatures
2.2.2 原料配比的影响
图3为原料中FA与IBA物质的量比不同时的HPA收率。从图4中反应终点处可知,n(FA):n(IBA)为1:1时,收率最低,n(FA):n(IBA)为1.1:1工况时的收率略高于n(FA):n(IBA)为0.8:1工况。从动力学角度看,可能由于反应初期甲醛浓度越高反应速率越快;随着反应的进行,强还原剂甲醛含量的增加,提高了HPA选择性,更有利于HPA的生成。考虑到IBA的价格相对于FA较高,建议在工业化生产中进料n(FA):n(IBA)为1.1:1。
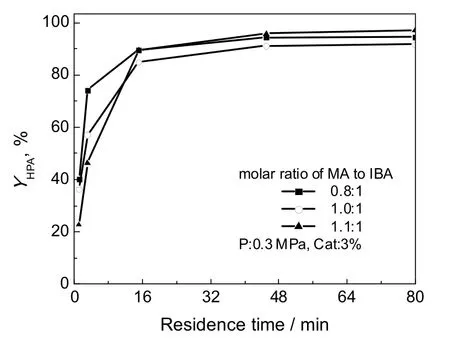
图3 FA与IBA物质的量比对HPA收率的影响Fig.3 Effect of starting material ratio of FA to IBA on HPA yield
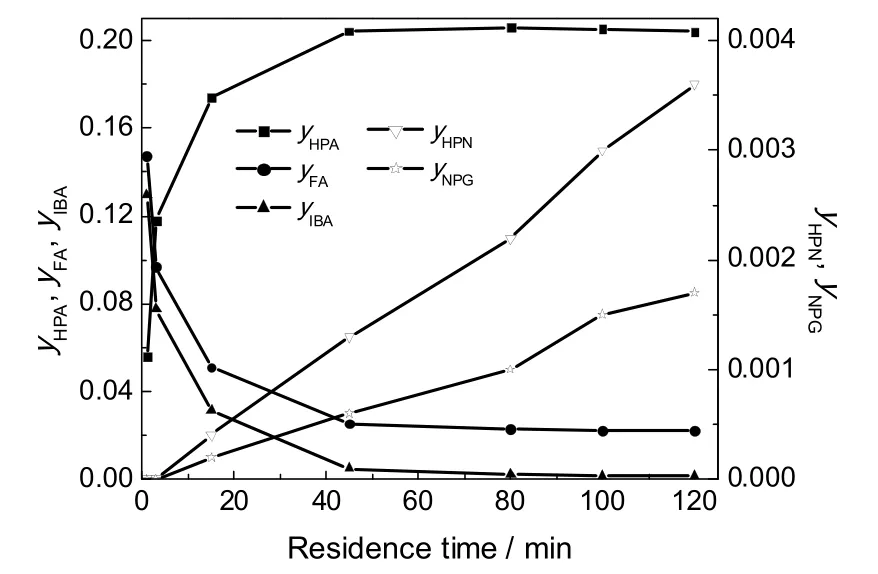
图4 停留时间对yFA、yIBA、yHPA和yHPN、yNPG的影响Fig.4 Effect of residence time on yFA, yIBA, yHPA, yHPNand yNPG
2.3 动力学模型及参数估值
2.3.1 动力学模型
从1.2节可以看出该过程副反应较多,但由于产物中异丁酸、异丁醇、异丁酸异丁酯、甲酸、甲醇、甲酸甲酯等副产物的量极少,因此忽略该类副反应。对于羟基新戊醛分解生成甲醛、异丁醛的可逆反应,经Aspen模拟计算,在反应温度75 ℃,主反应平衡常数为1.85×1018,平衡转化率接近100%,在动力学实验考察条件范围内,反应仍属于动力学控制区域,因此忽略该反应。
图4为反应温度75 ℃,原料配比n(FA):n(IBA)为1.1:1,催化剂加入量3%,停留时间120 min,反应压力0.3 MPa条件下各组成随停留时间时间的变化曲线。从图4可看出,副产物新戊二醇(NPG)含量极少仅有HPN含量的1/3,而羟基新戊醛到新戊二醇是等摩尔反应,考虑到羟基新戊醛是合成新戊二醇的中间体,因此将新戊二醇叠加至羟基新戊醛处理。这样,动力学仅考虑生成羟基新戊醛的主反应(1)和生成1115酯的副反应(3)。
为便于工程设计的应用,动力学方程模型采用幂函数形式[11],考虑到不同时刻反应体系密度和体积的变化,在物料衡算中采用以摩尔分率表示的幂函数动力学模型。
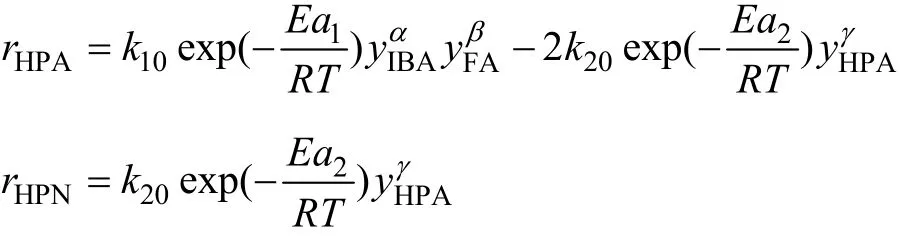
2.3.2 参数估值
进料中含有反应涉及的各种组分且初始组分已知,则根据反应配比,以反应某时刻yHPA、yHPN为独立变量,经物料衡算推导各组分摩尔分率如下:
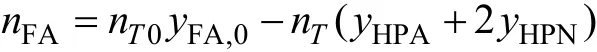

初始条件:t=0,yHPA=yHPN=0。
参数估值优化方法选用非线性最小二乘法,数值积分采用Runge-Kutta法。参数估值过程采用的目标函数的表达式为:
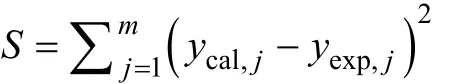
经计算得到模型中各参数为:α=1,β=1.2,γ=2,k10=3.983 9×106,k20=3.444 0×106,Ea1=40.801 kJ/mol,Ea2=64.088 kJ/mol。将各参数值代入反应的动力学方程可得到:
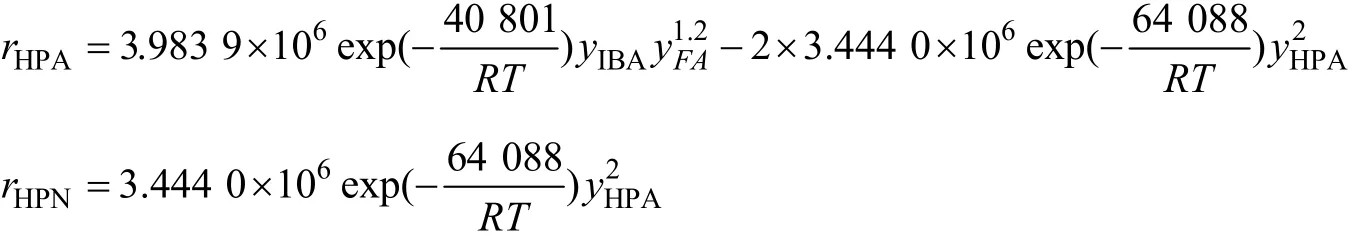
2.4 模型适用性检验
2.4.1 残差检验
不同进料配比和温度下由动力学模型计算得到的HPA和HPN的摩尔分率和实验值的对比见图5,残差分布图见图6,其平均相对误差值分别为1.77%、9.31%。
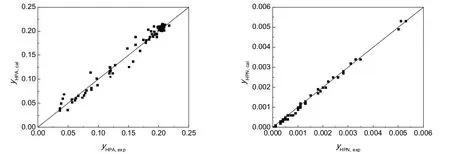
图5 模型计算值和实验值的比较Fig.5 Comparison between experimental and calculated data
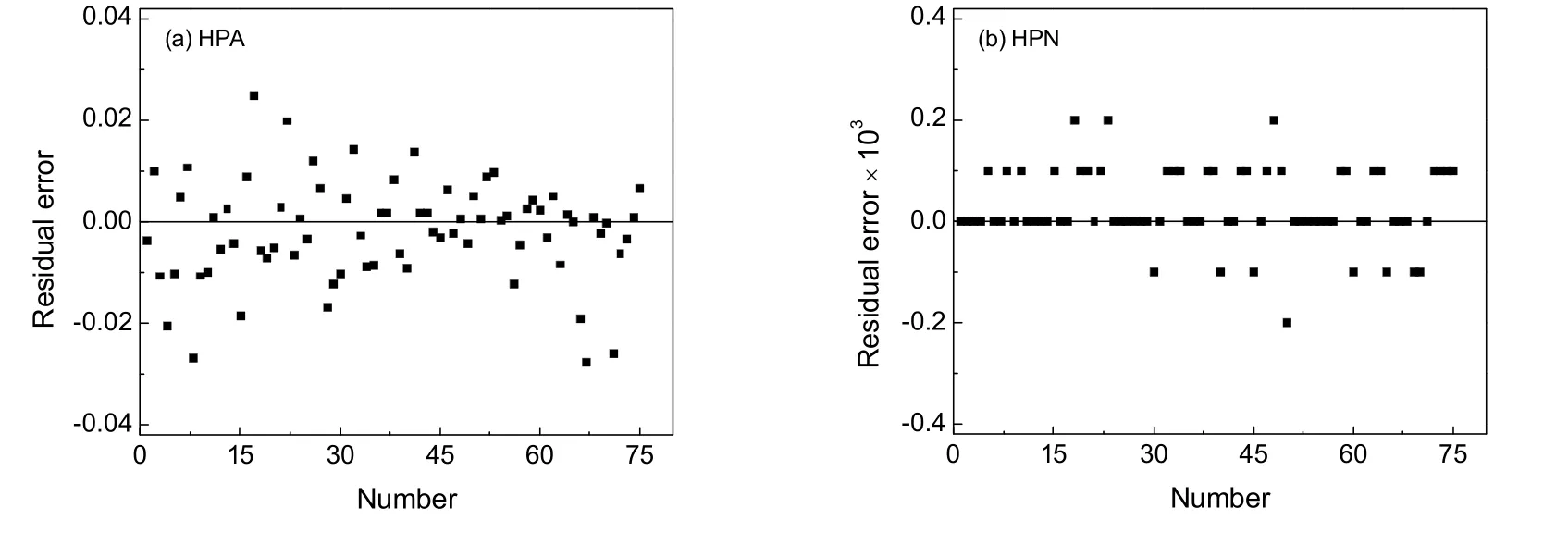
图6 模型计算值和实验值的残差分布Fig.6 Residual distributions of experimental and calculated data
2.4.2 统计检验
对动力学方程进行F统计和复相关指数检验,以检验动力学模型对实验数据的实用性,若得到的模型不能满足该检验,则应视为无效。
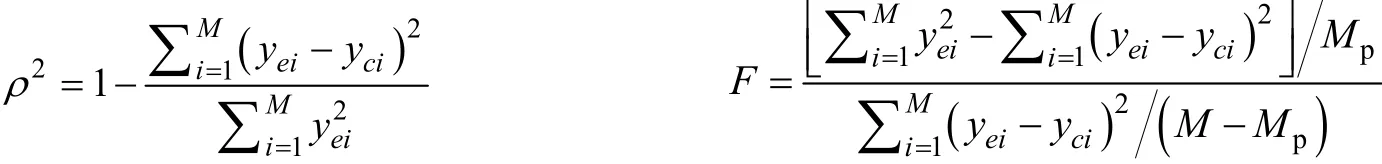
一般认为ρ2大于0.9、F大于10FT时[12],模型是适定的。计算得到动力学模型的复相关指数:,统计量:。综上所述,动力学模型是适定的。
3 结 论
a)采用5因素4水平正交实验设计法,确定了影响羟醛缩合反应各因素的主次顺序:催化剂用量、反应温度、反应物配比、反应压力、停留时间;并确定优化反应条件:FA与IBA的物质的量之比1.1:1,反应温度75 ℃,反应压力0.3 MPa,反应时间80 min,叔胺催化剂的用量为3%。在此条件下,HPA的收率可达98.03%。
b)在温度65~85 ℃、FA与IBA的物质的量之比0.8:1~1.1:1的条件内,考察了叔胺催化剂含量3%下甲醛异丁醛缩合制羟基新戊醛的动力学数据,选用幂函数型动力学模型,并运用最小二乘法,通过计算机模拟得到模型参数,得到以下最终表达式。
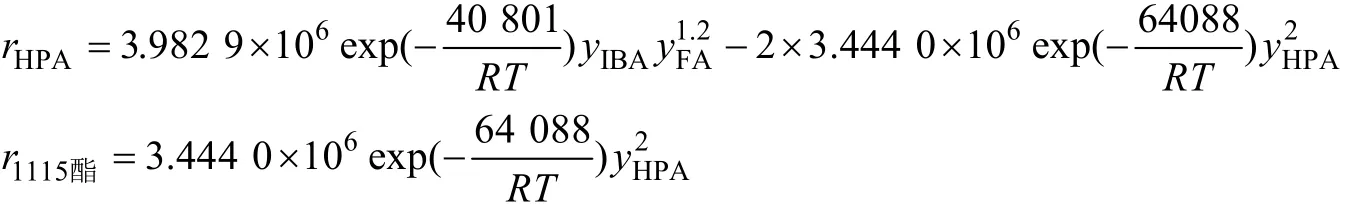
经统计检验与残差分析结果表明,动力学模型是适定的。
符号说明
A——峰面积nT——某一瞬时时刻物质的量,mol
Ea——活化能,kJ/molr——反应速率,min-1
F——回归均方和与模型残差均方和之比R ——气体通用常数,8.314 J/(mol·K)
fi——组分i的相对校正因子T——温度,℃
k——反应速率常数w——质量百分含量
m——反应物的质量,gy——摩尔分率
M——实验次数Y——收率
MP——参数个数α——异丁醛的浓度指数
n——物质的量,molβ——甲醛的浓度指数
γ——羟基新戊醛的浓度指数exp——实验值
δ——相对误差IBA——异丁醛
ρ2——决定性指标FA——甲醛
下标HPA——羟基新戊醛
0——反应物初始值HPN——1115酯
s——内标物NPG——新戊二醇
cal——计算值
[1] 杨永林, 龚 喜. 新戊二醇工艺合成及行业发展现状 [C]. 中国粉末涂料与涂装年会会刊, 2008:111-113.
[2] Auer H, Scholl S, Weber T, et al. Isolation of neopentyl glycol hydroxypivalate : US, 6048441 [P]. 2000-11-4.
[3] Jacobsen G, Fernholz H, Freudenberger D. Process for the continuous preparation of hydroxypivaldehyde: US, 3935274 [P]. 1967-01-27.
[4] 梁荣宁, 孙培生, 叶庆国. 羟戊醛的合成及其动力学研究 [J]. 化工中间体. 2007, 12:15-17. Liang Rongning, Sun Peisheng, Ye Qingguo. Study on synthesis and kinetics of hydroxypivalaldehyde [J]. Chemical Intermediate. 2007, 12(?):15-17.
[5] 吕志果, 郭振美, 刘香兰. 由异丁醛和甲醛缩合加氢合成新戊二醇的过程研究 [J]. 山东化工. 2003, 32(2):6-8. Lv Zhiguo, Guo Zhenmei, Liu Xianglan. Preparation technology of neopentyl glycol by condensation and hydrogenation from iso-butylaldehyde and formaldehyde [J]. Shandong Chemical Industry, 2003, 32(2):6-8.
[6] Choi J U, Jung S M, Lee K H, et al. Process for the continuous production of neopentyl glycol: US, 6201159B1 [P]. 2001-03-13.
[7] Don L, Billy W, Thomas W. Process for the production of neopentyl glycol: US, 4855515 [P]. 1989-08-08.
[8] Sirch T, Steiniger M, Maas S, et al. Method for producing hydroxyl pival dehyde and neopentyl glycol: US, 7767865B2 [P]. 2010-08-03.
[9] Tike M A, Gharde A M, Mahajani V V. Studies to aid process development for the manufacture of neopentyl glycol from isobutyraldehyde: aldol condensation followed by hydrogenation [J]. Chem Eng, 2008, 3(3):333-346.
[10] 章意坚. 新戊二醇合成的研究 [D]. 浙江: 浙江大学出版社, 2006.
[11] 楼芝英, 王法强. 钯催化剂丙烯腈气相加氢动力学研究 [J]. 上海师范大学学报(自然科学版), 2004, 33(2):73-77. Lou Zhiying, Wang Faqiang. Study on kinetics of gas phase hydrogenation with Pd catalyst of acrylonitrilc [J]. Journal of Shanghai Normal University(Natural Sciences). 2004, 33(2):73-77.
[12] 黄华江. 实用化工计算模拟-MATLAB在化学工程中的应用 [M]. 北京: 化学工业出版社, 2004:246-249.
Study on Synthetic Process and Kinetics of Hydroxypivalaldehyde
Liu Qiqiong1,2, Yu Penghao1,3, Cheng Shuang1,3, Zhang Xinping1,3
1. Technology Research Institute of Shanghai Huayi Group, Shanghai 200241, China;
2. Chemical Engineering Institute, East China University of Science and Technology, Shanghai 200237, China;
3. Computational Chemistry and Chemical Engineering Technology Research Center of Shanghai, Shanghai 200241, China
Hydroxypivalaldehyde (HPA) is an important intermediate for synthesizing many fine chemicals. In this paper, orthogonal design was used for the process conditions optimization of synthesizing hydroxypivalaldehyde by condensation reaction with formaldehyde and isobutylaldehyde using organic amine aqueous solution as catalyst. The reaction kinetics was also studied and the optimal reaction conditions were found to be as follows: catalyst loading 3%, reaction temperature 75 ℃, molar ratio of formaldehyde to isobutylaldehyde 1.1:1, reaction pressure 0.3 MPa and the reaction time 80 min, under which the HPA yielded 98.33%. The kinetics experimental results further indicated that the apparent activation energy for this condensation main and side reaction were 40.80 kJ/mol and 64.09 kJ/mol respectively, and the reaction orders for isobutyraldehyde, formaldehyde and hydroxypivalaldehyde were 1, 1.2 and 2 respectively. Both residual analysis and the statistic tests showed that the proposed kinetic models were reliable.
formaldehyde; isobutyraldehyde; hydroxypivalaldehyde; condensation; kinetics
TQ643.1
A
1001—7631 ( 2016 ) 01—0066—07
2015-06-30;
2015-09-15。
刘齐琼(1988—),女,助理工程师;程 双(1985—),女,工程师,通讯联系人。E-mail:chengshuang@shhuayi.com。

