红景天苷对博莱霉素诱导大鼠肺纤维化后VEGF及MMP表达的影响
李善华,黄 萍,陈 琴,何华琼
红景天苷对博莱霉素诱导大鼠肺纤维化后VEGF及MMP表达的影响
李善华1a,黄 萍1b,陈 琴1a,何华琼2*
目的 观察红景天苷对大鼠肺纤维化动物模型肺组织血管内皮生长因子(VEGF)及基质金属蛋白酶(Matrix Metalliproteinase,MMP)表达的影响,探讨其作用机制。方法 Wistar大鼠36只,随机分为对照组、模型组、红景天苷组。模型组和红景天苷组经气管内注射博莱霉素诱导大鼠肺纤维化,对照组注射等体积生理盐水。1周后红景天苷组经尾静脉注射1%红景天苷2 mL/(kg·d),1次/d,连续注射治疗14 d;对照组、模型组给予等体积生理盐水。采用ELISA法检测大鼠肺组织VEGF蛋白,采用反转录聚合酶链反应法测定其VEGF-mRNA表达,免疫组织化学染色法检测大鼠肺组织中MMP (MMP-1、MMP-2、MMP-3、MMP-9、MMP-13)与金属蛋白酶组织抑制剂-1(Tissue inhibitor of metalloproteinase-1,TIMP-1)表达,并检测外周血超氧化物歧化酶(SOD)、过氧化氢酶(CAT)水平。结果 治疗14 d后,红景天苷组VEGF蛋白及VEGF-mRNA、TIMP-1、外周血 SOD 及CAT升高,MMP-2、MMP-9表达降低,与模型组比较差异有统计学意义(P<0.05)。结论 红景天苷可上调肺纤维化模型大鼠肺组织VEGF蛋白及VEGF-mRNA的表达,增强SOD及CAT酶活性,减轻血管内皮炎症反应造成的纤维增生,调节MMP-2、MMP-9及TIMP-1的平衡,抑制博莱霉素诱导肺纤维化病理改变和进程。
红景天苷;肺纤维化;血管内皮生长因子;基质金属蛋白酶;金属蛋白酶组织抑制剂-1
0 引言
肺纤维化属“喘症、肺痿”范畴,病因复杂多样,以肺成纤维细胞增殖及肺泡间质性炎症为主,病理特点是长期慢性肺部炎症及肺泡持续性损伤导致细胞外基质金属蛋白酶(Matrix Metalliproteinase,MMP)聚集,特别是MMP-2、MMP-9异常增多,金属蛋白酶组织抑制剂-1 (Tissue inhibitor of metalloproteinase-1,TIMP-1)降低,使其平衡关系破坏,导致肺大量细胞外基质(Extracellular matrix,ECM)聚集,组织细胞重构和胶原过度沉积[1]。同时可能抑制组织VEGF表达,降低肺微、小静脉血管的通透性,抑制血管内皮细胞分裂增殖及血管再生[2],加重肺组织损伤,并最终导致弥漫性肺间质疾病-肺纤维化。目前无有效的抗纤维化药物,常用糖皮质激素抗炎以降低抗纤维化进程,但疗效有限。有研究表明,红景天具有扶正固本、清热润肺、补气养血之功效,对器官纤维化和肺损伤有一定的防治作用[3],但是否具有治疗肺纤维化的药理作用尚未明确。本研究采用免疫组化方法,观察博莱霉素诱导建立大鼠肺纤维化模型肺组织中的血管内皮生长因子(VEGF)蛋白及VEGF-mRNA表达、MMP亚型及其抑制剂TIMP-1的变化,以分析红景天苷对大鼠肺纤维化病理改变的干预作用,为其可能用于临床治疗及预防肺纤维化提供实验依据。
1 材料与方法
1.1 实验动物及分组 Wistar大鼠36只,SPF级,雌雄各半,鼠龄50~55 d,体重(180±20) g,实验动物生产许可证SCXK(鄂)2011-0008。采用随机数字表编号后随机分为对照组、模型组、红景天苷组,每组12只。动物房湿度控制在50%~75%,温度18~25 ℃,动物自由饮水,分笼饲养,自然光照,普通饲料喂养。本研究中实验动物由湖北医药学院实验动物中心提供,动物处置方法均符合动物伦理学及实验动物福利标准[4]。
1.2 药品与试剂 红景天苷粉(杭州正大青春宝药业有限公司,10 mg/瓶,批号:GR0532),使用前用蒸馏水配制成1%溶液,保存于4 ℃冰箱备用。博莱霉素(日本株式会社),使用前用生理盐水稀释成0.5 U/mL溶液于4 ℃冰箱暂存备用。鼠抗鼠MMP单克隆抗体(NEO Mark-ers公司提供),鼠抗鼠TIMP-1多克隆抗体(武汉博士德公司提供),大鼠VEGF试剂盒、提取mRNA试剂及反转录试剂(上海酶联生物科技有限公司)。
1.3 大鼠肺纤维化模型造模及给药方法 参照文献[5],所有动物在造模前夜均停止喂食,不禁水,2%戊巴比妥钠(120 mg/kg)腹腔注射麻醉,仰卧位固定于小动物手术台,碘伏消毒后无菌操作,切开大鼠颈部皮肤后,用玻璃分针钝性分离大鼠气管,用5 mL注射器将配制好的0.5 U/mL博莱霉素溶液(5 mg/kg)经气管灌入模型组和红景天苷组,对照组灌入等体积生理盐水,灌入后立即将大鼠头上尾下直立并左右旋转大鼠,使药物均匀灌入动物双肺,缝合颈部皮肤,再用碘伏消毒。本造模方法简单,成功率达100%。造模后1周,红景天苷组大鼠经尾静脉注射1%红景天苷溶液2 mL/(kg·d),按此剂量连续预处理14 d,对照组及模型组注射等量生理盐水对照。
1.4 检测指标及方法 三组动物分别于造模后和治疗14 d时经尾静脉取外周静脉血,检测外周血超氧化物歧化酶(SOD)、过氧化氢酶(CAT)水平。参照文献[6],三组大鼠取血后分2次断头处死(造模后和治疗14 d,每组6只),剪开胸腔,先取动物右肺组织于-4 ℃冰箱暂存,以备VEGF检测。之后结扎右侧主支气管,用4%多聚甲醛灌入气管内至左肺膨胀,边缘变锐、胸膜平展后结扎左主支气管,将肺组织标本置于4%多聚甲醛溶液中固定,24 h后取左侧肺常规石蜡包埋、切片,用免疫组织化学染色法观察大鼠肺组织中MMP亚型及TIMP-1表达。检测VEGF时,先暂存右肺组织,研磨、组织匀浆,以3 000 r/min高速离心,取上清液,严格按SP试剂盒说明操作,采用ELISA法检测肺组织VEGF蛋白,应用反转录聚合酶链反应法测定其VEGF-mRNA表达。
2 结果
2.1 红景天苷对大鼠肺组织MMP的影响 见表1。对照组、模型组及红景天苷组的TIMP-1分别为8.75±0.67、5.72±0.43、8.17±0.56。对照组大鼠肺组织MMP亚型及TIMP-1均有少量表达,在造模及治疗14 d后保持在相对平衡状态。模型组大鼠MMP-2、MMP-3、MMP-9表达在造模及治疗14 d后均升高,TIMP-1降低,与对照组比较差异有统计学意义(P<0.05)。治疗14 d后,红景天苷组的MMP-2、MMP-9表达降低,TIMP-1表达上调,与模型组比较差异有统计学意义(P<0.05)。
2.2 红景天苷对大鼠肺组织VEGF蛋白及VEGF-mRNA表达的影响 见表2。造模及治疗14 d后,对照组大鼠肺组织VEGF蛋白及VEGF-mRNA表达无明显变化(P>0.05);模型组VEGF蛋白、VEGF-mRNA表达明显降低,与对照组比较差异有统计学意义(P<0.05)。治疗14 d后,红景天苷组VEGF蛋白及VEGF-mRNA表达增强,与模型组比较差异有统计学意义(P<0.05)。
2.3 红景天苷对大鼠外周血SOD、CAT酶活性的影响 见表3。造模及治疗14 d后,对照组大鼠外周血SOD、CAT酶活性均无明显变化(P>0.05)。治疗14 d后,模型组大鼠外周血SOD、CAT酶活性降低,与对照组比较差异有统计学意义(P<0.05);红景天苷组大鼠外周血SOD、CAT酶活性增强,与模型组比较差异有统计学意义(P<0.05)。
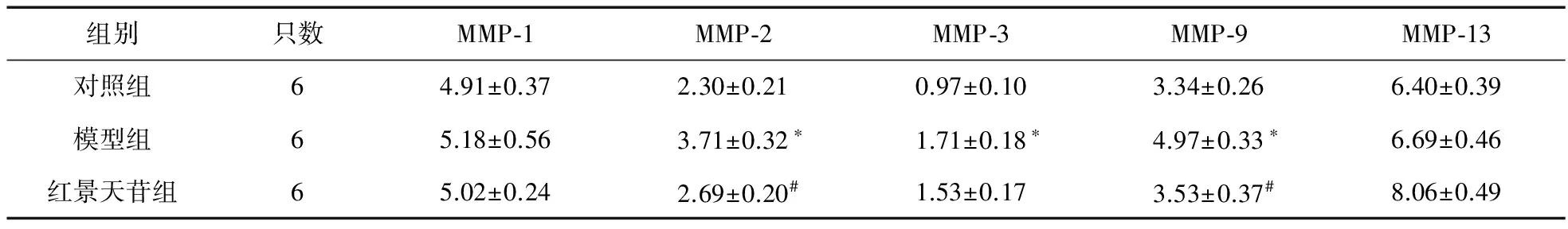
表1 大鼠肺组织MMP比较(ng/L)
注:*与对照组比较,P<0.05;#与模型组比较,P<0.05

表2 大鼠肺组织VEGF蛋白及VEGF-mRNA表达比较
注:*与对照组比较,P<0.05;#与模型组比较,P<0.05
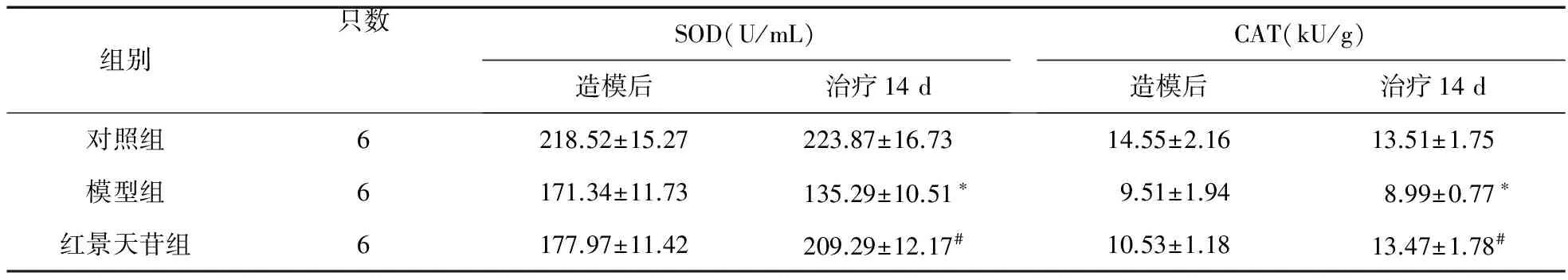
表3 大鼠外周血SOD、CAT水平比较
注:*与对照组比较,P<0.05;#与模型组比较,P<0.05
3 讨论
红景天主要产于高寒地带,西藏、青海、四川、东北三省等均有种植,属景天科植物,其药性寒、味甘涩,归脾肺经[7],《神农本草经》誉其为“高原人参”、“东方神草”[8],以藏红景天为上品。药用其根茎,后者富含红景天苷、没食子酸、二苯甲基六氢、β-谷甾醇吡啶等多种有机化合物[9]。红景天苷(Salidroside,SAL)是其主要有效成分,具有滋补壮阳、抗缺氧及消除疲劳的作用[10],可增强组织耐缺氧,提高免疫力,抑制脂质过氧化,清除组织氧自由基,还具有上调缺血组织VEGF蛋白及VEGF-mRNA表达的作用[11]。
本研究中,治疗后,模型组大鼠VEGF蛋白及VEGF-mRNA、TIMP-1、外周血 SOD 及CAT明显降低,各视野MMP-2、MMP-9表达增强,说明博莱霉素诱导大鼠肺纤维化病理改变成功,肺纤维化VEGF蛋白及VEGF-mRNA、MMP-2、MMP-9过度表达,MMP-2、MMP-9与TIMP-1失衡密切相关。与模型组比较,红景天苷组VEGF蛋白及VEGF-mRNA、TIMP-1、外周血SOD及CAT明显升高,各视野MMP-2、MMP-9表达降低。VEGF蛋白及VEGF-mRNA表达上调,提示红景天苷具有促进肺纤维化后大鼠VEGF分泌的作用,与石惠荣等[12]研究结果(红景天注射液诱导缺血心肌的血管再生、促进受损血管内皮修复的功能)相似。贾凤玖等[13]研究显示,红景天可增强血管Na+-K+-ATP酶活力,阻止Ca2+内流,减少细胞内钙超载而改善组织能量代谢,诱导缺血组织血管再生、改善微循环而起组织保护作用。本实验中,VEGF蛋白及VEGF-mRNA表达上调是否与之有关无直接证据。肺纤维化时,肺泡间质性炎症,成纤维细胞增殖,大量细胞外ECM聚集,由于ECM反复破坏、修复、重构和胶原过度沉积造成肺纤维化。而MMP中MMP-2、MMP-9与TIMP-1是降解ECM的一组特异酶,其比例失衡是造成肺纤维化发生及发展的关键,MMP-2、MMP-9增加时ECM降解作用也增强,此降解病理过程会造成肺组织的损伤,触发肺纤维化[14]。红景天苷组TIMP-1活性增强,MMP-2、MMP-9表达降低,说明红景天苷可增强TIMP-1活性,抑制MMP-2、MMP-9的合成与活化,使纤维化期MMP-2、MMP-9与TIMP-1失衡得以恢复,间接降低ECM降解,延缓甚至抑制纤维化进程。另外,机体氧自由基的生成与清除处于动态平衡中,血管内皮及功能正常,当组织纤维化病理改变时,MMP-2、MMP-9与TIMP-1失衡造成的肺纤维化可能导致组织灌注不足,机体SOD、CAT等自由基清除酶活性急剧降低,造成自由基清除酶对氧自由基清除能力下降,加重肺纤维化进程[15]。机体在发生脂质过氧化反应时,产生的有害代谢产物过氧化氢对组织器官造成严重损害,而CAT可清除体内过氧化氢,SOD也可减轻组织细胞避免受过氧化氢的损害[16-18]。本研究显示,红景天苷明显增强SOD、CAT酶活性,说明其可增强SOD、CAT等自由基清除活性酶的活性,抑制有害代谢产物过氧化氢造成的脂质过氧化反应,间接降低肺纤维化对肺组织的破坏。
[1]苏韫,张毅,李娟,等.红芪黄酮对肺纤维化模型大鼠基质金属蛋白酶-2及其抑制剂-1蛋白表达的影响[J].中国中医药信息杂志,2015,2(1):47-48.
[2]王勤,于俊民,张小波,等.中药对缺血心肌血管内皮细胞生长因子、碱性成纤维细胞生长因子水平的影响[J].中国医药导报,2013,10(7):30-32.
[3]李艳娇,张晓荧,周微,等.大株红景天注射液的临床应用分析[J].实用药物与临床,2015,18(2):199-201.
[4]顾宪红.动物伦理与动物福利[J].兰州大学学报:社会科学版,2015,43(3):49-52.
[5]王媛媛,王庆,杨文海,等.红景天对肺纤维化大鼠MMP-2与TIMP-1表达关系的影响[J].重庆医科大学学报,2010,35(5):690-691.
[6]姚婷,郑洁,胡国信,等.羟基喜树碱对肺纤维化大鼠MMP-1、TIMP-1及I型胶原的影响[J].实用医学杂志,2013,2(19):3133-3136.
[7]曹俊岭,薛春苗,王艳梅,等.红景天颗粒体内外抗氧化作用研究[J].中国药学杂志,2014,49(14):1222-1223.
[8]杨雷,刘暖,毛秉豫,等.红景天苷上调大鼠心肌梗死后心肌组织VEGF的表达[J].南阳理工学院学报,2013,5(6):120-121.
[9]谢卉,王珍,季燕,等.红景天苷对Tourette综合征模型大鼠抽动行为的影响[J].中国中西医结合杂志,2016,1(1):90-93.
[10]雷尚芳,郭俐宏,鲍升娟,等.红景天苷对大鼠急性心肌缺血/再灌注损伤离体心脏心功能的影响[J].实用药物与临床,2015,18(11):1289-1892.
[11]杨萍,彭吉霞,陈德森,等.大株红景天注射液对大鼠心肌缺血预处理血管内皮生长因子的影响[J].现代中西医结合杂志,2015,24(7):710-712.
[12]石惠荣,王德伟,赵丹丹,等.大株红景天注射液治疗缺血性心肌病伴心力衰竭的效果及对血清hsCRP、VEGF的影响[J].河北医科大学学报,2016,13(2):129-132.
[13]贾凤玖,姚卫华,赵青山,等.红景天注射液和红景天注射液联合应用对急性心肌梗死患者肌钙蛋白T的影响[J].中西医结合心脑血管病杂志,2013,11(11):1385-1386.
[14]李丛锋,朱光发.基质金属蛋白酶-2、基质金属蛋白酶-9与急性肺损伤关系的研究进展[J].国际呼吸杂志,2011,31(14):1097-1099.
[15]袁红,周慧霞,兰秋艳,等.芦丁对脂多糖诱导急性肺损伤小鼠的作用及机制[J].实用药物与临床,2015,18(9):1011-1014.
[16]刘沛,蔡宏斌,刘志艳,等.大珠红景天对高原急性脑梗死患者血清超氧化物岐化酶、丙二醛等指标水平的影响[J].中华全科医学,2016,12(2):176-178.
[17]陈伟,欧阳劭,何振华,等.辛伐他汀对肺纤维化鼠肺组织血管新生及VEGF和PF4基因表达的影响[J].实用医学杂志,2014,30(17):2711-2714.
[18]杨洁.大株红景天注射液治疗特发性肺纤维化的临床研究[J].中医临床研究,2014,6(17):8-9.
Effect of salidroside on the expression of VEGF and MMP in rats with bleomycin induced pulmonary fibrosis
LI Shan-hua1a,HUANG Ping1b,CHEN Qin1a,HE Hua-qiong2*
(1.a.Department of Respiratory,b.Department of Dermatology,Shiyan Taihe Hospital,the Affiliated Hospital of Hubei Medical College,Shiyan 442000,China;2.Department of Internal Medicine,Hubei Medical College,Shiyan 442000,China)
Objective To observe the effect of salidroside on the expression of vascular endothelial growth factor (VEGF) and matrix metalloproteinases (MMP) in rat model of bleomycin-induced pulmonary fibrosis,and explore the mechanism.Methods Totally 36 Wistar rats were randomly assigned to control group,model group and salidroside group.Rats in model group and salidroside group were injected with bleomycin via the tail vein to induce pulmonary fibrosis,and rats in control group were injected with equal volume of saline.Rats in salidroside group were injected with 1% salidroside 2 mL/(kg·d) via the tail vein (once daily) after 1 week for 14 d,while rats in control group and model group were given the same volume of normal saline.The VEGF protein in lung tissue was measured by ELISA,and the expression of VEGF mRNA was detected by reverse transcription polymerase chain reaction method.The expression of MMP (MMP subtype included MMP-1,MMP-2,MMP-3,MMP-9 and MMP-13) and tissue inhibitor of metalloproteinase-1 (TIMP-1) in the lung tissue of rats was detected by immunohistochemical staining,and the levels of superoxide dismutase (SOD) and catalase (CAT) in peripheral blood were determined.Results The VEGF protein,VEGF-mRNA,TIMP-1,SOD and CAT in peripheral blood increased significantly (P<0.05) after 14 d treatment,while the expression of MMP-2 and MMP-9 decreased (P<0.05).Conclusion Salidroside can up-regulate the expression of VEGF protein and VEGF mRNA,enhance the activity of SOD and CAT enzyme,reduce the fiber hyperplasia induced by vascular endothelial inflammatory response,regulate the balance of MMP-2,MMP-9 and TIMP-1,and inhibit the pathological changes and processes of bleomycin-induced pulmonary fibrosis.
Salidroside;Pulmonary fibrosis;Vascular endothelial growth factor;Matrix metalloproteinases (MMP);Tissue inhibitor of metalloproteinase-1 (TIMP-1)
2016-04-19
1.十堰市太和医院(湖北医药学院附属医院),a.呼吸内科,b.皮肤科,湖北 十堰 442000;2.湖北医药学院机能实验室,湖北 十堰 442000
*通信作者
10.14053/j.cnki.ppcr.201611005

