羊粪低温沼气发酵细菌群落多样性分析
代金平,陈竞,古丽·艾合买提,买尔哈巴,杨新平,冯蕾
(新疆农科院微生物应用研究所,乌鲁木齐 830091)
羊粪低温沼气发酵细菌群落多样性分析
代金平,陈竞,古丽·艾合买提,买尔哈巴,杨新平,冯蕾
(新疆农科院微生物应用研究所,乌鲁木齐 830091)
【目的】研究不同处理羊粪低温沼气发酵液的细菌群落多样性,为羊粪低温沼气发酵菌剂制备提供理论依据。【方法】对不同处理羊粪沼液总DNA进行16S rDNA V3区PCR扩增,扩增产物进行变性梯度凝胶电泳(DGGE)分离、回收、测序,BLAST软件比对分析,构建发育树;同时利用Biolog-ECO法对沼液样本进行微生物功能多样性分析。【结果】PCR-DGGE方法结果显示,在低温条件下(15℃),在发酵各阶段均存在共有优势菌群,包括梭菌属 (Clostridiumsp.)、拟杆菌属(Bacteroidalesbacterium)、假单胞菌属(Pseudomonassp.)、Proteiniphilumsp.等,其中菌剂III处理的4号为最优发酵试验组,主要为梭菌属(Clostridiumsp.)表现有较高的丰度;Biolog-ECO法分析结果显示,在15℃培养条件下,产气高峰期处理2、3和4中,碳代谢活性相对较高,产气量也比对照组高。通过微生物群落的多样性分析发现,处理2的均匀性指数均高于其它处理组。处理3和4的微生物群落的丰富度、优势度指数相对较高。【结论】在低温条件下(15℃)的不同处理中,添加配伍III(配伍I+2 g ZHC固体菌剂)发酵效果最优。
羊粪;沼气;细菌;低温;PCR-DGGE;16S rDNA;多样性
0 引 言
【研究意义】沼气发酵过程是一个极其复杂的过程。包括水解阶段、产酸阶段和产甲烷阶段。在不同阶段中微生物菌群结构也不同。变性梯度凝胶电泳(Denatured Gradient Gel Electrophoresis,DGGE)是根据DNA的接连特性、DNA双螺旋结构的不同碱基的组成发生变性所需要的变性剂浓度不同,在变性梯度凝胶电泳时,随着浓度的不断增加,电泳的迁移率也不同,从而分离不同DNA分子。Biolog板培养方法中,可由颜色平均变化率来反应单一碳源代谢活性。平均颜色变化率( AWCD)是判断土壤微生物群落利用碳源能力的重要指标之一,代表微生物的代谢活性。【前人研究进展】对沼气池中细菌群落的研究表明,微生物群落在沼气池的不同层次上呈现出空间分布多样性的差异,经过富集培养后,微生物群落的多样性及特异性会发生很大的差别[1-3]。【本研究切入点】利用PCR-DGGE技术对不同发酵阶段羊粪沼液细菌优势菌群多样性变化规律进行分析,利用 Biolog-ECO法对发酵高峰期的细菌群落功能多样性进行分析。【拟解决的关键问题】研究低温条件下,分析羊粪沼气发酵细菌优势菌群多样性变化规律及功能,为羊粪低温沼气发酵促进剂的制备提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 材料的准备与取样
称取自然晾干,粉碎后的羊粪220 g分别装于2 L模拟发酵瓶中,再分别加入自筛促进菌剂配伍,其中ZHC菌为实验室自筛菌株巴氏醋杆菌(Acetobacterpastcurianum)[4](配伍I添加Fe3+∶Ni2+0.1∶0.02 mg/L·d));配伍II(配伍I+2 g 固体酱渣);配伍III(配伍I+2 g ZHC固体菌剂)),最后加水至1 500 g,混匀,连接集气装置,制备模拟沼气发酵罐,处理1、2、3、4置于15 ℃恒温培养,处理5置于30 ℃恒温培养。分别在发酵第0、30、60、180 d取发酵沼液样品进行分析。表1
表1 不同样品处理
Table 1 Different sample processing table

编号No.处理(℃)processing菌剂的组成Componentofhandleah115(对照)215配伍I(Fe3+∶Ni2+0.1∶0.02mg/L·d)315配伍Ⅱ(配伍I+2g固体酱渣)415配伍Ⅲ(配伍I+2gZHC固体菌剂)530(对照)
1.2 方 法
1.2.1 沼气日产气量测定
产气量的测定采用液压原理,当反应装置的压力过大时,会迫使装满水的容器中的水溶液移至到另一空瓶中,每隔24 h测量量筒水的体积即为相对日产气量,连续测量180 d。
1.2.2 沼液样品总DNA提取及16S rDNA V3片段 PCR扩增
沼液总DNA提取方法参考陈竞等[5]的方法。
沼液总DNA 16S rDNA V3片段以341F-GC(5'-CGCCCGCCGCGCGCGGC GGGCGGGGCGGGGGCACGGGGGGCCTACGGGAGGCAGCGA-3')和 518R (5'-ATTACCG CGGCTGCTGG-3')为引物进行PCR扩增[6],引物由上海生物工程技术服务有限公司合成。
PCR 反应体系为:DNA模板1 μL,引物各1 μL,2×PCR mix 25 μL,ddH2O 22 μL。PCR扩增条件为:95℃,4 min;94℃,30 s;63℃,40 s;72℃,30 s,30个循环;72℃,10 min。PCR产物在0.8%琼脂糖凝胶中电泳检测。
1.2.3 16S rDNA V3区域的两种胶浓度DGGE分析
参考胡宇容等[7]方法,DGGE的浓度为8%,变性剂梯度为40%~60% (100%的变性剂浓度为:尿素7 mol/L、甲酰胺40%),回收DGGE图谱最下端条带,对其再次扩增后进行变性剂浓度为50%~70%梯度分离。电泳条件为60℃、75V电泳16~18 h,经EB染色后,应用GK-330C凝胶成像系统进行观察分析。
1.2.4 不同处理阶段沼液样品DGGE优势条带回收及测序
回收DGGE优势条带和不同处理的差异条带,采用柱式PAGE胶DNA回收试剂盒进行回收,并以此为模板,以不带GC夹板的引物341F和518R分别进行PCR扩增,用0.8%的琼脂糖凝胶电泳检测。送北京六合华大基因科技股份有限公司进行纯化测序。将测序结果提交至NCBI,Blast找出最相近的细菌种类,利用MEGA5.0软件,以邻接法(Neighbor-Joining,NJ)绘制进化树。
1.2.5 Biolog-ECO微平板法测定沼液微生物功能多样性
采用Biolog-ECO平板法对发酵高峰期样品的碳源代谢特征进行分析。取50 μL不同处理样品上层液,加入9 mL 0.9%的生理盐水中,混匀后,倒入加样槽,用排枪取150 μL,逐一加入 Biolog 板中,每个样加4排。接种好的平板置于25℃恒温培养箱内。每隔24 h测定OD590和OD750。连续培养7 d。
2 结果与分析
2.1 沼气不同阶段产气量
研究表明,在15℃培养条件下,在发酵0~30 d,产气总量相比较为处理4>处理2>处理3>处理1,其中处理4产气量达到764 mL;在发酵31~90 d,产气总量相比较为处理4>处理1>处理3>处理2,其中处理4产气量达到4 300 mL;在发酵91~180 d,产气总量相比较为处理4>处理2>处理3>处理1,其中处理4产气量达到11 500 mL。在30℃培养条件下的试验组的启动期产气量较大,产气量在0~30 d达到14 500 mL。图1
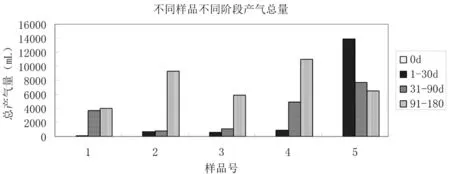
图1 不同处理不同阶段产气总量
Fig.1 Different samples at different stages of the total gas production
2.2 沼液细菌基因组DNA的提取
提取沼液总DNA结果显示,提取DNA片段大小约为20 kb以上,目标条带较好,可进行下一步实验。图2
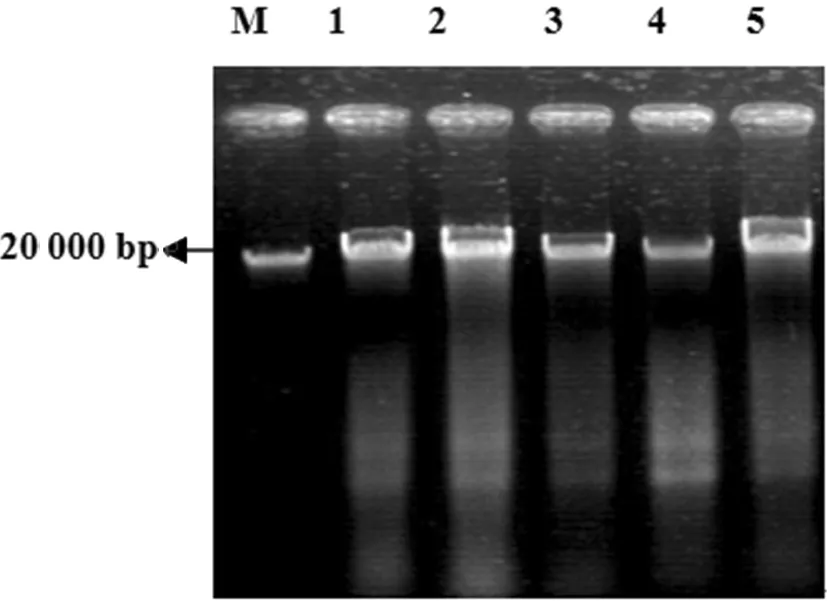
图2 沼液总 DNA 部分电泳图
Fig.2 A part of Agarose gel electrophoresis of total DNA
2.3 16S rDNA V3可变区域的PCR扩增结果
2.3.1 细菌16S rDNA V3可变区域的PCR扩增结果
以纯化的沼液总DNA为模板,进行16S rDNA V3区域的PCR扩增,获得PCR产物约为240 bp左右,与预计大小一致。经0.8%琼脂糖凝胶电泳检测,与目的条带一致,可进行后续试验。图3
2.3.2 细菌V3可变区片段DGGE分析
按照1.4所述方法进行DGGE电泳,电泳结果表明,随着发酵不同阶段,各条带从弱到强再到弱的过程,处理2中,条带3、4、11在发酵30 d有较高丰度,2、5、7、9在发酵90 d条带丰度明显,其中5和9号条带丰度最高。处理3中,条带4、11在发酵30 d有较高丰度,条带3、4、10在发酵180 d条带丰度明显。处理4中条带较为丰富,条带12、13在发酵起始丰度较明显,条带3在发酵30 d丰度明显增强,6、8、9、12、13在发酵90 d条带丰度明显,其中6和9号条带丰度最高。处理5(30℃)中也随着发酵时间的增长,菌群的条带逐渐减少, 3、4、11号条带在发酵30 d有较高丰度,发酵90 d仅4号条带丰度明显。同时,分别回收下层胶两个条带(上和下),对其再次进行DGGE 50%~80%胶浓度分离鉴定。图4
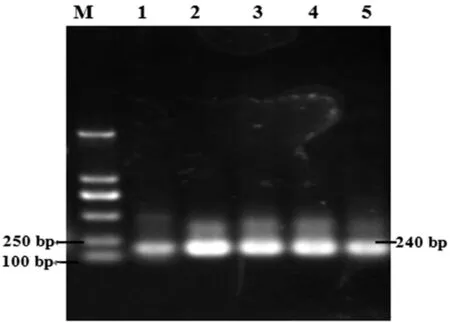
图3 16S rDNA V3 区 PCR 产物部分电泳图
Fig.3 A part of Agarose gel electrophoresis of 16S rDNA V3
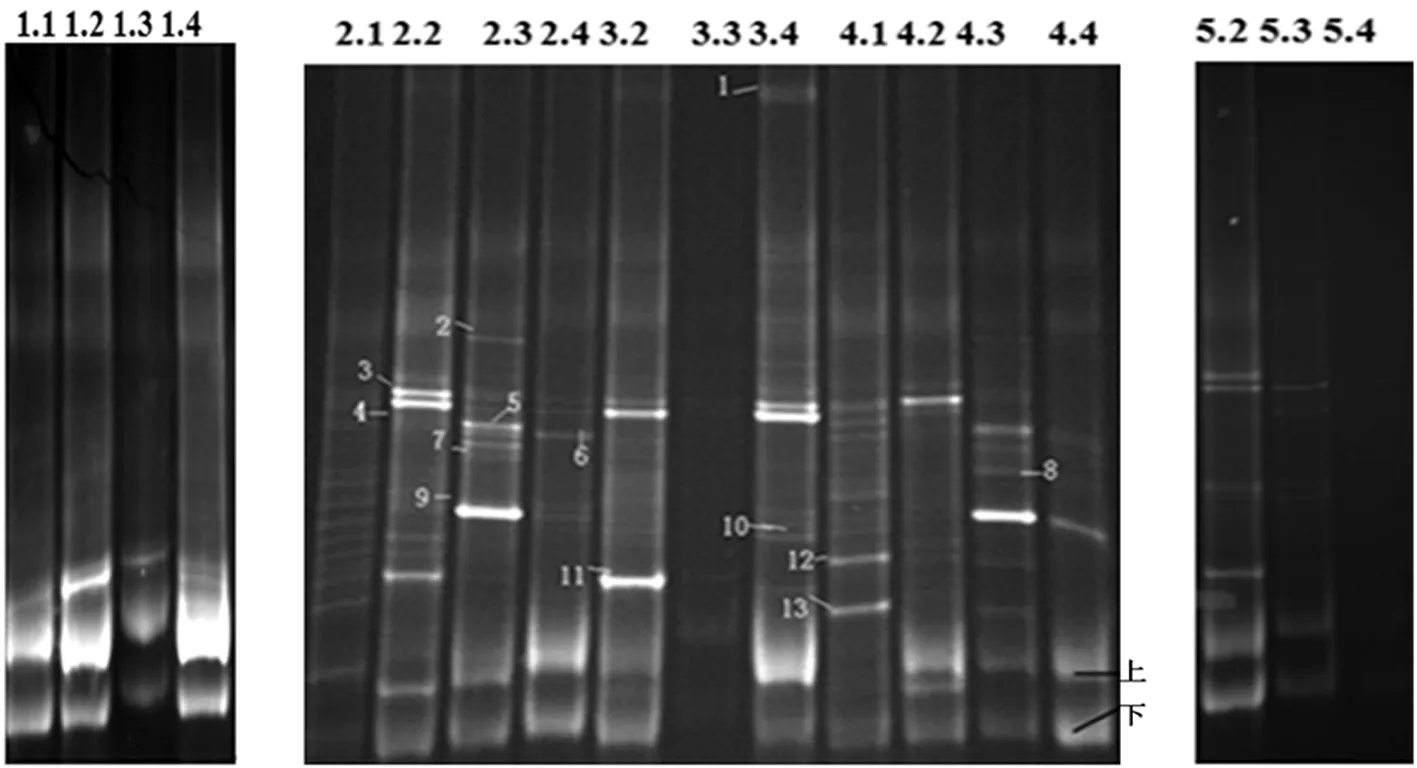
注:1.1、1.2、1.3、1.4为处理1发酵第0、30、90和180 d取相同体积的菌泥所提取的总DNA的16S rDNA V3片段PCR扩增产物的DGGE分析图谱(处理2、3、4、5为相同处理方法及编号)
图4 不同菌剂处理发酵过程中细菌动态变化 DGGE 电泳图
Fig.4 Changes of bacterial count of DGGE electrophoresis diagram of different microbes treatment in the fermentation process(40%-60%)
经切胶回收条带DNA作为模板进行PCR扩增、测序及分析,结果表明,1、3为紫单胞菌属(Prophyromonadaceaebacterium),2、4、5、6、7、8为假单胞菌属(Pseudomonassp.),9为梭菌属(Clostridiumsp.),10、12为拟杆菌属(Bacteroidetesbacterium), 11为德库菌属(Desemizasp.),13为毛螺菌属(Lachnospiraceaesp.)。
2.3.3 细菌V3可变区片段下层胶DGGE分析
DGGE胶浓度为40%~60%时,底层有2个条带丰富度较高,但回收后大部分无法测序,因此,回收底层丰富度较高的上和下2个条带,分别对其再次进行胶浓度为50%~80%的DGGE分离鉴定,结果表明,发酵过程中在发酵90 d时相对优势菌群条带比较丰度,其中处理2中d、e、k条带出现较高的丰度,处理3中f、g、h、n、o条带表现较高的丰度,处理4中f、g、h、n、o、m条带都具有较高的丰度,处理5在发酵30 d时条带最为丰富。图5
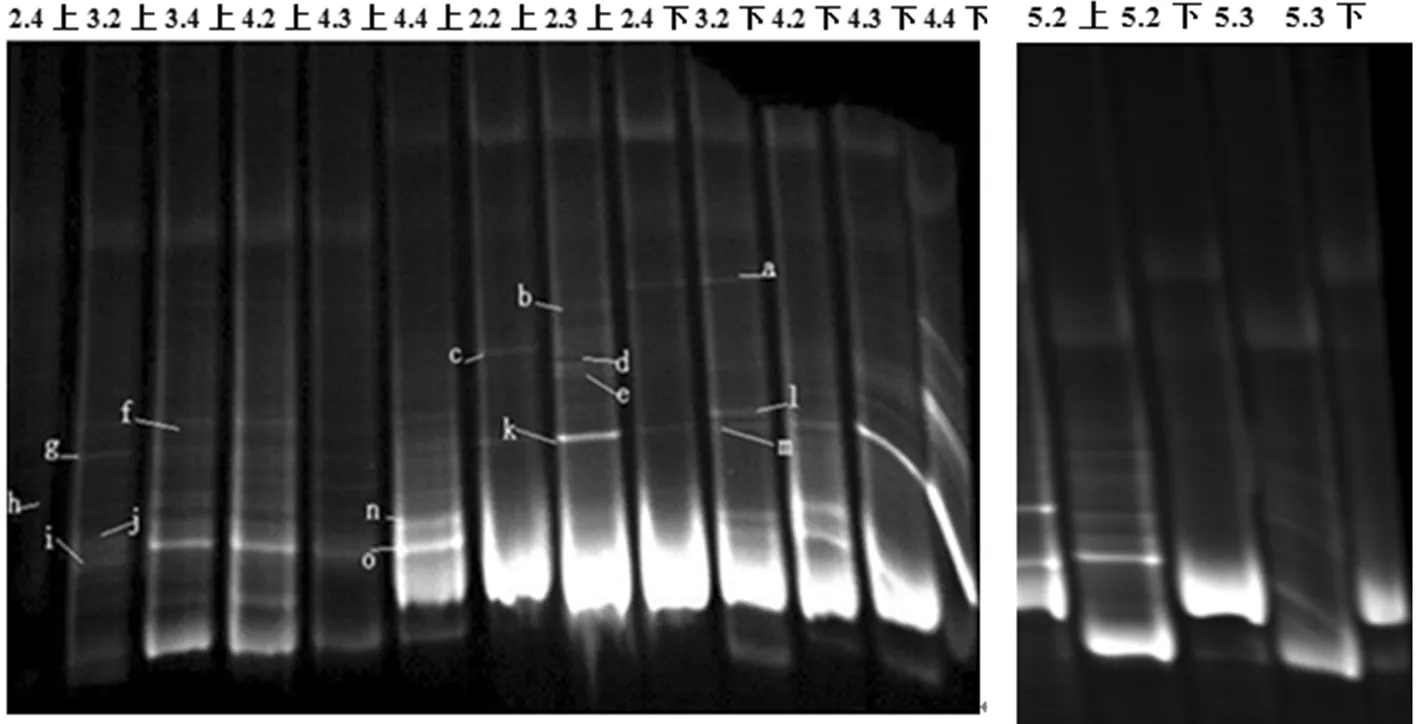
图5 下层胶不同菌剂处理发酵过程中细菌动态变化 DGGE 电泳
Fig.5 Changes of bacterial count of DGGE electrophoresis diagram of different microbes treatment in the fermentation process(50%-80%)
经BLAST对比检测:c为假单胞菌属(Pseudomonassp.),n、f、d、e、g、h为梭菌属(Clostridiumsp.),j、k为毛螺菌科(Lachnospiraceaesp.)。a、b条带序列无同源性对比结果。l、m、o未检测出结果。表2
2.3.4 细菌16S rDNA V3 可变区优势基因扩增及系统进化
回收上述优势条带和变化较明显的条带进行测序分析,所测得的序列在 GenBank 数据库中进行BLAST 比对分析,并采用MEGA5.0软件绘制系统进化树。进化树结果表明:28条带中分属于3个菌门4个纲6个属,其中,假单胞菌属(Proteiniphilumsp.)占29%,梭菌属(Clostridiumsp.)占25%,拟杆菌属(Bacteroidetessp.)占7.1%。图6
表2 条带序列的BLAST结果
Table 2 BLAST results of the sequences
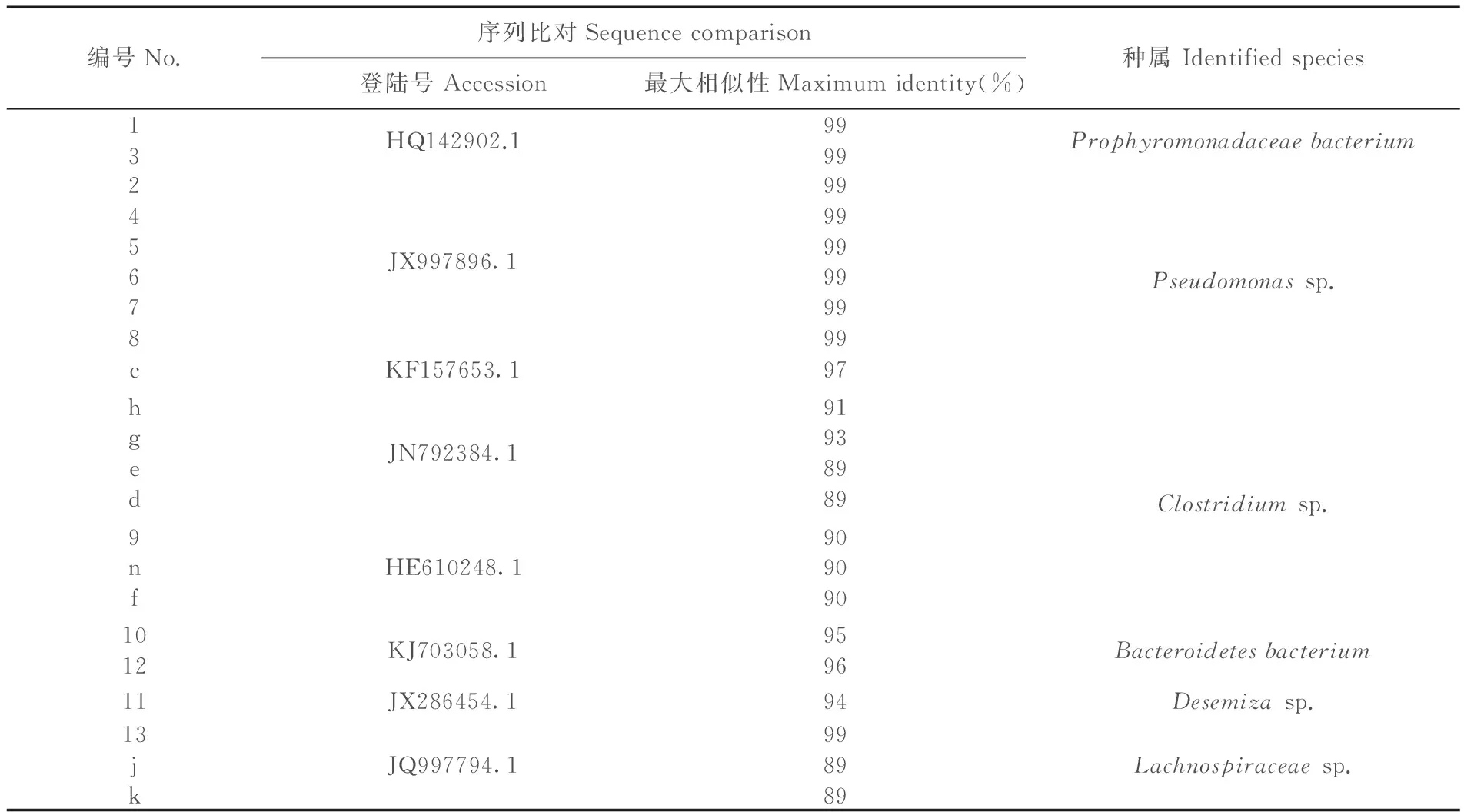
编号No.序列比对Sequencecomparison登陆号Accession最大相似性Maximumidentity(%)种属Identifiedspecies13HQ142902.19999Prophyromonadaceaebacterium245678JX997896.1999999999999cKF157653.197Pseudomonassp.hgedJN792384.1919389899nfHE610248.1909090Clostridiumsp.1012KJ703058.19596Bacteroidetesbacterium11JX286454.194Desemizasp.13jkJQ997794.1998989Lachnospiraceaesp.
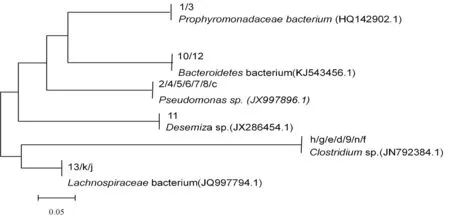
图6 不同处理羊粪沼气发酵优势细菌进化树
Fig.6 The cladogram of bacteria predominant under the different processing of cattles and sheep dung biogas fementation
2.3.5 不同处理微生物群落代谢平均颜色变化率及多样性指数
不同处理下,单一碳源代谢活性可由颜色平均变化率来反应。平均颜色变化率(AWCD)是判断土壤微生物群落利用碳源能力的重要指标之一,代表微生物的代谢活性。5组处理样品接种培养后,每隔24 h测定吸光值,消除原始菌浓影响后计算平均吸光值,连续7 d后,得到平均吸光值动态变化,结果表明,样品在24 h后,碳源利用强度开始上升。处理3和4的碳代谢活性较高,处理2在碳代谢水平较弱,处理5由于取样时间是在发酵末期,因此在碳代谢水平上也表现最弱。图7
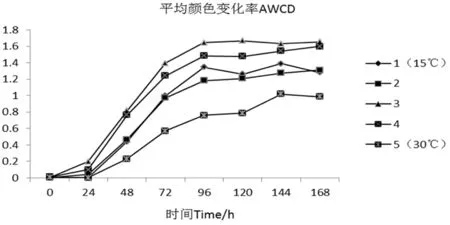
图7 不同处理生态板AWCD
Fig. 7 Ecological different treatments plate AWCD
研究表明,在发酵高峰阶段处理3和处理4的Simpson 指数(D)和Shannon-Wiener 指数(H’)均高于其他组,分别为0.980 2、0.979 5和4.798 7、4.735 8,处理2的McIntosh 指数(U)均高于其它组。在15℃培养条件下的处理样品的Simpson 指数(D)和Shannon-Wiener 指数(H’)均高于30℃培养条件下的处理5样品。表3
表3 有机肥微生物多样性指数
Table 3 Diversity indices of organic fertilizer microorganisms
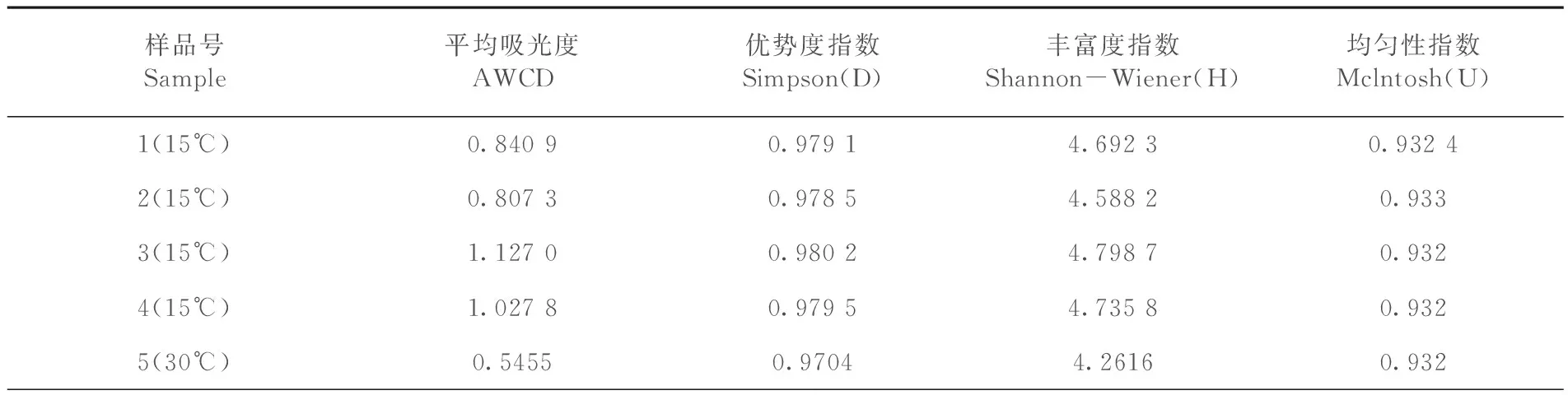
样品号Sample平均吸光度AWCD优势度指数Simpson(D)丰富度指数Shannon-Wiener(H)均匀性指数Mclntosh(U)1(15℃)0.84090.97914.69230.93242(15℃)0.80730.97854.58820.9333(15℃)1.12700.98024.79870.9324(15℃)1.02780.97954.73580.9325(30℃)0.54550.97044.26160.932
3 讨 论
3.1 研究通过PCR-DGGE技术,采用两种梯度浓度的分离方法,对不同处理羊粪沼气发酵液细菌多样性进行了对比分析研究。鉴定出的羊粪沼气优势菌群主要有,拟杆菌属菌、紫单胞菌科细菌、假单胞菌,梭菌属菌等,不同处理的样品在菌群的种类和数量上都有所变化。(1)在15℃条件下,添加菌剂处理后的反应器中优势菌的丰度比对照组中更高,在发酵前期中期和末期,细菌群落变化明显。(2)从回收的28条带中鉴定出的梭菌属(Clostridumsp.)占25%、拟杆菌属(Bacteroidetessp.)占7.1%、假单胞菌属(Pseudomonassp.)占29%。(3)在30℃条件下,优势菌群主要有Bacteroidalesbacterium、Pseudomonassp、Clostridialesbacterium。
实验中产气量最高的是添加菌剂Ⅲ的处理4,其优势条带在发酵前、中、后期变化明显,尤其是在发酵90 d后产气高峰期,优势条带变化明显,其中梭菌属(Clostridiumsp.)和假单胞菌(Pseudomonassp.)均表现有较高的丰度。同样的结果也出现在发酵90 d后产气较高的处理2样品中,其中梭菌属(Clostridiumsp.)条带亮度变化尤为明显。初步证明在低温条件下添加配伍III可能改变沼液中优势微生物种类和丰度的变化,尤其是梭菌属(Clostridiumsp.)的变化。
进化树结果也表明,回收的28条带中梭菌属(Clostridiumsp.)比例较高,菌剂处理对发酵体系微生物区系的影响还需进一步的研究。相关研究结果也表明,沼气池中微生物种类丰富,并且拥有优势群落,各细菌种类不同发酵层、不同发酵时间对微生物多样性存在影响[8]。假单胞菌(Pseudomonassp.)和拟杆菌(Bacteroidessp.)菌群在有机物的高效降解中发挥重要作用[9]。蒋建林等[10]对农村户用沼气池中细菌种类的研究结果表明,占优势的类群分别为Firmicutes(28%)、Delta-proteobacteria(18%)、Bacteroidetes(17%),大多数16 S rDNA序列与GenBank数据库中未培养细菌相似性最高(91%~99%)。宋金龙等[3]对沼气池的古菌和细菌研究结果也表明,微生物群落在沼气池的不同层次上呈现出空间分布多样性的差异,经过富集培养后,微生物群落的多样性及特异性发生了很大的差别。序列比对的结果显示,沼气池中的优势细菌为梭菌属(Clostridialessp.)和互养菌属(Syntrophussp.)。
3.2 利用DGGE分析复杂处理时,获得高分辨率的图谱是重要的前提条件。影响DGGE分辨率的因素很多,如DNA(或RNA)的提取、PCR扩增、电泳时间、电泳温度、凝胶浓度、变性剂梯度、染色方法等,在DGGE操作过程中的每一个环节都会对后续分析产生影响,沼液里的微生物群落结构庞大复杂,即使同样的发酵底物,来自不同处理的总DNA经DGGE分析,群落结构也会存在差异。因此,为了获得DGGE的最大分辨率,必须对全部环节进行优化,这一技术对实验试剂、仪器,操作人的要求都较高,需经过反复摸索才能掌握实验操作要领。后续将对低温下添加微生物菌剂对产甲烷古生菌的影响进行研究,为低温沼气发酵菌剂的进一步完善,提供理论指导。
3.3 利用Biolog-ECO法分析样品时,碳代谢活性反映了发酵微生物群落结构的变化,分析结果表明,在15℃培养条件下,产气高峰期处理2、3和4样品碳代谢活性相对较高,产气量也比对照组高。通过微生物群落的多样性分析发现,处理2的均匀性指数均高于其它处理组。处理3和4的微生物群落的丰富度、优势度指数均高于其他处理组。而且在处理2产气高峰期样品中条带5和9丰度较高,经BLAST对比分析为假单胞菌属(Pseudomonassp.)和梭菌属(Clostridiumsp.);在处理4的产气高峰期样品中条带6和9为优势条带,丰度较高,为假单胞菌属(Pseudomonassp.)和梭菌属(Clostridiumsp.),这两种菌群可能对低温条件下甲烷的产生具有一定的促进作用。
4 结 论
微生物群落结构多样性可能影响了发酵微生物群落功能的多样性。不同处理下,羊粪低温沼气发酵细菌群落比较丰富,添加配伍III的试验组4号为最优试验组,产气量效果为:配伍III>配伍I>配伍II。处理2、3和4对碳源的综合利用率较高,且其AWCD、物种丰富度、均匀度和优势度也较高。利用DGGE分子生物学技术对其分析结果为:在低温条件下(15℃)中,在发酵各阶段,群落结构均有所变化,但仍然存在共有优势菌群,主要包括梭菌属菌(Clostridiumsp.)、拟杆菌属(Bacteroidalesbacterium)、假单胞菌属(Pseudomonassp.)、Proteiniphilumsp.等。羊粪低温沼气发酵过程中细菌群落的分析表明,梭菌属(Clostridiumsp.)和假单胞菌属菌(Pseudomonassp.)对低温条件下沼气的发酵具有较好的促进作用。
References)
[1] Lee, C., Kim, J., Shin, S. G., O'Flaherty, V., & Hwang, S. (2010). Quantitative and qualitative transitions of methanogen community structure during the batch anaerobic digestion of cheese-processing wastewater.AppliedMicrobiology&Biotechnology, 87(5):1,963-1,973.
[2] 王刘阳,尹小波,胡国全.分子生物学技术在产甲烷古菌研究中的应用[J].中国沼气,2008,26(1):19-24.
WANG Liu-yang, YIN Xiao-bo, HU Guo-qi. (2008). Application of Molecular Biology Technology in Methanoarchaea Research [J].ChinaBiogas, 26(1):19-24.(in Chinese)
[3] 宋金龙,阮志勇,胡国全,等.沼泥及其富集物中微生物多样性和区系变化的分析[J].中国沼气,2010,28(2):3-11.
SONG Jin-long, RUAN Zhi-yong, HU Guo-quan, et al. (2010). Microbial Diversity and Community Composition in Biogas Sludge and Its Enriched Product [J].ChinaBiogas, 28(2):3-11. (in Chinese)
[4] 陈竞,苏艳,冯蕾.两株细菌纤维素产生菌发酵条件优化初探[J]. 新疆农业科学,2015,52(8):1 491-1 496.
CHEN Jing, SU Yan, FENG Lei. (2015). Two Strains of Bacterial Cellulose Producing Strain fermentation Technology Optimization [J].XinjiangAgriculturalSciences, 52(8):1,491-1,496. (in Chinese)
[5] 陈竞,冯蕾,杨新平,等.羊粪沼液微生物总DNA提取方法优化比较研究[J].新疆农业科学,2013,50(12):2 280-2 285.
CHEN Jin, FENG Lei, YANG Xin-ping, et al. (2013). The Optimization Extraction Methods of Total Microbial DNA of Sheep Dung Biogas Slurry [J].XinjiangAgriculturalSciences, 50(12):2,280-2,285. (in Chinese)
[6] 赵兴青,杨柳燕, 陈灿,等.基于不同引物的湖泊沉积物中细菌群落结构多样性的比较研究[J].南京大学学报,2008,44(3):289-296.
ZHAO Xing-qing, YANG Liu-yan, CHEN Can, et al. (2008). Study on the bacterial diversity in lake sediments based on different primers [J].JournalofNanjingUniversity, 44(3):289-296. (in Chinese)
[7] 胡宇容,叶小梅,常志州,等.沼气池微生物生态群落PCR-DGGE分析方法研究[J].江苏农业科学,2012,40(3):39-42.
HU Yu-rong, YE Xiao-mei, CHANG Zhi-zhou, et al. (2012). Study on the bacterial diversity in degesters with PCR-DGGE [J].JiangsuAgriculturalSciences, 40(3):39-42. (in Chinese)
[8] 徐庆贤,官雪芳,林碧芬,等.PCR-DGGE技术在智能化沼气池微生物多样性研究中的应用[J]. 福建农业学报,2013,28(6):597-603.
XU Qin-xian, GUAN Xue-fang, LIN Bi-fen, et al. (2013). Application of PCR-DGGE on Analyzing Microbial Diversity in Intelligent Biogas Digester [J].FujianJournalofAgriculturalSciences, 28(6):597-603. (in Chinese)
[9] 曹占平,张景丽,张宏伟. 电生物还原降解二氯酚的动力学特性及功能菌解析[J].高等学校化学学报,2013,34(4):964-969.
CAO Zhan-ping, ZHANG Jing-li, ZHANG Hong-wei. (2013).Kinetics and Functional Bacteria Analysis of Dichlorophenol Degradation by Electro-biological Reduction [J].ChemicalJournalofChineseUniversities, 34(4):964-969. (in Chinese)
[10] 蒋建林,周权能,车志群,等.PCR-RFLP技术分析沼气池厌氧活性污泥细菌的多样性[J].广西农业生物科学,2008,27(4):372-377.
JIANG Jian-ling, ZHOU Quan-neng, CHE Zhi-qun, et al. (2008). Bacterial diversity in household biogas digester sludge analyzed by PCR-RFLP [J].JournalofGuangxiAgriculturalandBiologyScience, 27(4):372-377. (in Chinese)
[11] 张琳,熊格生,吴莎莎,等.沼气池污泥微生物总DNA提取方法的比较[J].激光生物学报,2011,20(6):847-853.
ZHANG Lin, XIONG Ge-sheng, WU Sha-sha, et al. (2011). Comparison of Three Protocols for Total DNA Extraction of Microorganism in Biogas Digesters [J].ActaLaserBiologySinica, 20(6):847-853. (in Chinese)
[12] 王伟东,宁亚彬,王彦杰,等.复合菌系BYND-8的种群组成及其对沼气产量的影响[J].环境科学,2011,32(1):253-258.
WANG Wei-dong, NING Ya-bing, WANG Yan-jie, et al. (2011). Biodiversity of Mesophilic Microbial Community BYND-8 Capability of Lignocellulose Degradation and Its Effect on Biogas Production [J].EnvironmentScience, 32(1):253-258. (in Chinese)
[13] 王庆,阮志勇,高立洪,等.基于mcrA克隆文库和PCR-DGGE技术对羊粪为原料的农村户用沼气池产甲烷古菌的多样性研究[J].中国沼气,2012,30(3):3-13.
WANG Qin, RUAN Zhi-yong, GAO Li-hong, et al. (2012).Methanogenic Archaea Diversity in Rural Cow Manure Biogas Digester Determined by mcr A Clone Library and DGGE Analysis [J].ChinaBiogas, 30(3):3-13. (in Chinese)
Fund project:Supported by NSFC (31260016) and NSFC(21666038)
Analysis of the Diversity by Using Molecular Ecology Techniques for Sheep Slurry Bacterial Communities under Low Temperature Conditions
DAI Jin-ping, CHEN Jin, Guli Ahamat, Marhaba, YANG Xing-ping, FENG Lei
(ResearchInstituteofAppliedMicrobiology,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
【Objective】 The experiment aims to provide a theoretical basis of low-temperature test in sheep biogas fermentation microbial diversity for the preparation of sheep cryogenic methane fermentation agents.【Method】The total DNA 16S rDNA sheep manure slurry V3 region by different treatments was amplified by PCR and the amplified products were separated, recycled and sequenced by denaturing gradient gel electrophoresis (DGGE), and phylogenetic trees were constructed with BLAST alignment analysis software. At the same time, the microbial functional diversity of biogas slurry samples was analyzed by biolog-eco method.【Result】PCR-DGGE method results showed that at low temperature (15℃) in the various stages of fermentation, there were dominant bacteria in each stage of fermentation, includingClostridiumsp.,Bacteroidalesbacterium,Pseudomonassp., andProteiniphilumsp. Among them, Sample No. 4 was the optimum treatment agents in test group III. Especially clostridium (Clostridiumsp.) showed a higher abundance; Biolog-ECO assay showed that the peak of gas production in 2, 3 and 4, the carbon activity was relatively high, and the gas production was higher than the control group at a low temperature (15℃). By microbial community diversity analysis, the process uniformity index of treat 2 was higher then others. The microbial community richness and dominance index of treat 3 and 4 was relatively high.【Conclusion】Compatibility III ( compatibility I+2 g ZHC solid microbial agent)is the best in different processing at a low temperature (15℃).
bacteria; low-temperature; PCR-DGGE; 16S rDNA; diversity
10.6048/j.issn.1001-4330.2016.10.015
2016-04-21
国家自然科学基金项目(31260016);国家自然科学基金项目(21666038)
代金平(1987-),女,新疆乌鲁木齐人,助理研究员,研究方向为酶工程,(E-mail)383691178@qq.com
冯蕾(1967-),女,新疆乌鲁木齐人,研究员,研究方向为生物能源,(E-mail)fl_xj03@sina.com
S188+.4
A
1001-4330(2016)10-1885-09

