新疆吐鲁番地区三种甜瓜病毒病的发生与分子鉴定
韩盛,韩成贵,玉山江·麦麦提,杨军,杨渡
(1. 新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;2. 国家农业生物技术重点实验室/中国农业大学农学与生物技术学院,北京 100193;3. 新疆葡萄瓜果开发研究中心 新疆鄯善 838201)
新疆吐鲁番地区三种甜瓜病毒病的发生与分子鉴定
韩盛1,韩成贵2,玉山江·麦麦提1,杨军3,杨渡1
(1. 新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;2. 国家农业生物技术重点实验室/中国农业大学农学与生物技术学院,北京 100193;3. 新疆葡萄瓜果开发研究中心 新疆鄯善 838201)
【目的】明确吐鲁番地区西瓜花叶病毒(WMV)、小西葫芦黄化花叶病毒(ZYMV)、南瓜蚜传黄化病毒(CABYV)的发生情况及三种病毒不同来源分离物间的遗传差异。【方法】采用分子检测方法,确定吐鲁番地区甜瓜CABYV、WMV、ZYMV的侵染比例,应用序列比对及构建系统发育树分析三种病毒,吐鲁番分离物与国内外其他分离物间遗传差异。【结果】吐鲁番地区40份病毒病样中WMV、ZYMV、CABYV分子检测阳性比例分别达87.5%、50%、30%。ZYMV吐鲁番分离物等部分国内外分离物NIB与CP蛋白之间存在蛋白切割位点Q/S, WMV、ZYMV吐鲁番分离物等部分国内外分离物DAG基序的氨基酸序列均为DAG。依据系统发育树分析将三种病毒吐鲁番分离物分别划分至不同的亚组。 【结论】WMV、ZYMV为吐鲁番地区甜瓜病毒病的优势毒原,CABYV为吐鲁番地区甜瓜病毒病的主要病毒之一。CABYV、WMV吐鲁番分离物与国内部分省份分离物亲缘关系更近,ZYMV吐鲁番分离物XJturufan2与东欧、中东国家的分离物亲缘关系更近, ZYMV吐鲁番分离物XJturufan与国内部分省份分离物及美国、西班牙、日本等国分离物亲缘关系更近。
西瓜花叶病毒;小西葫芦黄化花叶病毒;南瓜蚜传黄化病毒;系统发育树;DAG基序
0 引 言
【研究意义】新疆独特的地理位置以及气候特征,使其成为国内重要的甜瓜生产基地。近年来,新疆甜瓜种植面积逐年扩大,自2007年以来种植面积即稳定在6×104hm2以上, 2007~2014年种植面积达6.28×104~8.67×104hm2,2009年达峰值8.67×104hm2[1]。随着新疆甜瓜种植面积不断增大,甜瓜产量日益增加,新疆甜瓜产业已成为新疆农业生产重要经济增长点。而病毒病一直是影响新疆甜瓜种植的重要病害,受病毒病侵染的甜瓜植株会出现叶片畸形、花叶、黄化等多种症状,最终导致甜瓜果实品质严重下降、产量大大降低,病重年份部分甜瓜种植区甚至面临绝收的境况。2007~2015年,受环境气候影响,新疆南北疆各主要甜瓜种植区甜瓜作物上病毒病发病严重,分别于2007、2013、2014年在不同甜瓜种植主产区发生病毒病暴发流行,其中2014年6~8月期间新疆吐鲁番地区0.066 7×104hm2(1万多亩)复播甜瓜因病毒病暴发流行而毁种。研究分析吐鲁番地区甜瓜病毒病流行区致病病毒种类,对于根据不同致病病毒的流行、传播特性制定合适的防治策略具有重要意义。【前人研究进展】20世纪80年代,国内许多学者对新疆侵染瓜类作物的病毒采用生物学、血清学及电镜观察相结合的方法进行了研究鉴定,认为当时新疆侵染哈密瓜的病毒主要有西瓜花叶病毒2号(WMV-2,即PRSV-W),黄瓜花叶病毒(CMV)、南瓜花叶病毒(SqMV),烟草坏死病毒(TNV), 甜瓜叶脉坏死病毒(MVNV),哈密瓜叶脉坏死病毒(HmVNV),哈密瓜花叶病病毒(HMMV),但优势病毒为WMV-2(即PRSV-W),CMV和SqMV[2-13]。1991年魏宁生等[14]对新疆、甘肃两省(区)厚皮甜瓜病毒病样进行鉴定认为两地病毒种类有CMV、WMV和SqMV,其中WMV是优势病毒。1991年郑光宇等[15]报道了小西葫芦黄化花叶病毒(ZYMV)在新疆瓜类作物上的侵染发生,随后,赵荣乐等[16]和刘卫荣等[17]分别于1998年、2008年对新疆不同瓜类作物ZYMV分离物进行了研究报道。2004年赵荣乐等[18]对侵染新疆甜瓜的SqMV分离物的部分生物学特性进行了研究。2008年,刘卫荣等[19]对从新疆南瓜病样上分离得到的WMV-2(即PRSV-W)新疆昌吉分离物的CP基因序列进行了研究分析。【本研究切入点】课题组前期研究确定了新疆喀什地区大面积暴发流行的甜瓜"黄叶病"病原主要为CABYV(该研究结果由中国农业大学韩成贵教授合作研究证实),研究证实了新疆喀什地区大面积暴发流行的甜瓜“黄叶病”病原主要为CABYV,吐鲁番产区CABYV的发生情况尚不明确。此外吐鲁番地区WMV、ZYMV等Potyvirus属主要瓜类作物病毒的发生情况及侵染比例也不清楚。研究调查吐鲁番地区表现明显黄化症状或畸形、花叶症状的甜瓜病毒病发生情况,同时采集相关病样,采用分子鉴定的方法检测Polerovirus属病毒CABYV及Potyvirus属WMV、ZYMV的侵染情况,并分析相关病毒不同分离物间的遗传差异。【拟解决的关键问题】确定吐鲁番地区WMV、ZYMV、CABYV等病毒的侵染情况,初步确定WMV、ZYMV、CABYV等病毒吐鲁番分离物与国内外其他分离物间的遗传差异。
1 材料与方法
1.1 材 料
1.1.1 毒 源
2014年分别由吐鲁番地区鄯善县鲁克沁镇沙坎尔乡、沙坎尔农场、吐峪沟乡、迪卡尔乡、哈密瓜研究中心采集表现明显黄化症状或畸形、花叶症状的甜瓜植株叶片,-20℃保存备用。
1.1.2 载体与菌株
MMLV反转录酶购自PROMEGA公司,pEASY-T1 Cloning Kit和Trans10 Chemically Competent Cell 均购自全式金公司。
1.1.3 酶及化学试剂
M-MLV反转录酶购自Promega公司;TaqDNA聚合酶、2×EasyTaqPCR SuperMix (购自北京全式金公司);RNase抑制剂(Ribonuclease Inhibitor,RRI)、T4DNA ligase、pMD19-TVector Ligation Kit购自TAKARA公司, Agarose Gel DNA Purification Kit购自AXYGEN公司;其它化学试剂均为国产分析纯。
1.2 方 法
1.2.1 植物总RNA的提取
取样品液氮研磨后,先加入800 μL水饱和酚,再加入830 μL RNA buffer于2.0 mL EP管中;剧烈震荡混匀后,静置一会于离心机上12 000 r/m离心10 min,取上清600 μL于新管中,加等体积的水饱和酚,上下颠倒轻柔混匀静置后,12 200 r/m离心15 min;取上清300 μL于新管中,加入等体积的4MliCL,轻柔混匀后-20℃沉淀1 h(注意此步最好使用新灭的枪头和EP管); 4℃离心机12 000 r/m离心15 min;弃上清,加70%无水乙醇1 000 μL,洗2次(每洗一次后12 000 r/m离心3 min,弃上清), 第二次洗后空转一次,吸出废液;置于37℃吹干,约7~8 min;加入30 μL ddH2O。
1.2.2 RT-PCR扩增目的片段
RT体系:在30 μL RT反应体系中加入8.5 μL DEPC水、6 μL 5×反转录酶Buffer、3 μL d NTPs(5 mmol/l)、1 μL M-MLV反转录酶(200 U/μL)、0.5 μL RNase抑制剂(40 U/μL)、Polerovirus属病毒与Potyvirus属病毒通用反向引物PococpR(-)和M4T(-)各3.0 μL(0.1 ug/ul),6 μL植物总RNA提取液,于42℃反转录60 min,70℃ 变性10 min,4℃保持。
PCR体系:25 μL PCR扩增反应体系中加入8.5 μL ddH2O、2×EasyTaqPCR SuperMix 12.5 μL、1 μL(10 umol/L)正向引物、1 μL(10 umol/L)反向引物、2 μL反转录产物,反应扩增产物经1%琼脂糖凝胶电泳检测。表2
表1 不同病毒分子检测使用的引物序列及目标基因
Table 1 Primer sequences and target genes for detection of different viruses

引物名称及序列Primernameandsequences目标基因Targetgenes目标片段大小Sizeoftargetgene(bp)M4T:5'GTTTTCCCAGTCACGAC(T)153'Potyvirus属病毒反向通用引物[20]PCCOCPR:5'CGTCTACCTATTTSGGRTTN3'PCCONF: 5'TGYTCYGGTTTTGACTGG3'Polerovirus属病毒CP基因,参考自尚巧霞博士论文引物序列[21]1300WMV1F:5'-ACGTAGCAAAGAACAGACAAA-3'WMV1R:5'-ACATAAACAGTACGAAGGTGA-3'WMVCP基因序列参考自何丹论文引物序列[22]1300ZYMV1F5'-CACGAAGGACAAGGATGTGA-3'ZYMV1R5'-ACATTGCTAAGAGCTGCTGC-3'ZYMVCP基因序列参考自李继洋论文引物序列[23]596ZYMVF:5’AGCTCCATACATAGCTGAGACAG3’ZYMVR:5’GCTTGCAAACGGAGTC3'ZYMV NIB-CP基因参考自刘卫荣等文献引物序列[17]1100WMVF:5’GGTTGCTGYGARTCAGTGTC3'(注Y=C/T,R=A/G)WMVR:5’CGACCCGAAATGCTAACT3'WMV CP基因参考自刘卫荣等文献引物序列[19]1000
表2 不同目标片段的PCR扩增反应程序
Table 2 PCR amplification reaction procedure for different target segments

目标片段TargetsegmentsPCR反应程序PCRamplificationreactionprocedureWMV、ZYMV94℃预变性4min,94℃变性30s,53℃退火45s,72℃延伸1min30s,35个循环,最后72℃延伸10min,4℃保持。Polerovirus属病毒VirusesbelongstoPolerovirusgenus95℃预变性4min,95℃变性30s,52℃退火45s,72℃延伸1min30s,35个循环,最后72℃延伸10min,4℃保持。
1.2.3 DNA片段的回收纯化
采用试剂盒法-AxyPrepTM DNAgel extraction kit(Axygen biosciences)
参照试剂盒使用说明。将切下的凝胶称重,加入3倍体积(质量体积比)的溶胶缓冲液A,75℃加热约10 min至胶完全融化,加入缓冲液A1/2体积的缓冲液B,混匀转移至回收柱中,12 000 r/min离心1 min;弃溶液,在柱中加入500 μL洗涤缓冲液W1,12 000 r/min离心洗涤30s;弃溶液,在柱中加入700 μL洗涤缓冲液W2,12 000 r/min离心洗涤30s,再加700 μL洗涤缓冲液W2,12 000 r/min离心1 min,弃溶液,12 000 r/min离心1 min;之后再12 000 r/min离心1.5 min,回收柱放入新的1.5 mL离心管中,加入25~30 μL预热至65℃的dd H2O或TE,室温静置1 min,12 000 r/min,离心1.5 min,得到回收片段。
1.2.4 目的片段与载体质粒的连接
使用全式金Peasy-T1 Cloning kit,PCR 纯化产物4 μL,Peasy-T1 Cloning Vector 1 μL,轻轻混合,干式恒温仪中25℃ 反应15 min,可放于-20℃备用。
1.2.5 大肠杆菌感受态细胞的转化
参照全式金Peasy-T1 Cloning kit方法进行。加连接产物(最多5 μL)于50 μL Trans1-T1感受态细胞中(在感受态细胞刚刚解冻时加入连接产物),轻弹混匀,冰浴20~30 min;42℃热激30s,立即置冰上2 min;加入250 μL平衡至室温的SOC或 LB液体培养基,200RPM,37℃1 h;取8 μL 500 mMIPTG和40 μL 20 mg/mL X-gal 混合,涂于LB固体平板(含50 μg/mL的Amp或Kan),37℃培养30 min;待IPTG 和X-gal被吸收后,取全部300 μL菌液4 000 r/min离心1 min,弃部分上清,保留150 μL,轻弹悬浮菌体,将剩余全部菌液涂板,37℃培养过夜。
1.2.6 重组质粒的菌落PCR鉴定
用灭菌的牙签挑单菌落于LB固体平板(含50 μg/mL的Amp)上划线后,挑少许菌落涂布于200 μL PCR管的底部。在上述离心管中加入25 μL在PCR扩增反应体系,8.5 μL ddH2O、2×EasyTaqPCR SuperMix 12.5 μL、1 μL(10 μmol/L)正向引物M13F、1 μL(10 μmol/L)反向引物M13R、2 μL反转录产物。扩增条件为:94℃预变性4 min,94℃变性30s,52℃退火30s,72℃延伸2 min,35个循环,最后72℃延伸10 min,4℃保持。复性温度根据所用引物的Tm值确定,延伸时间根据所扩增片段的长度确定(1 kb/min),反应扩增产物经1%琼脂糖凝胶电泳检测。
1.2.7 序列测定和分析比较
挑取阳性克隆的菌种接到2 mL LB(含50 μg/mL Amp)液体培养基中,于摇床中37 ℃150 r/min振荡培养过夜。取1.5 mL菌液送交北京英俊科技有限公司进行序列测定。在NCBI上进行序列相似性检索获得国内外已报道的相关序列比对结果,并利用DNAMAN、MEGA6.0等序列分析软件分析比较,同时应用MEGA6.06软件采用近邻分析法依据各病毒具有一定代表性的不同地区或寄主来源分离物间CP或NIB-CP基因核苷酸序列构建系统发育树,分析各病毒不同分离物间的遗传进化关系。
2 结果与分析
2.1 吐鲁番鄯善县甜瓜病毒病发生情况
2014年6月中旬后,吐鲁番地区0.066 7×104hm2(1万多亩)秋茬复播甜瓜病毒病逐渐加重,7月中上旬达发病高峰,大部分地块因病毒病严重发生而毁种。于7月16日和8月21日调查鄯善县鲁克沁镇沙坎尔乡、沙坎尔农场、吐峪沟乡、迪卡尔乡、哈密瓜研究中心等地调查发现,当地主要有黄化类型及畸形、花叶类型两种类型病毒病发生。畸形、花叶类型病毒病发生最为普遍,凡是发生病毒病的地块该类型病毒病均有发生,黄化类型病毒病发生程度仅次于畸形、花叶类型病毒病,但部分地块仅有畸形、花叶类型而无黄化类型病毒病发生,而畸形、花叶类型与黄化类型病毒病均有发生的地块大部分病株两种症状同时存在,表明多数病株为复合侵染。
播种时间与病毒病发病程度具有一定相关性,研究中调查的 6月10~25日复播的甜瓜畸形花叶类型病毒病发病率为87%~100%,平均发病率96.17%,黄化类型病毒病发病率0~100%,平均发病率62%,7月1~24日复播甜瓜畸形花叶类型病毒病发病率为0~75%,平均发病率12.22%,黄化类型病毒病发病率0~8%,平均发病率2.11%,整体来看,6月复播甜瓜发病程度明显重于7月复播甜瓜,发病程度与播种时间存在播种越晚发病程度越轻的趋势。 表3
2.2 黄化类型病样及畸形花叶类型病样的分子检测结果
应用WMV、ZYMV特异性引物及Polerovirus属病毒通用引物分别检测吐鲁番鄯善地区29份畸形、花叶类型病毒病样和11份黄化类型病样, 畸形、花叶类型病毒病样和黄化类型病样均能检测到WMV、ZYMV及Polerovirus属病毒,并且部分样品存在多种病毒复合侵染情况。 图1~5,表4
供试29份畸形、花叶类型病毒病样中25个病样WMV检测阳性、2个病样CABYV检测阳性、10个病样ZYMV检测阳性,以病毒复合侵染样本统计所有供试样品中2个病样为WMV、ZYMV、CABYV复合侵染,7个病样为WMV、ZYMV复合侵染。供试11份黄化类型病毒病样中,含有WMV、ZYMV、CABYV侵染的病样均为10份,并且9个样本WMV、CABYV复合侵染数为,9个样本为ZYMV、CABYV复合侵染,8个样本为WMV、ZYMV、CABYV复合侵染。表4
表3 吐鲁番鄯善县甜瓜病毒病发生情况
Table 3 the occurrence of melon virus disease in Shanshan county, Turpan city
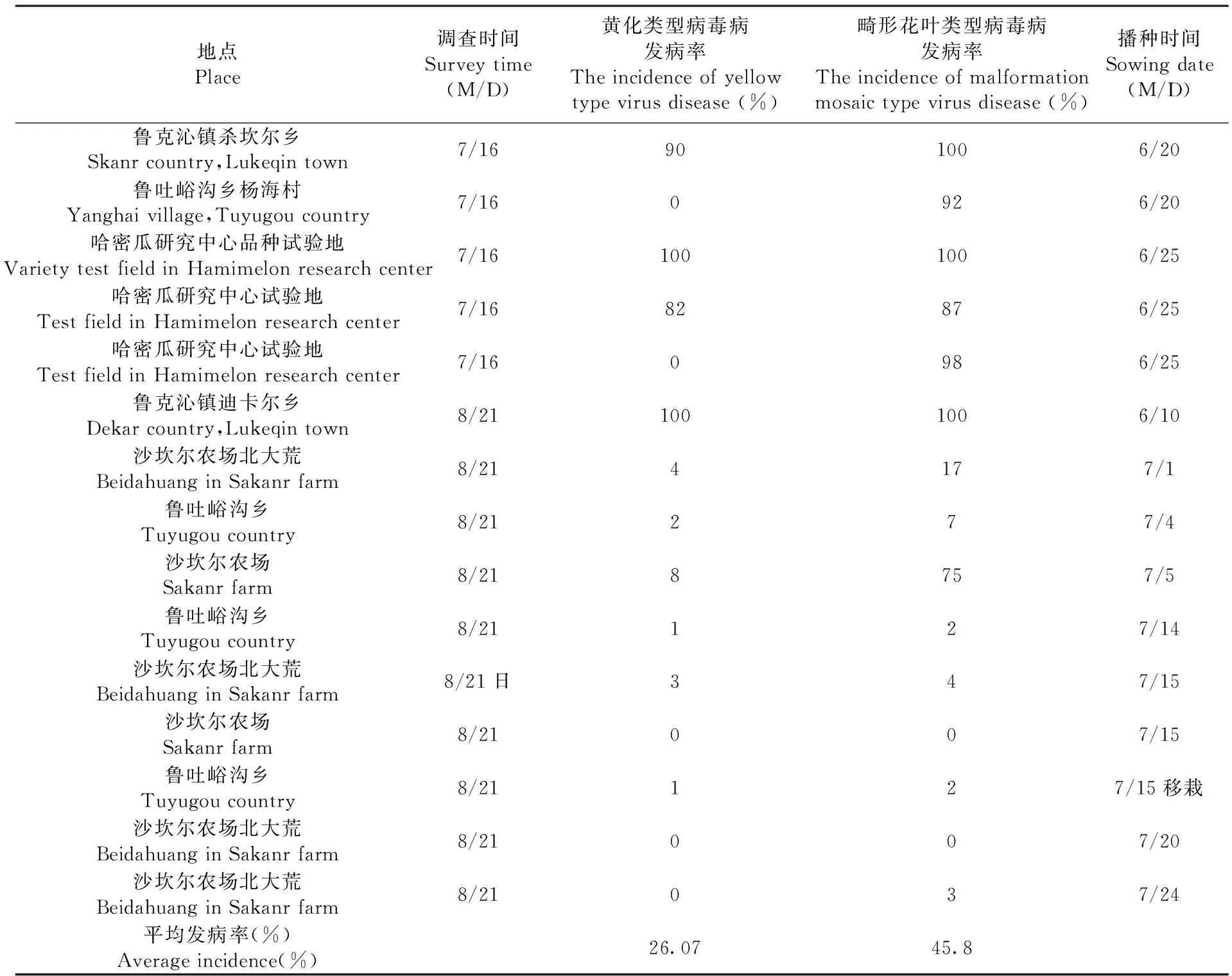
地点Place调查时间Surveytime(M/D)黄化类型病毒病发病率Theincidenceofyellowtypevirusdisease(%)畸形花叶类型病毒病发病率Theincidenceofmalformationmosaictypevirusdisease(%)播种时间Sowingdate(M/D)鲁克沁镇杀坎尔乡Skanrcountry,Lukeqintown7/16901006/20鲁吐峪沟乡杨海村Yanghaivillage,Tuyugoucountry7/160926/20哈密瓜研究中心品种试验地VarietytestfieldinHamimelonresearchcenter7/161001006/25哈密瓜研究中心试验地TestfieldinHamimelonresearchcenter7/1682876/25哈密瓜研究中心试验地TestfieldinHamimelonresearchcenter7/160986/25鲁克沁镇迪卡尔乡Dekarcountry,Lukeqintown8/211001006/10沙坎尔农场北大荒BeidahuanginSakanrfarm8/214177/1鲁吐峪沟乡Tuyugoucountry8/21277/4沙坎尔农场Sakanrfarm8/218757/5鲁吐峪沟乡Tuyugoucountry8/21127/14沙坎尔农场北大荒BeidahuanginSakanrfarm8/21日347/15沙坎尔农场Sakanrfarm8/21007/15鲁吐峪沟乡Tuyugoucountry8/21127/15移栽沙坎尔农场北大荒BeidahuanginSakanrfarm8/21007/20沙坎尔农场北大荒BeidahuanginSakanrfarm8/21037/24平均发病率(%)Averageincidence(%)26.0745.8

1~11:Polerovirus属病毒检测结果,目标基因片段1 300 bp左右;M:DNA分子量标准
1-11:Polerovirusvirus detection results,the length of target fragment is 1,300 bp.M:DNA molecule marker
图1 鄯善县甜瓜黄叶类型病样Polerovirus属病毒分子检测结果
Fig. 1 The molecule detection results ofPolerovirusvirus from melon virus samples with yellow systom in Shanshan County

图2 鄯善县甜瓜部分畸形、花叶类型病样Polerovirus属病毒检测结果
Fig.2 The molecule detection results ofPolerovirusvirus from melon virus samples with deformity mosaic symptom in Shanshan County

1~11:WMV扩增结果,目标基因片段1 000 bp (WMVF/WMVR引物对扩增);M:DNA分子量标准
1-11:WMV detection results,the length of target fragment is 1,000 bp(Amplified gene by ZYMVF/ZYMVR primer).M:DNA molecule marker
图3 鄯善县甜瓜黄叶类型病样WMV分子检测结果
Fig.3 The molecule detection results of wmv from melon virus samples with yellow systom in Shanshan County

1~11: ZYMV扩增结果,目标基因片段约1 100 bp (ZYMVF/ZYMVR引物对扩增);M:DNA分子量标准
1-11:ZYMV detection results,the length of target fragment is 1,100 bp(Amplified gene by ZYMVF/ZYMVR primer).M:DNA molecule marker
图4 鄯善县甜瓜黄叶类型病样ZYMV分子检测结果
Fig.4 The molecule detection results of ZYMV from melon virus samples with yellow systom in Shanshan County
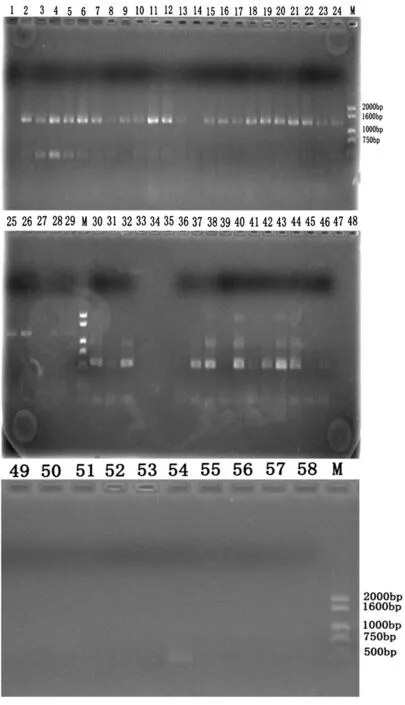
1~29号为WMV检测结果,目标片段1 300 bp左右(WMV1F/WMV1R引物对扩增);30~58号为ZYMV检测结果,目标片段596 bp左右(ZYMV1F/ZYMV1R引物对扩增)
1-29: WMV detection results, the length of target fragment is 1,300 bp(Amplified gene by WMV1F/WMV1R primer); 30-58:ZYMV detection results, the length of target fragment is 596 bp (Amplified gene by ZYMV1F/ZYMV1R primer)
图5 鄯善县甜瓜部分畸形、花叶类型病样 WMV和ZYMV 检测结果
Fig.5 The molecule detection results of WMV and ZYMV from melon virus samples with deformity mosaic symptom in Shanshan County
2.3 WMV、ZYMV、CABYV测序结果
将鄯善县病样以WMV、ZYMV两种病毒特异性引物及Polerovirus属病毒通用引物扩增得到的PCR产物经回收纯化克隆后以菌液送交上海英俊公司测序,测序结果在GENEBANK数据库中进行BLAST比对, WMV新疆鄯善分离物(暂命名为XJturufan和XJturufan2)与WMV新疆SO3-21分离物CP基因序列(NCBI 序列登录号KP406644) 同源性达100%。ZYMV新疆鄯善分离物(暂命名为XJturufan和XJturufan2)与ZYMV斯洛文尼亚SE04T分离物CP基因序列(NCBI 序列登录号KF976713)同源性达99%。CABYV新疆分离物(暂命名为XJturufan)与CABYV韩国HS1分离物CP基因序列(NCBI 序列登录号KR231952 )同源性达98%。测序结果表明经PCR扩增得到了PCR产物分别为WMV、ZYMV、CABYV对应基因序列,证明供试病样分别为WMV、ZYMV、CABYV侵染。
2.4 两种类型病样不同病毒的侵染比例
供试29份畸形、花叶类型病毒病样中25个病样WMV检测阳性、2个病样CABYV检测阳性、10个病样ZYMV检测阳性,以病毒复合侵染样本统计所有供试样品中2个病样为WMV、ZYMV、CABYV复合侵染,7个病样为WMV、ZYMV复合侵染。供试11份黄化类型病毒病样中,含有WMV、ZYMV、CABYV侵染的病样均为10份,并且9个样本WMV、CABYV复合侵染数为,9个样本为ZYMV、CABYV复合侵染,8个样本为WMV、ZYMV、CABYV复合侵染。表4
2.5 WMV与ZYMV不同地区分离物间氨基酸序列比较
根据包括新疆吐鲁番分离在内的16个来源于不同地区的ZYMV分离物DNA序列推导其蛋白质氨基酸序列并进行序列比对,表明16个分离物NIB蛋白3’端与CP蛋白5’端之间均存在蛋白切割位点Q/S,并且所有分离物CP蛋白N端均存在DAG基序,但是新加坡分离物该基序突变为GAG,法国和以色列分离物该基序突变为DTG。
根据包括新疆吐鲁番分离在内的15个来源于不同地区的WMV分离物DNA序列推导其蛋白质氨基酸序列并进行序列比对,表明15个分离物CP蛋白5’端之间同样存在DAG基序,但除澳大利亚分离物该基序突变为DTG外,其余分离物该基序序列均为DAG。图6,图7
表4 鄯善县黄化类型和畸形花叶类型病毒病样三种病毒的检测结果
Table 4 The detection result of yellow types virus disease samples and malformation mosaic types three virus disease samples in Shanshan county

症状类型Symptomtype统计项目Statisticalitems样本数(个)SamplenumberWMVZYMVCABYVWMVZYMV共侵染InfectedbybothWMV、ZYMVWMVCABYV共侵染InfectedbybothWMV、CABYVZYMVCABYV共侵染InfectedbybothZYMV、CABYVZYMVWMVCABYV共侵染InfectedbybothZYMV、WMV、CABYV黄化类型Yellowtype样本数(个)111010109998侵染比例(%)90.9190.9190.9181.8281.8281.8272.73畸形花叶类型Malformationmosaictype样本数(个)29251027002侵染比例(%)86.2134.486.9024.140.000.006.90总计Total样本数(个)40352012169910侵染比例(%)87.5050.0030.0040.0022.5022.5025.00
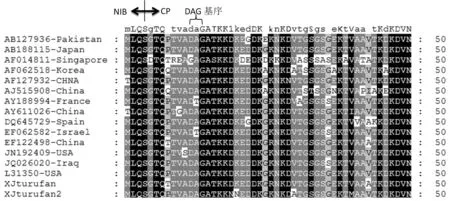
图6 ZYMV 不同地区分离物NIB-CP基因氨基酸序列比对
Fig.6 NIB-CP gene amino acid sequence alignment between different ZYMV isolates from different regions

图7 WMV 不同地区分离物CP基因氨基酸序列比对
Fig.7 CP gene amino acid sequence alignment between different ZYMV isolates from different regions
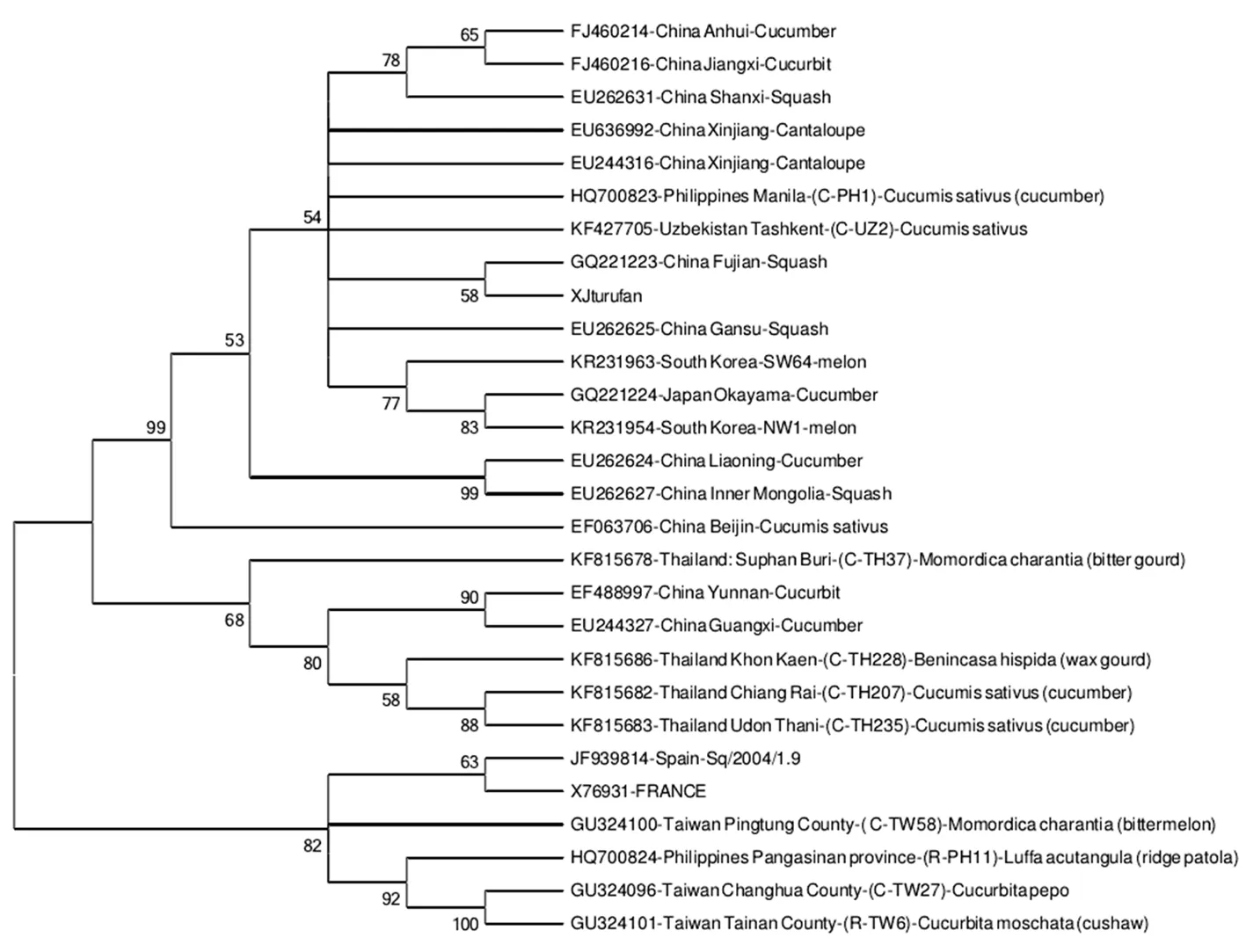
CABYV吐鲁番分离物Xjturufan、Xjturufan2与来自西班牙、法国、泰国、菲律宾、韩国、日本、乌兹别克斯坦等国分离物的CP基因序列应用MEGA6.06软件采用近邻法构建系统发育树。供试所有28个分离物可分为三个大组,CABYV吐鲁番分离物、菲律宾、韩国、日本、乌兹别克斯坦以及包括大部分中国分离物在内的亚洲国家分离物划分至组Ⅰ,来自泰国的四个分离物及中国云南、广西的分离物被划分至组Ⅱ,西班牙、法国、台湾及菲律宾的分离物被分组Ⅲ。研究获得的CABYV新疆分离物与来自中国国内省份的分离物亲缘关系更近,大部分亚洲国家分离物与欧洲来源分离物间亲缘关系较远,但台湾与菲律宾部分分离物与欧洲国家分离物亲缘关系较近。图8
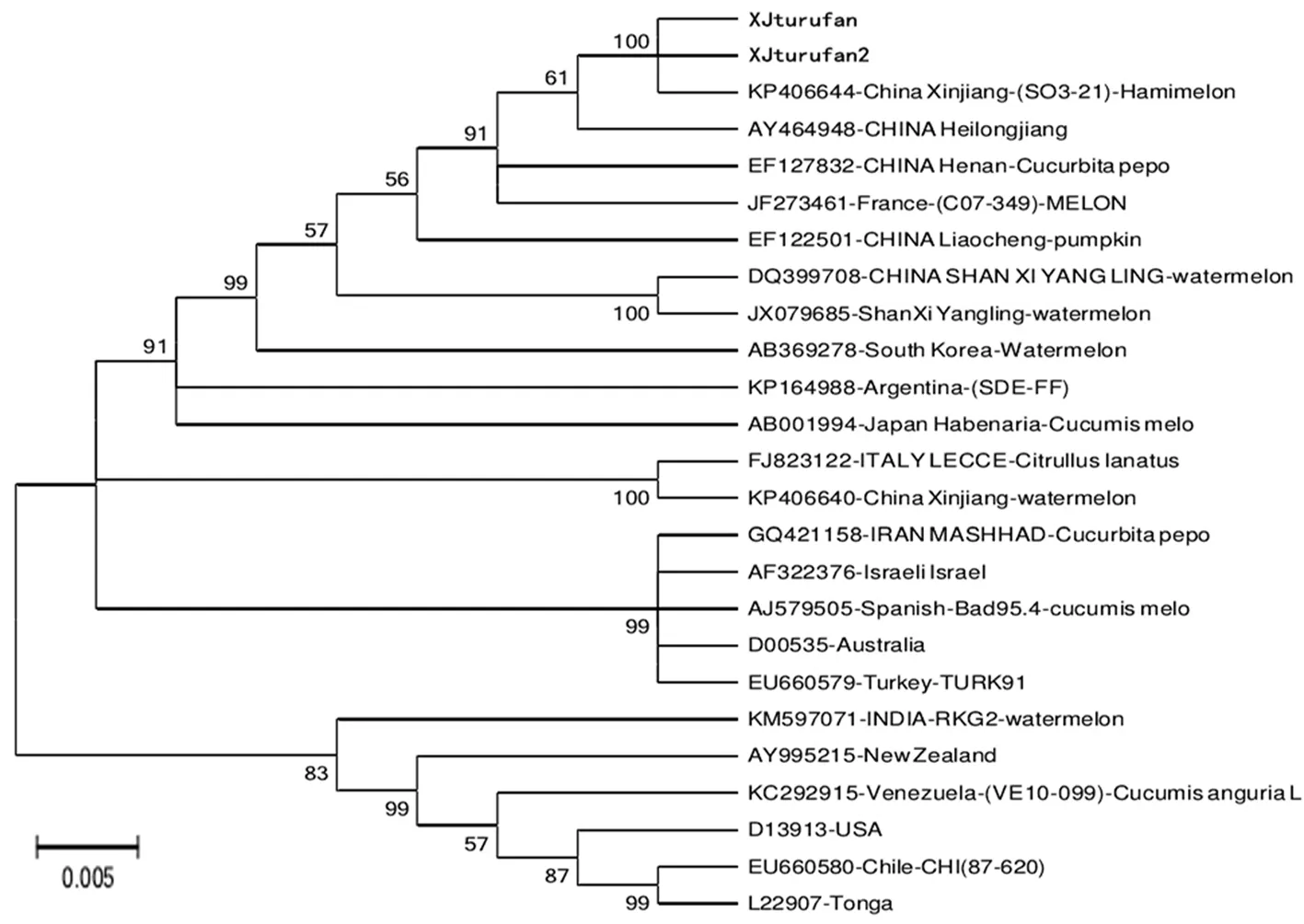
WMV吐鲁番分离物Xjturufan、Xjturufan2与来自欧洲、亚洲、中东、北美、南美、澳洲等不同地区具有代表性国家的分离物CP基因序列应用MEGA6.06软件采用近邻法构建系统发育树,结果表明,供试25个分离物可分为四个大组,WMV吐鲁番分离物与法国、韩国、阿根廷、日本及大部分中国分离物划分至组Ⅰ,来自中国新疆西瓜的分离物与意大利分离物单独划分至组Ⅱ,伊朗、以色列、西班牙、澳大利亚、土耳其分离物划分至组Ⅲ,印度、新西兰、委内瑞拉、美国、智利、汤加分离物划分至组Ⅳ。研究获得的WMV吐鲁番分离物与来自中国不同省份的分离物间亲缘关系最近,同时其与法国、韩国、阿根廷、日本分离物间也具有一定的亲缘关系。图9
注:系统发育树上分离物信息为GENEBANK登录号-地理来源-分离物名称-寄主来源,Bootstrap 值(%)大于50%显示
Note: the phylogenetic tree isolate information include genebank accession number - geographic origin - isolate name - host source, Bootstrap value (%) showed greater than 50%
图8 依据28个CABYV分离物CP基因核苷酸序列构建的系统发育树
Fig.8 The Phylogenetic tree were constructed using nucleotide sequence of CP gene from 28 CABYV isolates
注:系统发育树上分离物信息为GENEBANK登录号-地理来源-分离物名称-寄主来源,Bootstrap 值(%)大于50%显示
Note: the phylogenetic tree isolate information include genebank accession number - geographic origin - isolate name - host source, Bootstrap value (%) showed greater than 50%
图9 根据25个WMV分离物CP基因核苷酸序列构建的系统发育树
Fig.9 The Phylogenetic tree were constructed using according to nucleotide sequence of CP gene from 25 WMV isolates
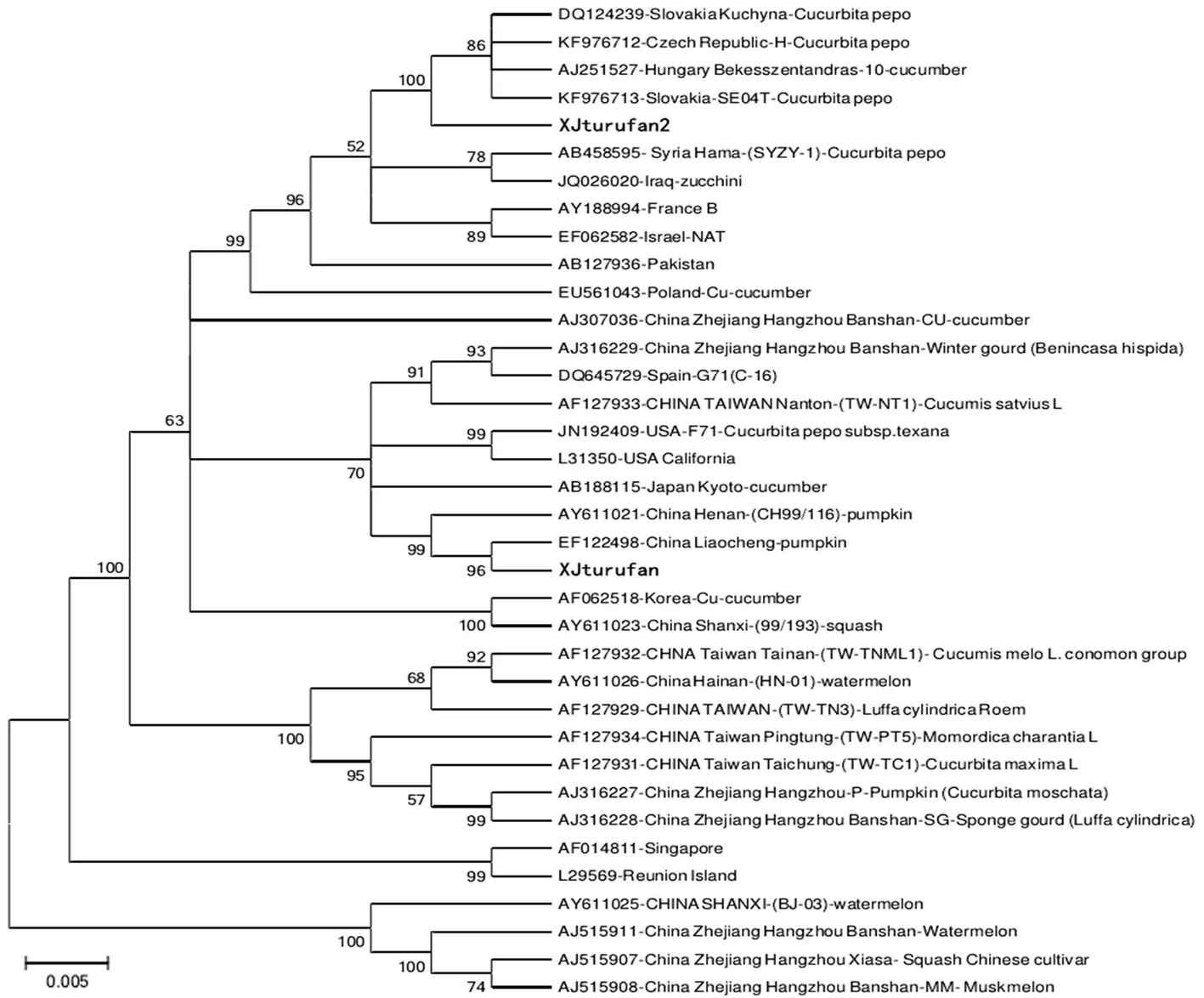
注:系统发育树上分离物信息为GENEBANK登录号-地理来源-分离物名称-寄主来源,Bootstrap 值(%)大于50%显示
Note: the phylogenetic tree isolate information include genebank accession number - geographic origin - isolate name - host source, Bootstrap value (%) showed greater than 50%
图10 根据36个ZYMV分离物NIB-CP基因核苷酸序列构建的系统发育树
Fig.10 The Phylogenetic tree were constructed according to nucleotide sequence of NIB-CP gene from 36 ZYMV isolates
ZYMV吐鲁番分离物Xjturufan、Xjturufan2与来自亚洲、欧洲、美洲、大洋洲不同国家分离物的NIB-CP基因序列应用MEGA6.06软件采用近邻法构建系统发育树。结果表明,供试36个分离物可被划分至六个大组,研究获得的新疆吐鲁番分离物XJturufan2与斯洛伐克、捷克、匈牙利、叙利亚、伊拉克、法国、以色列、巴基斯坦、波兰等欧洲及中东国家分离物与划分至组Ⅰ,新疆吐鲁番分离物XJturufan与中国浙江、河南、聊城、台湾等地区分离物和美国、西班牙、日本等国分离被划分至组Ⅱ,中国山西分离物99/193与韩国分离物Cu被划分至组Ⅲ,中国台湾THML1、TN3、PT5、TC1等4个分离物、中国浙江杭州P、SG等2个分离物、中国海南HN-01分离物被划分至组Ⅳ,新加坡与留尼汪岛分离物被划分至组Ⅴ,中国山西BJ-03分离物、中国浙江杭州西瓜、南瓜、甜瓜三种作物来源分离物被单独划分至组Ⅵ。研究获得的两个分离物均来自新疆吐鲁番地区甜瓜,但分属于两个不同的组,分离物XJturufan2与来自东欧、中东国家的分离物亲缘关系更近,而分离物XJturufan与同属组Ⅱ的中国浙江、河南、聊城、台湾等地区分离物和美国、西班牙、日本等国分离物亲缘关系更近。划分的6个组群中,除组Ⅴ不含来自中国的分离物外,其余5组均包含中国分离物,表明ZYMV中国不同地区的分离物间分子变异比较大。图10
3 讨 论
3.1 经调查2014年度吐鲁番地区0.066 7×104hm2(1万多亩)秋茬复播甜瓜病毒病以黄化症状和畸形、花叶症状两种症状类型为主,两种症状类型的病毒病发病率最高可达100%,但以畸形、花叶症状类型病毒病的平均发病率较高。从播种时间与病毒病发病程度相互关系来看,6月复播的甜瓜发病程度明显重于7月复播甜瓜,发病程度与播种时间存在播种越晚发病程度越轻的趋势,这种发病规律可能与吐鲁番地区甜瓜病毒病传毒介体传毒特性、当地不同时间段田间寄主结构变化和气候条件等多重因素共同作用相关,其病害流行机制需通过进一步试验研究予以解析。
3.2 研究检测的40个供试病毒病样本中,WMV、ZYMV、CABYV侵染比例依次为87.5%、50%、30%,WMV、ZYMV两种病毒在黄化症状和畸形、花叶症状的病毒病样中的侵染比例均很高,因此WMV、ZYMV为吐鲁番地区甜瓜病毒病的优势病毒。CABYV病毒已在全国多数地区均有分布[21, 24],但是国内相关研究中新疆地区的检测样本均来自南疆喀什地区,北疆地区的发生情况尚不明确,研究结果表明,吐鲁番地区已有CABYV病毒病发生危害。2014年度采集自吐鲁番甜瓜病毒病暴发流行区病毒病样的检测结果表明,黄化类型病毒病样CABYV的侵染比例高达90%以上,畸形花叶类型病样CABYV的侵染比例也达6.9%,因此CABYV已成为引起吐鲁番地区甜瓜病毒病的主要病毒之一。黄化类型病样中存在严重的WMV、ZYMV、CABYV复合侵染情况,上述两种或两种以上病毒在黄化类型病样中复合侵染比例高达70%以上,但是从症状来看供试病样均为黄化,而WMV、ZYMV单独侵染的情况下甜瓜发病症状主要为畸形、疱斑、花叶,因此WMV、ZYMV、CABYV三种病毒间可能存在一定的互作而影响症状表现。CABYV是造成黄化症状的主要病毒,据调查吐鲁番地区部分地块黄叶症状病毒病发病率可达100%,因此CABYV的发生危害应引起种植者的重视。
3.3 ZYMV等马铃薯Y病毒属基因组的翻译策略是先翻译一个多聚蛋白,再经自我催化切割成不同的蛋白质。3’端CP蛋白与Nib切割位点一般为Q/G,QS/,Q/A。研究表明ZYMV两个新疆吐鲁番分离物的CP与NIB蛋白之间的切割位点为Q/S,而参与比较的其他国家分离物也表现相同的遗传特征。
3.4 马铃薯Y病毒属CP基因氨基酸序列中含有一段蚜传所必需的DAG基序,该基序任意一个氨基酸残基发生改变,该病毒分离物均会丧失蚜传能力[25]。研究表明WMV、ZYMV新疆吐鲁番分离物该基序的氨基酸序列同样为DAG,推测其应具备蚜传能力。但是参与比较的ZYMV新加坡分离物、法国分离物、以色列分离物及WMV澳大利亚分离物该基序分别突变为GAG、DTG、DTG、 DTG,理论推测上述四个分离物失去蚜传能力,刘卫荣等[19]也曾报道WMV新疆昌吉分离物该基序突变为DAE,表明不同地区WMV、ZYMV分离物蚜传特征结构域DAG存在一定的突变频率,该突变也有可能影响不同地区分离物的致病传播能力。
3.5 CABYV新疆吐鲁番分离物与来自中国国内省份的分离物亲缘关系更近,而大部分亚洲国家分离物与欧洲来源分离物间亲缘关系较远,尤其是地理位置较为相近的来自泰国的四个分离物与来自中国云南、广西的分离物被划分至一组,上述分析结果表明CABYV不同分离物间的遗传差异与其地理来源相关。这主要是由于CABYV为非种传病毒且以虫传为主,其相对于其他种传病毒较难发生快速高频率的远距离传播,不同地理来源分离物间发生病毒基因重组的机率较低。
3.6 WMV、ZYMV吐鲁番分离物均与来自中国不同省份的分离物间亲缘关系最近,系统进化分析表明两种病毒不同地理来源分离物间遗传差异与地理分布间相关性不显著。供试WMV、ZYMV不同地理来源分离物分别可划分为4个亚组和6个亚组,表明两种病毒不同地理来源分离物间分子变异较大。ZYMV除组Ⅴ不含来自中国的分离物外,其余5组均包含中国分离物,表明ZYMV中国不同地区的分离物间分子变异比较大。
4 结 论
吐鲁番地区甜瓜病毒病以黄化症状和畸形、花叶症状两种症状类型为主,两种症状类型的病毒病发病率最高可达100%,但以畸形、花叶症状类型病毒病的平均发病率较高。WMV、ZYMV为吐鲁番地区甜瓜病毒病的优势病毒,CABYV已成为引起吐鲁番地区甜瓜病毒病的主要病毒之一。ZYMV新疆吐鲁番分离物的CP与NIB蛋白之间的切割位点为Q/S,WMV、ZYMV新疆吐鲁番分离物CP基因蚜传特征结构域DAG基序的氨基酸序列均为DAG。CABYV、WMV、ZYMV新疆吐鲁番分离物与来自国内省份的分离物亲缘关系更近。
References)
[1]新疆维吾尔自治区统计局. 新疆统计年鉴[J]. 北京: 中国统计出版社, 2015:383-384.
Statistics Bureau of Xinjiang Uygur Autonomous Region. (2015).XinjiangSurveyYearbook[J].Beijing: China Statistics Press :383-384. (in Chinese)
[2] 王志民,郑光宇,冯贡泽,等. 侵染哈密瓜的西瓜花叶病毒的血清学鉴定[J]. 植物病理学报,1983,(1):14-22.
WANG Zhi-ming, ZHENG Guang-yu, FENG Gong-ze, et al. (1983). Serological identification of watermelon mosaic virus infected melon [J].ActaPhytopathologicaSinica, (1):14-22. (in Chinese)
[3] 尹玉琦,崔星明,全俊仁,等. 新疆哈密瓜病毒病毒源的分离和鉴定[J]. 植物保护学报,1982,(3):157-162.
YIN Yu-qi, CUI Xing-ming, QUAN Jun-ren, et al. (1982). Isolation and identification of the virus of Xinjiang Hami melon [J].JournalofPlantProtection, (3):157-162. (in Chinese)
[4] 谢浩,赵长生,邱并生. 感染南瓜花叶病毒的哈密瓜种子的ELISA检测和热处理[J]. 微生物学通报,1986,(3):100-102.
XIE HAO, ZHAO Chang-sheng, QIU Bin-sheng. (1986). ELISA detection and heat treatment of squash mosaic virus infected melon seeds [J].Microbiol.China. (3):100-102. (in Chinese)
[5] 李国玄,王志民,孙怡,等. 引起哈密瓜坏死的两种病毒的分离及鉴定[J]. 植物病理学报,1985,(3):165-170.
LI Guo-xuan, WANG Zhi-ming, SUN Yi, et al.(1985). Isolation and identification of two viruses causing Hami-melon necrosis [J].ActaPhytopathologicaSinica, (3):165-170. (in Chinese)
[6] 裴美云,邱并生,谢浩,等. 哈密瓜花叶病毒病的研究-Ⅰ病原学[J]. 植物病理学报,1982,(4): 29-34.
PEI Mei-yun, QIU Bing-sheng, XIE Hao, et al. (1982). Study of Hami melon mosaic virus disease-Ⅰ Etiology[J].ActaPhytopathologicaSinica, (4):29-34. (in Chinese)
[7] 孙怡,徐海燕,毕圻,等. 哈密瓜种子带毒率检测及带毒种子的热处理效果研究[J]. 植物病理学报,1985,(1):64-65.
SUN Yi, XU Hai-yan, BI QI, et al. (1985). Study on detection of percentage of seeds infected virus and the effect of heat treatment with seeds infected virus [J].ActaPhytopathologicaSinica, (1):64-65. (in Chinese)
[8] 谢浩,孙严,危晓薇,等. 感染西瓜花叶病毒2号(WMV-2)的哈密瓜种子带毒的证实[J]. 植物病理学报,1988,(4):28.
XIE Hao, SUN Yan, WEI Xiao-wei, et al. (1988). The identification on Hami melon seed infected by watermelon mosaic virus 2 (WMV-2) [J].ActaPhytopathologicaSinica, (4):28. (in Chinese)
[9] 郑光宇,王志民,孙怡,等. 新疆哈密瓜病毒病的免疫电子显微镜诊断[J]. 植物病理学报,1984,(1):47-50.
ZHENG Guang-yu, WANG Zhi-ming, SUN Yi, et al. (1984).The diagnosis of Xinjiang Hami melon virus used immune electron microscopy [J].ActaPhytopathologicaSinica, (1):47-50. (in Chinese)
[10] 向本春,尹玉琦,崔星明. 酶联免疫吸附法检测哈密瓜(WMV-2)种子及幼苗的带毒研究[J]. 石河子农学院学报,1985,(2):1-7.
XIANG Ben-chun, YI Yu-qi, CUI Xin-ming. (1985).The study on Hami Melon seed and Seedling infected by (WMV-2) using enzyme linked immunosorbent assay [J].JournalofShiheziAgriculturalCollege, (2):1-7. (in Chinese)
[11] 黄传贤,覃秉益,奚仲兴,等. 从新疆哈密瓜分离到的烟草坏死病毒及其理化性质的研究[J]. 植物病理学报,1984,(3):153-158.
HUANG Chuan-xian, QIN Bing-yi, XI Zhong-xin, et al. (1984). Study on tobacco necrosis virus isolated from Xinjiang Hami melon and its physicochemical properties [J].ActaPhytopathologicaSinica, (3):153-158. (in Chinese)
[12] 李国玄,赵长生,谢浩,等. 新疆哈密瓜病毒类型及分布[J]. 植物病理学报,1986,(3):9-12.
LI Guo-xuan, ZHAO Chang-sheng, XIE HAO, et al. (1986).The types and distribution Hami Muskmelon virus in Xinjiang [J].ActaPhytopathologicaSinica, (3):9-12. (in Chinese)
[13] 吾尔尼沙,李维琪,彭加木. 新疆哈密瓜花叶病病原体的研究-Ⅰ.病毒质粒的分离提纯方法[J]. 生物化学与生物物理学报,1980,(3):237-241.
WU Er-ni sha, LI Wei-qi, PENG Jia-mu. (1980). Study on Hami melon mosaic disease pathogen in Xinjiang-Ⅰ. separation and purification method of virus plasmid [J].ActaBiochimicaetBiophysicaSinica, (3):237-241. (in Chinese)
[14] 魏宁生,张满良,吴云峰,等. 新疆、甘肃甜瓜病毒病的鉴定及防治[J]. 植物保护学报,1991,(1):81-85.
WEI Ning-sheng, ZHANG Man-liang, WU Yun-feng, et al. (1991). Identification and control of melon virus disease in Xinjiang and Gansu [J].JournalofPlantProtection, (1):81-85. (in Chinese)
[15] 郑光宇,董涛. 在新疆发生的小西葫芦黄化花叶病毒的研究初报[J]. 植物病理学报,1991,(1):74.
ZHENG Guang-yu, DONG Tao. (1991). The study report on occurrence of Zucchini yellow mosaic virus in Xinjiang [J].ActaPhytopathologicaSinica, (1):74. (in Chinese)
[16] 赵荣乐,郑光宇. 危害新疆西瓜的一种线状病毒的研究[J]. 北京师范大学学报(自然科学版),1998,34(2):258-263.
ZHAO Rong-le, ZHENG Guang-yu. (1998). Study on a kind of linear virus infected watermelon in Xinjiang [J].JournalofBeijingNormalUniversity(NaturalScienceEdition), 34(2):258-263. (in Chinese)
[17] 刘卫荣,向本春,韩盛. 新疆小西葫芦黄化花叶病毒的分子鉴定与序列分析[J]. 西北农业学报,2008,17(4):223-228.
LIU Wei-rong, XIANG Ben-chun, HAN Shen.(2008). Molecular identification and sequence analysis of zucchini yellow mosaic virus in Xinjiang[J].NorthwestAgricultureJournal, 17(4):223-228. (in Chinese)
[18] 赵荣乐. 感染新疆甜瓜的南瓜花叶病毒的鉴定[J]. 喀什师范学院学报,2004,25(3):46-50.
ZHAO Rong-le.(2004). Identification of squash mosaic virus infected melon in Xinjiang [J].JournalofKashiTeacher'sCollege, 25(3):46-50. (in Chinese)
[19] 刘卫荣,向本春. 西瓜花叶病毒2号新疆昌吉分离物外壳蛋白基因核苷酸序列分析[J]. 植物病理学报,2008,38(6):576-581.
LIU Wei-rong, XIANG Ben-chun. (2008).Nucleotide sequence analysis of coat protein gene of Watermelon mosaic virus 2 Xinjiang Changji isolates [J].ActaPhytopathologicaSinica, 38(6):576-581, (in Chinese)
[20] 陈炯,陈剑平. Potyvirus属成员基因组全序列的简并引物PCR和RACE扩增方法[J]. 病毒学报,2002,18(4):371-374.
CHENG Jiong, CHENG Jian-ping. (2002).Determination of genome sequence of potyviruses by degenerated PCR and RACE methods [J].ChineseJournalofVirology, 18(4):371-374. (in Chinese)
[21]尚巧霞. 侵染瓜类作物的马铃薯卷叶病毒属病毒的检测、分布和分子变异研究[D]. 中国农业大学,2009.
SHANG Qiao-xia. (2009).Detection,distributionandmoleculardiversityofcucurbits-infectingpoleroviruses[D]. China Agricultural University, Beijing. (in Chinese)
[22] 何丹,海利力·库尔班,玉山江·麦麦提,等. 西瓜花叶病毒(WMV)外壳蛋白基因克隆及序列分析[J]. 新疆农业科学,2015,52(10):1 849-1 858.
HE Dan, Haili Kuerban, Yushanjiang Maimaiti, et al. (2015). Coat protein .gene cloning and sequence analysis of watermelon mosaic virus (WMV) in Xinjiang main planting areas [J].XinjiangAgriculturalSciences, 52(10):1,849-1,858. (in Chinese)
[23] 李继洋,杨渡,韩盛,等. 基于多重RT-PCR技术检测新疆甜瓜主栽区3种病毒病及其分布[J]. 西北农业学报,2015,(8):123-130.
LI Ji-yang, YANG Du, HAN Shen, et al. (2015). Detection and distribution of three viral diseases in xinjiang melon region based on multiplex rt-pcr technique [J].NorthwestAgricultureJournal, (8):123-130. (in Chinese)
[24] 尚巧霞,向海英,韩成贵,等. 侵染瓜类作物的两种马铃薯卷叶病毒属病毒在我国的分布检测[C]//. 中国植物病理学会2008年学术年会论文集: 2008:376.
SANG Qiao-xia, XIANG Hai-ying, HAN Chen-gui, et al. (2008).The distribution and detection of two kinds of viruses which belong to Polerovirus genus infecting cucurbits in China [C]//.Proceedingsofthe2008AnnualConferenceoftheChineseSocietyforplantpathology: 376. (in Chinese)
[25] Atreya, C. D., Raccah, B., & Pirone, T. P. (1990). A point mutation in the coat protein abolishes aphid transmissibility of a potyvirus.Virology, 178(1):161-165.
Fund project:Special fund for innovation and development of scientific research institutions in Xinjiang Uygur Autonomous Region "Study on monitoring and control technology of main diseases in melons in Xinjiang"(2014006); The fund project for outstanding youth science and technology talents in Xinjiang Academy of Agricultural Sciences "The study on identification and molecular variation of viruses: Polerovirus and Potyvirus that infect melons in Xinjiang"(xjnky-2012-038); The open research project for State Key Laboratory of Agricultural Biotechnology "The study on identification and molecular variation of viruses: Polerovirus and Potyvirus that infect cucurbit crops in Xinjiang"(2012SKLAB06-3)
Occurrence and Molecular Identification of Three Kinds of Melon Virus Diseases in Turpan Area, Xinjiang
HAN Shen1,HAN Cheng-gui1,Yushanjiang Maimaiti1,YANG Jun2, YANG Du1
(1.KeyLaboratoryofIntegratedManagementofHarmfulCropVermininChinaNorth-westernOasis,MinistryofAgriculture,P.R.China/ResearchInstituteofPlantProtection,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China;2.CollegeofAgricultureandBiotechnologyandStateKeyLaboratoryforAgro-Biotechnology/ChinaAgriculturalUniversity;Beijing100193,China;3.DevelopmentResearchCenterforGrapes,MelonsandFruitsofXinjiangUygurAutonomousRegion,ShanshanXinjiang838200,China)
【Objective】 To determine the occurrence situation of WMV, ZYMV, CABYV in Turpan area, and find out genetic differences between these virus isolates from different place.【Method】The Infection proportion of CABYV, WMV, ZYMV that infected melons in Turpan area were determined by the method for molecular detection. The genetic differences between the three kinds of viruses from Turpan and these isolates from different domestic and overseas place was analyzed by the method for sequence alignment and construction of phylogenetic trees.【Result】The positive rates of WMV, ZYMV and CABYV in 40 samples of virus disease in Turpan area were 87.5%, 50% and 30%, respectively. There was a protein cleavage site Q/S between NIB protein 3 'terminal and CP protein 5' ends of ZYMV isolates that were isolated from Turpan and other domestic and foreign places. The acid sequences of aphid transmission characteristic domains DAG motif of WMV isolates isolated from Turpan and other domestic and foreign places are DAG separation. The three viruses were divided into different subgroups according to phylogenetic tree.【Conclusion】WMV, ZYMV were the dominant viruses that infected muskmelon in Turpan area, CABYV has become one of the major virus causing muskmelon virus disease in Turpan area. CABYV, WMV Turpan isolates were closer to the isolates from China's domestic provinces, the ZYMV Turpan isolate XJturufan2 is closer to the isolates from Eastern Europe and the Middle East countries, But ZYMV Turpan isolates XJturufan are closer to the isolates from Zhejiang, Henan, Liaocheng, Taiwan in China and other isolates from The United States, Spain and Japan.
WMV; ZYMV; CABYV; phylogenetic tree; DAG motif
10.6048/j.issn.1001-4330.2016.10.009
2016-03-10
新疆维吾尔自治区科研机构创新发展专项资金项目“新疆甜瓜主要病害监测与系统防控技术研究”(2014006);新疆农业科学院优秀青年科技人才基金项目“新疆甜瓜Polerovirus属与Potyvirus属病毒鉴定与分子变异研究”(xjnky-2012-038);农业生物技术国家重点实验室开放研究课题项目“新疆瓜类作物Polerovirus属与Potyvirus属病毒鉴定与分子变异研究”(2012SKLAB06-3)
韩盛(1981-),男,河北海兴人,助理研究员,硕士,研究方向为瓜类作物病害防治,(E-mail)hanshen_1981@163.com
杨渡(1964-),男,新疆乌鲁木齐人,研究员,研究方向为瓜类作物病害防治,(E-mail)zbsyangdu@ sina.cn
S436.5
A
1001-4330(2016)10-1829-14

