新疆4种林木腐烂病菌PCR快速检测技术研究
郭开发,姚兆群,吴彩兰,向本春,赵思峰
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆石河子 832003)
新疆4种林木腐烂病菌PCR快速检测技术研究
郭开发,姚兆群,吴彩兰,向本春,赵思峰
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆石河子 832003)
【目的】建立新疆林木腐烂病菌的快速PCR检测方法,为新疆林木腐烂病的早期测报和防治提供技术依据。【方法】针对新疆林木腐烂病菌主要种苹果黑腐皮壳(Valsamali),污黑腐皮壳(Valsa.sordida),Leucostomaniveum和Valsa.malicola的rDNA-ITS特异性区段设计属专化型引物和种特异性引物。【结果】属专化型引物VF/VR可以从腐烂病菌中扩增一条424 bp的条带,检测灵敏度为10 pg/mL;设计的4对种特异性引物分别可对4种腐烂病菌V.mali,V.sordida,L.niveum,V.malicola检测到263 bp、423 bp、307 bp、308 bp的条带,检测灵敏度均为10 pg/mL。【结论】采用腐烂病菌Valsa 的rDNA-ITS特异性区段设计的引物及PCR方法,可用于新疆林木腐烂病的快速分子检测。
林木;腐烂病菌;rDNA-ITS;PCR检测;特异性引物
0 引 言
【研究意义】新疆具有发展特色林果产业的地理气候优势,截止到2014年底,特色林果种植面积已达167.67×104hm2,总产量650×104t,产值450×108多元,新疆已成为全国重要的“西域大果园”[1]。然而新疆冬季寒冷,林木受冻后易发生腐烂病,尤其近年来香梨优斑螟在新疆南疆苹果、梨、枣、杨树等林木上普遍发生,进一步加重了腐烂病为害[2,3]。由于腐烂病菌具有潜伏侵染特性,树木受感染后早期不表现症状,待树势衰弱后开始扩展并导致腐烂病发生,此时防治为时已晚[4]。若能在果园枯枝落叶以及树皮上提前检测到腐烂病菌的存在,并在其蔓延扩散前进行预防,可有效提高林木腐烂病的防治效果。【前人研究进展】Zang[5]依据腐烂病菌rDNA-ITS的特异序列,设计3种特异性引物分别检测三种苹果树腐烂病菌V.malivar.mali,V.malicola,V.persoonii,检测灵敏度达到100 fg/μL。【本研究切入点】腐烂病的检测采用传统分离方法费时费力,且对潜伏侵染部位以及新感染部位分离效果不佳,基于腐烂病菌 rDNA-ITS 序列分析的PCR检测技术则更为有效和准确[5]。研究采用林木腐烂病菌的rDNA-ITS 序列设计特异性引物,为林木腐烂病菌的快速检测提供技术支持。【拟解决的关键问题】以林木腐烂病在新疆已报道种Valsamali,Valsasordida,Leucostomaniveum和Valsamalicola[2]为研究对象,设计特异性引物,建立针对新疆林木腐烂病菌快速、准确的PCR 检测方法,为新疆林木腐烂病菌的早期监测和防治提供技术支持。
1 材料与方法
1.1 材 料
所用腐烂病菌菌株有4个种,分别是V.mali,V.sordida,L.niveum和V.malicola,前期已通过形态学、ITS序列、β微观蛋白基因等进行准确鉴定。列出菌株编号、来源、种名以寄主等。表1
表1 腐烂病菌分子快速检测供试菌株
Table 1 The strains of valsa canker pathogens were used to rapid molecular detection

序号No.编号IsolatesNo.来源Originsofstrains种名Species寄主Host16T4L-L新疆兵团第一师6团Regiment6ofDivisionNo.1ofXPCG,Akesu,XinjiangV.mali梨树Pyrus229-1-6新疆兵团第二师29团Regiment29ofDivisionNo.2ofXPCG,Korla,XinjiangV.mali梨树Pyrus328-Y-1-1新疆兵团第二师28团Regiment28ofDivisionNo.2ofXPCG,Korla,XinjiangV.mali毛白杨Populustomentosa4cfcc84640中国林业微生物菌种保藏管理中心ChinaforestryculturecollectioncenterV.mali海棠Malusspectabilis5TMG-3新疆兵团第二师29团Regiment29ofDivisionNo.2ofXPCG,Korla,XinjiangV.sordida胡杨Populuseuphratica6Ks新疆喀什市Kashgar,XinjiangV.sordida毛白杨Populustomentosa7HS-2新疆巴州和硕县HeshuocountyofXinjiangV.sordida沙枣Elaeagnusangustifolia8cfcc85445中国林业微生物菌种保藏管理中心(Chinaforestryculturecollectioncenter)V.sordida毛白杨Populustomentosa9cfcc84642中国林业微生物菌种保藏管理中心(Chinaforestryculturecollectioncenter)V.sordida刺槐Robiniapseudoacacia1022T-XL新疆兵团第二师22团Regiment22ofDivisionNo.2ofXPCG,Korla,XinjiangV.malicola梨树Pyrus1129-1-11新疆兵团第二师29团Regiment29ofDivisionNo.2ofXPCG,Korla,XinjiangV.malicola梨树Pyrus12TMG-8新疆兵团第二师29团Regiment29ofDivisionNo.2ofXPCG,KorlaXinjiangL.niveum新疆杨Populusalba13YQ-1新疆巴州焉耆县YanqicountyofXinjiangL.niveum新疆杨Populusalba14cfcc86482中国林业微生物菌种保藏管理中心(Chinaforestryculturecollectioncenter)V.mali苹果Malus15FCH-1新疆兵团第六师芳草湖农场FangcaohufarmofDivisionNo.6ofXPCG,Changji,XinjiangAlternariasp.毛白杨Populustomentosa16FCH-2新疆兵团第六师芳草湖农场FangcaohufarmofDivisionNo.6ofXPCG,Changji,XinjiangFusariumsp.毛白杨Populustomentosa
注:黑色字体为购买的标准菌株; XPCG为新疆生产建设兵团(Xinjiang Production and Construction Group)简写
Note:Standard strains are presented with black font;XPCG are short for Xinjiang Production and Construction Group
1.2 方 法
1.2.1 特异性引物设计
采用 DNAStar 软件中的 Seqman 程序,对V.mali,V.sordida,L.niveum和V.malicola的rDNA-ITS 序列和在 GeneBank 中找到的同属其它种的 rDNA-ITS 序列进行多重同源性比较,以这四个种的 rDNA-ITS保守区段和多态性丰富的特异性区段为靶标,参考藏睿等[6]文献报道的Valsa属专化型引物VF/VR,应用Primer 5.0 软件分别设计种特异性引物(Species-specific primers),其中针对V.mali的是VmmF/VmmR,目标片段263 bp,针对V.sordida的是VsF/ VsR,目标片段423 bp,针对L.niveum的是VnF/ VnR,目标片段307 bp,以及针对V.malicola的是VmF/VmR,目标片段308 bp。引物委托北京华诺时代科技有限公司合成。表2
表2 林木腐烂病的保守引物和种特异性引物的序列与退火温度
Table 2 The nucleotide sequences and annealing temperatures of universal primers and species-specific primers of tree Valsa canker

引物名称(Primername)引物序列PrimerSequence(5’-3’)引物退火温度Annealingtemperature(℃)VmmFGCCGGCGGCCCAATTAA52VmmRCGCCCGGAGGCGGTCTC59VsFTCGTAAAACACCTGGGGAAAA50VsRAAATTTTCAGAAGTTGGGGGT49VnFCTGGTCGTCAAAAGCCAGGGGA59VnRTTCTGTAAACAGTCAGGTAATGCCCC58VmFTTGGCTGCCTCTCCCCTCGG60VmRGGAAGGTAATGCCCCAACACC56VFGTTGCCTCGGCGCTGGCT57VRGCGAGGGTTTTACTACTGC51
1.2.2 DNA提取及PCR反应
病原菌DNA的提取采用Edwards[7]的方法:挑取少量腐烂病菌菌丝体加入1.5 mL离心管中,加入500 μL的buffer提取液(200 mM Tris HCl pH 7.5,250 mM NaCl,25 mM EDTA,0.5% SDS),用研磨棒进行研磨,室温静置2 h,13 000 r/min离心2 min,取上清液400 μL加入新的离心管中;加入400 μL的异丙醇,静置5 min后,13 000 r/min离心5 min后,弃上清液;加入75%乙醇进行洗涤,晾干后加入40 μL的TE溶液,-20℃保存。也可采用市售DNA提取试剂盒提取病原菌的DNA。
PCR反应体系:PCRTaqMix 10 μL,10 μmol/L引物各1 μL,病原物DNA 0.5 μL,ddH2O 12.5 μL,终体积为25 μL。扩增条件为:94℃预变性4 min;94℃变性30s,引物退火30s,72℃延伸40s,30个循环;最后72℃延伸10 min。反应完成后,10 g/L琼脂糖凝胶电泳检测PCR反应产物。表2
1.2.3 引物特异性检测
以在林木腐烂病菌分离过程中出现频率最高的其它属分离物:1株链格孢菌(Alternariasp.)和1株镰刀菌(Fusariumsp.)为阴性对照。用合成引物对参试菌株的基因组DNA 进行PCR扩增,检测其特异性条带的有无来分析引物的特异性。
1.2.4 引物灵敏度检测
用紫外分光光度计测量所提取腐烂病菌基因组DNA 的OD260值,将浓度调整为1 μg/mL,并按10倍梯度稀释为1 μg/mL、100 ng/mL、10 ng/mL、1 ng/mL、100 pg/mL、10 pg/mL备用。PCR反应体系和反应程序同上。
“学为中心”要求教师尽量减少对学生学习时间的占领,把学习的大部分时间交给学生,让学生自己“生发”知识。只有学生自已“生发”出来的浸润着学生自己血脉的知识才有生命,才是刻骨铭心的。
2 结果与分析
2.1 属专化性引物检测
属专化性引物的检测,旨在快速检测枯枝落叶以及树皮上是否携带腐烂病菌,而非腐烂病菌则不能扩增出特异性条带。研究表明,VF/VR引物对4个种均可以检测到约为350 bp的条带,而链格孢菌(Alternariasp.)和镰刀菌(Fusariumsp.)及对照均未检测到特异性条带。图1

注:泳道1~4为V.mali菌株;5~9为V.sordida菌株;10~11 为L.niveum菌株;12~13为V.malicola菌株;14为V.mali菌株;15~17分别为Alternariasp、Fusarium sp.和阴性对照;M表示2 000 DNA Marker,下同
Note:Lane 1-4 isV.mali, lane 5-9 isV.sordida, lane 10-11 isL.niveum, lane 12-13 isV.malicola,lane 14 isV.mali,line 15 to 17 isAlternariasp.,Fusariumsp.and CK (no DNA template), M represents 2,000 DNA Marker, the same as below
图1 属专化型引物VF/VR对不同病原物检测结果
Fig.1 Specificity test of genus-specific primers VF/VR by PCR from different strains
2.2 种特异性引物检测
对种特异性引物特异性的检测,检测所设计的引物是否只具有靶向的唯一性,即只对其所检测的靶标菌进行扩增,而不能对非靶标菌进行扩增。
研究表明,菌株6T4L-L,29-1-6,28-Y-1-1,cfcc84640和cfcc86482共5株为V.mali,仅6T4L-L,29-1-6,28-Y-1-1,cfcc84640检测到约为250 bp左右的目的片段,cfcc86482和其他菌株均未检测到目标片段。表明引物VmmF /VmmR对V.mali具有相对专一性,可用于腐烂病菌V.mali的快速分子检测。图2

图2 VmmF/VmmR 对不同病原菌特异性检测
Fig.2 Specificity test of species-specific primersVmmF/VmmR by PCR from different isolates
研究表明,采用特异性引物对TMG-3,KS,HS-2,cfcc84642和cfcc95445共5株均为V.sordida菌株,可以检测到约为400 bp左右的目的片段,其他腐烂病菌、镰刀菌和链格孢属均未检测到特异性目标条带。表明引物VsF /VsR对V.sordida具有相对专一性,可用于腐烂病菌V.sordida的快速分子检测。图3

图3 VsF/VsR 对不同病原菌特异性检测
Fig.3 Specificity test of species-specific primersVsF/VsR by PCR from different isolates
研究表明,22T-xl和29-1-11共2株均为L.niveum,通过PCR检测均扩增出约为300 bp左右的目的片段,而其他的均未检测到。说明引物VnF/VnR对L.niveum具有相对专一性,可用于腐烂病菌V.nivea的快速分子检测。图4
研究表明,TGM-8、YQ-1共2株为V.malicola,通过检测到约为300 bp左右的目的片段,其他的均未检测到。表明引物VmF /VmR对V.malicola具有相对专一性,可用于腐烂病菌V.malicola的分子检测。图5
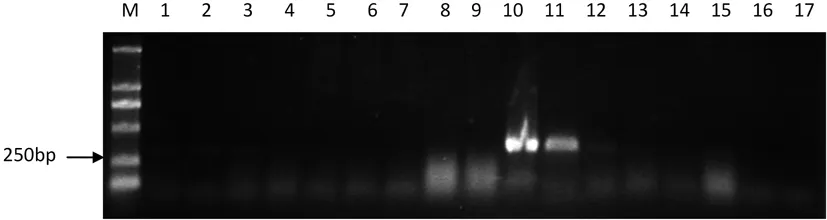
图4 VnF/VnR 对不同病原菌特异性检测
Fig.4 Specificity test of species-specific primersVnF/VnR by PCR from different isolates

图5 VmF/VmR 对不同病原菌特异性检测
Fig.5 Specificity test of species-specific primersVmF/VmR by PCR from different isolates
以稀释为1 μg/mL、100 ng/mL、10 ng/mL、1 ng/mL、100 pg/mL、10 pg/mL作为模板,选用属专化型引物VF/VR进行PCR扩增后,均可以检测出一条400 bp左右的条带,条带较为清晰。图6

注:泳道1~6分别为稀释浓度为1 μg/mL,100 ng/mL,10 ng/mL,1 ng/mL,100 pg/mL,10 pg/mL,泳道7为对照,M表示2 000 DNA Marker
Note:Lanes 1-6:Amplified products using DNA at concentrations of 1 μg/mL,100 ng/mL,10 ng/mL,1 ng/mL,100 pg/mL, 10 pg/mL,respectively, lane 7 for control, M represents 2,000 DNA Marker.
图6 属专化型引物对腐烂病菌灵敏性检测
Fig.6 Sensitivity of PCR with specific primers for detection of Valsa Canker
4种腐烂病菌V.mali、V.sordida、L.niveum、V.malicolaDNA浓度稀释后,选择对应种特异性引物进行PCR 扩增后电泳条带。4种病原物DNA浓度稀释为10 pg/mL时均可以检测到条带。图7

注:泳道1~6分别为稀释浓度分别为1 μg/mL、100 ng/mL、10 ng/mL、1 ng/mL、100 pg/mL、10 pg/mL,泳道7为对照,M表示2 000 DNA Marker(A :V.mali; B:V.sordida; C: L.niveum; D:V.malicola)
Note:Lanes 1-6:Amplified products using DNA at concentrations of 1 μg/mL,100 ng/mL,10 ng/mL,1 ng/mL,100 pg/mL, 10 pg/mL respectively, lane 7 for control, M represents 2,000 DNA Marker
图7 种特异性引物对腐烂病菌灵敏性检测
Fig.7 Sensitivity of PCR with specific primers for detection of Valsa Canker
3 讨 论
随着分子检测技术的发展,建立基于 rDNA-ITS区段的分子检测技术已得到了广泛应用[8-10]。Feau[11]利用种特异性的引物,成功的从杨树上检测到了三种壳针孢属(Septoria)病原菌的存在。Zang[5]利用苹果树腐烂病菌的 rDNA-ITS 的特异区段为靶标设计特异性的引物,区分苹果树腐烂病菌V.malicola,V.persoonii和V.malivar.mali,检测灵敏度达到100 fg/μL。周晓云等[12]设计特异性引物SF1/SR2对华丽腐霉(A.andraeanum)进行快速检测,检测灵敏度在 DNA 水平上可达1 pg。
新疆林木腐烂病有逐年加重的趋势,已成为新疆林木主要的病害之一[13,14]。腐烂病菌危害寄主种类较多,且病菌种类复杂多样[15-18]。传统的生物学形态鉴定就显得十分困难。因此建立快速PCR检测技术对于腐烂病病害的早期诊断、预防显得十分重要。研究中采用的属专化型引物VF/VR能准确的区别出林木腐烂病菌和其他病菌,检测灵敏度达到10 pg/mL。设计的四对种特异性引物,可准确的区分四种林木腐烂病菌V.mali、V.sordida、L.niveum、V.malicola。检测浓度达到10 pg/mL。
研究建立方法只对新疆林木腐烂病进行快速定性检测,并且可满足农业生产上大量样品批量检测的需求。很多文献报道苹果腐烂病菌V.mali存在异名[19-21]。研究设计的VcF/VcR特异性引物中,购买的菌株V.mali(cfcc86482)没有被检测出来,具体原因还需要进一步试验进行确认。同时新疆林木腐烂病菌是否存在其他种类,也需要进一步进行分离鉴定。
4 结 论
建立了一种基于DNA分析的新疆林木腐烂病菌的PCR快速检分子测检测体系,该体系可以快速检测出枯枝落叶以及潜伏侵染的腐烂病菌,设计的属专化型引物对4种腐烂病菌均检测到424 bp的条带,检测灵敏度为10 pg/mL;设计的4对种特异性引物分别对4种腐烂病菌V.mali,V.sordida,L.niveum,V.malicola检测到263 bp、423 bp、307 bp、308 bp的条带,检测灵敏度均为10 pg/mL。该方法具有高通量、快捷、灵敏度高的特点,用于新疆林木腐烂病预测预报、田间诊断,越冬场所、传播途径等研究有重要意义。
References)
[1]牛金辉. 新疆特色林果种植面积突破 2 200 万亩[N]. 新疆科技报(汉),2015-02-13(001)
NIU Jin-hui. (2015). Fruit cultivation area exceeded 146.67*104hm2in Xinjiang [N].XinjiangScienceandTechnology, 2015-2-13(001)
[2]杜琴,孔利,赵思峰,等.新疆库尔勒香梨腐烂病病原鉴定[J].新疆农业科学,2013,50(12):2 258-2 265.
DU Qin, KONG Li, ZHAO Si-feng, et al. (2013). Identification of valsa canker pathogen of Korla pear tree [J].XinjiangAgriculturalSciences, 50(12):2,258-2,265.(in Chinese)
[3]侯世星,温俊宝,庞华.新疆果树害虫香梨优斑螟研究进展[J].林业科学,2011,47(9):148-152.
HOU Shi-xing, WEN Jun-bao, PANG Hua. (2011). Research Progress of Euzophera pyriella [J].ScientiaSilvaeSinicae, 47(9):148-152.(in Chinese)
[4]宋娜,戴青青,黄丽丽,等.苹果树腐烂病菌 GTP-环化水解酶II 基因敲除载体构建及其突变体的表型分析[J].中国农业科学,2014,47(15):2 980-2 989.
SONG Na, DAI Qing-qing, HUANG Li-li, et al. (2014).Construction of Knockout Vector of GTP Cyclohydrolase II Gene and Mutant's Biological Characteristics of Valsa mali [J].ScientiaAgriculturaSinica,47(15):2,980-2,989.(in Chinese)
[5] Zang, R., Yin, Z., Ke, X., Wang, X., Li, Z., & Kang, Z., et al. (2012). A nested pcr assay for detecting valsa mali var. mali in different tissues of apple trees.PlantDisease, 96(11):1,645-1,652.
[6] 藏睿.中国苹果树腐烂病菌的种群组成、分子检测及其ISSR遗传分析[D].杨凌:西北农林科技大学博士学位论文,2011.
ZANG Rui. (2011).ThephylogenticrelationshipmoleculardetectionappletreevalsacankercausalagentsinChina,andpopulationstructureanalysisusingISSRmarker[D]. PhD Dissertation. Northwest A & F University. Yangling.(in Chinese)
[7] Edwards, K., Johnstone, C., & Thompson, C. (1991). A simple and rapid method for the preparation of plant genomic dna for pcr analysis.NucleicAcidsResearch, 19(6):1,349-1,349.
[8]赵永强,张成玲, 张薇, 等.烟草根黑腐病菌的PCR分子检测[J].植物病理学报,2009,39(1):23-29.
ZHAO Yong-qiang, ZHANG Chen-ling, ZHANG Wei, et al. (2009). Molecular detection ofThielaviopsisbasicolaby PCR assay [J].ActaPhytopathologicaSinica, 39(1):23-29.(in Chinese)
[9] 张海峰,任众, 刘翔, 等.冬生疫霉(Phytophthorahibernalis)的快速分子检测[J].植物病理学报,2008,38(3):231-237.
ZHANG Hai-feng, REN Zhong, LIU Xiang, et al. (2008). Rapid molecular detection ofPhytophthorahibernalisby PCR [J].ActaPhytopathologicaSinica, 38(3):231-237. (in Chinese)
[10]宋娜,陈卫民,杨家荣,等.向日葵黑茎病菌的快速分子检测[J].菌物学报,2012,31(4):630-638.
SONG Na, CHEN Wei-ming, YANG Jia-rong, et al. (2012).Fast molecular detection of the pathogen of sunflower black stem [J].Mycosystema, 31(4):630-638. (in Chinese)
[11] Feau, N., Weiland, J. E., Stanosz, G. R., & Bernier, L. (2005). Specific and sensitive pcr-based detection of septoria musiva, s. populicola and s. populi the causes of leaf spot and stem canker on poplars.MycologicalResearch, 109(Pt 9):1,015-1,028.
[12]周晓云,游春平.红掌根腐病病原鉴定及其PCR检测方法[J].园艺学报,2013,40(5):989-996.
ZHOU Xiao-yun, YOU Chun-ping. (2013). Identification and PCR Detection of the Pathogen Causing Root Rot ofAnthuriumandraeanum[J].ActaHorticulturaeSinica, 40(5):989-996. (in Chinese)
[13] 潘朝印.库尔勒香梨树腐烂病大流行原因浅析及防治意见[J].植保技术与推广,1997,17(3):29.
PAN Chao-yin. (1997). Korla fragrant pear rot disease causes and prevention [J].PlantProtectionTechnologyandExtension,17(3):29. (in Chinese)
[14]郭铁群.库尔勒香梨病虫害发生趋势及综合治理研究[J].新疆农业科学,2002,39(1):27-30.
GUO Tie-qun. (2002). Occurrence trend and comprehensive control of pests and diseases of Korla fragrant pear[J].XinjiangAgriculturalSciences,39(1):27-30. (in Chinese)
[15] Adams, G. C., Wingfield, M. J., Common, R., & Roux, H. (2004). Phylogenetic relationships and morphology of cytospora species and related teleomorphs ( ascomycota, diaporthales, valsaceae ) from eucalyptus.StudiesinMycology:52.
[16]马荣,王阳阳,刘晓琳,等.新疆核桃树腐烂病拮抗细菌的筛选及初步鉴定[J]. 新疆农业科学,2015,52(5):895-901.
MA Rong, WANG Yang-yang, LIU Xiao-lin, et al. (2015). Isolation and identification of the antagonistic bacteria against Walnut canker in Xinjiang [J].XinjiangAgriculturalSciences, 52(5):895-901. (in Chinese)
[17] 岳朝阳,张新平,马沛沛,等.新疆杨树不同种、品种(无性系)造林初期对腐烂病的抗性研究[J].西北林学院学报,2011,26(1):113-118.
YUE Zhao-yang, ZHANG Xin-ping, MA Pei-pei, et al. (2011). Resistance of different poplars in the initial afforestation stages onCytosporachrysospermain Xinjiang [J].JournalofNorthwestForestryUniversity, 26(1):113-118.(in Chinese)
[18] Zhuang, W. Y., Guo, L., Guo, S. Y., Guo, Y. L., Mao, X. L., & Sun, S. X., et al. (2005). Fungi of northwestern china. Fungi of Northwestern China.
[19] Kobayashi, T. (1970). Taxonomic studies of japanese diaporthaceae with special reference to their life-histories.JapForestExpStaBull.
[20] Suzaki, K. (2008). Population structure of valsa ceratosperma, causal fungus of valsa canker, in apple and pear orchards.JournalofGeneralPlantPathology, 74(2):128-132.
[21] Wang, X., & Kang, Z. (2011). Re-evaluation of pathogens causing valsa canker on apple in china.Mycologia, 103(2):317-324.
Fund project:The science and technology aid project of the Xinjiang Uygur Autonomous Region(201491150); The project of the introduction of the higher-grade talented persons of the Xinjiang Uygur Autonomous Region(2015-2017)
Rapid PCR Detection Technology for Four Species of Valsa Canker Pathogens of Trees in Xinjiang
GUO Kai-fa,YAO Zhao-qun,WU Cai-lan,XIANG Ben-chun,ZHAO Si-feng
(CollegeofAgronomy,ShiheziUniversity/KeyLaboratoryforOasisAgriculturalPestManagementandPlantResourceUtilizationatUniversitiesofXinjiangUygurAutonomousRegion,ShiheziXinjiang832003,China)
【Objective】 To develop a rapid PCR assay for detection of trees Valsa canker in Xinjiang and provide the technical support for forecast and prevention of treesValsacanker.【Method】Based on rDNA-ITS conservative sequence of theValsagenus, a pair of genus-specific primers and four pairs of species-specific primers were designed forValsamali,Valsasordida,LeucostomaniveumandValsamalicola.【Result】Using genus-specific primers VF/VR to amplify a unique 424 pb band from Valsa and using four pairs of species-specific primers to amplify 263 bp,423 bp, 307 bp and 308 bp band fromV.mali,V.sordida,L.niveumandV.malicolarespectively. And the detection sensitivity was 10 pg/mL.【Conclusion】The results suggested that developed rapid molecular detection method in this study based on rDNA-ITS conservative sequence of theValsagenus can be used in the Xinjiang treesValsacanker.
tree;Valsacanker;rDNA-ITS;PCR detection;specificity primers
10.6048/j.issn.1001-4330.2016.10.010
2016-12-30
新疆维吾尔自治区科技援疆项目(201491150);新疆维吾尔自治区高层次人才引进项目(2015-2017)
郭开发(1985-),男,甘肃威武人,博士研究生,研究方向为植物菌物病害,(E-mail)andygkf@126.com
向本春(1958-),男,四川宣汉人,教授,博士生导师,研究方向为植物病理学,(E-mail)xbc@shzu.edu.cn 赵思峰(1975-),男,四川巴中人,教授,博士生导师,研究方向为植物菌物病害及其生物防治,(E-mail)zhsf_agr@shzu. edu.cn
S436.6
A
1001-4330(2016)10-1843-07

