紫薯渣果胶提取工艺研究
赵丰丽,吕金莲,吴奔,陈静
(1.广西师范大学生命科学学院,广西桂林541004;2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林541004)
紫薯渣果胶提取工艺研究
赵丰丽1,2,吕金莲1,吴奔1,陈静1
(1.广西师范大学生命科学学院,广西桂林541004;2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西桂林541004)
该试验以紫薯渣为原料研究果胶提取工艺,对预处理后的紫薯渣以果胶含量为考察指标,研究酸提取条件及脱色条件。结果表明,紫薯渣在pH 7.0,温度75℃时,α-淀粉酶用量60 U/g原料,酶解时间30 min条件下除去淀粉;酸提取工艺条件为盐酸提取液pH值1.5,温度85℃,时间105 min;脱色条件为活性炭用量1%,脱色温度70℃,时间30 min;在此条件下制备的果胶含量为3.979%。
紫薯渣;果胶;提取;纯化;正交试验
果胶物质是一种多糖聚合物,成分主要为甲酯化的α-1,4-D-聚半乳糖醛酸。其是一种直链高分子聚合物,通常为白色或淡黄色粉末,无臭、味微甜、稍带酸味,不溶于乙醇等有机溶剂,溶于热水、微溶于冷水,具有优良的凝胶性和乳化稳定性,其相对分子质量约12万~20万u[1]。目前在食品、保健品、纺织和一些化妆品中有许多应用[2-3]。利用果蔬提取果胶的相关研究已有许多,但在紫薯渣中提取果胶的研究还未见有报道。
紫薯又称紫甘薯,属于一年生植物,除含有普通甘薯的营养成分外,还富含花青素、膳食纤维、果胶、多种维生素和矿物质元素。在机体抗氧化、抗癌、防辐射、抗高血压等方面都有不同程度的功效[4]。目前,有关对紫薯的研究涉及紫薯全粉加工研究[5-6]、影响紫薯花青素的提取及抗氧化活性[7-9]、紫薯中提取果胶[10]、紫薯饮料工艺[11]、紫薯汁糖化工艺进行研究[12]、紫薯的抗氧化及活性成分[13],高压高温短时间处理紫甘薯蜜品质的研究[14],微波真空干燥法混合荔枝等。
紫薯渣是紫薯色素、淀粉提取过程中产生的副产物,含水量大,极易腐败,含有大量的淀粉、纤维素和果胶。但是,这些废渣一般作为废料处理,存在着资源浪费的现象[15]。因此,本试验以紫薯提取花青素和淀粉后的废渣为原料,采用酸提醇沉法对紫薯渣中果胶的提取进行工艺研究,以期为紫薯渣的综合利用提供理论基础。
1 材料与方法
1.1 材料与试剂
紫薯渣:购买于桂林市灌阳县;浓盐酸(36%~38%):株洲石英化玻有限公司;浓硫酸(95%~98%)、磷酸(分析纯)、无水乙醇(分析纯)、氢氧化钠(分析纯)、过氧化氢(分析纯):西陇化工股份有限公司;柠檬酸(分析纯)、咔唑、α-淀粉酶(50 U/mg)、D-(+)-半乳糖醛酸(分析纯):上海蓝季科技发展有限公司。活性炭:天津市福晨化学试剂厂;硅藻土:上海展云化工有限公司。
1.2 仪器与设备
UVmini-1240型紫外分光光度计:日本岛津公司;TAISITE型粉碎机:天津泰斯特仪器有限公司;RE-2000B型旋转蒸发仪:上海亚荣生化仪器厂;FB224型电子天平:上海舜宇恒平科学仪器有限公司;TD-5A型大容量离心机:常州中诚仪器制造有限公司;HWS26型恒温水浴锅:上海—恒科学仪器有限公司;SHB-B95A型循环水式多用真空泵:郑州长城科工贸有限公司;DHG-9070A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司。
1.3方法
1.3.1 工艺流程

1.3.2 操作要点
预处理:紫薯渣干燥、粉碎过60目筛,分装于三角瓶(5 g/瓶),按料液比1∶10(g∶mL)加入蒸馏水,用1 mol/L NaOH调节pH值为7.0,于100℃水浴中加热糊化20 min。糊化后,待温度降至75℃时,加入60 U/g的α-淀粉酶溶液,75℃酶解30min,用碘液检查酶解是否完全。若检测到溶液不变蓝色,则薯渣中的淀粉已经被α-淀粉酶水解,过滤、离心得湿渣[12]。
乙醇沉淀:利用果胶不溶于醇类有机溶剂的特点,先将果胶提取液浓缩,再将乙醇加入果胶水溶液中使果胶沉淀析出,析出的果胶经干燥、粉碎得到成品[16]。其中,原料浓缩倍数和醇沉浓度是关键。参照参考文献[16],选择醇沉时所用果胶提取液以浓缩至1/4为宜,乙醇用量为1∶1,沉淀时间为30 min对紫薯渣中的果胶进行沉淀提取。
1.3.3 果胶提取工艺的确定[10,16]
称取2 g经过预处理的原料,装于离心管中。分别选择硫酸、盐酸、磷酸、硝酸和柠檬酸等调节酸液pH值为1.5,按料液比1∶20(g∶mL)加入各离心管,恒温85℃提取60 min,过滤、离心得上清液,测定果胶的含量,选择合适的酸种类。
在确定提取果胶所用酸种类的基础上,参照参考文献[10,16],固定料液比为1∶20(g∶mL),以提取温度、时间、酸液pH值为3个因素,果胶提取率为考察指标,选用L9(33)正交试验考察各因素对果胶提取的影响。
1.3.4 果胶脱色工艺的确定
酸提取得到的果胶提取液含有色素等杂质,为提高果胶的质量,研究几种脱色剂(活性炭、硅藻土、双氧水)的脱色效果。以脱色后剩余的果胶含量为指标,筛选较佳的脱色剂。
脱色剂的选择:分别在试管中加入20 mL果胶提取液,再分别加入0.2 g的活性炭、0.2 g的硅藻土、0.667 mL的双氧水,然后在80℃条件下保温30 min,离心,取其上清液测定半乳糖醛酸的含量[14],得到果胶含量选出较佳脱色剂。
果胶活性炭脱色工艺的正交试验:在脱色剂选择的实验基础上,参照参考文献[14],以温度、时间、活性炭用量为3个因素,以剩余的果胶含量为指标,进行正交试验,确定活性炭脱色最佳工艺条件。
1.3.5 测定方法[17-18]
果胶经过水解生成半乳糖醛酸,在强酸中与咔唑试剂发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,故可以用比色定量。参照参考文献[17]制作标准曲线,取1 mL样品稀释液于试管中,按制标曲方法操作,测定吸光度值。代入标准曲线方程,求出半乳糖醛酸含量(μg/mL)。通过试验,得出半乳糖醛酸标准曲线的线性方程为:y=0.008 32x-0.005 33,R2=0.999 2。
样品(紫薯提取液)果胶含量按下列公式计算:
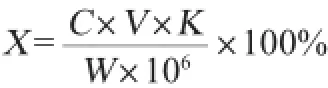
式中:X为紫薯渣中的果胶含量(以半乳糖醛酸计),%;C为通过标曲求得稀释果胶提取液的半乳糖醛酸质量浓度,μg/mL;V为果胶提取液原液体积,mL;K为果胶提取液的稀释倍数;106为质量单位换算系数。
2 结果与分析
2.1 紫薯渣果胶酸提取工艺
2.1.1 酸种类对果胶提取效果的影响
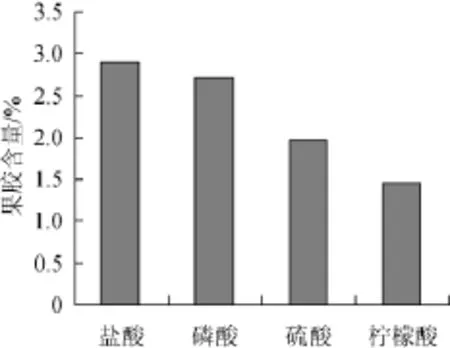
图1 酸种类对果胶提取效果的影响Fig.1 Effect of acid type on the extraction rate of pectin
由图1可知,盐酸提取果胶的含量最高,磷酸也比较高,最低的为柠檬酸。从经济方面考虑,盐酸价格也更加便宜,因此本研究提取紫薯渣中的果胶选用盐酸溶液。
2.1.2 酸提取工艺的正交试验
选用L9(33)正交试验对盐酸提取紫薯渣中果胶的最佳提取条件进行研究,结果与分析见表1。

表1 酸提取工艺条件优化正交试验结果与分析Table 1 Results and analysis of orthogonal tests for acidolysis extraction conditions optimization
由表1可以看出,各因素影响主次顺序为C>B>A。即pH值对提取率的影响最大,其次为时间和温度。本研究最优组合为A2B3C2,即提取温度85℃,提取时间105 min,pH值为1.5。在该条件下进行验证试验(重复3次),测得果胶的平均含量为4.247%。
2.2 果胶脱色工艺研究的结果
2.2.1 脱色剂种类对果胶脱色效果的影响
通过测定脱色后各果胶液中果胶的含量,分别为3.594%(活性炭)、3.252%(硅藻土)、2.174%(双氧水)。因此,脱色剂选用活性炭的脱色效果最好。
2.2.2 脱色工艺的正交试验
选用L9(33)正交试验对脱色工艺的最佳条件进行研究,结果与分析见表2。

表2 脱色工艺条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for decolorization process optimization
由表2可以看出,影响脱色工艺的因素主次顺序为B>A>C,表明温度对脱色影响最大,其次为活性炭的用量,最后是时间。脱色工艺的最优组合为A1B2C1,即活性炭用量1%,脱色温度70℃,脱色时间为30 min。在此条件下进行验证试验(重复3次),测得果胶的平均含量为3.979%。
3 结论
本研究通过试验确定了盐酸提取紫薯渣果胶的最佳工艺条件为:紫薯渣在pH 7.0,温度75℃时,α-淀粉酶用量60 U/g原料,酶解时间30 min条件下除去淀粉;酸提取工艺条件为盐酸提取液pH值1.5,温度85℃,时间105 min;脱色条件为活性炭用量1%,脱色温度70℃,时间30 min;在此条件下制备的果胶含量为3.979%。
[1]周红,肖安红.功能性膳食纤维食品[M].北京:化学工业出版社,2005:15-19.
[2]段红,曹稳根.果胶及其应用研究进展[J].宿州学院学报,2006,21(6):80-83.
[3]谢明勇,李精,聂少平.果胶研究与应用进展[J].中国食品学报,2013,13(8):1-14.
[4]吕昱,严敏.紫薯花色苷的生理功能及分离纯化研究进展[J].食品与机械,2013,29(4):205-254.
[5]刘阳,傅亚平,廖卢艳,等.紫薯熟全粉变温压差膨化干燥技术研究[J].中国酿造,2015,34(8):58-62.
[6]PENG Z,LI J,GUAN Y F,et al.Effect of carriers on physicochemical properties,antioxidant activities and biological components of spraydried purple sweet potato flours[J].LWT-Food Sci Technol,2013,51 (1):348-355.
[7]田喜强,董艳萍.超声波辅助提取紫薯花青素及抗氧化性研究[J].中国酿造,2014,33(1):77-80.
[8]CIPRIANO P D A,EKICI L,BARNES R C,et al.Pre-heating and polyphenol oxidase inhibition impact on extraction of purple sweet potato anthocyanins[J].Food Chem,2015,180:227-234.
[9]TRUONG V D,HU Z,THOMPSON R L,et al.Pressurized liquid extraction and quantification of anthocyanins in purple-fleshed sweet potato genotypes[J].J Food Compos Anal,2012,26(1-2):96-103.
[10]郑凯,何方岳,徐静雯,等.紫薯中果胶提取工艺条件的研究[J].广州化工,2015,43(4):79-81.
[11]赵红岩.紫薯功能饮料双酶水解工艺[J].中国酿造,2015,34(3):118-121.
[12]党娅,刘水英.响应面法优化紫薯汁糖化工艺研究[J].中国酿造,2014,33(8):55-59.
[13]蔡湛,兰余,赵淑娟,等.紫薯的抗氧化及活性成分研究[J].粮食与油脂,2015,28(1):43-48.
[14]WANG Y T,LIU F X,CAO X M,et al.Comparison of high hydrostatic pressure and high temperature short time processing on quality of purple sweet potato nectar[J].Innov Food Sci Emerg Technol,2012,16:326-334.
[15]梁陈冲,于会民,王月超,等.甘薯渣的饲用价值及应用[J].饲料与畜牧,2012(12):34-36.
[16]张允.薯渣及柚皮果胶提取工艺的研究[D].北京:北京化工大学,2012.
[17]王福荣.生物工程分析与检验[M].北京:中国轻工业出版社,2005:156-157.
[18]徐慧.辣椒果胶的提取工艺及理化性质研究[D].天津:天津科技大学,2010.
[19]魏海香,梁宝东.甘薯果胶酸提取工艺的研究[J].食品科学,2009,30(4):131-135.
Pectin extraction process from purple sweet potato(Ipomoea batatas)residue
ZHAO Fengli1,2,LV Jinlian1,WU Ben1,CHEN Jing1
(1.College of Life Science,Guangxi Normal University,Guilin 541004,China;2.Key Laboratory of Ecology of Rare and Endangered Species and Environmental Protection(Guangxi Normal University),Ministry of Education,Guilin 541004,China)
Using purple sweet potato residue as raw material,pectin content of the purple sweet potato after pretreatment as evaluation indexes,the pectin extraction process was studied,and the acid extraction conditions and decolorization process was optimized.Results showed that the starch removal condition of pruple sweet potato was pH 7.0,temperature 75℃,alpha amylase addition 60 U/g,enzymolysis time 30 min.The acid extraction condition were hydrochloric acid pH 1.5,temperature 85℃,time 105 min,and the optimal decoloring conditions were carbon addition 1%,decoloring temperature 70℃,time 30 min.Under these conditions,the pectin content of the product was 3.979%.
purple sweet potato residue;pectin;extraction;purification;orthogonal tests
TS209
0254-5071(2016)11-0133-03
10.11882/j.issn.0254-5071.2016.11.027
2015-11-19
广西科学研究与技术开发计划项目(桂科重14121001-4-3);桂林市科学研究与技术开发计划项目(20140111-3)
赵丰丽(1961-),女,教授,硕士,研究方向为功能性食品研究与应用。
——α-葡萄糖醛酸酶的研究进展*

