富含黄酮的山楂果酒发酵条件优化
李楠,杨春杰,邓随胜,王芮东,阎晓东
(1.运城学院生命科学系,山西运城044000;2.运城职业技术学院有机食品工程系,山西运城044000;3.运城学院理科实验中心,山西运城044000)
富含黄酮的山楂果酒发酵条件优化
李楠1,杨春杰2,邓随胜1,王芮东3,阎晓东1
(1.运城学院生命科学系,山西运城044000;2.运城职业技术学院有机食品工程系,山西运城044000;3.运城学院理科实验中心,山西运城044000)
该试验研究发酵条件对提高山楂果酒发酵过程中总黄酮含量的影响。首先通过单因素试验初步研究发酵温度、酵母接种量、初始糖度及发酵液pH值4个发酵条件对发酵后果酒中总黄酮含量的影响,然后以发酵后山楂果酒中总黄酮含量为响应值通过响应面法确定最优发酵条件。结果表明,优化发酵条件为发酵温度26.6℃,酵母接种量0.40 g/L,初始糖度15.2%,pH 3.2,最终果酒总黄酮含量为10.75 mg/100 mL,总糖(以葡萄糖计)含量为10.6 g/L,酒精度(20℃)为7.5%vol,酒质澄清透明,无明显悬浮物,色泽呈桔红色,具有较明显的山楂果香,酸甜协调。
山楂;果酒;总黄酮;响应面法;发酵
山楂(Crataegus pinnatifido)又名红果、山里红,是蔷薇科山楂属植物山里红或山楂的成熟果实[1-2],是一味药食两用的核果类植物[3]。黄酮是山楂的活性成分之一,对高血压、糖尿病、高血脂、冠心病等均具有辅助治疗作用,是防治心血管疾病较好的天然植物资源[4-7]。
我国山楂资源丰富,但由于口感较酸,鲜食量不大,山楂加工多是传统工艺,产品附加值低[8-10]。果酒是以野生或人工种植植物的果实为原料发酵而成的低酒精度饮料,其保留了水果原有的糖类、有机酸、黄酮和矿物质等成分[11-12]。以山楂为原料生产果酒,不仅能够提高山楂的加工价值,而且能够利用山楂中已发现并被临床证实的黄酮等具有特殊治疗作用的活性物质,发挥山楂独特的保健、药理作用。但是,生物发酵是一个复杂的过程,酵母菌的种类、发酵温度、含糖量、发酵液初始pH值等因素都会对发酵结果产生影响,进而影响果酒中总黄酮的含量,不适宜的发酵条件会导致果酒中黄酮等活性物质失去活性[13]。因此本研究旨在以保留山楂中活性因子总黄酮为目标,探讨发酵温度、酵母接种量、初始糖浓度和发酵液pH值对山楂果酒中总黄酮含量的影响,以期为新型山楂果酒的开发提供理论与实践依据。
1 材料与方法
1.1 材料与试剂
山楂:产地山西运城绛县,品种为大金星,采摘后在冰箱中密闭冷藏保存。
果酒专用干酵母:湖北安琪酵母股份有限公司;芦丁标准品:上海润捷化学试剂有限公司;硝酸铝、亚硝酸钠、无水乙醇、氢氧化钠、亚硫酸、柠檬酸、硫酸铜、酒石酸钾钠、葡萄糖、盐酸、次甲基蓝(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
UV-5500PC紫外可见分光光度计:上海元析仪器有限公司;SPX-250C恒温恒湿箱:上海博迅实业有限公司医疗设备厂;TDL6M台式冷冻离心机:湖南湘立科学仪器有限公司;JJ-2组织捣碎机:江苏省金坛市荣华仪器制造有限公司;PHS-3E精密pH计:上海佑科仪器仪表有限公司;WZB便携式糖度计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 山楂果酒发酵工艺流程

切片:将山楂去梗、去蒂、去核,切成片后立即放入4% D-异抗坏血酸钠溶液中,防止褐变;打浆:将用D-异抗坏血酸钠溶液浸泡的山楂沥干水分,放入组织捣碎机中,再加入蒸馏水(料液比1∶3(g∶mL)),充分搅打至浆状;软化处理:在山楂浆中加入0.02%的果胶酶;酶解:45℃恒温酶解2 h[14];调整成分:用白砂糖调整山楂浆的糖度,柠檬酸或氢氧化钠调整山楂浆的酸度,并加入1 mL/L H2SO3抑制杂菌生长和防止氧化;发酵:在试验设置的温度条件下发酵7 d左右,残糖含量基本稳定时发酵结束;分离、澄清:取上层酒液,4 000×g离心10 min,测定上清液中总黄酮含量。
1.3.2 单因素试验
发酵温度:取已酶解的山楂果浆,在酵母接种量0.3g/L,初始糖度10%,发酵液pH值3.0的条件下,分别在15℃、20℃、25℃、30℃、35℃进行发酵。发酵结束后,离心,取上层清液测定总黄酮含量。
酵母接种量:在发酵温度25℃,初始糖度10%,发酵液pH值3.0的条件下,分别调整酵母接种量为0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L进行发酵。发酵结束后,离心,取上层清液测定总黄酮含量。
初始糖度:在发酵温度25℃,酵母接种量0.3 g/L,发酵液pH值3.0的条件下,分别调整初始糖度为10%、15%、20%、25%、30%进行发酵。发酵结束后,离心,取上层清液测定总黄酮含量。
发酵液pH值:在发酵温度25℃,酵母接种量0.3 g/L,初始糖度10%的条件下,分别调整发酵液pH值为2.0、3.0、4.0、5.0、6.0进行发酵。发酵结束后,离心,取上层清液测定总黄酮含量。
1.3.3 响应面试验
根据单因素试验结果,使用Design-Expert 8.0.6软件的Box-Behnken方法设计4因素3水平响应面试验,因素与水平见表1。

表1 山楂果酒发酵条件优化响应面试验因素与水平Table 1 Factors and levels of response surface experiments for fermentation conditions optimization of hawthorn fruit wine
1.3.4 测定方法
总黄酮含量测定采用紫外可见分光光度法。参照文献[15-16]方法并稍作修改。以芦丁作为标品绘制标准曲线:准确吸取0、2.0mL、4.0mL、6.0mL、8.0mL、10.0mL的0.4 mg/mL芦丁标准溶液,置于50 mL容量瓶中。分别加入5%NaNO2溶液0.8 mL并充分摇荡,6 min后,加入10%Al(NO3)3溶液0.8 mL,混匀,静置6 min,再加入1 mol/L NaOH溶液10 mL,充分摇荡,25℃反应15 min后用体积分数30%的乙醇定容,于波长510 nm处测定吸光度值。测定酒中总黄酮的含量时,精确量取0.4 mL酒样,测定方法与绘制标准曲线相同,利用回归方程和测得的吸光度值计算酒液中总黄酮的含量(以芦丁计)。
总糖含量测定[17]:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的直接滴定法。酒精含量测定[17]:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的酒精计法。感官质量分析[17-18]:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》、QB/T 1983—1994《山楂酒》中的感官分析方法。感官评价标准见表2。

表2 感官评价标准Table 2 Sensory evaluation standards
2 结果与分析
2.1 芦丁标准曲线
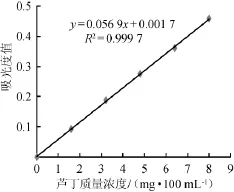
图1 芦丁标准曲线Fig.1 Standard curve of rutin
由图1可知,标准曲线的回归方程为:y=17.556x-0.029,相关系数R2=0.999 7。结果表明在一定范围内,芦丁质量浓度与吸光度值间的线性关系良好。
2.2 单因素试验
2.2.1 发酵温度对总黄酮含量的影响
不同发酵温度对总黄酮含量的影响如图2所示。

图2 发酵温度对总黄酮含量的影响Fig.2 Effect of fermentation temperature on the total flavonoids contents
由图2可以看出,当发酵温度在15~35℃时,山楂果酒中总黄酮含量呈现出先上升后下降的趋势。15℃时温度较低,酵母的生长代谢缓慢,产生的酒精少,溶解在酒中的黄酮也少;35℃时温度过高,发酵速率虽快,但发酵停止得也快,酵母没有充足的糖代谢,过早的衰老,酒精度低,溶解的黄酮也少[19]。当温度为25℃时,酵母的生长代谢条件适宜,酒精产量较高,黄酮物质在酒中的溶解量能达到最高。因此,选择发酵温度25℃为宜。
2.2.2 酵母接种量对总黄酮含量的影响
不同酵母接种量对总黄酮含量的影响如图3所示。

图3 酵母接种量对总黄酮含量的影响Fig.3 Effect of yeast inoculum on the total flavonoids contents
由图3可以看出,当酵母菌接种量为0.1~0.5 g/L时,随着接种量的不断增大,总黄酮含量呈现先升后降的趋势。酵母接种量为0.1 g/L时,发酵启动慢,产生的酒精量少,所以溶解在酒中的黄酮量也少;接种量为0.5 g/L时,可用于酵母菌代谢的糖分相对较少,酵母繁殖数目少,易衰老,酒精产量低,酒中的黄酮含量也较低[19]。当酵母接种量为0.4 g/L时,发酵较快,酒精产量也较高,黄酮含量也达到了最大值。因此,选择酵母接种量0.4 g/L为宜。
2.2.3 初始糖度对总黄酮含量的影响
不同初始糖度对总黄酮含量的影响如图4所示。

图4 初始糖度对总黄酮含量的影响Fig.4Effectofinitialsugarconcentrationonthetotalflavonoidscontents
由图4可以看出,随着初始糖度的升高,总黄酮含量呈现先升后降的趋势。当初始糖度为10%时,糖度较低,代谢生成的酒精含量也低,不利于黄酮在酒中的溶出。当初始糖度上升至15%时,糖度比较适宜酵母菌的生长,产生的酒精量也能达到一个比较高的水平,进而使果酒中总黄酮含量达到最高。初始糖度>15%后,随着糖度的升高,果酒中的总黄酮含量反而越来越低,原因可能是酵母的生长和代谢受到抑制,糖度太高时甚至在一定程度上导致发酵停止。因此,选择初始糖度15%为宜。
2.2.4 发酵液pH值对总黄酮含量的影响
不同pH值对总黄酮含量的影响如图5所示。

图5 发酵液pH值对总黄酮含量的影响Fig.5 Effect of fermentation liquid pH on the total flavonoids contents
由图5可以看出,当发酵液pH值为2~6时,总黄酮含量表现出先上升后下降的趋势。在pH值为2的强酸环境下,酵母菌的生长和代谢受到抑制,酒精产量较低,溶出的黄酮也较少。当pH值为3时,总黄酮含量最高。此外,过高的pH值会使山楂果酒受到杂菌污染[20],黄酮类化合物也不能稳定存在。因此,选择发酵液pH值3为宜。
2.3响应面法优化发酵条件
2.3.1 回归模型的建立及方差分析
响应面试验设计及结果见表3,方差分析见表4。

表3 山楂果酒发酵条件优化响应面试验设计及结果Table 3 Design and results of response surface experiments for fermentation conditions optimization of hawthorn fruit wine
响应面试验设计及结果见表3,采用Design-Expert8.0.6软件对表3中数据进行分析和推导,得到回归方程如下:
Y=10.82+0.96A+0.10B+0.097C+0.66D-0.66AB-0.15AC+0.19AD+0.64BC+0.19BD+0.077CD-1.55A2-1.50B2-1.11C2-1.43D2。
由表4可以看出,决定系数R2=0.954 7,校正决定系数R2Adj=0.9094,说明91.83%的响应值变化是由所选变量引起的,方程的拟合程度较优;失拟项差异不显著(P=0.823 2>0.05),说明实验误差较小;总黄酮含量(Y)的变异系数为5.01%,说明试验的精确度和可靠性都达到了一个较优水平[21],通过响应面法对山楂果酒中总黄酮含量进行优化是可行的。
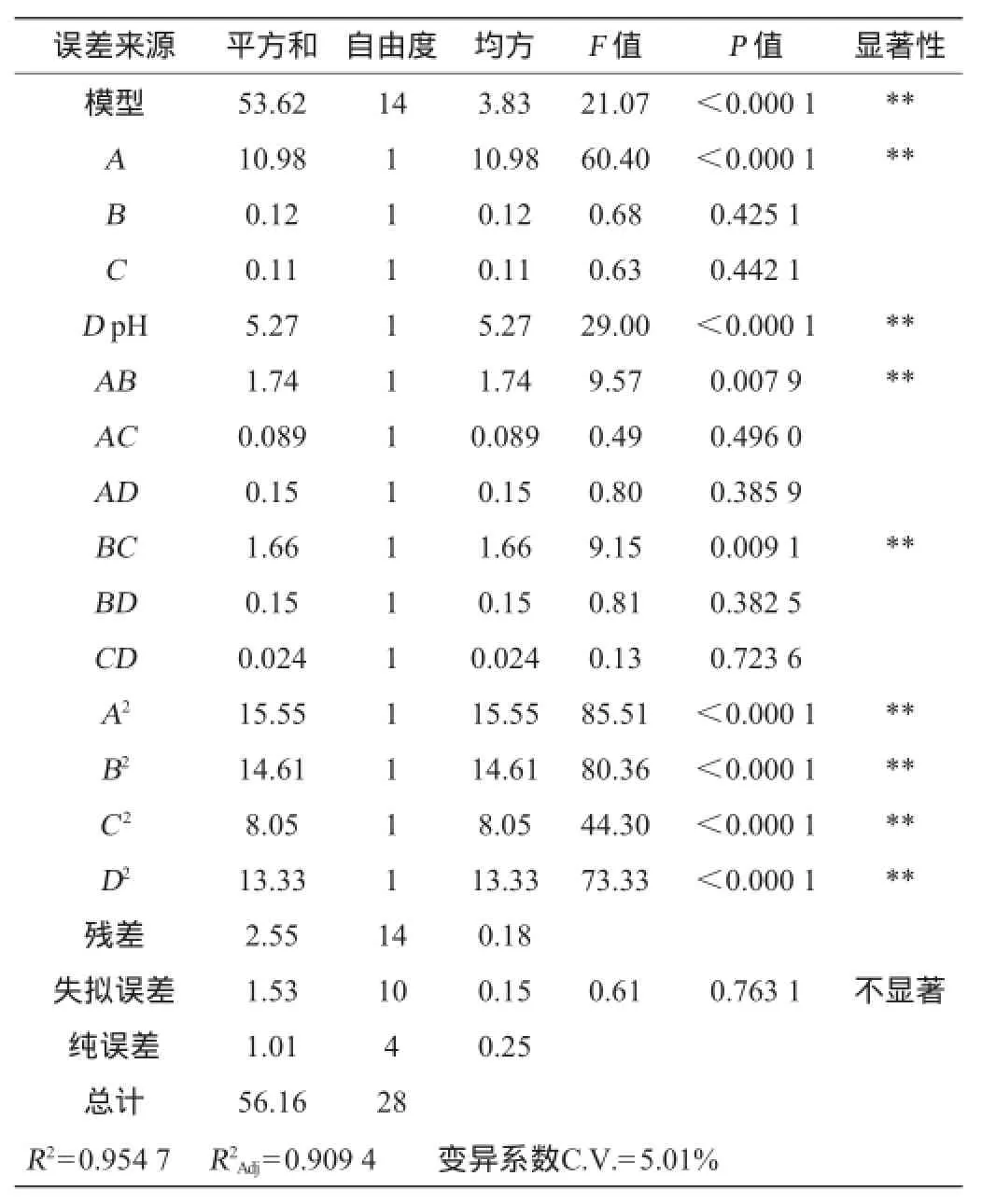
表4 响应面模型方差分析结果Table 4 ANOVA for response surface quadratic model analysis
使用F检验判定回归方程中4个变量对总黄酮含量影响的显著性,也就是说,P值越小,相应变量的显著性越高[22]。从表4可以看出,该模型的P<0.01%,这表明该模型是显著的。发酵温度、pH值以及4个变量的二次项(A2、B2、C2、D2)对总黄酮含量有极显著影响(P<0.01)。交互项AB与BC对总黄酮含量有显著影响(P<0.05)。从各变量P值的大小,得出4个变量对山楂果酒中总黄酮含量的影响大小依次是发酵温度>发酵液pH值>酵母接种量>初始糖度。
2.3.2 响应曲面分析
由图6可以看出,随着发酵温度和酵母接种量不断增大,总黄酮含量先上升后下降,说明这两者过大或过小都不能使总黄酮含量达到最大值,只有当它们取某个适中值时,总黄酮含量才可达到最大值。当初始糖浓度在14%~16%范围变化时,总黄酮含量先升高后降低,且达到最大值。发酵温度和酵母接种量的交互作用>酵母接种量和糖浓度的交互作用,通过表3中P值的大小(PAB<PBC)进行验证,结果与此相同[23-24]。
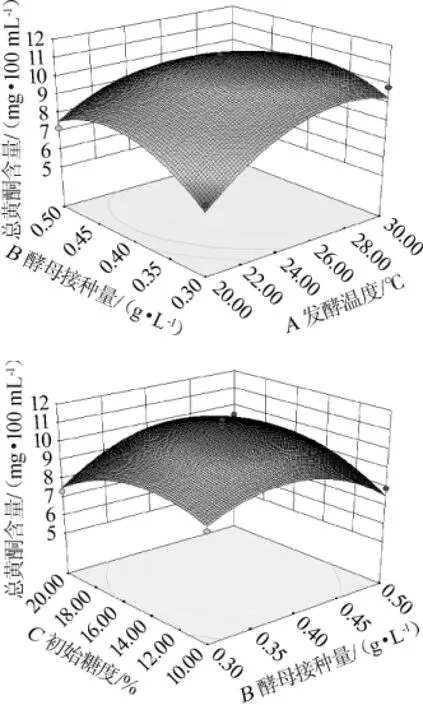
图6 发酵温度、初始糖度与酵母接种量交互作用对总黄酮含量影响的响应曲面和等高线Fig.6 Response surface plots and contour line of effects of interaction between fermentation temperature, yeast inoculum,initial sugar concentration and yeast inoculum on the total flavonoids contents
2.3.3 验证试验
通过Design-Expert 8.0.6软件得到的最优发酵条件为优化发酵条件为发酵温度26.57℃,酵母接种量0.40 g/L,初始糖度15.18%,发酵液pH值3.23,果酒总黄酮含量11.05 mg/100 mL。为方便实际操作修改条件为发酵温度26.6℃、酵母接种量0.40 g/L、初始糖度15.2%、发酵液pH值3.2,在优化得出的最优条件下做3次平行试验进行验证,得到总黄酮含量平均值为10.75 mg/100 mL,与理论预测值接近,酒中总糖(以葡萄糖计)含量为10.6 g/L,酒精度(20℃)为7.5%vol。
3 结论
通过Design-Expert 8.0.6软件得到4个因素对总黄酮含量影响的主次顺序为发酵温度>发酵液pH值>酵母接种量>初始糖度,发酵温度与酵母接种量的交互作用>酵母接种量与初始糖度的交互作用。
采用响应面法得出高黄酮含量山楂果酒的最优发酵条件为发酵温度26.6℃、酵母接种量0.40g/L、初始糖度15.2%、pH3.2,该条件下山楂果酒中总黄酮含量为10.75mg/100mL,总糖(以葡萄糖计)含量为10.6g/L,酒精度(20℃)为7.5%vol,酒质澄清透明,色泽呈桔红色,无明显悬浮物,具有较明显的山楂果香,酸甜协调。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:31.
[2]何义,李宁,淑英.山楂酒饮料的加工工艺[J].食品研究与开发,2015,36(3):9-13.
[3]刘慧,张春岭,刘杰超,等.超声-果胶酶协同提取山楂类黄酮的工艺优化[J].食品与机械,2016,32(1):154-157.
[4]张雪,丁长河.紫外分光光度法检测山楂总黄酮方法的建立[J].食品工业科技,2007,28(7):200-202.
[5]刘北林,董继生,倪小虎,等.山楂黄酮提取及降血脂研究[J].食品科学,2007,28(5):324-327.
[6]RIGELSKY J M,SWEET B V.Hawthorn:pharmacology and therapeutic uses[J].Am J Health-Syst Ph,2002,59(5):417-422.
[7]KURKINA A V.Determination of total flavonoids in siberian hawthorn fruit[J].Pharm Chem J,2015,48(12):800-803.
[8]尹立富.山楂加工方向探讨[J].上海农业科技,1997(1):39-40.
[9]玥冀太.不同工艺及酵母对山楂酒发酵过程及成品酒品质的影响[D].泰安:山东农业大学,2012.
[10]裴洋.山楂黄酒加工工艺及超高压处理对其品质影响的研究[D].镇江:江苏大学,2012.
[11]沈颖,刘晓艳,白卫东,等.果酒中有机酸及其对果酒作用的研究[J].中国酿造,2012,31(2):29-32.
[12]孙洪浩,颜雪辉,张家庆,等.果酒降酸方法研究进展[J].酿酒,2013,40(6):27-30.
[13]许亮,师俊玲,陈东方,等.枸杞果酒中总黄酮含量的发酵条件优化[J].食品科学,2011,32(7):188-193.
[14]张志军.果胶酶处理对山楂汁提取及理化指标影响的研究[J].天津农业科学,2003,9(4):18-20.
[15]胡冀太,杜金华,何桂芬.果酒酵母对发酵山楂酒品质及抗氧化性的影响[J].酿酒,2010,39(5):52-56.
[16]董文娟.酵母菌种对冰苹果酒和山楂酒品质的影响[D].泰安:山东农业大学,2015.
[17]中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[18]中华人民共和国轻工业部.QB/T 1983—1994山楂酒[S].北京:中国标准出版社,1994.
[19]陈玲,余昆,崔振华,等.枸杞果酒发酵过程中黄酮含量变化及其发酵条件优化[J].酿酒,2015,42(6):65-68.
[20]曲芬霞,潘中田,吴桂容,等.桂东野山楂酒发酵工艺研究[J].中国酿造,2011,30(7):94-96.
[21]林建原,季丽红.响应面优化银杏叶中黄酮的提取工艺[J].中国食品学报,2013,13(2):83-90.
[22]吕娜,刘阳,崔艳艳,等.响应面法优化超声波提取山荆子总黄酮工艺[J].中国酿造,2014,33(2):71-74.
[23]侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,34(6):124-128.
[24]张黎明,李瑞超,郝利民,等.响应面优化玛咖叶总黄酮提取工艺及其抗氧化活性研究[J].现代食品科技,2014,30(4):233-239.
Optimization of fermentation conditions for flavonoids-rich hawthorn fruit wine
LI Nan1,YANG Chunjie2,DENG Suisheng1,WANG Ruidong3,YAN Xiaodong1
(1.Department of Life Science,Yuncheng University,Yuncheng 044000,China; 2.Department of Organic Food Engineering,Yuncheng Polytechnic College,Yuncheng 044000,China; 3.Science Experiments Center,Yuncheng University,Yuncheng 044000,China)
The effects of fermentation conditions(including fermentation temperature,yeast inoculum,initial sugar concentration and fermentation liquid pH)on total flavonoids content during the hawthorn fruit wine fermentation process were researched.Using the total flavonoids content as response value,the optimal fermentation conditions were determined by the single factor experiments and response surface methodology.The results showed that the optimal fermentation conditions were fermentation temperature 26.57℃,yeast inoculum 0.40 g/L,initial sugar concentration 15.18%and pH 3.23.Under the conditions,the total flavonoids content,total sugar content(with glucose)and alcohol content(20℃)in fruit wine were 10.75 mg/100 ml,10.6 g/L and 7.5%vol,respectively.The wine was clear without obvious suspended solids,and the colour was orange.The wine had obvious hawthorn fruit flavor,harmonious sourness and sweetness.
hawthorn;fruit wine;total flavonoids;response surface methodology;fermentation
TS262.7
0254-5071(2016)11-0112-05
10.11882/j.issn.0254-5071.2016.11.023
2016-07-13
运城学院院级科研项目(CY-2015003)
李楠(1986-),女,助教,硕士,研究方向为食品功能性成分提取与评价。

