植物饮料提取液中微生物的分离鉴定及耐热性研究
邓腾
(广东加多宝饮料食品有限公司,广东东莞523852)
植物饮料提取液中微生物的分离鉴定及耐热性研究
邓腾
(广东加多宝饮料食品有限公司,广东东莞523852)
以植物饮料提取液为研究对象,通过16SrDNA序列分析法和基于毛细管法测定微生物的D值和Z值的方法对分离出的耐热性菌株进行分子生物学鉴定和耐热性能研究。结果表明,本试验共分离出6株耐热性菌株,包括嗜热脂肪芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌、人参土芽孢杆菌、脂环酸芽孢杆菌和蜡样芽孢杆菌。其中,罐头食品中典型耐热性代表菌株嗜热脂肪芽孢杆菌芽孢的耐热性测试结果为:D121℃=1.4min,Z=10.05℃。
植物饮料;耐热微生物;分子生物学鉴定;耐热性能
近年来,随着消费者的生活水平及健康意识的提高,一类以植物或植物抽提物为原料经加工或发酵制成的植物饮料制品越来越受到消费者的热捧[1-2]。目前,植物饮料的研究方向主要倾向于功能性及毒理学方面,有关控制腐败变质的研究较少。引起罐头食品腐败变质的原因较多,包括原辅料的质量和工艺操作等问题。但对于低酸性罐头食品而言,产品的密封缺陷及杀菌强度不足则是引起产品二次污染的主要原因[3-4]。植物饮料行业现已呈现多家规模化生产的龙头品牌企业,但不同企业在原料及工艺方面还存在较大差别。植物饮料较易因微生物活动作用而发生腐败变质,一定程度上限制了植物饮料行业的推广和进一步发展。因此,探究植物饮料提取液中腐败微生物的种类及典型耐热代表菌株的耐热性能,对于进一步的制定合理、经济的杀菌工艺和延长植物饮料的保质期都具有重要的理论意义和实用价值。
1 材料与方法
1.1 材料
1.1.1 样品来源
植物饮料提取液采自广东地区某企业植物饮料生产线。
1.1.2 主要培养基
平酸菌增菌培养基、营养琼脂培养基、平板菌落计数培养基、促芽孢生长培养基[5-6]。
1.1.3 主要仪器和设备
SW-CJ-1C型洁净工作台:购自苏州净化设备有限公司;DHP-9612型电热恒温培养箱:购自上海一恒
科技有限公司;HVE-50型电热蒸汽自动灭菌锅:购自日本HIRAYAMA公司;DYY-10C型电泳仪:购自北京六一仪器厂;sigma 3k15离心机:购自德国希格玛离心机有限公司;CH1506恒温油浴锅:购自苏州江东精密仪器有限公司。
1.2 方法
1.2.1 样品的采集
将采集到的样品收集至灭菌管内,带回实验室放置于4℃冰箱内保存备用。
1.2.2 提取液中微生物的分离和纯化
将各样品置于55℃下培养5 d后,在无菌条件下将样品用无菌水依次作10-1、10-2、10-3、10-4、10-5等10倍梯度稀释操作,分别接种至平酸菌增菌培养基中。细菌在55℃下培养2 d后进行观察,挑取菌落形态不同的单菌落至液体培养基中培养,并反复采用平板划线的方法获得纯种。最终将纯化后菌株置于4℃冰箱中保存备用。
1.2.3 各菌株基因组DNA提取
将液体培养物离心后收集菌体。采用天根公司的细菌基因组DNA提取试剂盒提取DNA。提取物置于-20℃保存。
1.2.4 16S rDNA序列扩增和测序
利用通用引物A27F和A1495R[7]对各菌株的16S rDNA片段进行扩增,正引物为27F:5'-AGTTTGACMTGGCTCAG-3',反向引物为1540R:5'-AGGAGGTGATCCAGCCGCA-3'。菌体扩增条件为:94℃预变性4min;30个循环:94℃变性45 s,55℃退火45 s,72℃延伸1min;72℃末端延伸10min。然后将扩增成功的产物直接送往上海生工纯化和测序。
1.2.5 序列比对及系统发育树的构建
从模式菌株数据库LSPN中获得一系列参比菌株的16SrDNA序列,利用ClusterW软件完成序列的成对比对和多重序列比。再采用NJ(neighbor-joining method)法,利用MEGA 5.0软件完成系统发育树的构建工作,使用的模型为maximum composite likelihood model,自展分析设置为1 000次重复[8]。
1.2.6 嗜热脂肪芽孢杆菌的耐热性能测试
1.2.6.1 菌株的复壮
将分离并保存的嗜热脂肪芽孢杆菌在平酸菌增菌平板上划线后,置于55℃培养24 h。以上操作重复3次,以确保其活力和纯度。
1.2.6.2 耐热性试验
1)制备芽孢菌悬液
挑取复壮后的嗜热脂肪芽孢杆菌单个菌落,划线接种于促芽孢生长培养基斜面上,55℃培养10 d。当革兰氏染色镜检芽孢数达90%以上,用无菌生理盐水洗下斜面菌苔,将此原液在(90±1)℃热水中加热30min后,迅速浸入冷水中进行冷却,以杀死营养体细胞,制成含活菌数大于106个/mL芽孢菌悬液。以上步骤均在严格无菌的条件下操作,制得的芽孢悬浮液原液置于4℃左右的冰箱中保存备用[9]。
2)细菌减少试验
菌悬液经离心去上清液后,以成品植物饮料为稀释液与菌种充分混合后加入灭菌后毛细管中,经热封口后按一定的温度和时间组合在油浴锅内进行加热处理。热杀菌结束后,取出毛细管并迅速浸入冷水中冷却。毛细管去油污后,浸入次氯酸钠溶液中进行外壁消毒处理。在无菌水中反复荡洗后,将毛细管捣碎,并分别稀释至通常认为的最佳计数浓度[10]。按GB 4789.2-2010《食品安全国家标准食品微生物学检验菌落总数测定》的方法进行灭菌效果的检验。
3)D值的计算
以热处理时间为横坐标,残菌数的对数值为纵坐标绘制受热致死温度曲线。采用线性回归分析法确定D值。图解作出的“最佳”直线可由y=m x+b来表示。其中:m为直线的斜率,D值是该斜率的负倒数[10]。
4)Z值的计算
采用线性回归分析法,以热处理温度为横坐标,微生物在各热处理温度下的D值对数为纵坐标,绘制仿热力致死时间曲线。图解作出的“最佳”直线可由y= m x+b来表示。其中:m为直线的斜率,Z值为该斜率的负倒数[10]。
2 结果与讨论
2.1 各菌株DNA序列的提取
各菌株基因组DNA电泳图见图1。
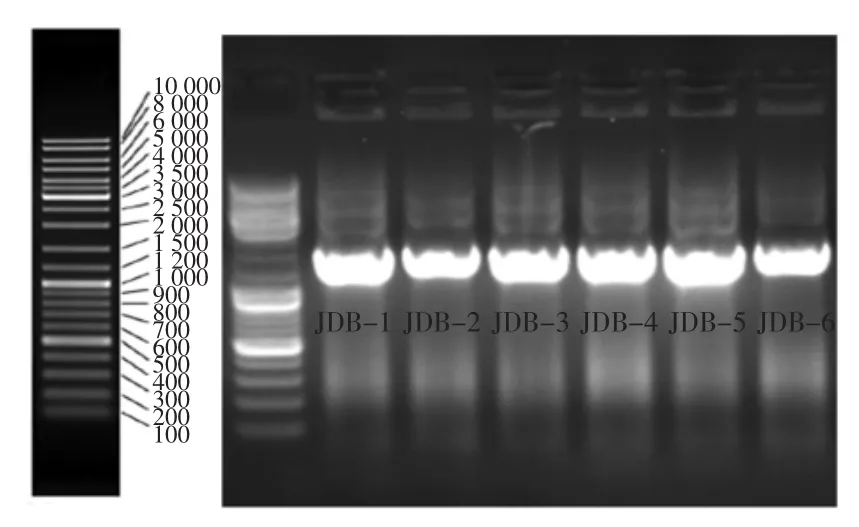
图1 各菌株基因组DNA电泳图Fig.1 Electrophoresisof totalDNA of strains
由图1可知,在采集到的提取液样品中,共分离出来6株不同微生物。琼脂糖凝胶电泳检测结果显示,
各菌株提取的DNA均只有一条明显清晰的条带,说明本试验提取的各菌株的基因组DNA的纯度很高,没有蛋白质、糖类物质和RNA的污染。
2.2 菌株16SrDNA序列的同源性比对分析
菌株JDB-2和JDB-3基于16SrDNA序列的树状图见图2。

图2 菌株JDB-2和JDB-3基于16S rDNA序列的树状图Fig.2 Phylogenetic treebased on the16S rDNA alignmentof strains JDB-2 and JDB-3
如图2所示,菌株JDB-2和JDB-3同属于芽孢杆菌属。其中,菌株JDB-2与Bacilluspumilus系统发育关系最为密切,16S rDNA序列同源性达98%。菌株JDB-3与Bacillus cereus系统发育关系最为密切,16S rDNA序列同源性达99%。
菌株JDB-1和JDB-5基于16SrDNA序列的树状图见图3。

图3 菌株JDB-1和JDB-5基于16S rDNA序列的树状图Fig.3 Phylogenetic treebased on the16S rDNA alignmentof strains JDB-1 and JDB-5
如图3所示,菌株JDB-1和JDB-5同属于芽孢杆菌属。其中,菌株JDB-1与Alicyclobacillussp.系统发育关系最为密切,16S rDNA序列同源性达99%。菌株JDB-5与Bacillus subtilis系统发育关系最为密切,16S rDNA序列同源性达99%。
菌株JDB-4和JDB-6基于16SrDNA序列的树状图见图4。
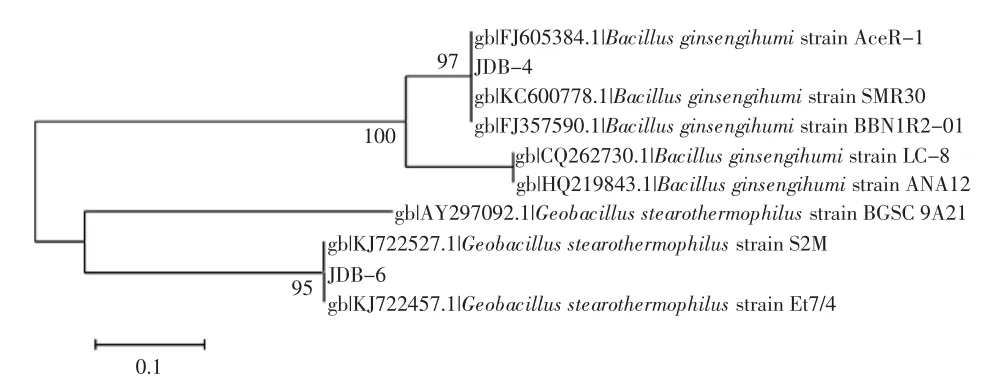
图4 菌株JDB-4和JDB-6基于16S rDNA序列的树状图Fig.4 Phylogenetic treebased on the16S rDNA alignmentof strains JDB-4 and JDB-6
如图4所示,菌株JDB-4和JDB-6同属于芽孢杆菌属。其中,菌株JDB-4与Bacillusginsengihumi系统发育关系最为密切,16SrDNA序列同源性达97%。菌株JDB-6与Geobacillusstearothermophilus系统发育关系最为密切,16SrDNA序列同源性达95%。
2.3 嗜热脂肪芽孢杆菌的耐热性能测试
大量研究表明[11-12],嗜热脂肪芽孢杆菌是能够引起低酸性罐头食品(pH>4.6)产酸腐败的主要代表微生物之一。该微生物所产芽孢一般无致病性、无热原、无毒,且对压力蒸汽的抵抗力较强,被欧洲药典、美国药典、日本药典等作为热力灭菌生物指示剂的标准菌株收录[13]。因此,本研究主要是针对从植物饮料提取液中分离纯化出的典型耐热性代表菌株-嗜热脂肪芽孢杆菌进行耐热性能测试。
按照试验设计,以油浴锅为加热设备,毛细管为提取液贮存容器,将添加嗜热脂肪芽孢杆菌芽孢的植物饮料在不同温度-时间组合条件下进行加热处理后,再用PCA培养基在55℃的培养箱内保温培养48 h,其结果如图5和图6所示。
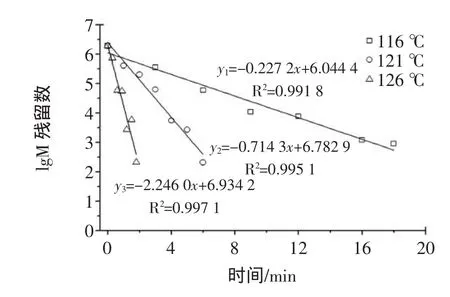
图5 嗜热脂肪芽孢杆菌芽孢在提取液中的致死率曲线Fig.5 Thermaldeath rate curveof Bacillusstearothermophilus in herbal tea
D值是反映微生物在某一温度下的耐热性,D值越大,表明其耐热性越强,也即死亡所需的时间越长。D值与温度之间的关系也成对数关系,即温度升高,D值按对数级减少,且不受原始菌数的影响[14]。图5表明,嗜热脂肪芽孢杆菌芽孢在不同温度-时间下的受热致死曲线是典型的对数直线关系,其方程分别是y1=-0.227 2x+6.044 4(116℃)、y2=-0.714 3x+6.782 9
(121℃)、y3=-2.246 0x+6.934 2(126℃)。
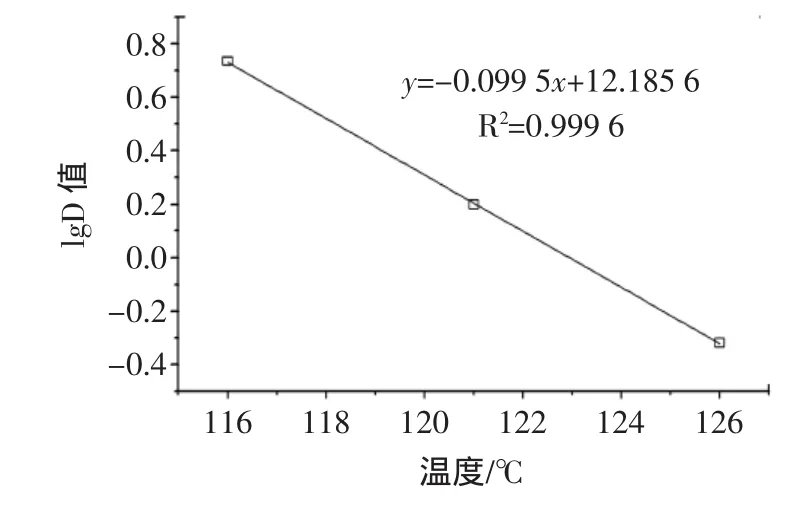
图6 嗜热脂肪芽孢杆菌芽孢在植物饮料中的仿热力致死率曲线Fig.6 Im itation thermaldeath rate curveof Bacillus stearothermophilus in herbal tea
以提取液中嗜热脂肪芽孢杆菌芽孢在各杀菌温度下的D值对数值为纵坐标,以杀菌温度为横坐标,绘图可得出y=-0.099 5x+12.185 6的关系曲线(如图6)。该曲线的斜率的负倒数,即为Z值。Z值表示在致死温时曲线中,时间降低一个对数期所需升高的温度[14]。
根据致死率曲线和仿热力致死时间曲线的对数直线方程,计算出提取液中嗜热脂肪芽孢杆菌芽孢的耐热特性参数如表1所示。

表1 植物饮料中嗜热脂肪芽孢杆菌芽孢的耐热特性参数Table1 Thermal resistance parametersof Bacillus stearothermophilus in herbal tea
3 结论
在世界各国,耐热性高的芽抱菌给食品工业带来的威胁都时有发生。特别是在工业上称作“平酸菌”的芽抱杆菌,它们一般以使食品酸败变质而不产生气体,能耐受较高程度的热处理为特征,给食品工业的生产和食品保藏带来巨大麻烦[11]。本文一方面以植物饮料提取液为样品,进行平板划线分离、纯化,共得到6株耐热性细菌。经细菌16SrDNA鉴定结果表明,可导致植物饮料腐败的耐热微生物主要有嗜热脂肪芽孢杆菌、短小芽孢杆菌、枯草芽孢杆菌、人参土芽孢杆菌、脂环酸芽孢杆菌和蜡样芽孢杆菌。另一方面又通过毛细管法对罐头食品中耐热性代表菌株嗜热脂肪芽孢菌芽孢进行了耐热性能测定,测试结果为:D121℃= 1.4min,Z=10.05℃。此外,在植物饮料的实际杀菌操作中,仅知道杀菌微生物的D值是不够的,还需进一步的确定在一定温度下,杀灭一定量微生物所需的时间,即安全杀菌值(F)。本研究工作的开展不仅对植物饮料行业杀菌工艺的制定提供了参考依据,同时为延长植物饮料的保质期,开发适合植物饮料防腐的措施奠定了基础。
[1]罗友华,黄亦琦,杨辉,等.中草药凉茶的研究概述[J].海峡药学, 2006,18(5):95-98
[2]王萍,肖更生,张友胜,等.广式凉茶研究进展[J].食品科技,2010,35 (2):77-80
[3] 徐青,许喜林,王蔚瑜,等.凉茶中腐败微生物的分离纯化及初步鉴定的研究[J].食品科技,2012,31(11):31-34
[4]费墉.低酸性罐头食品腐败原因的分析[J].成都大学学报(自然科学版),1990(2):7-11
[5] 武玉艳,李汴生,阮征,等.热协同超高压对不同介质中嗜热脂肪芽孢杆菌芽孢的灭活作用[J].食品与发酵工业,2009,35(4):5-9
[6]武玉艳,李汴生,黄娟.热协同超高压处理对不同介质中芽孢发芽的影响[J].食品研究与开发,2010,31(1):138-141
[7] 杨汝德,潘力,郭迪,等.嗜盐性乳酸菌的生理与分子生物学鉴定[J].现代食品科技,2005,21(4):67-69
[8]杨晓春.乳酸乳球菌KLDS4.0325全基因组序列的测定及比较分析[D].哈尔滨:东北农业大学,2014
[9] 闫国宏,傅力,肖春芳,等.新疆番茄酱中枯草芽孢杆菌耐热性的研究[J].食品研究与开发,2008,29(11):88-90
[10]Sherman Alfors,娄有宜.用毛细管测定微生物指示剂的D值和Z值[J].中国医药工志,1989,20(10):470-472
[11]汤天曙.从食品中分离嗜热脂肪芽孢杆菌性状初步研究[J].郑州轻工业学院学报,1987,2(1):65-71
[12]何红艳,钱平,卢蓉蓉,等.超高压低酸性罐头中腐败菌的致死特性[J].食品与发酵工业,2009,35(6):18-22
[13]吴潇,刘波,姚栗,等.嗜热脂肪芽孢杆菌的特性及应用[J].中国消毒学杂质,2011,28(2):215-217
[14]罗龙新.罐装乌龙茶水的灭菌技术及其对茶汁品质的影响[J].茶叶科学,1996,16(2):147-152
Study on Isolation and Identification and Thermal Resistance of Thermophilic M icroorganism s in the Plant Beverage Extracts
DENGTeng
(Guangdong Jiaduobao Drink&Food Co.,Ltd.,Dongguan 523852,Guangdong,China)
For studying on diversity and thermal resistance,6 strains ofmicrobe isolated from the plantbeverage extractswere identified by 16S rDNA sequence analysis and weremeasured D value,Z value by capillary tube method.The result showed that these isolates identified to be Bacillus stearothermophilus,Bacillus pumilus,Bacillusanthracis,Bacillusginsengihumi,Alicyclobacillus sp.and Bacillus cereus,respectively.In addition,the results of thermal resistance of Bacillus stearothermophilus which was predominant thermoduric bacteria in canned food showed that the valuesofD121℃=1.4min and Z=10.05℃.
plantbeverage;thermophilicmicroorganisms;identificationofmolecularbiology;thermalresistance
10.3969/j.issn.1005-6521.2016.23.038
2016-08-03
邓腾(1965—),男(汉),工程师,研究方向:主要从事饮料新产品开发与工艺研究。

