花生黄曲霉毒素污染生防细菌筛选及菌株B85-1的鉴定和抗菌活性
姚彦坡,张立田,郑百芹,张建民,董李学,项爱丽,李爱军
(河北省唐山市畜牧水产品质量监测中心/农业部农产品质量安全风险评估实验站,河北 唐山 063000)
花生黄曲霉毒素污染生防细菌筛选及菌株B85-1的鉴定和抗菌活性
姚彦坡,张立田,郑百芹,张建民,董李学,项爱丽,李爱军*
(河北省唐山市畜牧水产品质量监测中心/农业部农产品质量安全风险评估实验站,河北 唐山 063000)
从采自广西、江西、湖北及河北花生产区的花生荚果内分离到511株内生细菌。平板拮抗实验结果显示,有10株拮抗细菌对黄曲霉菌具有显著的抑制作用,拮抗带宽超过10 mm,抑制率从45.5%~90.2%。实验发现8株内生拮抗细菌对黄曲霉菌生长及毒素产生有较强的抑制作用,对黄曲霉菌的防治效果为22.5%~65.0%,对黄曲霉毒素污染的抑制率为40.0%~90.5%,其中,菌株B85-1、B11-3及B50-9对黄曲霉菌的防治效果分别达到65.0%、60.0%和44.2%,抑毒率最强菌株为B85-1、B50-9及B78-5,抑毒率分别为90.5%、75.2%和74.5%。田间试验结果显示,菌株B85-1促生率及抑毒率最高,分别达到4.5%及65.5%,生防潜力巨大。经形态、生理生化及分子生物学分析,初步鉴定菌株B85-1为解淀粉芽孢杆菌。菌株B85-1发酵液、上清液、滤液及粗蛋白提取液对黄曲霉菌菌丝生长与孢子萌发均有较强的抑制活性。
花生;黄曲霉菌; 生防细菌;抗菌活性
花生是我国主要油料作物之一,同时也是重要的饲料原材料。花生在生长、储藏和转运过程中易受到霉菌毒素的污染,特别是黄曲霉毒素,这将严重影响到花生农产品的质量安全。如何解决花生霉菌毒素污染问题,已成为一个亟待解决的难题。
黄曲霉菌寄主范围广,产生的黄曲霉毒素污染危害重,给花生、玉米、油菜等农作物的生产带来严重损失,每年导致的经济损失高达数百亿美元[1-2]。黄曲霉毒素是一类强致癌、剧毒性真菌毒素,包括B、G和M族,其中B1最普遍且毒性最强,为氰化钾的10倍、砒霜的68倍,致癌力为六六六农药的10000倍[3-4],因此,加强花生等农产品中黄曲霉侵染及毒素污染的防控刻不容缓。目前,防控花生黄曲霉菌侵染及毒素污染以化学防治为主,由于化学防治成本较高和易污染环境,而且病原物易对杀菌剂产生耐药性甚至抗药性,所以,寻找一种对人体健康、对环境友好的防控措施势在必行。植物内生细菌分布广、种类多、数量大,在长期进化过程中,与植物建立了密切关系,其中有些细菌具有抑制病原菌、促进植物生长、增强植株抗逆性、增殖和扩散快等优点,因而成为发展前景很好的植物病害生防菌[5-6]。
目前,国内花生内生拮抗菌的研究主要针对花生根腐病和茎腐病,对花生黄曲霉毒素污染的研究鲜有报道。本文以黄曲霉菌及毒素污染为研究对象,从健康的花生荚果中分离出内生细菌,并采用活体方法筛选拮抗细菌,研究内生拮抗菌的抗菌活性,以期为解决花生黄曲霉毒素污染的防控瓶颈问题探索新的途径。
1 材料与方法
1.1 供试菌株及植物
花生黄曲霉菌由中国农业科学院油料作物研究所质标室/农业部生物毒素检测重点实验室提供。内生细菌自江西、广西、湖北及河北省等黄曲霉菌侵染严重病区的健康花生荚果内分离获得。供试花生品种:唐花11号(唐山市农业科学院花生研究室提供)。
1.2 花生内生细菌的分离、纯化与保存
花生内生细菌的分离参照Dey等[5]方法。选取江西、广西、湖北及河北省等罹病花生田中健康花生植株,连同土壤一同带回实验室分离。超净工作台上将花生植株上部长有叶片的茎秆剪掉,轻轻抖掉荚果上附着且结合程度低的土壤,将健康荚果及其上附着牢固的土壤一起放入无菌水中,震荡30min,获得土壤悬浮液。将荚果从上述土壤悬浮液中无菌操作取出,用吸水纸吸干后用镊子夹至无菌天平上称重。将称重后的花生荚果用自来水及牙刷洗净表面土壤至眼睛看不见为止,然后在无菌三角瓶中用3%次氯酸钠溶液浸泡10min,最后无菌水冲洗5次,沥干水分。取出花生荚果,无菌操作掰开荚果,将果壳用无菌剪刀平均分成5等份,放置在牛肉膏蛋白胨培养基平板中,于28℃恒温培养,每天观察菌落生长状况,并及时挑取特征差异明显、分离良好的单菌落,进一步纯化获得纯菌株,在牛肉膏蛋白胨斜面培养基上保藏备用。
1.3 花生内生拮抗细菌的离体筛选
采用对峙培养法对黄曲霉菌内生拮抗细菌进行筛选。将预先准备好的黄曲霉菌菌碟置于PDA平板中央,然后用高温灭菌的牙签蘸取内生细菌,等距离(距病原菌2cm处)对称点接到PDA平板上,于28℃黑暗培养,3~7d观察抑菌带有无及大小,重复3次。选出抑菌带较宽的内生细菌菌株在花生籽仁上进行复筛及计算抑制率。
抑制率(%)=(对照生长量-处理生长量)/对照生长量×100
1.4 花生黄曲霉菌内生拮抗细菌的活体筛选
1.4.1 拮抗菌发酵液的准备 用挑针挑取离体实验中具有抑菌活性的拮抗细菌菌株的单菌落,转移至装有50mL NB培养液的三角瓶中,于28℃、150r·min-1振荡培养1 d。吸1mL培养液转接至装有50mL NB培养液的三角瓶中,28℃、150r·min-1振荡培养2d,获得拮抗菌株的发酵液。
1.4.2 拮抗细菌的活体筛选 把上述发酵2d的拮抗菌发酵液(孢子最终浓度为3.0×106孢子·mL-1)和培养7d生长旺盛的黄曲霉菌菌悬液(孢子最终浓度为3.0×106孢子·mL-1)分别浸泡花生籽仁30 min,阴凉处晾干后放入无菌平板,每板20粒花生,放入光照培养箱培养10 d。培养箱培养条件为:温度28℃,湿度70%~80%,光照为12 h黑暗/12 h光照。以不浸菌液为空白对照,每处理设3次重复。
1.5 田间试验
采用随机设计,3个重复,每个小区的面积为15 m×3 m。将60kg·hm-2(1×108孢子·g-1)生防制剂于花生播种时随肥料施入,设置化学防治方法(70%甲基托布津可湿性粉剂0.5g/棵)及对照,农药的施用方法同生防制剂。花生收获后每处理随机调查5个点,每点10株。调查生防菌对黄曲霉毒素污染的防治效果及促生效果。
抑毒率(%)=(对照毒素量-处理毒素量)/对照毒素量×100
促生率(%)=(对照株高-处理株高)/对照株高×100
1.6 内生拮抗细菌菌株B85-1的鉴定
1.6.1 常规鉴定方法参见文献[7]。
1.6.2 16S rDNA PCR扩增及序列测定 生防细菌基因组DNA的提取采取试剂盒的方法。以27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')为引物扩增细菌菌株的16S rDNA。PCR体系:10×PCR缓冲液5μL,dNTPs(10 mmo1)lμL,引物27f(10μmol·L-1)1μL,引物R1492(10μmol·L-1)1μL,模板DNA约10pmol,Taq酶(5μ·μL-1)0.25μL,加重蒸水至50μL。扩增条件:98℃ 5min;95℃ 35s,55℃ 35s,72℃ 1min,35个循环;72℃ 8min。琼脂糖凝胶电泳并回收目标DNA片段,由上海派诺森生物公司测序;测序结果用BLAST软件在GenBank进行同源性比较,以ClustalX进行多序列比对后,用MEGA 4.0的Neighbor-Joining法构建系统发育树。
1.7 菌株B85-1对花生黄曲霉菌的抑制作用
1.7.1 上清液和过滤液制备 生防菌B85-1在LB斜面上活化后,取一环于LB培养液中,100mL/300mL装液量,37℃,160r·min-1振荡培养48 h后,制备成的处理液在12000 r·min-1下离心15 min,取上清,用0.22μm细菌过滤器过滤后得到无菌的过滤液。
1.7.2 菌悬液制备 培养液在12000 r·min-1下离心15 min,弃上清,用无菌水清洗3次再离心,加入无菌水。
1.7.3 蛋白粗提液 培养液于4℃下12000 r·min-1离心15min弃沉淀,在上清液中加固体硫酸铵至70%饱和度,4℃静置过夜,于4℃下10000 r·min-1离心20 min,弃上清液,沉淀用1/25体积10 mmol/L,pH7.0磷酸缓冲液悬浮,然后用0.22μm细菌过滤器过滤除掉可能存在的细菌。
1.7.4 生防菌代谢产物对黄曲霉菌菌丝生长的影响 测定方法:取黄曲霉菌菌悬液5mL(1×106孢子·mL-1),放入温度降到35℃左右PDA三角瓶中(100mL/350mL),摇晃2min后,均匀地倒入培养皿中。用打孔器在PDA平板周围等距离打3个孔,用移液枪分别加入100μL上清液、过滤液、冷冻上清液、冷冻过滤液及蛋白粗提液,30℃培养3~5d,待CK长满平板时检测各处理抑菌圈的半径,每个处理三个重复。同时,研究生防菌过滤液在40℃、50℃、60℃、70℃、80℃、110℃下的热稳定性实验,热稳定性实验在水浴锅中浸加热1 h,121℃温度下处理20 min。
2 结果与分析
2.1 花生内生细菌的分离
根据菌落形态、颜色及出现的早晚等差异,从表面彻底消毒的花生荚果碾碎液涂布的平板中挑取不同菌落进行纯化,得到511株内生细菌。其中,江西健康花生荚果上共分离出内生菌115株,广西健康花生荚果上共分离出内生菌142株,湖北健康花生荚果上共分离出内生菌152株,河北健康花生荚果上共分离出内生菌102株。结果显示,不同省份区域的花生荚果内的细菌数量明显不同。
2.2 内生拮抗细菌的筛选
2.2.1 离体拮抗筛选 将分离获得的511株花生内生细菌通过对峙培养法进行拮抗筛选,其中,10株生防菌的抑菌带宽均在10mm以上,拮抗效果在45%以上。菌株B85-1对花生黄曲霉菌的抑制率最高,达90.2%,其次为菌株B78-5和B423-2,抑制率分别达82.5%和75.5% (表1)。
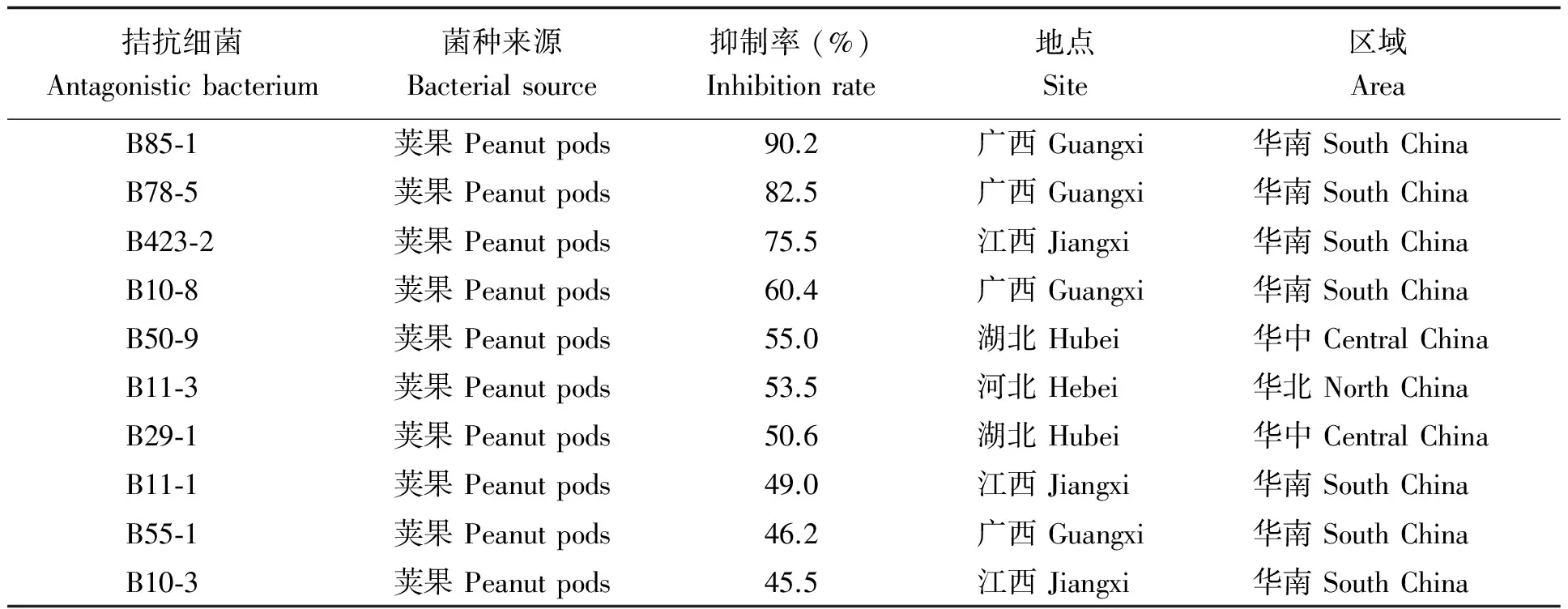
表 1 生防菌株对黄曲霉菌的拮抗作用
2.2.2 活体拮抗筛选 将离体条件下具有较强拮抗作用的内生细菌在花生籽仁上进行活体筛选(表2),结果表明,获得的内生细菌在籽仁上表现出较好防病效果,对黄曲霉菌毒素污染抑制率较高。花生内生拮抗细菌对花生黄曲霉菌的防病效果为22.5%~65.0%,其中,菌株B85-1对花生黄曲霉菌的防效最高,达65.0%,其次为菌株B11-3和B50-9,防效分别为60.0%和44.7%。抑毒效果较好的菌株分别为B85-1、B50-9、B78-5,抑制率分别为90.5%、75.2%、74.5%。
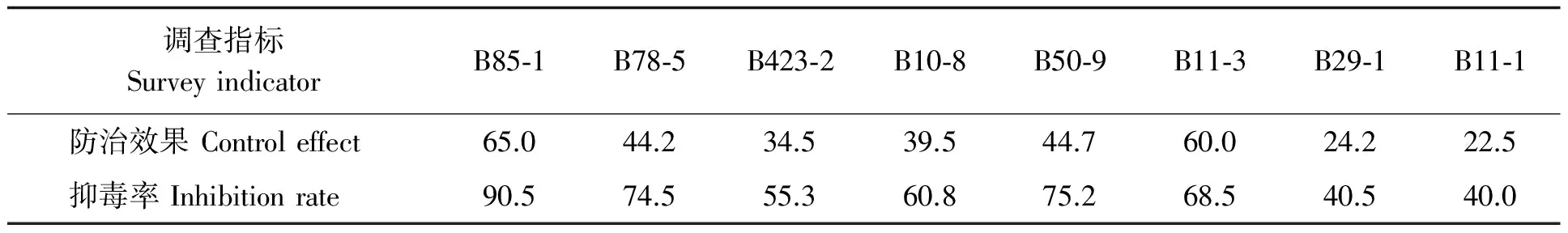
表 2 拮抗菌对黄曲霉菌的防治效果及抑毒率 (%)
2.2.3 田间试验 田间试验结果显示,生防菌对黄曲霉毒素污染具有较好的抑制效果,除菌株B11-3及B42-1外,其他菌株均具有一定程度的促生作用,菌株B85-1促生率及抑毒率最高,分别达到4.5%及65.5%,该菌株有进一步研究的价值,生防潜力巨大,其次是菌株B78-5,促生率及抑毒率分别达到3.5%及61.5% (表3)。
2.3 菌株B85-1的鉴定
2.3.1 常规鉴定 形态观察发现,菌株B85-1在NA培养基上菌落圆形,边缘不规则,表面较光滑,不产色素;菌体杆状,大小为(0.9~1.2)μm×(2.8~3.2)μm;革兰氏染色阳性;产芽孢,芽孢椭圆形;具有运动性,证明该菌株为芽孢杆菌(Bacillussp.)。
菌株B85-1接触酶反应、葡萄糖、甘油、D-木糖、淀粉水解、山梨醇、甘露糖、果糖、肌醇及纤维二糖均为阳性,氧化酶、D-阿拉伯糖等试验均为阴性。该菌株与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的特征基本相似,因此判断该菌株可能为解淀粉芽孢杆菌[8-9](表4)。
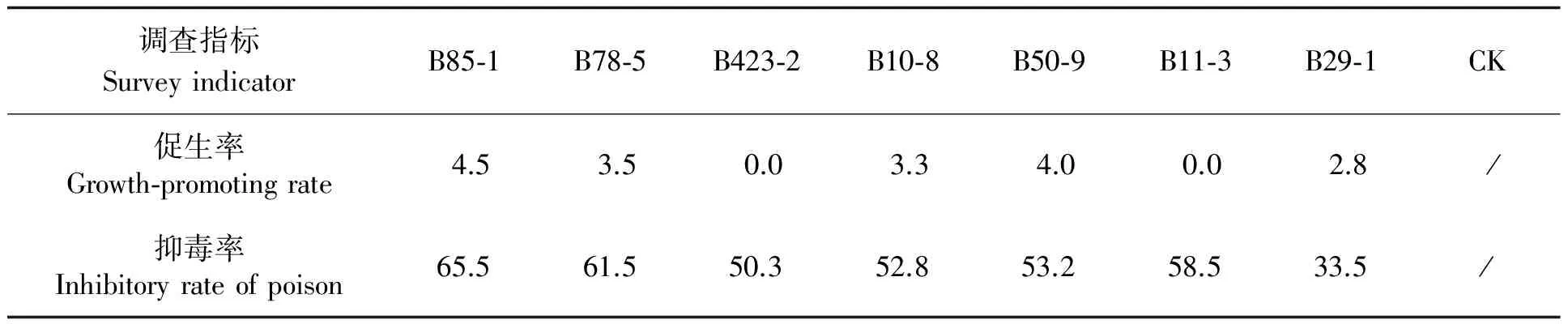
表 3 生防菌对黄曲霉毒素抑制率及对花生促生效果 (%)

表 4 菌株B85-1的生理生化特征
注:“+”为阳性反应,“-”为阴性反应。
Note: "+"means positive reaction, "-"means negative reaction.
2.3.2 16S rDNA的序列分析 以菌株B85-1基因组DNA为模板,通过PCR扩增得到该菌株1.48kb左右的16S rDNA。测序结果表明该菌株16S rDNA序列长度为1477bp。BLAST分析发现该菌株的16S rDNA序列与芽孢杆菌属细菌的16S rDNA相似,用Clustal W进行多重序列对比,用软件MEGA 4.0按Neighbor-Joining法构建系统发育树(附图)。菌株B85-1与解淀粉芽孢杆菌菌株JF496388关系最紧密,同源性达到98%。结合菌株B85-1形态特征及生理生化指标测定等鉴定结果,初步将菌株B85-1鉴定为解淀粉芽孢杆菌。

附图 基于16S rDNA序列构建的菌株B85-1的系统发育树Fig. Phylogenetic tree of strain B85-1 based on 16S rDNA sequences
2.4 菌株B85-1代谢物对黄曲霉菌的影响
6株生防菌培养液对病原菌菌丝生长作用的抑制作用均为100%;生防菌蛋白粗提液的抑制作用也很强,达到96%以上;生防菌过滤液和冻过滤抑菌率均在30%以上,其中B10-8抑菌率最强,分别达到55.0%和50.0%,其次是B85-1,达到52.5%和45.5%;生防菌的上清液和冻上清抑菌率在52%以上,其中B85-1抑菌率最强,分别达到65.5%和60.0%,其次是B10-8,分别达到62.0%和60.0% (表5)。
温度对生防菌代谢产物作用影响显著,尤其对菌株B85-1、B11-3和B423-2影响明显,超过60℃将失去对黄曲霉菌孢子萌发的抑制作用,说明生防活性物质对热较敏感,温度对菌株B78-5、B10-8和B50-9影响不明显,生防活性物质对热不敏感 (表6)。
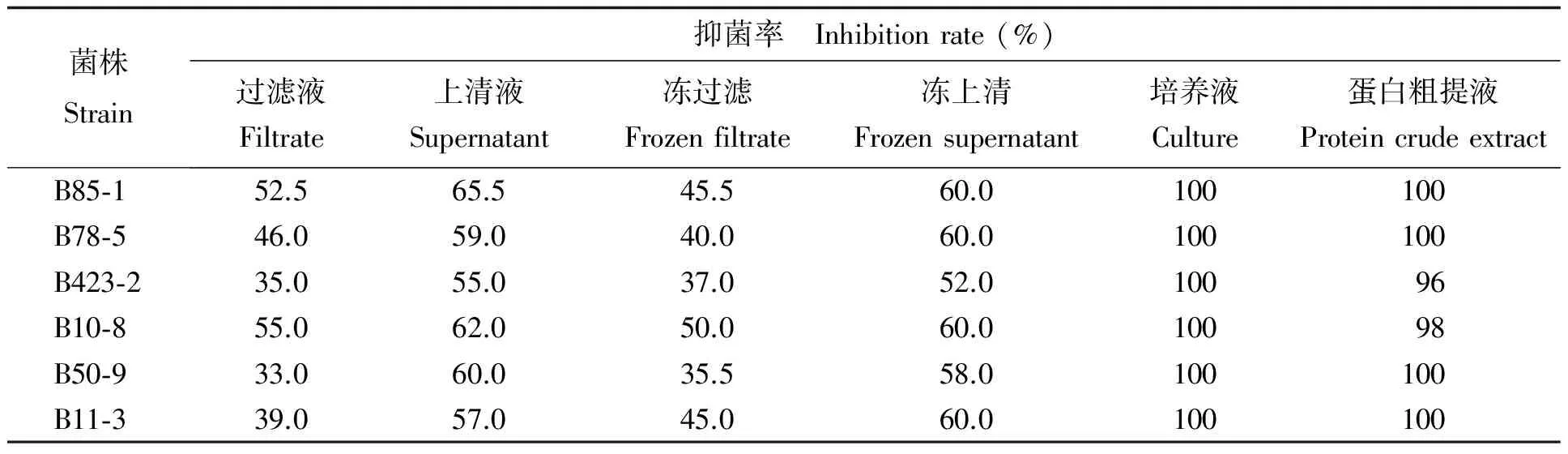
表 5 生防菌代谢产物对黄曲霉菌生长的抑制作用
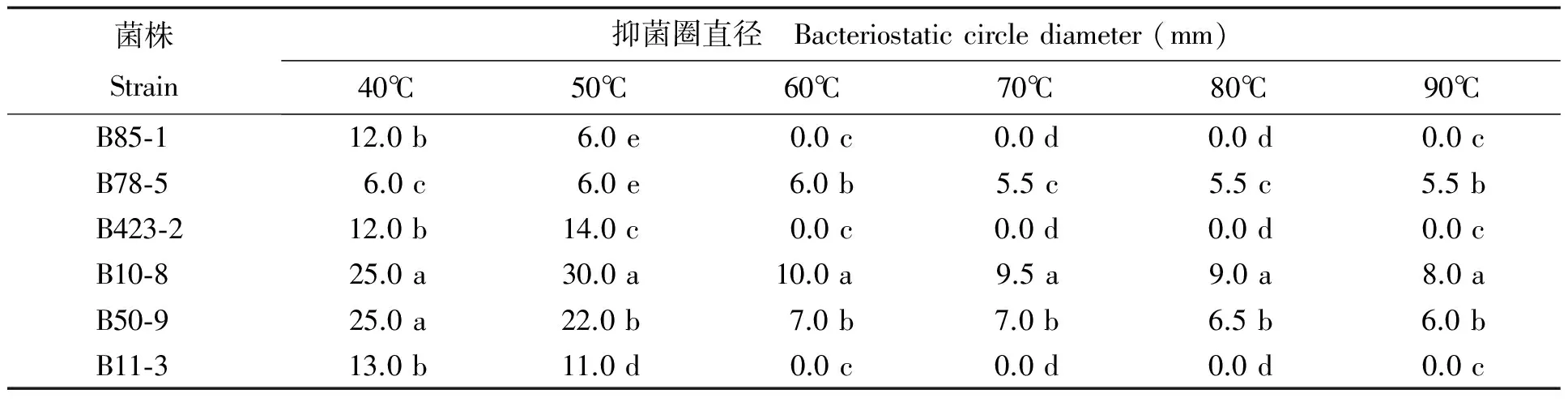
表 6 温度对生防菌代谢产物的影响作用
3 讨 论
生态环境中存在诸多生物致癌因素,其中由黄曲霉和寄生曲霉产生的黄曲霉毒素是已知的生物毒素中毒性最强的一种[1,11-13],该毒素可通过不同途径进入人体诱导产生恶性肿瘤,而治理黄曲霉毒素的最佳办法就是预防[14-15]。本研究采用对人体无害、对环境友好的生物防治技术,针对花生黄曲霉毒素的生防细菌展开研究。从我国不同主产区的花生荚果内生环境中分离不同类群的细菌,筛选出高效抑制黄曲霉菌生长及黄曲霉毒素合成的生防细菌,选择抑菌抑毒能力较强的生防菌株对其生防机制进行研究。
内生细菌在植物体内具有稳定的生存空间,不易受环境条件影响,可以在植物体内繁殖和生长,成为生物防治中有潜力的生防菌而加以利用[10]。研究结果显示出不同区域花生荚果内细菌数量和种类明显不同,这可能与不同花生黄曲霉菌的发生程度、内生细菌进入花生体内的方式、植株组织结构及营养物质分布有关。本研究从病区健康的花生荚果中分离内生细菌,分离到的511株内生细菌中有20株对花生黄曲霉菌有较强的拮抗作用,经室内实验和田间试验,菌株B85-1对黄曲霉毒素污染的防治效果室内和田间分别达到90%及60%以上,具有较好的开发应用潜力。菌株B85-1发酵滤液、上清液及蛋白粗提液对黄曲霉菌的菌丝生长和孢子萌发具有较强的抑制活性。本研究表明,内生拮抗细菌B85-1可通过分泌抗菌物质来抑制黄曲霉菌丝生长和分生孢子萌发,抑制和减轻黄曲霉菌侵染和毒素污染的发生,即菌株分泌的抗菌物质为菌株抑菌抑毒机制之一。但其解毒机制、对环境中微生物种类和区系影响、定殖能力、对花生品质与防病作用的关系有待进一步深入探索和研究。
[1] 范素芳,李培武,王秀嫔,等. 高效液相色谱和高效液相色谱离子阱质谱测定花生、玉米和大米中黄曲霉毒素方法比较[J]. 食品科学,2011,32 (12):254-258.
[2] Liu X. Strengthen research work of exposure and control of mycotoxin [J]. Chinese Journal of Preventive Medicine, 2006, 40: 307-308.
[3] Pal K, Gardener B. Biological control of plant pathogens [J]. The plant health instructor, 2006, DOI:10.1094/PHI-A-2006-1117-02.
[4] Dorner J W. Biological control of aflatoxin contamination of crops [J]. Toxin Reviews, 2004, 23(2): 425-450.
[5] Dey R, Pal K K, Bhatt D M, et al. Growth promotion and yield enhancement of peanut (ArachishypogaeaL.) by application of plant growth-promoting rhizobacteria [J]. Microbiological Research, 2004, 159(4): 371-394.
[6] 何红,邱恩鑫,胡方平,等. 植物内生细菌生物学作用研究进展[J]. 微生物学杂志,2004,24(3):40-45.
[7] 东秀珠,蔡妙英. 常见细菌鉴定手册[M]. 北京:科学出版社,2001.
[8] Buchanan R E, Gibbons N E. 伯杰细菌鉴定手册 [M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译. 8版.北京:科学出版社,1984.
[9] Ji X L, Lu G B, Gai Y P. Biological control against bacterial wilt and colonization of mulberry by an endophyticBacillussubtilisstrain [J]. FEMS Microbiology Ecology, 2008, 65(3): 565-573.
[10] Kirk G D, Bah E, Montesano R. Molecular epidemiology of human liver cancer: Insights into etiology, pathogenesis and prevention from the Gambia [J]. Carcinogenesis, 2006, 27: 2070-82.
[11] Groopman J D, Kensler T W, Wild C P. Protective Interventions to Prevent Aflatoxin-Induced Carcinogenesis in Developing Countries [J]. Annual Review of Public Health, 2008, 29: 187-203.
[12] Wu F, Khlangwiset P. Health economic impacts and cost-effectiveness of aflatoxin reduction strategies in Africa: Case studies in biocontrol and postharvest interventions [J]. Food Additives and Contaminants, 2010, 27: 496-509.
[13] Liu Y, Wu F. Global Burden of Aflatoxin-Induced Hepatocellular Carcinoma: A Risk Assessment [J]. Environmental Health Perspectives, 2010, 118: 18-24.
[14] Van Egmond, Dragacci S. Liquid Chromatographic Method for Aflatoxin M1 in Milk [J]. Methods in Molecular Biology, 2001, 157: 59-69.
[15] Tekinsen K, Eken H S. Aflatoxin M1 levels in UHT milk and kashar cheese consumed in Turkey [J]. Food and Chemical Toxicology, 2008, 46: 3287-3289.
Screening of Peanut Endophytic Bacterial Antagonists againstAspergillusflavus,and Identification and Antagonistic Activities of Strain B85-1
YAO Yan-po, ZHANG Li-tian, ZHENG Bai-qin, ZHANG Jian-min, DONG Li-xue, XIANG Ai-li, LI Ai-jun*
(Tangshan Livestock and Aquatic Products Quality Inspection and Test Center/Agricultural Product QualitySafetyRiskAssessmentExperimentStation,MinistryofAgriculture,Tangshan063000,China)
511 strains of endophytic bacteria were isolated from healthy peanut pods in severely infested plots in Guangxi, Jiangxi, Hubei and Hebei Provinces. Their antagonistic activities toAspergillusflavuswere tested by peanut in vivo and dual culture tests. The results showed that 10 strains from peanut pods showed strong antagonistic activities toAspergillusflavuswith the width of inhibition zones more than 10 mm, control efficiency from 45.5% to 90.2%. The control efficacy of 8 strains of the endophytic bacteria to peanutAspergillusflavusranged from 22.5%to 65.0%, inhibitory rate of poison to aflatoxin from 45.5%to 90.5%, and the control efficiency of B85-1、B11-3 and B78-5 were 65.0%、60.0% and 44.2%, respectively, inhibitory rate of poison of B85-1, B50-9, B78-5 were 90.5%, 75.2% and 74.5%, respectively. Based on the morphological, physiological and biochemical characteristics and 16S rDNA sequences analysis, strain B85-1 identified asBacillusamyloliquefaciens. The fermentation filtrate, supernatant, filtrate and crude protein extract of B85-1 showed strong antagonistic activities to the hyphal growth, hyphal morphology and spore germination ofAspergillusflavus.
peanut;Aspergillusflavus; biocontrol bacteria; antagonistic activity
10.14001/j.issn.1002-4093.2016.03.004
2016-03-18
国家农产品质量安全风险评估重大专项(GJFP2015007);农业部生物毒素检测重点实验室开放课题
姚彦坡(1977-),男,河北邯郸人,唐山市畜牧水产品质量监测中心高级农艺师,博士,主要从事粮油产品质量安全、产毒真菌防控及微生态学研究。
*通讯作者:李爱军,男,研究员,主要从事农产品质量安全研究。E-mail: ts03157909155@163.com
S565.2; S154.36
A

