5%丁硫克百威在花生植株及土壤中消解动态及最终残留研究
姜 蔚,王志新,姚 杰,鹿泽启,段小娜,臧宏伟,柳 璇,兰 丰,刘传德
(山东省烟台市农业科学研究院/农业部果品质量安全风险评估实验室(烟台)/农业部果品及苗木质量监督检验测试中心(烟台),山东 烟台 265500)
5%丁硫克百威在花生植株及土壤中消解动态及最终残留研究
姜 蔚,王志新,姚 杰,鹿泽启,段小娜,臧宏伟,柳 璇,兰 丰,刘传德*
(山东省烟台市农业科学研究院/农业部果品质量安全风险评估实验室(烟台)/农业部果品及苗木质量监督检验测试中心(烟台),山东 烟台 265500)
采用气相色谱—氮磷检测器(GC-FTD),对5%丁硫克百威颗粒剂在花生植株及土壤样品中的消解动态和最终残留进行了研究。两年三地试验结果表明,丁硫克百威在花生植株及土壤中的残留消解动态符合一级动力学反应模式,在植株和土壤中的消解半衰期分别为9.5~12.1d和9.8~13.3d。5%丁硫克百威颗粒剂按照推荐使用上限量3750 g a.i./hm2和推荐上限量的1.5倍5625 g a.i./hm2,于花生播种时一次性使用,收获时在花生植株、果壳、籽仁以及0~15cm耕层中的最终残留量<0.01 mg/kg,低于国标0.2 mg/kg的限量。表明,当花生播种时一次性使用剂量为3750~5625 g a.i./hm2的5%丁硫克百威颗粒剂,收获时产品是安全的,也不会造成土壤污染。
丁硫克百威;花生;土壤;消解动态;最终残留
蛴螬等地下害虫是影响花生产量的最主要害虫,一般使花生减产10%~20%,重者达50%以上,甚至绝收。在花生蛴螬的综合治理中, 药剂防治占有重要地位,选用高效、低毒、低残留的新农药可有效兼顾产量和产品的安全性。丁硫克百威属高效安全的杀虫杀螨剂,是剧毒农药克百威较理想的替代品种之一。其特点是作用迅速、内吸性好、残留低、渗透力强、有较长的残效、使用安全等,对成虫及幼虫均有效,对作物无害。我国《食品安全国家标准 食品中农药最大残留限量》(GB 2763-2014)规定,丁硫克百威在花生仁上的最大残留限量值为0.05mg/kg。5%丁硫克百威颗粒剂有效成分为丁硫克百威,其推荐使用量为2250~3750 g a.i./hm2,全生育期施药1次,对花生蛴螬有明显的防治作用[1]。国内外关于氨基甲酸酯类农药的残留检测技术报道较多[2-9],而在花生和土壤中残留研究的较少。
本文通过在山东省烟台市、河北省石家庄市、江苏省南京市开展两年三地的残留动态试验,以期为该药剂在花生上的安全使用提供科学依据。
1 材料与方法
1.1 试验概况
2012-2013年,在山东烟台、河北石家庄、江苏南京三地市进行5%丁硫克百威颗粒剂田间试验。试剂来自广东中迅农科股份有限公司。
1.2 田间试验设计
1.2.1 最终残留试验 试验设3个处理:T1:3750 g a.i./hm2(推荐使用量上限,相当于制剂量5000 g/667m2);T2:5625 g a.i./hm2(1.5倍推荐使用量上限,相当于制剂量7500 g/667m2);T0(空白,对照)。按农药残留试验准则要求设试验小区,小区面积30m2,重复3次,小区间设保护带。施药方法为花生播种后撒入播种沟内,然后覆土,以后不再施药。
1.2.1.1 植株取样。在试验小区内随机选出生长正常的花生10个点,用铁锹小心挖出花生植株5穴10株,然后将完整植株(含根、茎、叶、针、荚果)带回实验室用水冲洗,晾干后置于-20℃冰柜中保存待测。
1.2.1.2 土壤取样。土壤以十点取样法进行。用土钻取0~15cm耕层土2kg左右,同时取对照样品,4h内运回实验室。除去土壤中的碎石、杂草和根茎等杂物,用塑料袋封装、编号,于-20℃冰柜中保存待测。检测同时测定水分含量,用于校正至干基残留量。
1.2.2 残留消解动态试验
1.2.2.1 花生植株残留消解动态试验。在最终残留试验的T2处理(5625 g a.i./hm2)小区内,当花生植株生长至10 cm左右时开始取样,记为0d、1d、3d、5d、7d、10d、14d、21d、30d、45d、60d,采集花生植株茎叶(地表以上)样品。取样时在试验小区内不同方向采集地表以上的植株茎叶,样本重约1.0kg,同时取对照样品,4h内运回实验室。切碎混匀后用四分法处理样品,留样250g,分别用塑料袋封装、编号,保存在-20℃冰柜中。
1.2.2.2 土壤中残留消解动态试验。试验设计剂量5625 g a.i./hm2,小区面积10 m2,重复3次。施药时将药剂用细沙土混匀撒施(兑土450kg/hm2),之后表面覆盖1cm厚的土壤。分别于施药后0d、1d、3d、5d、7d、10d、14d、21d、30d、45d、60d采样。土壤以十点取样法进行。用土钻取0~10cm耕层土约2kg,同时取对照样品,其余步骤同1.2.1.2。
1.3 分析方法
1.3.1 样品制备 花生植株剪成0.5~1.0cm长后,充分混匀后缩分至300g;将花生样本脱壳,收集花生仁,混匀后缩分至300g;将脱壳后的花生仁阴干后磨碎并混匀,缩分至200g;土壤样品去除杂草、碎石等,混匀缩分至400g,检测同时测定水分含量,用于校正至干基残留量。
1.3.2 样品提取 花生植株和花生壳:准确称取花生植株或花生壳样品5.0 g于100mL塑料离心管中,加入20 mL水,浸泡1h,加入20 mL乙腈,40℃恒温水浴振荡1h,加入NaCl 5~7g,剧烈振摇1 min,3000r/min离心5min,取上清液10mL。80℃水浴氮气吹至近干,加入2 mL正己烷,待净化。花生仁:准确称取花生仁样品10.0 g于100 mL塑料离心管,加入10 mL水,浸泡过夜,加入20 mL乙腈,在匀浆机中高速匀浆1min,其余步骤同上。土壤:准确称取土壤样品10.0 g于100 mL塑料离心管中,加入20.0 mL乙腈,40℃恒温水浴振荡1h,加入NaCl 5~7g,继续振摇1min,3000r/min离心5min,取上清液10mL。80℃水浴氮气吹至近干,用丙酮分三次冲洗烧杯,并转移至离心管,最后定容至5.0 mL,上机待测。
1.3.3 样品净化 花生植株和花生壳:将中性氧化铝柱用5 mL丙酮+正己烷(50+50)预淋洗,弃去淋洗液倒入上述待净化液,用15 mL刻度离心管收集洗脱液,用5 mL丙酮+正己烷(50+50)冲洗烧杯后淋洗中性氧化铝柱,并重复一次。将盛有淋洗液的离心管于80℃水浴上氮气吹至近干,用丙酮定容至2.5mL,上机待测。
花生仁:净化过程同上,用丙酮定容至5.0mL,上机待测。
1.4 色谱条件
检测器:氮磷检测器 (FTD)。
色谱柱:HP-5,30.0m×0.32mm×0.25μm。
进样口温度:250℃。
柱温:150℃保留1min,以15℃/min速度升至270℃,保持12min。
检测器温度:310℃。
进样方式:分流进样,分流比为8∶1。
进样量:1μL。
载气:氮气(≥99.99%),1.0mL/min。
燃烧气:氢气,1.5 mL/min;空气,145.0 mL/min仪器的最小检测量甲基硫菌灵和多菌灵均为0.5ng,甲基硫菌灵和多菌灵在土壤和荚果中的最低检测浓度均为0.05mg/kg。
1.5 数据统计
统计分析软件SPSS 13.0。
2 结果与讨论
2.1 添加回收率试验
分别在空白花生植株、花生仁、花生壳和土壤中加入一定量的丁硫克百威标准液,按上述方法提取、净化和检测,得到0.01、0.05 和1.0mg/kg三个浓度的添加回收试验。计算回收率和相对标准偏差。如附表所示,方法的准确度和精密度符合农药残留分析规定[10]。
2.2 丁硫克百威残留消解动态
2.2.1 花生植株消解动态 丁硫克百威在花生植株中残留消解动态符合指数函数C=aebT(图1)。图1可见,两年三个试点施药后,丁硫克百威在植株上的原始沉积量,2012年和2013年山东分别为3.639 mg/kg和2.976 mg/kg,河北分别为2.403 mg/kg和2.821 mg/kg,江苏分别为1.925 mg/kg和1.948 mg/kg;一个月后,山东、河北、江苏三个试点两年植株残留量分别为0.812 mg/kg和0.270 mg/kg、0.294mg/kg和0.345mg/kg、0.236mg/kg和0.239mg/kg,消解率分别达77.7%和90.9%、87.8%和87.8%、87.8%和87.8%;两个月后,三个试点两年植株残留量均在国标限量0.2%以下,分别为0.181 mg/kg和0.024 mg/kg、0.036 mg/kg和0.042 mg/kg、0.029 mg/kg和0.029 mg/kg,消解率达95.0%以上,分别为95.0%%和99.2%、98.5%和98.5%、98.5%和98.5%。三试点两年丁硫克百威在植株中的半衰期为9.5~12.5d,平均10.2d,说明该药在植株中半衰期较短。
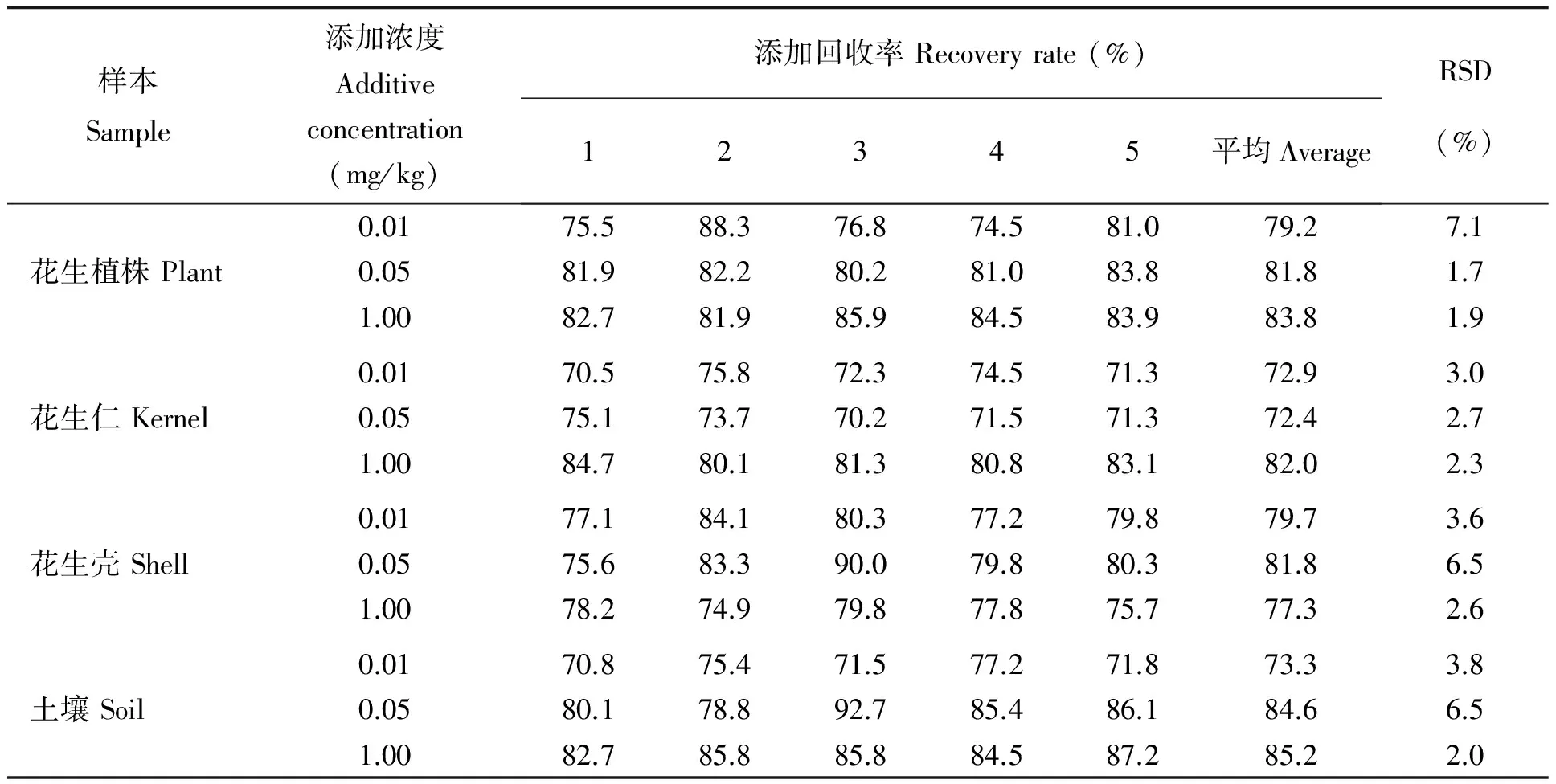
附表 丁硫克百威在花生和土壤中的方法回收率
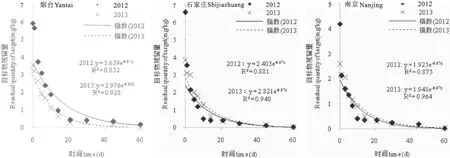
图 1 丁硫克百威颗粒剂在花生植株中的消解动态Fig. 1 The degradation dynamics of Carbosulfan in peanut plant

图 2 丁硫克百威颗粒剂在土壤中的消解动态Fig. 2 The degradation dynamics of Carbosulfan in soil
2.2.2 土壤中消解动态试验结果 丁硫克百威在土壤中的残留消解动态与植株相似,亦符合指数函数(图2)。图2可见,两年三试点施药后,丁硫克百威在土壤中的原始沉积量,2012和2013年山东分别为1.493mg/kg和2.224mg/kg,河北分别为1.315mg/kg和2.259mg/kg,江苏分别为1.799mg/kg和1.683mg/kg;一个月后,山东、河北、江苏三个试点两年土壤残留量分别为0.183 mg/kg和0.496 mg/kg、0.293 mg/kg和0.504 mg/kg、0.220 mg/kg和0.376 mg/kg,消解率分别达87.8%和77.7%、77.7%和77.7%和87.8%和77.8%;两个月后,三个试点两年土壤残留量分别为0.022mg/kg和0.111mg/kg、0.065mg/kg和0.112mg/kg、0.027mg/kg和0.084mg/kg,消解率分别达98.5%和95.0%、95.0%和95.0%、98.5%和95.0%。三个试点两年丁硫克百威在土壤中的半衰期为9.8~13.3d,平均12.2d,表明丁硫克百威被施入土壤后两周残留量即可减少一半以上。
2.3 丁硫克百威在花生植株和土壤中最终残留
对花生收获前植株和土壤样品分析表明,两年三地花生植株(茎叶、果壳、籽仁)和0~10cm耕层土壤所有处理均未检出丁硫克百威,表明丁硫克百威颗粒剂在花生上按照推荐使用量3750g a.i./hm2和1.5倍推荐使用量5625 g a.i./hm2两个剂量,在花生播种时一次性沟施,花生收获时产品和土壤是安全的。
3 结 论
结果表明,5%丁硫克百威颗粒剂在土壤和花生植株中的消解动态数据符合一级动力学方程,且结果的相关性较高。两年三地花生植株中5%丁硫克百威颗粒剂消解半衰期为9.5~12.1d,差异不大。两年三地土壤中消解半衰期为9.8~13.3d,差异不明显。三地降解速度的差异,可能是由于气候差异造成的。推测作物生长速度、土壤中微生物的作用对降解速度影响较大。
5%丁硫克百威颗粒剂在花生上按照推荐使用上限量3750 g a.i./hm2(相当于制剂量5000 g/667m2)和1.5倍推荐上限量5625 g a.i./hm2(相当于制剂量7500 g/667m2),在花生播种时沟施,全生育期施药1次,花生收获时,两年三地丁硫克百威在花生植株、果壳、籽仁以及0~15cm耕层中的最终残留量<0.01 mg/kg。表明5%丁硫克百威颗粒剂按推荐剂量在花生上施用是安全的,且对土壤无污染。
[1] 林笑丽,李紫信,刘开亮,等. 5%丁硫克百威·毒死蜱颗粒剂防治花生蛴螬药效试验[J] . 福建农业科技,2004(5):27-28.
[2] 杨爽,刘新刚,董丰收,等. GC-MS方法检测辣椒中丁硫克百威及代谢产物的残留[J]. 农药,2008,47(7):515-516.
[3] 陈莉,贺敏,余苹中,等. 糙米中丁硫克百威及其代谢物的残留测定[J]. 安徽农业科学,2011,23(8):14387-14388,14391.
[4] 罗俊凯,龚道新,丁春霞,等. 气相色谱—质谱法测定烟叶和土壤中丁硫克百威及其代谢产物的残留[J]. 农药学学报,2014,16(1):66-71.
[5] 赵桦林,邱静,王敏,等. 加速溶剂萃取—液相色谱—串联质谱法同步检测白菜中的丁硫克百威及其代谢物残留[J]. 农药学学报,2013,15(2):204-210.
[6] 朱亚红,吴俐勤,于志光,等. 丁硫克百威在柑桔上的残留分析[J]. 农药,1993(6):42-43,41.
[7] 徐应明,李军幸,李卫国,等. 丁硫克百威在韭菜和土壤中的残留动态研究[J]. 农业环境科学学报,2003,22(4):484-487.
[8] 黄士忠,李治祥,凌联银,等. 丁硫克百威(Marshal)在苹果和土壤中的残留动态研究[J]. 农业环境保护,2000,19(2):88-92.
[9] 侯宪文,李勤奋,邓晓,等. 高效液相色谱法分析丁硫克百威及其降解产物[J]. 农药,2009,48(9):654-655,657.
[10] 李本昌. 农药残留量实用检测方法手册[M]. 北京:中国农业科技出版社,1995:61-69.
The Study on Degradation Dynamics and Final Residues of 5% Carbosulfan GR in Peanut Plant and Soil
JIANG Wei, WANG Zhi-xin, YAO Jie, LU Ze-qi, DUAN Xiao-na,ZANG Hong-wei, LIU Xuan, LAN Feng, LIU Chuan-de*
(Lab.ofQuality&SafetyRiskAssessmentforFruit(yantai),MinistryofAgriculture/QualityInspectionandTestCenterforFruitandNurseryStocks,MinistryofAgriculture/YantaiAcademyofAgriculturalSciencesinShandongProvince,Yantai265500,China)
In order to provide scientific experimental data, the degradation rule and the final residues of 5% Carbosulfan granules (GR) in peanut plant and soil were studied using GC-FTD. The field trial on the dissipation and final residues of Carbosulfan were carried out in Yantai, Shijiazhuang and Nanjing during 2012~2013. The degradation dynamics of Carbosulfan based on first-order reaction dynamic equations in peanut and soil, the half-lives of Carbosulfan were 9.5~12.1 days and 9.8~13.3 days respectively. The final residual quantities of Carbosulfan in peanut seedlings, shells, kernel and 0~15cm topsoil were all below 0.01 mg/kg, which is less than 0.2 mg/kg (limited value referring to GB 2763). In conclusion, the peanuts with 5% Carbosulfan GR sprayed in the dose of 3750~5625 g a.i./hm2at one time appeared to be safe and led no soil pollution.
Carbosulfan; peanut; soil; degradation dynamics; final residues
10.14001/j.issn.1002-4093.2016.03.003
2016-08-01
农业部农药登记残留项目 (2012P086)
姜蔚(1983-),女,山东文登人,山东省烟台市农业科学研究院农艺师,硕士,主要从事蔬菜果品质量安全检测和风险评估、农药残留检测技术研究等工作。
*通讯作者:刘传德,研究员,主要从事植物保护和果品质量安全风险评估研究。E-mail: 13583577321@126.com
S565.2; S481+.8
A

