不同环境条件下花生产量相关农艺性状的遗传分析
王晓帅,梁明磊,胡长敏,王 嵩,倪皖莉,江建华*
(1. 山东省农村科技教育培训中心,山东 济南 250013;2. 聊城市农业委员会,山东 聊城 252000;3. 安徽农业大学,安徽 合肥 230036; 4. 安徽省农业科学院,安徽 合肥 230031)
不同环境条件下花生产量相关农艺性状的遗传分析
王晓帅1,梁明磊2,胡长敏3, 4,王 嵩4,倪皖莉4,江建华4*
(1. 山东省农村科技教育培训中心,山东 济南 250013;2. 聊城市农业委员会,山东 聊城 252000;3. 安徽农业大学,安徽 合肥 230036; 4. 安徽省农业科学院,安徽 合肥 230031)
主茎高等花生重要农艺性状与花生产量密切相关。本研究以远杂9102/皖花4号F2群体为材料,利用主基因+多基因混合遗传模型对两种环境条件下的花生主茎高、侧枝长、总分枝数、结果枝数、单株总果数、单株饱果数、单株生产力、百果重和百仁重等9个性状进行遗传分析。结果表明,主茎高、侧枝长、总分枝数、百果重和百仁重5个性状在两种环境中均表现出受2对主基因控制,其中控制侧枝长、百果重和百仁重3个性状两种环境中的2对主基因均表现为等显性效应,控制总分枝数的2对主基因在两种环境中均表现为加性—显性效应,而控制主茎高的2对主基因不同环境中表现不同,合肥环境中表现为加性—显性—上位性效应,固镇环境中表现为等显性效应;结果枝数性状在两种环境中表现出受1对加性—显性主基因控制;单株总果数、单株饱果数和单株生产力3个性状在合肥环境中均表现出受2对加性—显性主基因控制,而在固镇环境中则表现出受1对加性—显性主基因控制。
花生;农艺性状;遗传模型;遗传分析
中国是世界上最大的花生生产消费国。花生种植面积居国内农作物种植面积的第7位,而单位面积产值却高居第5位[1]。主茎高、侧枝长、总分枝数、单株总果数、单株饱果数、单株生产力、百果重和百仁重等性状是花生重要的农艺性状,与花生产量密切相关[2-5]。李清华等[2-4]以27个花生品种为研究对象,对花生农艺性状和产量间的关系进行分析,发现小区产量与单株荚果干重、单株果数、单株双仁果数、百果重和百仁重分别呈极显著正相关,与总分枝数和单株单仁果数呈显著正相关,但与主茎高和第一对侧枝长呈极显著负相关,认为这些农艺性状与花生产量间呈密切相关。翟素琴等[5]以15个花生品种为材料,对8个农艺性状与花生产量相关性状间的关系进行了相关性分析,认为花生单株产量与主茎高、侧枝长、单株果数、饱果数、百果重和百仁重均呈正相关,其中与单株果数和饱果数间的相关系数达到极显著水平。笔者前期也曾以来自不同国家和地区的126份花生材料为研究对象,对花生12个农艺性状与单株生产力之间的关系进行了分析,发现单株生产力与总分枝数、结果枝数、单株总果数和单株饱果数、百果重和百仁重6个性状间均呈(极)显著正相关,而与主茎高性状间呈显著负相关[6]。以上结果说明,不同研究者利用的研究材料不同,得出的结论也存在些许差异,但均一致认为花生农艺性状与产量之间及各农艺性状之间密切相关。在培育高产花生品种时,可通过对农艺性状的间接选择而达到提高产量的目的。
前人曾利用主基因+多基因混合遗传模型对花生的品质[7-9]、休眠性[10]和荚果/籽仁[11]性状进行了遗传分析,而关于花生农艺性状的主基因+多基因遗传分析报道较少。刘华等[12]利用主基因+多基因混合遗传模型对2个环境下郑9001/郑8903 RIL群体的主茎高和侧枝长性状进行了遗传分析,认为这2个性状主要受多基因效应影响;张新友等[13]利用郑8903/豫花4号RIL群体为研究对象,对2个环境下10个农艺性状进行了遗传分析,认为主茎高、结果枝数、单株饱果数、百果重和百仁重等5个性状均表现为受3对主基因控制,侧枝长表现为受2对主基因控制,总分枝数和单株产量性状不同环境中表现不一致。笔者[14]前期曾以远杂9102、皖花4号以及远杂9102/皖花4号F1和F2群体为研究对象,利用南京农业大学章元明教授提供的SEA-G4F2模型对单个环境中的主茎高、侧枝长、分枝数和结果枝数等4个农艺性状进行遗传分析,发现这4个性状均表现出受2对主基因+多基因控制,控制各性状的2对主基因的作用方式因性状而异。本研究拟在上述基础上,利用SEA-F2模型对合肥(E1)和固镇(E2)2个环境中的远杂9102/皖花4号F2群体的主茎高、侧枝长、总分枝数等9个农艺性状进行遗传分析,以期获得对上述9个花生农艺性状遗传方式更为全面的认识。
1 材料与方法
1.1 试验材料
供试材料为远杂9102(P1)、皖花4号(P2)以及由P1和P2杂交、自交获得的F2群体。安徽省农科院院内基地(E1)中的F2群体由133个单株组成,固镇县花生原种场(E2)中的F2群体由151个单株组成。E1位于江淮之间,北纬31°86′,东经117°29′,马肝泥田,黏性大,湿时黏韧,干时坚硬。花生生长季节雨量充沛。E2位于安徽省东北部,淮河中游北岸,北纬33°32′,东经117°32′,砂浆黑土,保水性差。花生生长季节阳光充足。
1.2 试验设计
2014年将P1、P2和F2分别播种于E1和E2。做畦,畦宽1.5m,分别于5月29日(E1)和6月20日(E2)人工单粒点播,P1和P2种植2行,F2全部种完,所有材料均为每行10穴,行距40.0cm,常规栽培管理。
1.3 测定项目与方法
花生成熟后,P1、P2选择长势良好的10个单株、F2群体所有单株参照《花生种质资源描述规范和数据标准》进行株高、侧枝长、总分枝数、结果枝数、单株饱果数、单株总果数、单株生产力、百果重和百仁重等9个农艺性状的调查与记录[15]。
1.4 数据分析
F2群体9个农艺性状的次数分布按照盖钧镒的方法进行整理[16],采用曹锡文等研发的植物数量性状分离分析软件中的SEA-F2模型对远杂9102/皖花4号的P1、P2和F2群体进行遗传分析。运算结果中最小信息准则(Akaike information criterion,AIC)值最小的模型即为该性状的最适模型,统计最适模型下的遗传参数[17]。
2 结果与分析
2.1 2个环境下P1、P2和F2群体9个农艺性状的表型分布
2个环境下P1、P2和F2群体9个农艺性状表型分布见表1。2个环境中的所有性状在F2分离世代均表现为连续分布,表明这些性状均由数量性状基因控制,且所有性状均出现不同程度的超亲分离。2个环境中多数性状的偏度值和峰度值的绝对值都小于1,说明这些性状均呈正态分布。各性状在2个环境中的F2频率分布基本一致。
2.2 2个环境下P1、P2和F2群体9个农艺性状的遗传分析
表1可见,对于株高而言,E1中远杂9102平均株高为38.8±5.2cm,皖花4号平均株高为51.0±1.6cm,双亲差异极显著;F2平均株高为42.3±10.3cm,介于双亲之间,偏向于低值亲本;F2平均株高呈连续分布且显示多峰。E2中远杂9102平均株高为31.8±2.4cm,皖花4号平均株高为43.0±4.6cm,双亲差异极显著;F2平均株高为31.7±8.7cm,与低值亲本接近;F2平均株高呈连续分布且显示多峰。其余8个农艺性状2个环境中的次数分布亦均列于表1。2个环境中的远杂9102×皖花4号组合F2世代各性状具有类似的次数分布。
以5类24种模型拟合表型次数分布,求出各种遗传模型的极大似然值(Max-likelihood-value, MLV)和AIC值,AIC值最小的模型即为该性状的最适模型(见表2)。结果表明:主茎高性状在E1中2MG-ADI模型的AIC值最小,为1014.18,说明E1中主茎高性状在远杂9102/皖花4号F2组合中表现为受2对加性—显性—上位性主基因控制。E2中主茎高性状的2MG-EEAD模型AIC值最小,为1095.45,说明E2中主茎高性状在远杂9102/皖花4号F2组合中表现出受2对等显性主基因控制。
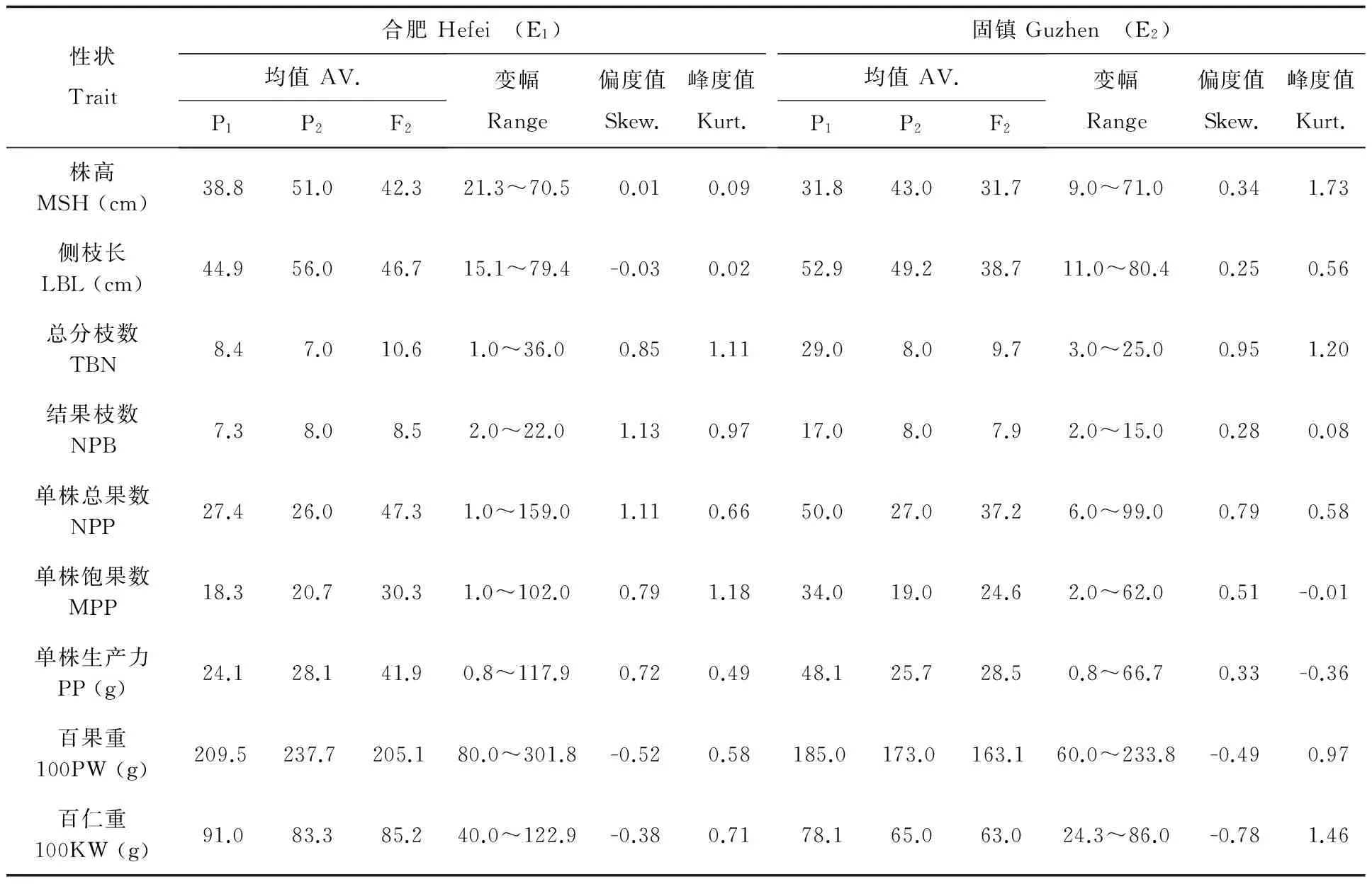
表 1 远杂9102/皖花4号F2群体2个环境下9个农艺性状的表型分布

表 2 9个农艺性状最适模型配合表型分布的极大似然函数值和AIC值 (IECM算法)
应用与处理主茎高性状相同的方法,选择2个环境下其他8个农艺性状的最适遗传模型。发现侧枝长、百果重和百仁重3个性状在2个环境下的最适模型表现相同,均为2MG-EEAD,说明这3个性状均受2对主基因控制,主基因表现为等显性效应。总分枝数性状在2个环境下的最适模型一致,均为2MG-AD,说明总分枝数性状受2对主基因控制,主基因表现为加性—显性效应。结果枝数性状在2个环境下的最适模型一致,均为1MG-AD,说明结果枝数性状受1对主基因控制,主基因表现为加性—显性效应。单株总果数和单株生产力性状在E1中的最适模型均为2MG-AD,说明E1中这2个性状均表现出受2对加性—显性主基因控制;E2中2个性状的最适模型均为1MG-AD,说明E2中这2个性状均表现为受1对加性—显性主基因控制。单株饱果数性状在E1中的最适模型为2MG-ADI,说明单株饱果数性状在E1中表现出受2对加性—显性—上位性主基因控制;E2中的最适模型为1MG-AD,说明该性状在E2中表现出受1对加性—显性主基因控制。
2.3 2个环境下9个农艺性状的遗传参数估计
从表3中的一阶参数可以看出,E1中株高性状的|[da(d)]|+|[db]|=10.00,|[ha(h)]|+|[hb]|=10.01,|i|+|jab|+|jba|+|l|=15.02,说明E1中控制株高性状的2对主基因的上位性效应大于其加性效应和显性效应;E2中只检测到控制株高性状的主基因的加性效应,说明E2中株高性状以加性效应为主;2个环境中的侧枝长、百果重和百仁重3个性状均只检测到加性效应,说明这3个性状以加性效应遗传为主;而对于总分枝数、结果枝数、单株总果数和单株生产力4个性状来说,2个环境中各性状的|[da(d)]|与|[ha(h)]|或|[da(d)]|+|[db]|与|[ha(h)]|+|[hb]|之和基本接近,说明这4个性状以加性和显性效应遗传并重;E1中单株饱果数性状的|[da(d)]|+|[db]|=26.78,|[ha(h)]|+|[hb]|=29.35,|i|+|jab|+|jba|+|l|=32.93,说明E1中该性状受上位性、加性和显性效应共同控制,E2中|[da(d)]|与|[ha(h)]|效应值分别为10.19和10.00,说明该性状受加性和显性效应共同控制。
从表3中的二阶参数来看,主茎高性状在2个环境中的主基因遗传率分别为18.37%(E1)和8.13%(E2);侧枝长性状在2个环境中的主基因遗传率分别为9.15%(E1)和7.11%(E2);说明这2个性状受微效基因或环境的影响较大。总分枝数、单株总果数和单株饱果数3个性状在2个环境中的主基因遗传率均大于50%,说明这3个性状以主基因遗传为主,遗传较为稳定。而对于结果枝数、单株生产力、百果重和百仁重4个性状来说,2个环境中的主基因遗传率介于37.26%和58.88%之间,说明这4个性状主基因遗传占较大比重,同时也受到微效基因或环境一定的影响。

表 3 远杂9102/皖花4号F2群体9个农艺性状遗传参数的估计值


3 讨论与结论
本研究利用远杂9102/皖花4号F2群体对2个环境中9个农艺性状进行了主基因+多基因遗传分析,发现2个环境中的侧枝长、总分枝数、结果枝数、百果重和百仁重5个性状的最适模型一致;其中侧枝长、百果重和百仁重3个性状均表现为受2对等显性主基因控制,总分枝数和结果枝数性状分别表现出受2对和1对加性—显性主基因控制。而主茎高、单株结果数、单株总果数和单株生产力4个性状在2个环境中的遗传模型不一致,其中主茎高2个环境中均受2对主基因控制,但E1中2对主基因表现为加性—显性—上位性,而在E2中表现为等显性;E1中单株结果数性状表现出受2对加性—显性—上位性主基因控制,而在E2中则表现为受1对加性—显性主基因控制;E1中的单株总果数和单株生产力性状均表现出受2对加性—显性主基因控制,而E2中则表现为受1对加性—显性主基因控制。
笔者前期[14]曾以本研究中的P1、P2、F1和F24个世代为研究对象,利用主基因+多基因混合遗传模型中的SEA-G4F2模型对单个环境中的主茎高、侧枝长、总分枝数和结果枝数4个性状进行了遗传分析,发现这4个性状均受2对主基因+多基因控制,其中除控制结果枝数性状的2对主基因表现为加性效应外,其余控制3个性状的主基因均表现为等显性效应。这与本文的结果既有相同点也有差异,相同的是两者均认为主茎高、侧枝长和总分枝数受2对主基因控制,且控制侧枝长的2对主基因表现为等显性效应,这可能与研究对象的来源相同有关;不同的是本研究对2个环境中的9个花生农艺性状进行遗传分析时均没有检测到多基因效应,这可能与不同研究采用不同的遗传模型进行分析有关。
从与前人利用不同的研究对象对花生农艺性状进行分析得出的结论比较来看,本文认为花生主茎高和侧枝长主基因遗传低,这与刘华等[12]利用主基因+多基因遗传模型对郑9001/郑8903RIL群体进行遗传分析得出的结论基本一致。而与张新友等[13]利用郑8903/豫花4号RIL群体对主茎高、结果枝数等10个农艺性状进行遗传分析的结果比较来看,2篇研究尽管在控制花生农艺性状的主基因数量上存在差异,但均认为控制花生农艺性状的基因存在主效位点。上述结果说明。花生农艺性状遗传关系复杂,对于同一个性状,不同研究者所用研究材料不同或相同材料不同世代所得出的研究结果也是不尽相同的。因此,育种实践中,育种者要根据不同的育种材料/组合的不同世代采用不同的育种方法对相关性状进行遗传改良,从而达到育种目标。
[1] 张晓杰,姜慧芳,任小平,等. 中国花生核心种质的主成分分析及相关分析[J] .中国油料作物学报,2009,31(3):298-304.
[2] 李清华,黄金堂,陈海玲. 花生数量性状的多元遗传分析[J] . 江西农业学报,2009,21(11):7-9.
[3] 殷冬梅,李拴柱,崔党群. 花生主要农艺性状的相关性及聚类分析[J]. 中国油料作物学报,2010,32(2):212-216.
[4] 华福平,李晓亮,张毅. 河南省夏播花生主要数量性状与产量的相关和通径分析[J]. 中国种业,2010 (4):42-44.
[5] 翟素琴,王建成,何燕,等. 花生主要农艺性状和产量的相关、回归与通径分析[J]. 河南职技师院学报,2001,29(2):12-14.
[6] 江建华,倪皖莉,于欢欢,等. 花生单株生产力与主要农艺性状间的相关性研究[J]. 中国农学通报,2013,29(36):125-130.
[7] 韩柱强,高国庆,周瑞阳,等. 高油酸花生种质油酸亚油酸含量的主基因+多基因遗传[J]. 中国油料作物学报,2010,32(2):196-201.
[8]ZhangXY,ZhuSJ,HanSY,etal.Inheritanceoffatandfattyacidcompositionsinpeanut[J].AgriculturalScience&Technology, 2011, 12(7):943-946,974.
[9] 黄冰艳,张新友,苗利娟,等. 花生油酸和亚油酸含量的遗传模式分析[J]. 中国农业科学,2012,45(4):617-624.
[10] 胡晓辉,苗华荣,杨伟强,等. 花生种子休眠性的遗传分析及影响因素的研究[J]. 核农学报,2013,27(10):1449-1455.
[11] 李兰周,刘风珍,万勇善,等. 花生荚果和籽仁相关性状的主基因+多基因混合遗传模型分析[J]. 华北农学报,2013,28(5):116-123.
[12] 刘华,张新友,韩锁义,等. 花生主茎高、侧枝长的遗传分析及QTL检测[J]. 中国油料作物学报,2013,35(5):508-514.
[13] 张新友. 栽培花生产量品质和抗病性的遗传分析与QTL定位研究[D]. 杭州:浙江大学研究生院,2010:76-77.
[14] 江建华,王嵩,汪清,等. 花生4个主要农艺性状的遗传分析[J]. 花生学报,2015,44(3):7-13.
[15] 姜慧芳,段乃雄. 花生种质资源描述规范和数据标准[M]. 北京:中国农业出版社,2006.
[16] 盖钧镒. 试验统计方法(第3版)[M]. 北京:中国农业出版社,2000:99-126,157-189.
[17] 曹锡文,刘兵,章元明. 植物数量性状分离分析Windows软件包SEA的研制[J]. 南京农业大学学报,2013,36(6):1-6.
Genetic Analysis of 9 Yield-related Peanut Agronomic Traits under 2 Environments
WANG Xiao-shuai1, LIANG Ming-lei2, HU Chang-min3,4,WANG Song4, NI Wan-li4, JIANG Jian-hua4*
(1.RuralTechnology,ScienceandEducationTrainingCenterofShandong,Jinan250013,China; 2.LiaochengAgriculturalCommittee,Liaocheng252000,China; 3.AnhuiAgr.Uni.,Hefei230031,China; 4.AnhuiAcademyofAgr.Sci.,Hefei230031,China)
Agronomic traits such as main stem height (MSH), lateral branch length (LBL), total branch number (TBN), No. of pod branches (NPB), pods per plant (NPP), mature pods per plant (MPP), productivity per plant (PP), 100-pod weight (100PW) and 100-kernel weight (100KW) are highly related to peanut yield. To offer useful information for breeding cultivars with high yield, 9 traits (MSH, LBL, TBN, NPB, NPP, MPP, PP, 100PW and 100KW) of Yuanza9102 (P1), Wanhua4 (P2) , 133 (Hefei, E1) F2lines and 151(Guzhen, E2) F2lines derived from the cross of P1×P2were analyzed with mixed major gene plus polygene inheritance model. Genetic analysis revealed that the MSH, LBL, TBN, 100PW and 100KW were controlled by 2 pair major genes under 2 environments. LBL, 100PW and 100KW were controlled by 2 major genes with equivalence dominant effects under 2 environments. TBN were controlled by 2 major genes with additive-dominant effects under 2 environments. MSH were controlled by 2 major genes with additive-dominant effects under E1and equivalence dominant effects under E2. NPB were controlled by 1 pair major genes with additive-dominant effects under 2 environments. NPP, MPP and PP were controlled by 2 pair major genes with additive-dominant effects under E1, while these 3 traits were controlled by 1 pair major genes with additive-dominant effects under E2.
peanut; agronomic traits; mixed major-gene plus polygenes inheritance model; genetic analysis
10.14001/j.issn.1002-4093.2016.02.002
2016-01-13
王晓帅(1983-),男,山东淄博人,山东省农村科技教育培训中心农艺师,硕士,主要从事农技推广工作。
*通讯作者:江建华(1981-),博士,主要从事分子遗传育种研究。E-mail: peanutlabjjh@163.com
S565.201; Q348
A

