基因组DNA去甲基化法改良蛹虫草菌株高产虫草素及性状稳定性评价
朱巍巍李莉陈飞李杨王艳华包永明
(1. 大连理工大学生命科学与技术学院,大连 116024;2. 辽宁省微生物科学研究院,朝阳 122000)
基因组DNA去甲基化法改良蛹虫草菌株高产虫草素及性状稳定性评价
朱巍巍1,2李莉2陈飞2李杨2王艳华2包永明1
(1. 大连理工大学生命科学与技术学院,大连 116024;2. 辽宁省微生物科学研究院,朝阳 122000)
基因组DNA去甲基化能够激活沉默基因,改变次级代谢产物谱,是一种全新的菌种改良途径。利用不同浓度的DNA甲基化酶抑制剂5-氮杂胞苷(5-azaC)处理蛹虫草菌株CM-L1,降低基因组DNA甲基化水平,高效液相色谱筛检得到改良株LB-C3和LD-A7,菌丝体中虫草素含量分别提升127%和144.3%。LD-A7不能形成子实体,推测与关键的DNA甲基化修饰作用被改变有关。经5次继代培养后,以虫草素含量为指标考察性状稳定性。随传代次数增加,基因组中甲基化的DNA含量增加,液体发酵菌丝体中的虫草素含量均显著降低,但是子实体中虫草素含量非常稳定,改良的菌株更适合栽培生产而非工业发酵。
DNA去甲基化;5-氮杂胞苷;蛹虫草;虫草素
蛹虫草(Cordyceps militaris)隶属于子囊菌亚门肉座菌目虫草科虫草属,又名北虫草、北冬虫夏草,与冬虫夏草(Cordyceps sinensis)同属异种[1],二者的主要成分[2]和功效[3]存在相似性。蛹虫草因能够大批量的人工栽培而广受关注,于2009年3月被卫生部批准为新资源食品[4]。虫草素(cordycepin)
作为蛹虫草中最重要的活性成分之一[5],早在1964年即有文献记录[6],生物活性的研究方向集中在抑菌、体外抗肿瘤、保护肝肾系统[7]和增强免疫力[8]作用。虽然蛹虫草已实现规模化栽培,但虫草素的单位产量仍然很低[9],稳定遗传的高产虫草素菌株是蛹虫草育种的追寻目标。
高产菌株的诱变和改良多采用物理、化学手段诱导菌株形成点突变累积或增加相关基因丰度,再筛选正向突变菌株,如离子束诱变[10]、复合诱变[11]、原生质体融合[12]等。表观遗传学技术的发展把非DNA序列改变的育种策略带入视野[13],通过改变基因组DNA甲基化水平对基因表达进行调控,是一种激活真菌沉默的次级代谢生物合成基因的有效手段。Williams等[14]采用5-氮杂胞苷(5-azaC)、5-氮杂-2-脱氧胞苷、普鲁卡因等DNA甲基化酶抑制剂对12种真菌进行遗传选育获得了新的代谢产物,且已知代谢产物的产量也有所提升,但是对大型真菌基因组去甲基化育种未见报道。本研究使用DNA甲基化酶抑制剂5-azaC处理蛹虫草菌株,降低基因组DNA甲基化水平释放相关基因高表达以提升虫草素产量,旨为构造高产菌株提供新的途径。
1 材料与方法
1.1 材料
1.1.1 供试菌株与培养基 蛹虫草菌株CM-L1分离自辽西地区人工栽培蛹虫草。CPDA培养基:马铃薯200.0 g煮沸取滤液,葡萄糖20.0 g,蛋白胨5.0 g,牛肉膏1.0 g,KH2PO41.0 g,K2HPO40.5 g,琼脂16.0 g,水1 000 mL,pH值自然。
液体发酵培养基:蔗糖10.0 g,葡萄糖5.0 g,蛋白胨5.0 g,牛肉膏2.0 g,KH2PO41.0 g,K2HPO40.5 g,MgSO40.5 g,VB1 10.0 mg,水1 000 mL,pH值自然。
麦粒虫草瓶:550 mL培养瓶加小麦麦粒30.0 g,水50 mL,1% KH2PO40.5 g,MgSO40.5 g,121℃灭菌30 min。
1.1.2 试剂与仪器设备 SPX-450型生化培养箱(中仪国科);KQ-50DA型数控超声仪(昆山超声);SPH-2012生化摇床(上海世平);LHH.CP-505-Q大型人工气候箱(上海印溪);3K15高速冷冻离心机(SIGMA,德国);Waters e2695 高效液相色谱(Waters,美国);Waters 2489紫外检测器(Waters,美国);Multiskan GO 全波长酶标仪(ThermoFisher,美国);DYY-6型电泳仪(北京六一)等。
真菌基因组DNA提取试剂盒(#GD2416-01,BIOMIGA);比色法DNA甲基化定量试剂盒(#P-1034,EPIGENTEK),检测限0.2 ng甲基化DNA。
蔗糖、葡萄糖、蛋白胨、牛肉膏、KH2PO4、K2HPO4、MgSO4、5-azaC、二甲基亚砜均为国产分析纯,VB1为国产生化试剂,色谱纯甲醇(#A456-4,Thermo Fisher),虫草素标准品购自中国食品药品检定研究院(#110858),纯度以95.5%计。
1.2 方法
1.2.1 菌株处理 5-azaC用二甲基亚砜预溶,经0.22 μm滤膜过滤除菌,加入无菌水配制成10.0 μmol/L溶液,以2倍梯度逐级稀释成5.0、2.5、1.25、0.63、0.31及0.16 μmol/L溶液,每浓度取100 μL均匀涂布平皿后接种菌块,根据菌丝生长抑制情况测定最小抑菌浓度(MIC)。
使用90 mm平皿制作同心环诱变平板[15],中心环使用CPDA培养基,外环使用混入5-azaC的CPDA铺制,终浓度分别为0.01×MIC、0.1×MIC、0.5×MIC、MIC,CM-L1菌株接种后置培养箱中20℃暗培养。高浓度抑制明显区域在菌丝生长点取样,低浓度无明显抑制区域随机取样进行筛检,按取样位置5-azaC的浓度由低到高顺序编号LA-##、LB-##、LC-##、LD-##予以区分。
取直径2-4 mm接种块回接CPDA平皿,20℃暗培养至菌丝长满。刮取菌丝液氮研磨破碎,称取100.0 mg菌粉加入1 mL 纯水超声浸提30 min,10 000 r/min离心10 min 取上清进行液相色谱分析。
1.2.2 虫草素定量 高效液相色谱法检测虫草素含量[16],色谱柱Symmetry C18(3.9×150 mm),柱温30℃,流动相甲醇∶水(15∶85,V/V),上样量5 μL,流速1 mL/min,紫外检测波长260 nm。
液体发酵采用500 mL三角瓶加入150 mL培养基,转速150 r/min,20℃避光培养[17],每日测定生物量及菌丝体中虫草素含量,确定菌丝体中虫草素含量检测时间点。
菌丝体60℃烘干至恒重,研磨破碎,取100.0
mg加入1 mL 纯水超声浸提50 min,10 000 r/min离心10 min,取上清液定容至10 mL,0.22 μm滤膜过滤后进行液相色谱分析。每个样本设置3个重复。
子实体60℃烘干研磨破碎,取样品1.0 g加入25 mL纯水超声浸提50 min,10 000 r/min离心10 min,取上清定容至100 mL,0.22 μm滤膜过滤进行液相色谱分析。每个样本设置3个重复。
1.2.3 子实体形成能力验证 待验证菌株接种至麦粒虫草瓶,每株接种6瓶,20℃暗培养至菌丝长透,相对湿度65%-70%。转色期光照强度200-300 lx,培养温度20℃,每日给予12℃低温刺激6 h,相对湿度70%-75%。原基形成后光照强度100-200 lx,培养温度18℃,相对湿度85%-90%。
1.2.4 性状稳定性研究 菌株分别接种CPDA试管(20×200 mm)斜面,20℃暗培养12 d后转管继代,连续传代5次,考察各代次液体发酵菌丝体及子实体中虫草素的含量,以虫草素含量变化为指标评价该性状稳定性,采用SPSS软件进行显著性差异分析。
使用真菌基因组DNA提取试剂盒提取gDNA,电泳检测完整性,测定OD值检测纯度及含量,使用DNA甲基化定量试剂盒跟踪检测甲基化水平。
2 结果
2.1 筛检结果统计
5-azaC 对菌株CM-L1菌丝的MIC为2.5 μmol/L,实验共挑取5-azaC处理样本207株,经高效液相色谱筛检,其中虫草素含量增加10%-50%的正突变株43株,增加50%-100%的正突变株8株,增加一倍以上的正突变株有2株,LB-C3和LD-A7(图1)。虫草素含量减少10%以上的负突变株14株,未发现含量减少50%以上的负突变株。虫草素含量提升50%以上菌株筛检统计结果,见表1。
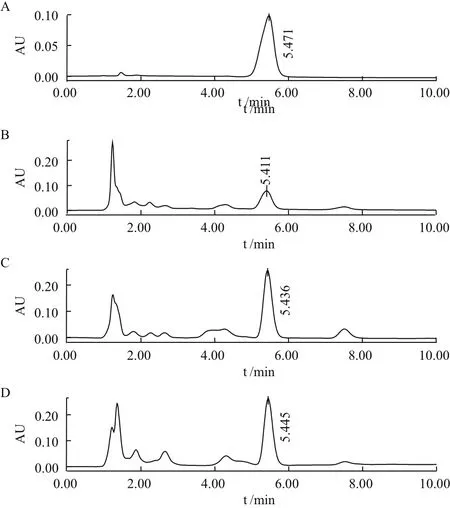
图1 虫草素高产菌株液相色谱筛检图
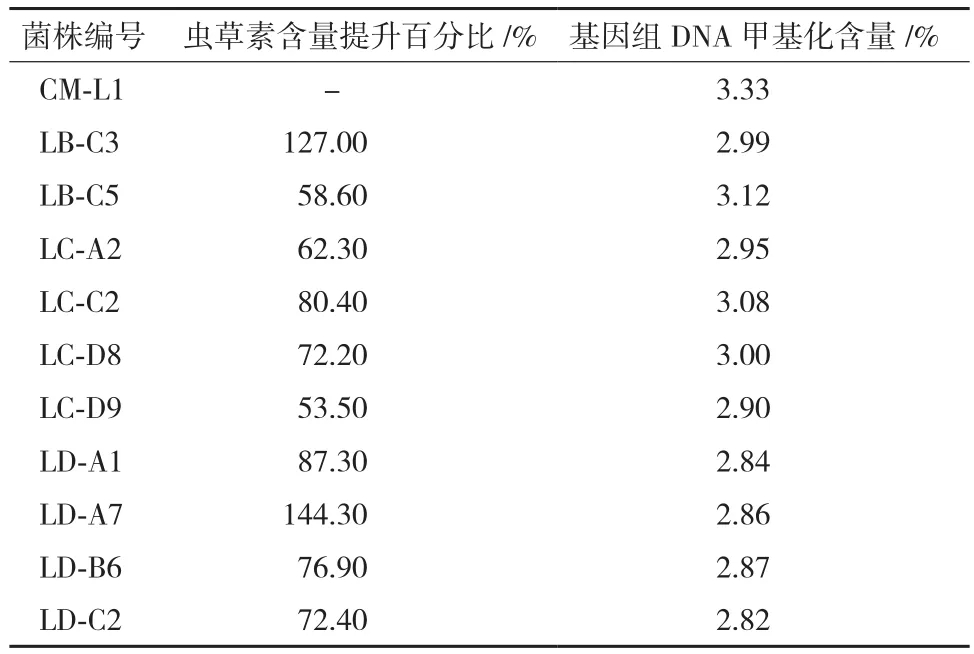
表1 虫草素含量提升>50%的菌株筛检结果
2.2 子实体形成能力验证
LB-C3、LD-A7和CM-L1接种至麦粒瓶平行培养,45 d后CM-L1和LB-C3子实体发育正常,长势同步;LD-A7仅见菌丝转色,无子实体分化(图2),继续培养至60 d后菌丝老化渗液,终止培养。
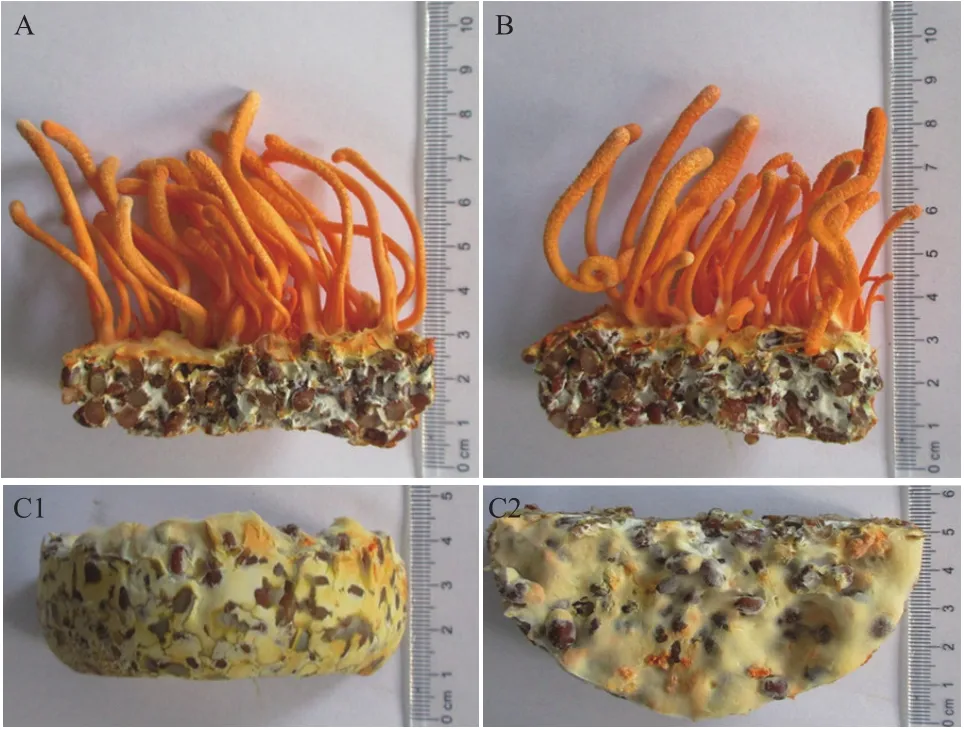
图2 虫草子实体结实性验证
2.3 性状稳定性评价
基因组DNA甲基化水平定义为5-甲基胞嘧啶(5-mC)和5-羟甲基胞嘧啶(5-hmC)在基因组中所占百分比。出发菌株CM-L1基因组甲基化水平在3次继代培养情况下相对稳定,但是继续传代会导致甲基化DNA增加,经5-azaC处理后基因组DNA甲基化水平下降,而当环境中的5-azaC消失后,LB-C3和LD-A7的基因组DNA甲基化水平随继代培养逐步恢复(图3)。

图3 继代培养后基因组DNA甲基化含量变化
蛹虫草液体发酵过程中,虫草素累积过程与生物量变化曲线趋于一致,二者几乎同时进入平台期
(图4)。LD-A7进入对数生长期的速度滞后,且最终菌丝生物量也偏低。三株菌10 d均进入平台期,虫草素含量与最终测定值接近,故菌株遗传稳定性考察设第10天采样。

图4 液体发酵过程中生物量(A)及虫草素含量(B)变化曲线
连续继代培养5次后,不同传代次数菌株液体发酵法菌丝体中虫草素含量出现显著性差异(P<0.05)。出发菌株CM-L1同样存在虫草素产量下降的问题,5-azaC处理株继代培养3次后显著下降(图5),但是虫草素含量仍较出发菌株增加一倍以上。

图5 继代培养次数对菌丝体中虫草素含量的影响
平行栽培试验测定子实体中虫草素含量,结果显示各代次之间虫草素含量差异无统计学意义(P>0.05),且同一代次间各样本的离散程度也比较低(图6)。虫草子实体的状态比较稳定,子实体生物学效率均可达到90%(P>0.05),即每栽培瓶30 g干麦粒均可收获新鲜虫草子实体27 g以上。
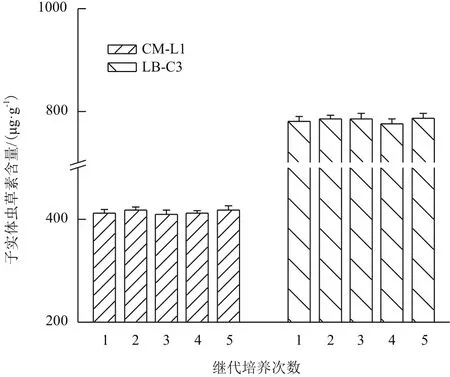
图6 继代培养次数对子实体中虫草素含量的影响
3 讨论
DNA甲基化是真核生物中非常重要的一种表观遗传学标记,虽然不改变基因的序列,却能调控基因的转录,对基因的表达起到促进或抑制的作用[18]。
5-azaC与DNA甲基转移酶(DNA methyltransferase,DNMT)具有很强的结合力,竞争性抑制DNMT活性,能够改变生物体基因组的甲基化状态,从而改变次级代谢产物谱。虫草素在蛹虫草中的生物合成途径尚不明确,但是通过基因组DNA去甲基化手段改良菌株很容易获得高产株,使用5-azaC处理后改良株的正突变率达到25.6%,其中 LB-C3和LD-A7的菌丝体中虫草素含量较出发菌株CM-L1分别提升127%和144.3%。虽然基因组DNA甲基化水平与虫草素含量存在关联,但二者并未呈现负相关性。LD-A7菌株子实体发育异常推测与基因组DNA甲基化修饰作用被改变有关,具体原因尚待进一步研究。除了目的物虫草素含量发生变化外,高效液相色谱检测到某些未知组分也发生了变化,这些变化的未知组分可能会成为功能性研究的宝藏。
如何以DNA甲基化作为契入点在基因组水平上标记、识别、控制优势性状,如何保持目标性状的稳定性,仍然是育种工作的难点[19]。性状稳定性受多因素共同调控,除了DNA序列的影响外,表观遗传修饰在环境与性状之间建立起纽带,即生物体对环境的适应和调整可以通过DNA甲基化形式记录在基因组中遗传下去[20]。无论是出发菌株还是改良株,在限定的培养条件下,随着继代培养次数增加基因组中甲基化的DNA都呈增加趋势,说明有自发甲基化不断形成,同时菌丝体虫草素含量降低,改良株尤其明显。继代培养对子实体中虫草素含量变化影响很小,可能是因为子实体发育阶段依靠基内菌丝传递营养物质维持生长,子实体并不直接参与,且固体培养基不具备流动性降低菌丝个体与环境交换的速率,有助于保持稳定;而菌丝体液体发酵过程中,每个菌丝体都持续与环境发生物质、能量交换,个体间基因组DNA甲基化水平分歧度比较高,具体表现为同一发酵批次样品离散度高和各发酵批次间的产量不稳定。5-azaC处理得到的高产菌株虽然在液体发酵过程性状稳定性有欠缺,但是较高的正突变率和相对稳定的子实体特性能够弥补这种缺憾。
4 结论
使用DNA甲基化酶抑制剂5-azaC处理蛹虫草菌株,降低基因组中DNA甲基化水平以提升虫草素含量,正突变率较高,但是对蛹虫草子实体的形成存在影响。连续继代培养后液体发酵菌丝体中的虫草素含量显著降低,子实体中虫草素含量非常稳定,经改良的菌株更适合栽培生产而非工业发酵。
[1]黄年来, 林志彬, 陈国良, 等. 中国食药用菌学[M]. 上海:上海科学技术文献出版社, 2010:1763.
[2]王志兵, 张洪玉, 刘洋, 等. 基质固相分散-高效液相色谱法同时测定冬虫夏草和蛹虫草中的9种核苷及碱基[J]. 食品工业科技, 2014, 35(4):83-87.
[3]王晓彤, 孙淑军, 房军伟. 简述蛹虫草与冬虫夏草异同[J].辽宁中医药大学学报, 2014(4):165-169.
[4] 中华人民共和国国家卫生和计划生育委员会. 卫生部关于批准蛹虫草为新资源食品的公告(2009年第3号)[Z/OL]. http:// www.moh.gov.cn/zhuzhan/gonggao/201304/e44ed1e230a244528faf8 181fc5c0b1c.shtml, 2009-03-18.
[5] 刘桂君, 周思静, 杨素玲, 等. 蛹虫草中虫草素的研究进展[J].食品科学, 2013, 34(21):408-413.
[6] Kaczka EA, Trenner NR, Arison B, et al. Identification of cordycepin, a metabolite of Cordyceps militaris, as 3’-deoxyadenosine[J]. Biochemical and Biophysical Research Communications, 1964, 14:456-457.
[7]曾宏彬, 宋斌, 李泰辉. 蛹虫草研究进展及其产业化前景[J].食用菌学报, 2011, 18(2):70-74.
[8]Zhu SJ, Pan J, Zhao B, et al. Comparisons on enhancing the immunity of fresh and dry Cordyceps militaris in vivo and in vitro[J]. Journal of Ethnopharmacology, 2013, 149(3):713-719.
[9]杨涛, 董彩虹. 虫草素的研究开发现状与思考[J]. 菌物学报, 2011, 30(2):180-190.
[10]Das SK, Masuda M, Hatashita M, et al. A new approach for improving cordycepin productivity in surface liquid culture of Cordyceps militaris using high-energy ion beam irradiation[J]. Letters in Applied Microbiology, 2009, 47(6):534-538.
[11]孟泽彬, 文庭池, 康冀川, 等. 蛹虫草高产胞外虫草素和虫草多糖的诱变育种[J]. 中国酿造, 2012, 31(7):57-61.
[12]周洪英, 边银丙. 蛹虫草虫草素高产原生质体融合子鉴定与筛选[J]. 食用菌学报, 2007, 14(2):65-70.
[13]赵文婷, 邹懿, 胡昌华. 微生物菌种改良的新方法新策略[J].生物工程学报, 2009, 25(6):801-805.
[14]Williams RB, Henrikson JC, Hoover AR, et al. Epigenetic remodeling of the fungal secondary metabolome. [J]. Organic & Biomolecular Chemistry, 2008, 6(11):1895-1897.
[15]朱巍巍, 李莉, 池景良, 等. 一种大型真菌去甲基化育种方法及装置:中国, ZL 2013 1 0377815. 7[P]. 2015-04-01.
[16]黄丽俊, 李利东, 宓晓黎. 高效液相色谱法同时检测虫草制品中腺苷和虫草素含量的研究[J]. 农学学报, 2015(5):25-28.
[17]罗巍, 刘东波, 吴郑武, 等. 蛹虫草液态发酵过程中有效成分的动态积累变化[J]. 食品与发酵工业, 2011, 37(10):96-99.
[18] 王瑞娴, 徐建红. 基因组DNA甲基化及组蛋白甲基化[J].遗传, 2014, 36(3):191-199.
[19]徐青, 余云舟, 赵萌, 等. DNA甲基化在动植物遗传育种中的研究进展[J]. 生物技术通讯, 2011, 22(1):113-117.
[20]Zhang TY, Meaney MJ. Epigenetics and the environmental regulation of the genome and its function[J]. Annual Review of Psychology, 2010, 61(1):439-466.
(责任编辑 马鑫)
Enhanced Cordycepin Production of Cordyceps militaris by Genomic DNA Demethylation and the Evaluation of Its Stability
ZHU Wei-wei1,2LI Li2CHEN Fei2LI Yang2WANG Yan-hua2BAO Yong-ming1
(1. School of Life Science and Biotechnology,Dalian University of Technology,Dalian 116024;2. Liaoning Research Institute of Microbiology,Chaoyang 122000)
Genomic DNA demethylation may activate silenced gene,which alters secondary metabolite spectrum,and therefore it is a completely novel approach for strain improvement. Using different concentrations of DNA methyltransferase inhibitor 5-azacytidine(5-azaC)to treat the Cordyceps militaris CM-L1,then the genomic DNA methylation level reduced. Further,the improved strains LB-C3 and LD-A7 were acquired by screening with high performance liquid chromatography,and in which the contents of cordycepin in mycelium increased by 127% and 144.3% respectively. LD-A7 could not form a fruiting body,which was speculated to be related to the role of DNA methylation changed. The stability was investigated after 5 times subculture using the content of cordycepin as an indicator. With the subculture times increased,the methylated DNA in the genome increased,and the cordycepin in mycelium of liquid fermentation significantly decreased;however,the content of cordycepin in fruiting bodies was very stable,indicating that improved strains were better suited to the cultivation rather than production in industrial fermentation.
DNA demethylation;5-azaC;Cordyceps militaris;Cordycepin
10.13560/j.cnki.biotech.bull.1985.2016.12.009
2016-04-11
辽宁省农业公关及产业化项目(2015209002),辽宁省农业领域重点培养青年人才项目(2014034)
朱巍巍,男,博士研究生,研究方向:食用菌育种及标准化栽培;E-mail:zhuweiwei@vip.163.com
包永明,男,博士,教授,博士生导师,研究方向:蛋白质及酶工程、生物催化与转化、药物化学及药理;E-mail:biosci@dlut.edu.cn

