DEHP暴露对鲤鱼肾脑生物标志物的影响
吴红松
菏泽学院 生命科学系,菏泽 274015
DEHP暴露对鲤鱼肾脑生物标志物的影响
吴红松
菏泽学院 生命科学系,菏泽 274015
为探讨邻苯二甲酸二乙基己酯(DEHP)对鱼类肾、脑组织生物标志物的影响,将鲤鱼分别在浓度为5、20、80、160 mg·L-1的DEHP水体,暴露20 d,以水和吐温-80为对照,测定肾脑组织中多种酶活性和丙二醛(MDA)含量的变化。结果表明:与水对照组相比,吐温-80组所测各项指标,差异均不显著。与水和吐温-80对照组相比,各染毒组,肾脏中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和抗羟自由基、抗超氧阴离子的活力均显著降低(P< 0.05或P< 0.01)。谷胱甘肽过氧化物酶(GSH-Px)酶活性呈现先升高后降低,在5、20、80 mg·L-1浓度组显著升高(P<0.05)。丙二醛(MDA)含量在80、160 mg·L-1浓度下,显著升高(P<0.05), 但脑组织中变化不显著。脑中一氧化氮合酶(NOS)在各浓度组显著升高(P<0.05或P<0.01);乙酰胆碱酯酶(AChE)在80、160 mg·L-1时降低显著(P< 0.05);钙调神经磷酸酶(CaN)呈先升高后降低的趋势,在20 mg·L-1下,升高显著(P< 0.01),在80、160 mg·L-1浓度组,降低极显著(P<0.01);抗羟自由基、抗超氧阴离子活性均显著下降(P<0.05或P<0.01)。可见,在实验浓度范围内,DEHP对鲤鱼具有一定免疫毒性和神经毒性,进一步的机理有待研究。
邻苯二甲酸二乙基己酯;鲤鱼;肾;脑;生物标志物;免疫毒性;神经毒性
邻苯二甲酸二乙基己酯(DEHP)全球年产量达300~400万吨[1]。广泛存在于各种PVC塑料制品中,如食品包装材料、儿童玩具、吸管等[2-3]。为主要聚氯乙烯(PVC)塑料增塑剂,用于提高塑料的可塑性和易弯曲性[4]。DEHP与塑料分子间以氢键或范德华力结合不牢固,易释放入大气、食品、饮用水及其他物质中造成污染[5-6]。美国、中国已先后将其列为优先控制的污染物[7]。
2014年12月12日,欧盟化学品管理局(ECHA)宣布DEHP为一种广泛使用的环境内分泌干扰物,会干扰机体激素的合成、代谢、活动等过程,影响自身生殖发育、神经和免疫等功能。目前对于DEHP的生殖遗传毒性[8-9]、心脏毒性[10-11]、肝脏毒性[12-13]等方面都有了相关报道,发现DEHP及其代谢产物MEHP可提前启动雄性小鼠生殖细胞的凋亡,从而导致睾丸萎缩[8],引起生殖系统紊乱,降低繁殖率[9];诱导肝细胞毒性[13],明显提高大、小鼠肝细胞癌发生率[12];引发大鼠血压升高,心脏、呼吸骤停等症状[11]。可抑制小锵鱼心率[10],促进雌性青鳉卵母细胞的发育[14],并引发鱼类肝损伤[14-15],造成金鲫鱼肾、脑组织脂质过氧化[16],并具有生殖毒性、神经毒性[17],对斑马鱼胚胎具有致死毒性和发育毒性[18];并诱导果蝇脑组织基因呈现差异表达等[19]。但对于DEHP对鲤鱼肾脑毒性相关报道较少。
环境胁迫,可引起免疫系统中相关酶活性和含量发生敏锐的变化,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、抗羟自由基、抗超氧阴离子活性、MDA含量都与机体抗氧化防御系统密切相关[20]。一氧化氮合酶(NOS)、乙酰胆碱酯酶(AChE)、钙调神经磷酸酶(CaN)活性和丙二醛(MDA)含量的改变,可作为指示环境中污染物胁迫对脑组织损伤的指标[21-25]。本文通过研究DEHP暴露对鲤鱼肾脑组织中生物标志物的影响,探讨DEHP对鱼类抗氧化系统和神经系统的影响,以期为DEHP的环境安全性评价和生物标志物筛选提供参考。
1 材料与方法 (Materials and methods)
1.1 实验动物
鲤鱼 (Cyprinus carpio Linnaeus),购买自菏泽市牡丹区养殖场,质量(62.74±4.16) g,体长(13.81±0.94) cm,在室温条件下驯养2周(驯养期间无死亡)。
1.2 仪器及主要试剂
主要试剂:邻苯二甲酸二乙基己酯(DEHP)、吐温-80均为天津市光复精细化工研究所分析纯试剂。
实验仪器:低温冷冻离心机(Eppendorf—5417R)、荧光分光光度计(日立F-4500)、自制玻璃缸(120 cm×80 cm×60 cm)等。
1.3 实验方法
实验设置水、吐温-80(80 mg·L-1) 2个对照组,DEHP用80 mg·L-1吐温-80助溶后(参照中国药典CP2005),设5、20、80、160 mg·L-14个染毒组,每组设3个平行,每个缸内处理液100 L,鲤鱼36尾。每天8时投喂1次,每2 天用已配制稀释的DEHP换掉缸内三分之一的处理液,水均为曝气2 d以上的自来水(T=13 ℃~17 ℃;OD>6 mg·L-1;pH=6.8~7.2),充氧过滤泵持续充氧,水质符合中国渔业水质标准(GB 11607-89),浸泡染毒20 d。
1.4 酶液的提取
染毒20 d后,随机从每组取鲤鱼6尾擦干、解剖,分离出肾脏、脑称重。按m (g):v (mL)=1:5的组织质量与0.65%的生理盐水体积之比混合,置于冰水中匀浆,在4 ℃,5 000 r·min-1,离心15 min,取上清,4 ℃冰箱保存备用,24 h内测定完。
1.5 酶活性的测定
SOD、CAT、GSH-Px、NOS、AChE、CaN、抑制羟自由基、抗超氧阴离子自由基的活性和MDA、组织蛋白含量的测定,均采用南京建成生物工程研究所提供的试剂盒,按照试剂盒说明操作,利用紫外分光法测出吸光值,根据公式计算出各样本的酶活和MDA、组织蛋白含量。
1.5.1 SOD活力测定
1.5.2 CAT活力测定
在一定条件下CAT可以分解底物过氧化氢(H2O2),使H2O2在反应体系中的浓度逐渐降低,吸光度也逐渐降低,240 nm处测定光吸收值,计算出酶活力。酶活力定义为:在一定的反应体系中,1 s中CAT分解吸光度为0.50~0.55的底物中的H2O2的摩尔量即为一个CAT的酶活单位。
1.5.3 GSH-Px活力测定
GSH-Px可以促进过氧化氢与还原型谷胱甘肽(GSH)反应生成H2O及氧化型谷胱甘肽,GSH-Px的活力以催化GSH的反应速度来表示,以412 nm下的光密度值计算酶活性。酶活力定义为:每毫克蛋白,每分钟扣除非酶反应的作用,使反应体系中GSH浓度降低1 μmol·L-1为1个酶活力单位。
1.5.4 MDA含量测定
用TAB法,在532 nm处进行比色测定。单位为nmol·mg prot-1。
1.5.5 抗超氧阴离子自由基能力测定

1.5.6 抑制羟自由基能力测定
H2O2的量和Fenton反应产生的·OH-量成正比关系,当给予电子受体后,用gress试剂显色,形成红色物质,其呈色与·OH-的多少成比例关系,在550 nm处进行比色测定。酶活力定义为:每毫克组织蛋白在37 ℃下反应1 min,使反应体系中H2O2的浓度降低1 mmol·L-1为1个抑制羟自由基能力单位。
1.5.7 一氧化氮合酶(NOS)活性测定
NOS催化L-Arg和分子氧反应生成NO,NO与亲核性物质生成有色化合物,在530 nm波长下测定吸光度,即可计算出NOS活力。酶活力定义为:每毫克组织蛋白每分钟生成1 nmol NO为1个酶活力单位。
1.5.8 AChE活力测定
乙酰胆碱酯酶水解乙酰胆碱生成胆碱及乙酸,胆碱可以与巯基显色剂反应生成TNB黄色化合物,根据颜色深浅进行比色定量,412 nm处测定吸光度。酶活力定义为:37 ℃每毫克组织蛋白在37 ℃保温6 min,水解反应体系中1 μmol基质为1个活力单位。
1.5.9 CaN活力测定
酶活力定义为:每小时每毫克蛋白的钙调神经磷酸酶分解底物PNPP产生1 μmol无机磷的量为1个CaN的活力单位。
1.5.10 蛋白质测定
用考马斯亮蓝法,蛋白质测定结果用于酶活性计算。
1.6 数据处理
求出各实验数据平均值±标准差(n=6)。并利用SPSS软件,在2个对照组之间,2个对照组和4个实验组间进行单因素方差分析(ANOVA),两两比较采用最小显著差数法(LSD),取显著性水平0.05为差异显著,0.01为差异极显著。
2 结果(Results)
2.1 DEHP对鲤鱼肾脏中生物标志物的影响
从图1、2可以看出,与空白对照组相比,吐温80对照组SOD、CAT、GSH-Px、抗羟自由基、抗超氧阴离子的活力和MDA 含量都变化不显著,可见吐温80的添加对鲤鱼肾脏中6种生物标志物的影响可以忽略。与对照组相比,鲤鱼肾脏中SOD、CAT酶活性和抗羟自由基、抗超氧阴离子的活力都明显地受到DEHP抑制。SOD酶活性情况:在DEHP各染毒组浓度下,都表现为显著下降(P<0.05)。CAT酶活性情况:5 mg·L-1浓度组表现为受诱导,升高不显著;在20、80、160 mg·L-1浓度下,均被抑制,最小值降低了77.7%,且80、160 mg·L-1浓度下下降极为显著(P<0.01)。抑制羟自由基活力:各染毒组随着DEHP浓度的增加而不断降低,均被抑制,且降低显著(P<0.05)。抗超氧阴离子活力:5 mg·L-1浓度组被抑制,下降不显著;20、80、160 mg·L-1各浓度组均被显著抑制(P<0.05),且在80、160 mg·L-1浓度下,下降极为显著(P<0.01),最小值降低了89.8%。GSH-Px酶活性在各染毒组随着DEHP浓度的升高表现为先升高后降低。5 mg·L-1浓度组被诱导达到最大值113.6 U·mg·prot-1,差异显著(P<0.05),20、80 mg·L-1浓度组均被显著诱导(P<0.05),在160 mg·L-1浓度下被抑制,但降低不显著。鲤鱼肾脏组织MDA含量在DEHP胁迫下表现为逐渐升高。5、20 mg·L-1浓度组的变化与对照差异不显著;在80、160 mg·L-1浓度下,升高显著(P<0.05),分别升高了33.0%、76.9%。

图1 不同浓度的DEHP 对鲤鱼肾脏中SOD、CAT、GSH-Px、抗羟自由基、抗超氧阴离子活性的影响 注:与水对照组相比,a表示差异显著(P<0.05),A表示差异极显著(P<0.01);与吐温80组相比,b表示差异显著(P<0.05),B表示差异极显著(P<0.01);浓度单位为mg·L-1;下同。Fig. 1 Effect of different concentration of DEHP on the activities of SOD, CAT, GSH-Px, resisting superoxide anion ) and scavenging hydroxyl free radical (·OH-) in kidney of carp Note: Compared with the water control, “a” represents significant difference (P<0.05), “A” represent extremely significant difference (P<0.01); Compared with the tween-80 group, “b” represents significant difference (P<0.05), “B” represent extremely significant difference(P<0.01); the concentration unit is mg·L-1; The same applies bellow.

图2 不同浓度的DEHP 对鲤鱼肾脏中MDA含量的影响Fig. 2 Effect of different concentration of DEHP on the content of MDA of kidney in carp
2.2 DEHP对鲤鱼脑组织中生物标志物的影响
如图3、4、5所示,与空白对照组相比,吐温80对照组NOS、CaN、AChE、抗羟自由基、抗超氧阴离子活性和MDA含量均变化不显著,可见,添加吐温80对鲤鱼脑组织中6种生物标志物的影响可以忽略。与对照组相比,各染毒组NOS酶活性都明显地受到了DEHP诱导,且各组都升高显著(P<0.05)。AChE酶活性在各染毒组分别被抑制降低了31.8%、38.1%、40.6%、43.5%,在80、160 mg·L-1浓度组,表现为降低显著(P<0.05)。CaN酶活性与对照组相比表现为先受诱导升高后抑制降低。5 mg·L-1浓度组升高不显著;在20 mg·L-1浓度下,被诱导极显著(P<0.01),最大值达到0.647 U·mg·prot-1;在80、160 mg·L-1高浓度下,降低极显著(P<0.01)。鲤鱼脑组织中抑制羟自由基、抗超氧阴离子自由基活力变化与肾脏中的相似:各DEHP染毒组均被抑制,显著降低(P<0.05),且在160 mg·L-1浓度下,均下降极为显著(P<0.01),分别比对照组下降了38.7%、30.3%。在DEHP胁迫下鲤鱼脑组织MDA含量表现为升高,但与对照组相比,变化不显著(P>0.05),染毒组间差异也不明显(P>0.05)。肾脏组织中MDA 含量在80、160 mg·L-1下显著升高,可见在DEHP胁迫下脑组织受到的脂质过氧化作用不如肾脏组织明显,DEHP胁迫产生的氧自由基在脑组织内可被抗氧化防御酶体系有效的清除,鲤鱼正常代谢未受到严重影响。
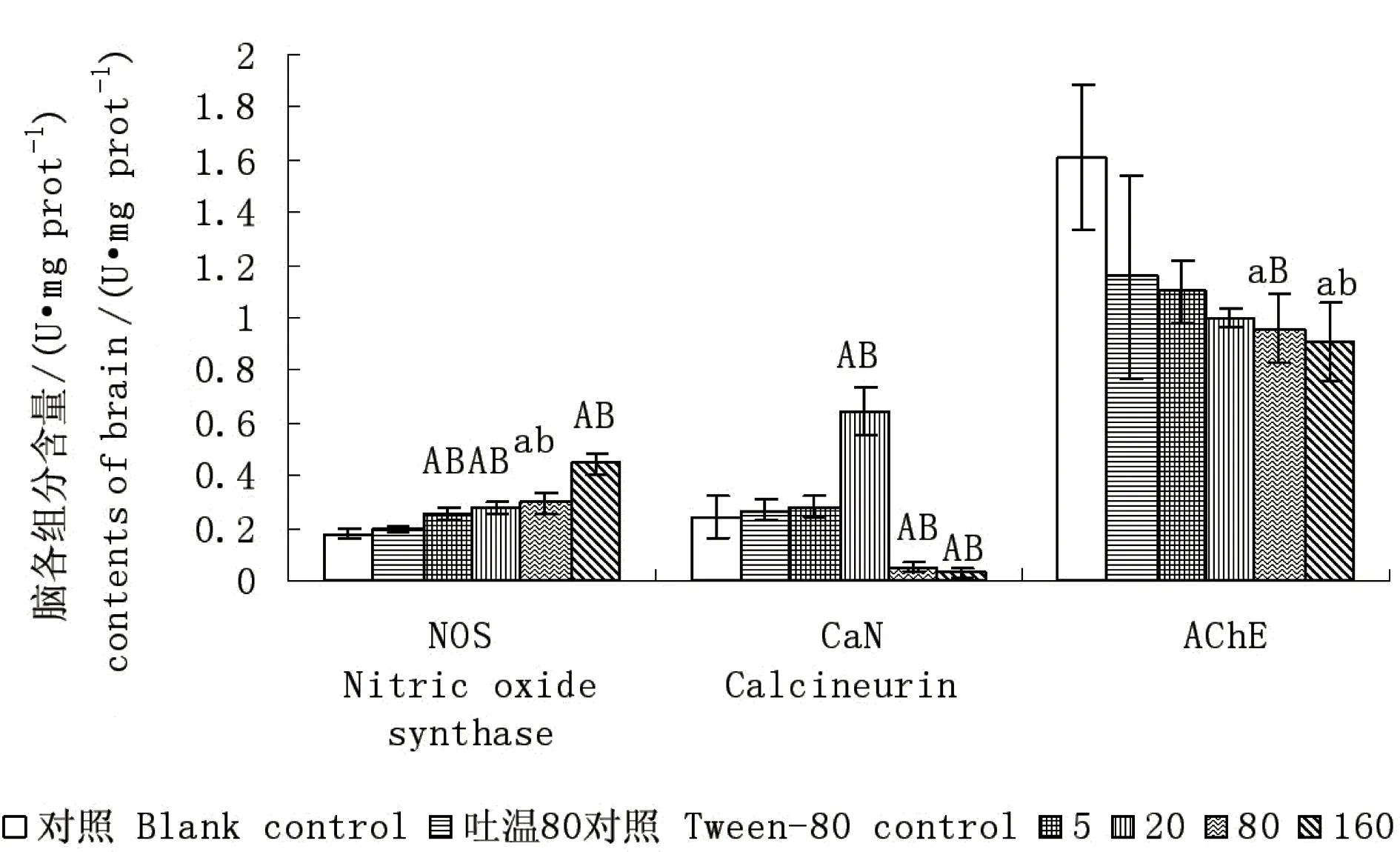
图3 不同浓度的DEHP对鲤鱼脑组织NOS、CaN、AChE活性的影响Fig. 3 Effect of different concentration of DEHP on the activities of NOS, CaN, AChE of brain in carp

图4 不同浓度的DEHP对鲤鱼脑组织抗羟自由基、抗超氧阴离子活性的影响Fig. 4 Effect of different concentration of DEHP on resisting superoxide anion ) and scavenging hydroxyl free radical (·OH-) activities of brain in carp

图5 不同浓度的DEHP对鲤鱼脑组织MDA含量的影响Fig. 5 Effect of different concentration of DEHP on the content of MDA in brain of carp
3 讨论(Discussion)
3.1 DEHP对鲤鱼肾脏的免疫毒性
污染物进入水生动物体内,能够直接或间接诱导产生活性氧自由基,主要包括超氧阴离子、羟自由基和过氧化氢等。在正常的生理条件下,生物体内产生的活性氧自由基在生物体内抗氧化防御系统控制下,浓度极低,且具有抗菌、消炎等作用。但在污染物刺激下,活性氧自由基可以快速增加,导致氧化应激和抗氧化防御间平衡失调,引起多种器官功能异常或组织病变。酶活性被认为是一种能够快速而灵敏地反映环境胁迫对生物体产生影响的生化指标[26]。

CAT在抗氧化防御系统内与SOD紧密联系,可通过清除·OH-,催化H2O2,生成H2O和O2,解除H2O2形成的氧化胁迫,阻止其对组织的侵害。因此,CAT活性与SOD活性的变化趋势有一定的相关性。本文中鲤鱼在80、160 mg·L-1浓度DEHP胁迫下,肾脏中SOD、CAT酶活性受到显著抑制,引起体内抗氧化防御系统失衡,降低生物体的免疫力。陈剑杰等[27]也报道过高浓度的氟可通过降低鲤鱼鳃中SOD、CAT活性,抑制其免疫能力。这与张贵生[28]发现的DEHP对鲤鱼具有一定免疫毒性的结果一致。
在DEHP实验浓度胁迫下,鲤鱼肾组织内MDA含量表现为升高,在80、160 mg·L-1升高显著。这可能是由于胁迫刚开始,机体产生的活性氧自由基还可以被抗氧化防御系统控制,保持相对平衡,但当体内各种抗氧化酶活性开始下降时,大量的活性氧自由基无法及时清除,导致了脂质过氧化,MDA含量相应升高。说明了水环境中DEHP会引起鲤鱼肾组织的脂质过氧化,造成其细胞损伤。这与张宜奎等[29]发现的文蛤鳃组织中SOD、CAT活性和MDA含量,经过96 h的不同质量浓度的Cd2+胁迫后,SOD、CAT酶活性受抑制,MDA含量升高的结果相似。与赵伟等[30]、Yokota等[31]的研究结果也相符。但鲤鱼在DEHP胁迫下脑组织受到的脂质过氧化作用不如肾脏组织明显,在各浓度组,MDA含量均表现为不显著升高。这与逯晓波等[32]用l0、100、1 000 mg·kg-1·d-1DEHP连续灌胃30 d,通过测定MDA含量,结果发现DEHP未能引起初断乳大鼠脑的脂质过氧化水平升高的结果相似;与陈莉等[33]通过体外培养脑细胞染毒,观察到DEHP可导致金鲫鱼脑细胞DNA 损伤,呈剂量-效应关系的结果不一致。这可能是因为DEHP不能通过动物体血脑屏障,也可能是DEHP进入体内后被分解,在脑组织中含量较低。而体外培养脑细胞由于没有其他免疫系统的参与保护,才更加敏感。
GSH-Px能清除体内活性氧,减轻和阻止活性氧的过氧化作用。GSH-Px酶活性随着DEHP浓度的升高表现为先升高后降低。在5、20、80 mg·L-1浓度组均被显著诱导(P<0.05),在160 mg·L-1下被抑制降低。可能由于低浓度下的DEHP刺激机体产生大量活性氧,GPX-Px为能清除体内过多活性氧而显著升高;在高浓度下,因GSH-Px过量消耗致使其活性下降。
生命活动产生的超氧阴离子自由基在SOD的保护作用下,不会破坏组织细胞的成分。文中鲤鱼肾、脑组织中的抗羟自由基、抗超氧阴离子的活力都明显地受到了DEHP抑制降低,可见抗氧化系统受损,机体内消除超氧阴离子自由基、羟自由基的能力减弱。过多的超氧阴离子自由,使细胞产生遗传突变,还能在 Fe3+或铁的复合物催化下,生成对生物体毒性最强、危害最大的羟自由基,造成细胞内脂类、糖类、蛋白质、核酸等的氧化性损伤,细胞出现坏死现象。陈文婕等[34]、Pngribny等[35]认为DEHP可能是一种过氧化物酶类的增值剂,能够降低抗氧化酶类的活性,打破机体内活性氧等自由基的动态平衡,造成细胞和组织的毒性损伤。
3.2 DEHP对鲤鱼脑的神经毒性
AChE被称为有毒物质存在的生物标志物[36],一个经典的毒理指标[37-38],是生物神经传导中的一种关键性的酶,刘晓宇等[22]认为,可以鱼脑乙酰胆碱酯酶作为指示酶或敏感材料。AChE主要存在于鱼类的神经系统,以脑中的活性为最高,朱小山等[39]指出,大多数硬骨鱼脑组织中只有AChE的存在。它主要在胆碱能突触间催化乙酰胆碱水解,终止神经递质对突触后膜的兴奋作用,防止乙酰胆碱在突触后膜上的积累,保证神经信号在生物体内的正常传递。现在的研究普遍认为,AchE活性抑制超过20%,说明污染物暴露作用的存在,超过50%说明污染物对生物的生存有危害作用,文中鲤鱼长期暴露于不同浓度DEHP 20 d,各染毒组AChE酶活性分别抑制31.8%、38.1%、40.6%、43.5%,可见DEHP直接影响突触间隙神经递质乙酰胆碱的降解,损害中枢神经系统的胆碱能,产生神经毒性。这与Guimaraes等[40]发现百敌虫胁迫下罗非鱼脑组织AChE活性被抑制的结果相同。与秦洁芳等[41]研究的邻苯二甲酸二乙基己酯(DEHP)胁迫下红鳍笛鲷出现的AChE先受抑制后被诱导的结果不同。
NOS在机体各组织器官中广泛存在,与精氨酸相互作用产生亲脂性很强的NO,自由通过细胞膜,参与机体防御机制。本文中NOS酶活性在各染毒组均被诱导,且升高显著。可能是NOS作为CaN的底物,被CaN去磷酸化,升高了催化活性,同时增加NO生成量,机体的免疫力提高,呈现出一种机体对外来异物的免疫应答反应。王广军等[42]发现,斜带石斑鱼体内注射副溶血弧菌后,NOS活力会被诱导升高。
CaN是目前唯一受Ca2+/钙调素(CaM)调节的丝/苏氨酸蛋白磷酸酶,从酵母到人其分子结构高度保守。DEHP胁迫下,鲤鱼脑内CaN酶活性表现为先升高后降低。在20 mg·L-1,升高显著;在80、160 mg·L-1,降低显著。可能是低浓度的DEHP刺激下,细胞内Ca2+浓度升高,与CaM结合相应也增多,很大程度上激活CaN,促进T细胞增殖活化,增强机体免疫力。范晓梅等[43]证实,活化的CaN可通过去磷酸化胞浆中的T细胞核因子,调控正常心肌细胞的生长。高浓度的DEHP下调了脑中CaN活性,抑制了CaN mRNA和PCNA(细胞核中DNA聚合酶的附属蛋白)的表达,表现为CaN受抑制,降低了细胞的生长和增殖。王静等[44]曾证明,二苯乙烯苷可通过抑制CaN 活性及其蛋白合成来降低SD大鼠心肌成纤维细胞增殖。
DEHP暴露可引起鱼的抗氧化系统障碍和神经机能紊乱,使鱼的肾、脑组织中细胞受到不同程度的损伤。但DEHP对鲤鱼免疫毒性和神经毒性的影响机理,与助溶剂吐温-80是否存在协同,还有待进一步的研究。鱼类肾脏中SOD、CAT、GSH-Px、抗羟自由基、抗超氧阴离子活性和MDA含量和脑组织中NOS、CaN、AChE、抗羟自由基、抗超氧阴离子活性变化可作为检测水体中酞酸酯类物质污染的毒理学指标。
致谢:感谢山东省菏泽学院张贵生副教授、朱道玉教授在实验中给予的帮助。
[1] Casals·Casas C, Desvergne B. Endocrine disruptors: From endocrine to metabolic disruption [J]. Annual Review of Physiology, 2011, 73: 135-162
[2] Rudel R A, Gray J M, Engel C L, et al. Food packaging and bisphenol A and bis(2-ethylhexyl) phthalate exposure: Findings from a dietary intervention [J]. Environmental Health Perspectives, 2011, 119(7): 914-920
[3] Shaz B H, Grima K, Hillyer C D. 2-(diethylhexyl) phthalate in blood bags: Is this a public health issue? [J]. Transfusion, 2011, 51(11): 2510-2517
[4] Latini G, Ferri M, Chiellini F. Materials degradation in PVC medical devices, DEHP leaching and neonatal outcomes [J]. Current Medicinal Chemistry, 2010, 17(26): 2979-2989
[5] Heudorf U, Mersch-Sundermann V, Angerer J. Phthalates: Toxicology and exposure [J]. International Journal of Hygiene and Environmental Health, 2007, 210(5): 623-634
[6] 王心. 邻苯二甲酸二-(2-乙基己基)酯的雌性生殖毒性研究[D]. 西安: 中国人民解放军第四军医大学, 2009: 13
Wang X. The study of female reproductive toxicity induced by DEHP [D]. Xi’an: The Fourth Military Medical University, 2009: 13 (in Chinese)
[7] 王佳, 董四君. 邻苯二甲酸二乙基己酯(DEHP)毒理与健康效应研究进展[J]. 生态毒理学报, 2012, 7(1): 25-34
Wang J, Dong S J. Research advances in toxicology of DEHP and its health effects [J]. Asian Journal of Ecotoxicology, 2012, 7(1): 25-34 (in Chinese)
[8] Erkekoglu P, Rachidi W, Yuzugullu O G, et al. Evaluation of cytotoxicity and oxidative DNA damaging effects of di(2-ethylhexyl)- phthalate (DEHP) and mono(2-ethylhexyl)- phthalate (MEHP) on MA- 10 Leydig cells and protection by selenium [J]. Toxicology and Applied Pharmacology, 2010, 248(1): 52-62
[9] Howdeshell K L, Rider C V, Wilson V S, et al. Mechanisms of action of phthalate esters individually and in combination, to induce abnormal reproductive development in male laboratory rats [J]. Environmental Research, 2008, 108(2): 168-176
[10] Pfuderer P, Janzen S, Rainey W T Jr. The identification of phthalic acid esters in the tissues of cyprinodont fish and their activity as heart rate depressors [J]. Environmental Research, 1975, 9(3): 215-223
[11] Labow R S, Barry Y A, Tocchi M, et al. The effect of mono (2- ethylhexyl) phthalate on an isolated perfused rat heart-lung preparation [J]. Environmental Health Per-spectives, 1990, 89: 189-193
[12] Rusyn I, Peters J M, Cunningham M L. Modes of action and species-specific effects of di-(2-ethylhexyl) phthalate in the liver [J]. Critical Reviews in Toxicology, 2006, 36(5): 459-479
[13] Ghosh J, Das J, Manna P, et al. Hepatotoxicity of di (2-ethylhexyl) phthalate is attributed to calcium aggravation, ROS-mediated mitochondrial depolarization, and ERK/NF- kappaB pathway activation [J]. Free Radical Biology and Medicine, 2010, 49(11): 1779-1791
[14] 叶婷, 康美, 黄乾生, 等. 邻苯二甲酸二(2-乙基己)酯和邻苯二甲酸单乙基己基酯对幼年期及青年期海洋青鳉(Oryzias melastigma)的内分泌干扰效应[J]. 环境化学, 2014, 33(4): 543-550
Ye T, Kang M, Huang Q S, et al. Endocrine-disrupting effects of DEHP and MEHP on the fry and juvenile stage medaka (Oryzias melastigma) [J]. Environmental Chemistry, 2014, 33(4): 543-550 (in Chinese)
[15] 张贵生. 邻苯二甲酸二(2-乙基己基)酯长期暴露对鲤鱼毒理学指标的影响[J]. 四川动物, 2015, 34(2): 256-263
Zhang G S. Effect of di-(2-ethylhexyl)phthalate on the toxicology parameter of Cyprinus carpio under a long-term exposure [J]. Sichuan Journal of Zoology, 2015, 34(2): 256-263 (in Chinese)
[16] 李学彬. 邻苯二甲酸二乙基己酯对金鲫鱼的氧化损伤作用的研究[D]. 武汉: 华中师范大学, 2009: 28
[17] 张贵生. 邻苯二甲酸二乙酯对鲤精巢组织结构和脑精巢生物标志物的影响[J]. 安全与环境学报, 2014, 14(5): 340-345
Zhang G S. Effect of diethyl phthalate on the biochemical markers of brain, testis and testicular tissue structure in Cyprinus carpio Linnaeus [J]. Journal of Safety and Environment, 2014, 14(5): 340-345 (in Chinese)
[18] 何秀婷, 李潇, 杨永涛, 等. 邻苯二甲酸酯对斑马鱼胚胎发育的联合毒性[J]. 中山大学学报:自然科学版, 2010, 49(5): 101-106, 112
He X T, Li X, Yang Y T, et al. Effects of combined toxicity of phthalic acid esters on zebrafish embryonic development [J]. Acta Scientiarum Naturalium Universitatis Sunyatsen, 2010, 49(5): 101-106, 112 (in Chinese)
[19] 马建红, 吕立夏, 厉曙光. 邻苯二甲酸二酯诱导果蝇脑组织基因差异表达谱的研究[J]. 环境与职业医学, 2005, 22(2): 91-94
Ma J H, Lv L X, Li S G, et al. Study on the gene expressed profile of di (2-ethylhexyl) phthalate-induced brain tissue in Drosophila melanogaster [J]. Journal of Labour Medicine, 2005, 22(2): 91-94 (in Chinese)
[20] 刘剑波, 宋心琦. 分子氧、活性氧与生命[J]. 大学化学, 1994, 9(5): 26-33
[21] 胡俊峰, 王丕文, 张春玲, 等. 2B(a)P对鲫鱼全脑NO、NOS水平的影响[J]. 中国公共卫生, 2005, 21(2): 186-187
Hu J F, Wang P W, Zhang C L, et al. Effect of B(a)P on induction of NO and NOS in brain of Carassius auratus [J]. Chinese Journal of Public Health, 2005, 21(2): 186-187 (in Chinese)
[22] 刘晓宇, 郝强, 吴谋成, 等. 鲫鱼脑乙酰胆碱酯酶(AChE)的活性测定及对有机磷农药的敏感性研究[J]. 食品科学, 2006, 27(12): 71-74
Liu X Y, Hao Q, Wu M C, et al. Study on the determination of brain AChE activity in crucian carp and its sensitivity to organophosphorus pesticides [J]. Food Science, 2006, 27(12): 71-74 (in Chinese)
[23] 符民桂, 唐朝枢. 钙调神经磷酸酶的研究进展[J]. 生物化学与生物物理进展, 2000, 27(2): 157-161
Fu M G, Tang C S. Progress in studying of calcineurin [J]. Progress in Biochemistry and Biophysics, 2000, 27(2): 157-161 (in Chinese)
[24] Li X Y, Luo Y R, Yun M X, et al. Effects of 1- methyl-3- octylimidazolium bromide on the anti-oxidant system of earthworm [J]. Chemosphere, 2010, 78: 853-858
[25] Li X Y, Zheng S H, Dong X Y, et al. Acute toxicity and responses of antioxidant systems to 1-methyl-3-octylimidazolium bromide at different developmental stages of goldfish [J]. Ecotoxicology, 2012, 21(1): 253-259
[26] 蔡立哲, 马丽, 高阳, 等. 蒽、菲、芘混合液对菲律宾蛤仔抗氧化酶活性的影响[J]. 海洋科学, 2005, 29(8): 47-52
Cai L Z, Ma L, Gao Y, et al. The effects of anthracene, phenathrene, pyrene and chrysene on activity of antioxidant enzyme of Ruditapes philippinarum [J]. Marine Sciences, 2005, 29(8): 47-52 (in Chinese)
[27] 陈剑杰, 曹谨玲, 罗永巨, 等. 氟对鲤鱼鳃组织免疫相关酶IL-1β表达影响[J]. 核农学报, 2014, 28(6): 1092-1098
Chen J J, Cao J L, Luo Y J, et al. Effects of fluoride on the activity of immune-related enzymes and IL-1 protein expression in gill of carp (Cyprinus carpio) [J]. Journal of Nuclear Agricultural Sciences, 2014, 28(6): 1092-1098 (in Chinese)
[28] 张贵生. 邻苯二甲酸二乙基己酯对鲤非特异性免疫的影响及遗传毒性[J]. 水生生物学报, 2014, 38(4): 729-736
Zhang G S. Effect of DEHP on non-specific immune function and genetic toxicity of Cyprinus carpio Linnaeus [J]. Acta Hydrobiologica Sinica, 2014, 38(4): 729-736 (in Chinese)
[29] 张宜奎, 宋秀凯, 刘爱英, 等. Cd2+胁迫对文蛤鳃组织SOD、CAT活性及MDA含量的影响[J]. 安全与环境学报, 2011, 11(6): 19-23
Zhang Y K, Song X K, Liu A Y, et al. Effects of Cd2+on SOD activity, CAT activity and MDA content in the gill of meretrix mere [J]. Journal of Safety and Environment, 2011, 11(6): 19-23 (in Chinese)
[30] 赵伟, 童丽丽, 乔永康, 等. 邻苯二甲酸二乙基己酯对小鼠血液中的SOD及MDA的影响[J]. 公共卫生与预防医学, 2007, 18(1): 12-15
Zhao W, Tong L L, Qiao Y K, et al. Effect of di-(2-ethylhexyl) phthalate (DEHP) on the activity of superoxide dismutase (SOD) and the concentration of malondialdehyde (MDA) in the red blood cell and the serum of the mice [J]. Journal of Public Health and Preventive Medicine, 2007, 18(1): 12-15 (in Chinese)
[31] Yokota S, Harnguchi C M, Oda T. Induction of pemxisomal Lon protease in rat liver after di-(2-ethylhexy1) phthalate treatment [J]. Histochemistry and Cell Biology, 2008, 129(1): 73-83
[32] 逯晓波, 刘秋芳, 靳翠红, 等. 短期重复暴露邻苯二甲酸二(2-乙基)己酯对雄性大鼠睾丸脂质过氧化水平的影响[J]. 环境与健康杂志, 2009, 26(2): 121-124
Lu X B, Liu Q F, Jin C H, et al. Study on didymus lipid peroxidation level on rats after sub-acute exposure to di-2-ethylhexyl phthalate [J]. Journal of Environment and Health, 2009, 26(2): 121-124 (in Chinese)
[33] 陈莉, 李学彬, 杨光涛, 等. 邻苯二甲酸二乙基己酯(DEHP)对金鲫鱼脑细胞DNA的损伤[J]. 生态毒理学报, 2008, 3(2): 144-148
Chen L, Li X B , Yang G T, et al. DNA damage in brain cells of gold crucian carp induced by di- (2-ethylhexyl) phthalate (DEHP) [J]. Asian Journal of Ecotoxicology, 2008, 3(2): 144-148 (in Chinese)
[34] 陈文婕, 戴红, 陈敏, 等. 邻苯二甲酸二乙基己酯(DEHP)对小白鼠肝脏毒性及脂质过氧化损伤[J]. 生态毒理学报, 2012, 7(1): 93-98
Chen W J, Dai H, Chen M, et al. Hepatotoxic effect and lipid oxidative damage of diethylhexyl phthalate (DEHP) on mice [J]. Asian Journal of Ecotoxicology, 2012, 7(1): 93-98 (in Chinese)
[35] Pngribny I P, Tryndyak V P, Boureiko A, et al. Mechanisms of peroxisome proliferator induced DNA hypomethylation in rat liver [J]. Mutation Research, 2008, 644(1-2): 17-23
[36] Walker C H. Biochemical biomarkers in ecotoxicology some recent developments [J]. The Science of the Total Environment, 1995, 171: 189-195
[37] Hart A D M. Relationships between behavior and inhibition of acetylcholinesterase in birds exposed to organ phosphorus pesticides [J]. Environmental Toxicology and Chemistry, 1993, 12(2): 321-336
[38] 穆大刚, 孟范平, 朱小山, 等. 海鱼AChE监测海水有机磷农药的可行性研究[J]. 海洋湖沼通报, 2004(1): 68-73
Mu D G, Meng F P, Zhu X S, et al. A study on the feasibility of monitoring organophosphorus pesticides in seawater using AChE in marine fish: Lateolabrax japonicas (cuvier) [J]. Transaction of Oceanology and Limnology, 2004(1): 68-73 (in Chinese)
[39] 朱小山, 孟范平, 何东海. 黄鱼(Hexagrammos otakii)脑组织AChE的亲和层析[J]. 中国海洋大学学报, 2004, 34(2): 231-237
Zhun X S, Meng F P, He D H. Purification and partial biochemical characterization of acetylcholine esterase from Hexagrammos otakii [J]. Periodical of Ocean University of China, 2004, 34(2): 231-237 (in Chinese)
[40] Guimaraes A T B, Silva de Assis H C, Boeger W. The effect of trichlorfon on acetyl-cholinesterase activity and histopathology of cultivated fish Oreochromis niloticus [J]. Ecotoxicology and Environmental Safety, 2007, 68(1): 57-62
[41] 秦洁芳, 陈海刚, 蔡文贵, 等. 邻苯二甲酸二乙基己酯(DEHP)胁迫下红鳍笛鲷不同组织生化指标的变化[J]. 农业环境科学学报, 2011, 30(3): 409-415
Qin J F, Chen H G, Cai W G, et al. The change of biochemical indexes in different tissue of crimson snapper (Lutjanus erythropterus) exposed to di-(2-ethylhexyl) phthalate (DEHP) [J]. Journal of Agro-Environment Science, 2011, 30(3): 409-415 (in Chinese)
[42] 王广军, 谢骏, 余德光, 等. 副溶血弧菌对斜带石斑鱼血清中一氧化氮合酶活力的影响[J]. 海洋渔业, 2005, 27(1): 60-63
Wang G J, Xie J, Yu D G, et al. Effect of vibrio parahaemolyticus on nitric oxide synthase activity in serum of Epinephelus coioides [J]. Marine Fisheries, 2005, 27(1): 60-63 (in Chinese)
[43] 范晓梅, 李春月, 李旭辉. 牛磺酸对压力超负荷大鼠心肌中钙调神经磷酸酶和肾上腺髓质素的影响[J]. 中国心血管病研究杂志, 2012, 10(12): 944-946
Fan X M, Li C Y, Li X H. The influence of taurine to CaN and ADM in the myocardium of pressure overload rats [J]. Chinese Journal of Cardiovascular Review, 2012, 10(12): 944-946 (in Chinese)
[44] 王静, 徐新, 孙艳云, 等. 二苯乙烯苷通过降低钙调神经磷酸酶的活性抑心肌成纤维细胞的增殖[J]. 南通大学学报:医学版, 2013, 33(4): 258-261
Wang J, Xu X, Sun Y Y, et al. Inhibitory effects of 2,3,4',5- tetrahydroxystilbene -2-O-β-D- glucoside on arginine vasopressin induced proliferation of cardiac fibroblasts through inhibition of calcineurin activation [J]. Journal of Nantong University: Medical Sciences, 2013, 33(4): 258-261 (in Chinese)
◆
Effect of Diethyl Phthalate on the Biochemical Markers of Kidney and Brain inCyprinuscarpioLinnaeus
Wu Hongsong
Department of Life Science, Heze University, Heze 274015, China
Received 23 November 2015 accepted 26 January 2016

di-(2-ethylhexyl)phthalate; Cyprinus carpio Linnaeus; kidney; brain; biochemical marker; immunotoxicity; neurotoxicity
10.7524/AJE.1673-5897.20151123001
山东省自然科学基金项目(ZR2010CM046);山东省十二五动物生理生化与应用重点实验室项目(201106)
吴红松(1977-),女,讲师,研究方向为动物生态毒理学,E-mail: hellowhs@163.com
2015-11-23 录用日期:2016-01-26
1673-5897(2016)2-732-10
X171.5
A
吴红松. DEHP暴露对鲤鱼肾脑生物标志物的影响[J]. 生态毒理学报,2016, 11(2): 732-741
Wu H S. Effect of diethyl phthalate on the biochemical markers of kidney and brain in Cyprinus carpio Linnaeus [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 732-741 (in Chinese)

