硒蛋白R抑制铜离子介导的Aβ42聚集和细胞毒性
郭明,陈平,都秀波,刘琼,
1. 深圳大学 生命与海洋科学学院,深圳 518000 2. 南阳理工学院,南阳 473000
硒蛋白R抑制铜离子介导的Aβ42聚集和细胞毒性
郭明1,陈平2,都秀波1,刘琼1,
1. 深圳大学 生命与海洋科学学院,深圳 518000 2. 南阳理工学院,南阳 473000
阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病,其主要病理特征包括脑内出现老年斑和神经纤维缠结以及神经元缺失。过渡金属离子如Fe2+、Zn2+、Cu2+等会在AD病人脑中大量蓄集,从而促进-淀粉样多肽(Aβ)聚集并产生大量活性氧自由基,引起细胞功能改变。硒蛋白R(SelR)是一种蛋氨酸亚砜还原酶,可将蛋白中的蛋氨酸亚砜还原为蛋氨酸。然而SelR与金属离子的关系尚无报道。文章对SelR的突变体SelR′(SelR中硒代半胱氨酸Sec95突变为半胱氨酸Cys95)结合Cu+的性质进行了表征,同时也对SelR′调节Cu+/Cu2+诱导的Aβ42聚集和细胞毒性的能力进行了研究。结果表明,SelR′可与Cu+特异性螯合剂BCA竞争结合Cu+,说明SelR′具有较强的Cu+结合能力。采用硫磺素荧光法(ThT),发现Cu+/Cu2+显著性抑制Aβ42的纤维化、诱导其形成非纤维化聚集体,而SelR′则能够显著抑制Cu+/Cu2+诱导的Aβ42聚集形态的改变。细胞实验表明:SelR′能显著降低Cu+/Cu2+诱导的Aβ42的细胞毒性。上述结果提示:SelR在脑内除了还原蛋氨酸亚砜,还可通过与铜离子的结合抑制其细胞毒性作用,从而干预AD的发展。
铜离子;β-淀粉样蛋白;阿尔茨海默症;硒蛋白R;细胞毒性
阿尔茨海默病(Alzheimer's disease,AD)是一种常见的神经退行性疾病,其主要病理特征为β-淀粉样蛋白(Aβ)聚集形成的老年斑和tau蛋白过度磷酸化形成的神经纤维缠结。Aβ是由淀粉样前体蛋白(APP)经过β-和γ-分泌酶剪切而成,在体内主要以Aβ40和Aβ42形式存在,Aβ42具有细胞毒性且容易聚集。过度金属离子如Cu2+、Zn2+和Fe2+被发现与 AD病人脑中的老年斑密切相关[1]。有研究表明Cu2+能参与细胞膜上的氧化还原反应并产生活性氧(ROS),而高浓度的Cu2+在Aβ聚集过程中起重要作用[2]。在AD病人脑中发现Aβ与金属离子(尤其是Cu2+)共定位[3]。Cu2+对Aβ的聚集和细胞毒性的影响已有广泛讨论[4],但是Cu+的作用机制尚不明确。有报道Aβ的His13和His14能与Cu+结合[5],Cu+-Aβ复合物可能是一种与AD病理相联的重要物质。传统的金属螯合剂如碘氯羟喹能调节金属离子介导的Aβ聚集和细胞毒性,但长期使用碘氯羟喹会产生副作用,即亚急性髓视神经病变[6]。因此,利用大脑内源性的金属结合蛋白来调节金属内稳态、降低金属介导的Aβ聚集和细胞毒性被认为是一种新的跟好策略。
硒蛋白是一类序列中包含硒代半胱氨酸(Sec)的特殊蛋白[7]。SelR是硒蛋白家族中的一个成员,也称为蛋氨酸亚砜还原酶B1(MsrB1),能在多种生物体中表达[8]。SelR是通过生物信息学的方法被鉴定为硒蛋白的。它可以立体专一性地还原蛋白质中的R型蛋氨酸亚砜(Met(O))为蛋氨酸(Met)[9]。Met对ROS的氧化十分敏感,SelR能通过还原被氧化的Met,发挥细胞抗氧化防御系统的功能[10]。Aβ中Met35的氧化与Aβ聚集和神经毒性密切相关[11]。而SelR所介导的Met与Met(O)之间的可逆转换与很多生理、病理进程相关,如氧化应激、细胞信号传导、神经退行性病理过程等[12]。另有报道,在Sec突变为Cys所形成的突变体SelR′中,蛋氨酸亚砜还原酶(Msr)活性中心的催化环境没有被破坏[13]。因此,用突变体SelR′替代SelR开展结构和功能的研究是可行的。本实验室前期已对Cu+和Cu2+与硒蛋白P的结合性质进行了表征[14],并对Cu+/Cu2+介导的Aβ42聚集和神经细胞毒性进行了研究。本文进一步研究了SelR′对Cu+/Cu2+介导的Aβ42聚集和细胞毒性的影响。
1 材料与方法 (Materials and methods)
1.1 试剂与材料
pET-HSV-2-A载体、大肠杆菌菌株Top10、BL21和N2a细胞为本实验室保存;S-pfu高保真酶、DL 2 000 DNA Marker购自TAKARA公司;T4 连接酶购自Ferments公司;Aβ42购自上海强耀有限公司;六氟异丙醇(HFIP)、硫磺素(ThT)、青霉素、链霉素购自Sigma公司;DMSO、胰蛋白酶购自Amresco公司;二喹啉甲酸(BCA)定量试剂盒、细胞增殖与活性检测试剂盒(CCK-8)购自碧云天生物技术研究所;DMEM细胞培养基、OPTI-MEM细胞培养基、胎牛血清购自Gibco公司。
1.2 实验方法
1.2.1 SelR突变体的制备及相关试剂的配制
根据SelR基因(NM_016332.2)编码序列及pET-HSV-2-A载体相关信息设计引物FP:5′-GCACTAGTATGTCGTTCTGCAG -3′,RP:5′-CCCAAGCTTCTAGTGACCCTGGGAG -3′。然后将SelR中的TGA码突变为TGC码,获得突变体SelR′,再连接到pET- HSV-2-A载体上,经过筛选和基因测序验证获得重组质粒pET-HSV-2-A-SelR′。将质粒转化至E. Coli BL21感受态细胞,利用氨苄青霉素抗性筛选得到单克隆菌种,用IPTG诱导表达法扩增并收集菌体,溶解于裂解缓冲液,超声裂解后离心收集蛋白粗溶液,采用快速蛋白质液相层析系统(TAKA FPLC),通过镍柱亲和层析分离纯化SelR′。Aβ42样品的处理是按照已有的方法,使其浓度为2 mmol·L-1[15]。配制1 mol·L-1的CuSO4母液,用ICP-MS测其准确浓度,存放4 ℃冰箱备用,Cu+是在所配的Cu2+中加入终浓度为1 mmol·L-1的抗坏血酸(H2Asc)而获得,BCA直接从定量试剂盒中获取。
1.2.2 BCA竞争结合法
用Cu+和BCA配制Cu2+-BCA-H2Asc原液,其中Cu+和BCA的终浓度分别为20 μmol·L-1和60 μmol·L-1,取原液100 μL,加入不同浓度的SelR′,用PBS 缓冲溶液补充到1 mL,分别加入96孔板中混合均匀,样品放置30 min后,将以上各组样品分别加入96孔板中,用全波长荧光化学发光酶标仪(Thermo Scientific)在450~700 nm波长下测定吸光度。
1.2.3 ThT荧光法
Aβ42的纤维化程度用ThT荧光法检测。将Aβ42与Cu+/Cu2+以及Aβ42、Cu+/Cu2+与SelR′共同孵育,三者的终浓度均为10 μmol·L-1,每组密封好后置于温控板中,温控板参数设置:37 ℃,600 r·min-1,24 h后取出,用荧光分光光度计,在444 nm激发下,扫描各组样品400~800 nm的荧光光谱。
1.2.4 细胞活力检测
用含10%血清、100 U·mL-1青霉素和100 U·mL-1链霉素的DMEM培养基在37 ℃、5% CO2的条件下培养N2a细胞系。当细胞生长处于对数期时,用胰酶消化至单细胞悬液,按5×103cells·孔-1的细胞密度转移到96孔板中,培养24 h使其贴壁,无血清培养基重复洗涤3次后分7组加入处理好的样品:PBS组;DMSO组;Aβ42组;Aβ42+Cu2+组;Aβ42+Cu2++SelR′组;Aβ42+Cu2++H2Asc组;Aβ42+Cu2++SelR′+H2Asc组。Aβ42、Cu2+及SelR′的终浓度均为10 μmol·L-1,继续培养24 h。在孵育好的96孔板中每孔加入10 μL的CCK-8试剂,37 ℃孵育2 h,用SpecTRA MAX 190酶标仪检测450 nm和650 nm下的吸光值。
2 结果(Results)
2.1 SelR′竞争结合Cu+的性质
2.1.1 SelR′的表达纯化
为获得重组SelR′蛋白,构建pET-HSV-2-A-SelR′重组质粒,测序成功后将重组质粒转化表达菌株E. Coli BL21感受态细胞,挑取合适菌株进行大量培养后,收菌,超声裂解提取蛋白质后,采用FPLC系统,通过镍柱亲和层析分离得到纯化的融合蛋白(见图1左图)。对融合蛋白采用凝血酶酶切后再进行纯化分离(图1右图),获得足量纯化的SelR′,用于后续实验。
2.1.2 SelR′竞争结合Cu+的性质
有研究指出,在脑脊液中,胞外高浓度的抗坏血酸可使通常存在的Cu2+生成Cu+,推断体内单体Aβ42可能与Cu+而非Cu2+相结合。因此本文首先采用BCA竞争法研究SelR′与Cu+的结合情况。结果发现,在Cu+-(BCA)2体系中加入不同浓度的SelR′后,其光吸收谱图均有不同程度的变化,此变化在加入高浓度的SelR′后更加明显。在562 nm处的光吸收值与SelR′呈现明显的浓度依赖性,随着SelR′浓度的增加,562 nm处的光吸收值呈较大幅度的降低(图2),说明SelR从Cu+-(BCA)2复合物中摄取了Cu+,使得Cu+-(BCA)2复合物含量减少,因此SelR具有较强的与BCA竞争性结合Cu+的能力。结合实验室前期结果可知且SelR与Cu+的结合要强于Aβ42与Cu+的结合。
2.2 SelR′对Cu+/Cu2+诱导的Aβ42聚集的影响
制备各组样品,并将样品在37 ℃孵育24 h,在444 nm激发波长下,以荧光分光光度计扫描455~605 nm波段的荧光光谱,结果如图3所示,在482 nm处出现最大的荧光发射峰,该处的荧光强度与Aβ42纤维体的含量成正比。Aβ42在37 ℃单独孵育24 h后,在482 nm处出现特征性荧光发射峰,Aβ42可自发聚集形成纤维。当Aβ42与Cu+或Cu2+共同孵育时,482 nm处的荧光强度显著降低,Cu+和Cu2+抑制了Aβ42的纤维化聚集,诱导Aβ42形成非纤维聚集体。而当Aβ42与Cu+/Cu2+及SelR′共同孵育时,482 nm处的荧光强度又有一定程度的回升,可见SelR′能够抑制Cu+/Cu2+诱导的Aβ42的非纤维化聚集,诱导Aβ42形成一定量的纤维体,这一结果也与Tougu等[16]的结果相吻合。Tougu等[16]曾通过ThT检测发现,Zn2+和Cu2+能够抑制Aβ42的纤维化聚集、促进其非纤维化聚集。结合文中结果不难看出,SelR′可通过与Cu+/Cu2+的结合,抑制铜离子诱导的Aβ42的非纤维化聚集。
2.3 SelR′对Cu+/Cu2+诱导的Aβ42细胞毒性的影响
采用CCK-8试剂盒检测N2a细胞培养过程中,SelR′对Cu+/Cu2+诱导的Aβ42细胞毒性的作用。样品于37 ℃孵育24 h,待其形成 Aβ42纤维体或Cu+/Cu2+- Aβ42无规则聚集体后,将其加入N2a细胞中孵育,结果如图4所示。以Aβ42单独孵育形成的纤维体处理细胞,细胞活力为对照组的82.5%,即Aβ42纤维体的细胞毒性很弱,而Aβ42与Cu+/Cu2+共同孵育24 h后处理的细胞,细胞活力分别为对照组的28.3%、28.9%,表明Cu+/Cu2+均能增加Aβ42对N2a细胞的毒性,这一结果也与前人所发现的在金属离子的存在下Aβ42具有很高的神经毒性的结果相吻合。为了检测SelR′的作用,Aβ42先与Cu+或Cu2+在37 ℃共同孵育1 h后,加入等摩尔浓度的SelR′再共同孵育23 h后处理N2a细胞,测定细胞活力。结果发现,在复合物Cu+-Aβ42和Cu2+-Aβ42中加入SelR′后再作用于细胞,细胞活力均有显著性的提高。结合前面的结果,可以看出:SelR′通过与Aβ42竞争性结合Cu+/Cu2+,抑制Cu+/Cu2+诱导的Aβ42非纤维化聚集,使得Aβ42生成一定量的纤维体,从而降低Aβ42的细胞毒性。
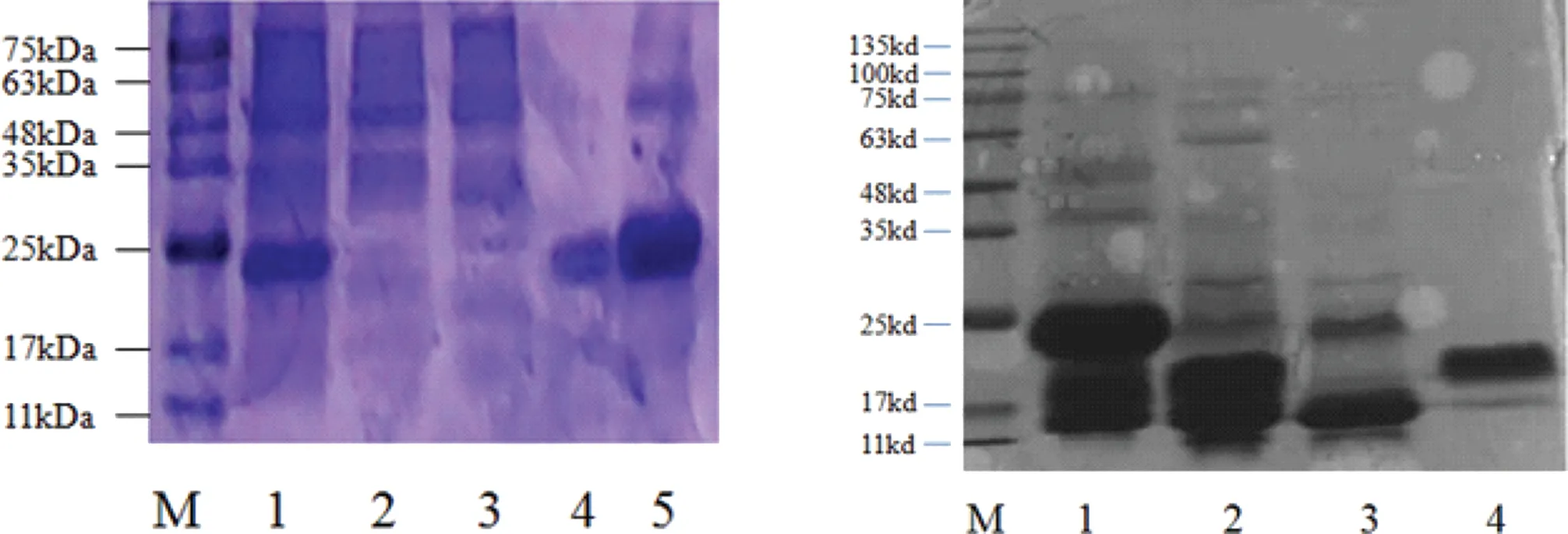
图1 SelR′的分离纯化及聚丙烯酰胺凝胶电泳分析 注:左图,融合表达蛋白的分离纯化;M,蛋白分子量标记物;泳道1,纯化前蛋白溶液;泳道2,穿透峰;泳道3,60 mmol·L-1咪唑洗脱峰;泳道4和5,500 mmol·L-1洗脱峰;右图,SelR′的分离纯化;泳道1,500 mmol·L-1洗脱峰;泳道2,凝血酶酶切后蛋白溶液;泳道3,酶切后穿透峰;泳道4,目的蛋白SelR′。Fig. 1 Isolation, purification and electrophoresis analysis of SelR′Note: M: M221-01 protein Marker; Lift, lane 1: pre-purified protein solution; lane 2: product eluted by balance buffer (i.e, unbound protein); lane 3: products eluted by 60 mmol·L-1 imidazole; lane 4 and lane 5: products eluted by 500 mmol·L-1 imidazole; Right, lane 1: product eluted by 500 mmol·L-1 imidazole; lane 2: protein solution after thrombin cleavage; lane 3: digested product eluted by balance buffer; lane 4: purpose protein SelR′.
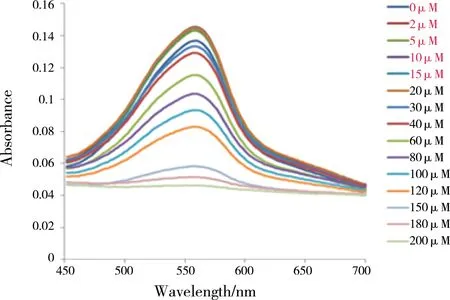
图2 不同浓度的SelR′ (0~100 μmol·L-1)滴入Cu+-(BCA)2复合物(20 μmol·L-1)的吸收光谱Fig. 2 The absorption spectrum of Cu+-(BCA)2 complex (20 μmol·L-1) added with different concentrations of SelR' (0-100 μmol·L-1)
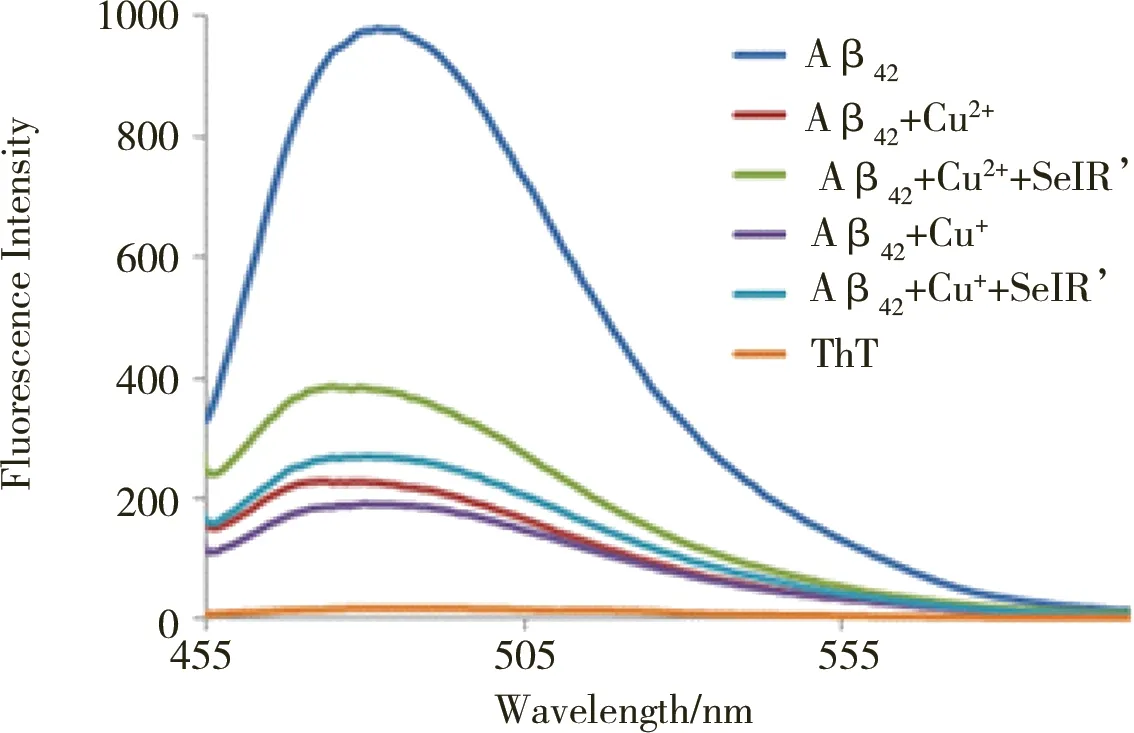
图3 SelR′对Cu+/Cu2+诱导的Aβ42非纤维化聚集的抑制作用Fig. 3 The inhibitory effect of SelR' on the nonfibrillar aggregation of Aβ42 induced by Cu+/Cu2+
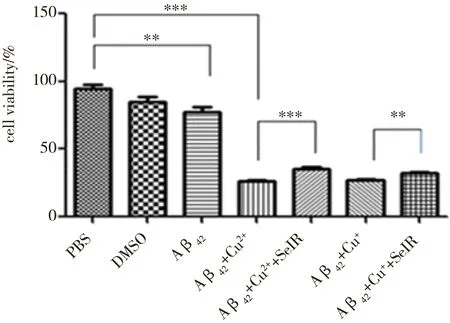
图4 CCK-8法检测不同组分对N2a细胞生长活性的影响 注:***P<0.001,**P<0.01。Fig. 4 CCK-8 cell viability assay of N2a cells treated with different componentsNote: ***P<0.001;** P<0.01.
3 讨论(Discussion)
Aβ中Met35易被体内ROS氧化为蛋氨酸亚砜,使Aβ聚集并产生神经毒性,这是AD病理发展过程中的关键问题之一[17]。SelR作为一种蛋氨酸亚砜还原酶,可特异性地还原R型的蛋氨酸亚砜,具有很强的还原性。当SelR基因被沉默后,细胞ROS水平显著增加,从而激活细胞保护机制,诱导Cu2+/Zn2+-超氧化物酶活性增强以清除ROS[18]。SelR还能通过与Clu相互作用来阻止Aβ的聚集,从而达到干预AD的效果[19]。由上可见SelR可通过多途径参与AD的预防和治疗过程,为此我们深入开展SelR与AD关系的研究,发现SelR还可通过与Cu+/Cu2+的结合来影响Aβ聚集形式,从而干预AD病理进程。
越来越多的研究表明一些金属离子,包括Fe2+、Cu2+、Mn2+、Zn2+等,它们浓度的变化与自由基的生成及其介导的神经疾病密切相关[20]。在对中枢神经系统的研究中发现,过渡金属可通过干扰突触传递、记忆形成等过程来影响神经系统[21]。Cu2+与Aβ结合后通过生物体内的还原剂(如:胆固醇、抗坏血酸盐、左旋多巴以及多巴胺等)被还原为Cu+[22],进而导致自由基的产生及Aβ的聚集。
我们的体外研究发现,Cu2+即使在没有还原剂存在的情况下,也能促进Aβ的聚集,导致自由基的产生和细胞毒性,推测Cu2+介导的Aβ的细胞毒性可能存在多种途径。在血浆中,胞外铜离子多被认为是以Cu2+的形式存在;而在脑脊液中,胞外高浓度的抗坏血酸很可能使Cu2+还原为Cu+,因此在脑内Aβ单体可能结合的是Cu+而非Cu2+,也就是说在脑内很可能是Cu+而非Cu2+诱导Aβ由可溶性的单体转化为不可溶、毒性强的非纤维聚集体。
我们还发现SelR可通过竞争作用抑制Aβ42与Cu+和Cu2+的结合。Cu+和Cu2+能够显著促进Aβ42形成非纤维聚集体并产生强细胞毒性,SelR通过与Cu+和Cu2+结合而不同程度地降低Aβ42形成非纤维聚集体,从而抑制其细胞毒性。这些结果提示我们:如果脑内的Cu+/Cu2+超出正常所需范围时,会促进脑中Aβ42的聚集,产生神经细胞毒性和造成氧化损伤,引发或加快AD的发生和发展。SelR不仅可以通过还原被氧化的蛋氨酸而发挥抗氧化作用,还由于其具有较高的铜离子结合特性,而抑制铜离子与Aβ42的结合,从而降低神经细胞毒性。综上所述,SelR在脑内可通过调节金属离子内稳态和氧化还原平衡来干预AD的病理过程、延缓AD的发生发展。
[1] 赵保路, 万莉. 金属离子代谢平衡失调与阿尔茨海默病早期发病机制[J]. 生物化学与生物物理进展, 2012, 39(8): 756-763
Zhao B L, Wang L. Metal metabolic homeostasis disruption and early initiation of mechanism for Alzheimers' disease [J]. Progress in Biochemistry and Biophysics, 2012, 39(8): 756-763 (in Chinese)
[2] Gaggelli E, Kozlowski H, Valensin D, et al. Copper homeostasis and neurodegenerative disorders (Alzheimer's, prion, and Parkinson's diseases and amyotrophic lateral sclerosis) [J]. Chemical Reviews, 2006, 106(6): 1995-2044
[3] Adlard P A, Bush A I. Metals and Alzheimer's disease [J]. Journal of Alzheimers Disease, 2006, 10(2-3): 145-163
[4] Luo Y, Xu Y X, Bao Q G, et al. The molecular mechanism for human metallothionein-3 to protect against the neuronal cytotoxicity of A beta(1-42) with Cu ions [J]. Journal of Biological Inorganic Chemistry, 2013, 18(1): 39-47
[5] Shearer J, Szalai V A. The amyloid-beta peptide of Alzheimer's disease binds Cu-I in a linear bis-his coordination environment: Insight into a possible neuroprotective mechanism for the amyloid-beta peptide [J]. Journal of the American Chemical Society, 2008, 130(52): 17826-17835
[6] Arbiser J L, Kraeft S K, van Leeuwen R, et al. Clioquinol-zinc chelate: A candidate causative agent of subacute myelo-optic neuropathy [J]. Molecular Medicine, 1998, 4(10): 665-670
[7] 黄峙, 向军俭, 郭宝江. 硒蛋白的分子生物学研究进展[J]. 生物化学与生物物理进展, 2001, 28(5): 642-645
Huang Z, Xiang J J, Guo B J. Progress in molecular biology research of selenoprotein [J]. Progress in Biochemistry and Biophysics, 2001, 28(5): 642-645 (in Chinese)
[8] Lescure A, Gautheret D, Carbon P, et al. Novel selenoproteins identified in silico and in vivo by using a conserved RNA structural motif [J]. Journal of Biological Chemistry, 1999, 274(53): 38147-38154
[9] Weissbach H, Resnick L, Brot N. Methionine sulfoxide reductases: History and cellular role in protecting against oxidative damage [J]. Biochimica et Biophysica Acta-Proteins and Proteomics, 2005, 1703(2): 203-212
[10] Levine R L, Berlett B S, Moskovitz J, et al. Methionine residues may protect proteins from critical oxidative damage [J]. Mechanisms of Ageing and Development, 1999, 107(3): 323-332
[11] He L, Wang X, Zhu D, et al. Methionine oxidation of amyloid peptides by peroxovanadium complexes: Inhibition of fibril formation through a distinct mechanism [J]. Metallomics, 2015, 7(12): 1562-1572
[12] 韩宗强, 崔宗杰. 信号蛋白中甲硫氨酸残基的可逆性氧化和甲硫氨酸亚砜还原酶[J]. 生物物理学报, 2010, 26(10): 861-879
Hang Z Q, Cui Z J. Signaling proteins in reversible oxidation of methionine residues and methionine sulfoxide reductase [J]. Biophysics Reports, 2010, 26(10): 861-879 (in Chinese)
[13] Kryukov G V, Kumar R A, Koc A, et al. Selenoprotein R is a zinc-containing stereo-specific methionine sulfoxide reductase [J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(7): 4245-4250
[14] Aachmann F L, Sal L S, Kim H Y, et al. Insights into function, catalytic mechanism, and fold evolution of selenoprotein methionine sulfoxide reductase B1 through structural analysis [J]. Journal of Biological Chemistry, 2010, 285(43): 33315-33323
[15] Du X, Li H, Wang Z, et al. Selenoprotein P and selenoprotein M block Zn2+-mediated Abeta42 aggregation and toxicity [J]. Metallomics, 2013, 5(7): 861-70
[16] Tougu V, Karafin A, Zovo K, et al. Zn(II)- and Cu(II)-induced non-fibrillar aggregates of amyloid-beta (1-42) peptide are transformed to amyloid fibrils, both spontaneously and under the influence of metal chelators [J]. Journal of Neurochemistry, 2009, 110(6): 1784-1795
[17] Jia Y, Zhou J, Liu H, et al. Effect of methionine sulfoxide reductase B1 (SelR) gene silencing on peroxynitrite-induced F-actin disruption in human lens epithelial cells [J]. Biochemical and Biophysical Research Communications, 2014, 443(3): 876-881
[18] Chen P, Wang C, Ma X J, et al. Direct Interaction of selenoprotein R with clusterin and its possible role in Alzheimer's disease [J]. Plos One, 2013, 8(6): 1-12
[19] Dumoulin M, Dobson C M. Probing the origins diagnosis and treatment of amyloid diseases using antibodies [J]. Biochimie, 2004, 86(9-10): 589-600
[20] Brown D R, Kozlowski H. Biological inorganic and bioinorganic chemistry of neurodegeneration based on prion and Alzheimer diseases [J]. Dalton Transactions, 2004, (13): 1907-1917
[21] Opazo C, Huang X D, Cherny R A, et al. Metalloenzyme-like activity of Alzheimer's disease beta-amyloid - Cu-dependent catalytic conversion of dopamine, cholesterol, and biological reducing agents to neurotoxic H2O2[J]. Journal of Biological Chemistry, 2002, 277(43): 40302-40308
[22] Kong G K, Adams J J, Harris H H, et al. Structural studies of the Alzheimer's amyloid precursor protein copper-binding domain reveal how it binds copper ions [J]. Journal of Molecular Biology, 2007, 367(1): 148-161
[23] Kim H Y, Gladyshev V N. Role of structural and functional elements of mouse methionine-S-sulfoxide reductase in its subcellular distribution [J]. Biochemistry, 2005, 44(22): 8059-8067
◆
Inhibitory Effect of Selenoprotein R on Cu+/Cu2+-Induced Aβ42Aggregation and the Corresponding Toxicity
Guo Ming1, Chen Ping2, Du Xiubo1, Liu Qiong1,*
1. College of Life Sciences and Oceanograohy, Shenzhen University, Shenzhen 518060, China 2. Nanyang Institute of Technology, Nanyang 473000, China
Received 30 November 2015 accepted 26 January 2016
Alzheimer's disease (AD) is a neurodegenerative disease characterized by the deposition of senile plaques and neurofibrillary tangles together with the loss of neurons in the brain. Previously, copper, iron and zinc ions were found with large amounts in the brains of AD patients. Metal ions can promote the aggregation of-amyloid peptide (Aβ) and lead to the formation of reactive oxygen species which further result in extensive impairment of cellular functions. Selenoprotein R (SelR) plays an important role in maintaining intracellular redox balance by reducing methionine sulfoxide to methionine. However, no report has been published on the relationship between SelR and metal ions. In this study, we characterized the Cu+binding property of SelR′ (a Sec-to-Cys mutation form of SelR) and investigated its ability to modulate the aggregation and neurotoxicity of Aβ42induced by Cu+/Cu2+. The results showed that SelR′ could compete for Cu+with bicinchoninic acid (BCA), a specific Cu+chelator, suggesting the high binding affinity between SelR′ and Cu+. Using thioflavine T fluorescence assay, it was observed that Cu+/Cu2+binding to Aβ42almost completely suppressed Aβ42fibrillization, leading to the non-fibrillar aggregation of Aβ42, which could be significantly restored by SelR′. Using living cells, SelR′ was also found to inhibit Cu+/Cu2+-Aβ42induced neurotoxicity. Results in this study indicated that SelR in the brain can not only reduce methionine sulfoxide, but also bind excessive copper ions to inhibit their toxic effects, which will be beneficial for the intervention of AD progress.
copper; β-amyloid; Alzheimer's disease; selenoprotein P; cytoxicity
10.7524/AJE.1673-5897.20151130008
国家自然科学基金(31470804,21271131,31500624);深圳市科技研发资金项目(JCYJ20130408172946974,JSGG20140703163838793)
郭明(1990-),男,硕士研究生,研究方向为硒蛋白对阿尔兹海默症作用机理的研究,E-mail: gm15138757783@163.com
*通讯作者(Corresponding author), E-mail: liuqiong@szu.edu.cn
2015-11-30 录用日期:2016-01-26
1673-5897(2016)2-399-06
X171.5
A
简介:刘琼(1965-),女,教授,博士生导师,主要从事阿尔兹海默症的早期诊断与干预机制研究。发表学术论文80余篇,申请专利5项,合作编写专著4本。
郭明,陈平,都秀波, 等. 硒蛋白R抑制铜离子介导的Aβ42聚集和细胞毒性[J]. 生态毒理学报,2016, 11(2): 399-404
Guo M, Chen P, Du X B, et al. Inhibitory effect of selenoprotein R on Cu+/Cu2+-induced Aβ42aggregation and the corresponding toxicity [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 399-404 (in Chinese)

