新型阻燃剂TCPP对斑马鱼的毒性研究
皮天星,蔡磊明,蒋金花,赵学平,王彦华,吴声敢,苏连水,汤涛
1. 新疆农业大学草业与环境科学学院,乌鲁木齐 830052 2. 浙江省农业科学院农产品质量标准研究所 浙江省植物有害生物防控重点实验室—省部共建国家重点实验室培育基地,农业部农药残留检测重点实验室,杭州 310021
新型阻燃剂TCPP对斑马鱼的毒性研究
皮天星1,2,蔡磊明2,*,蒋金花2,赵学平2,王彦华2,吴声敢2,苏连水2,汤涛2
1. 新疆农业大学草业与环境科学学院,乌鲁木齐 830052 2. 浙江省农业科学院农产品质量标准研究所 浙江省植物有害生物防控重点实验室—省部共建国家重点实验室培育基地,农业部农药残留检测重点实验室,杭州 310021
为了明确新型阻燃剂磷酸三(2-氯丙基)酯(TCPP)的生态风险,本研究采用斑马鱼为模式生物,评价了TCPP对成鱼和胚胎的毒性效应。急性毒性研究结果表明,TCPP对斑马鱼成鱼的96 h致死中浓度(LC50)为47.06 mg·L-1,而对胚胎96 h-LC50为26.01 mg·L-1,且会影响胚胎的正常发育,导致孵化出的仔鱼产生畸形。成鱼14 d延长毒性试验结果表明,TCPP对斑马鱼成鱼的无可观察效应浓度(NOEC)为1.00 mg·L-1,染毒暴露后肝脏和性腺指数随TCPP浓度增加轻微下降,但肝脏中卵黄蛋白原(VTG)的含量和性腺中芳香化酶的活性随TCPP浓度增加普遍升高。此外,TCPP的暴露还会导致斑马鱼脑垂体中合成促性腺激素的相关基因表达量增加。因此,TCPP对斑马鱼成鱼和胚胎的急性毒性均为低毒级,但长期暴露会干扰内分泌系统的调控功能,影响斑马鱼的正常发育。
磷酸三(2-氯丙基)酯(TCPP);斑马鱼;发育毒性
Received 9 July 2015 accepted 25 December 2015
磷酸三(2-氯丙基)酯(tris(2-chloroisopropyl) phosphate, TCPP)是一种有机磷酸酯类阻燃剂(organophosphate flame retardants, OPFRs)。目前,OPFRs作为多溴联苯醚(polybrominated diphenyl ethers, PBDEs)的替代物被广泛用于家具和汽车产品[1-2]。据估计,在1998、2002和2006年,仅美国OPFRs的产量就高达22 700 t[3]。截止1997年,世界范围内每年对TCPP的需求量超过40 000 t以上[4]。OPFRs化学性质极为稳定,无法通过污水处理厂的活性污泥去除[5],因此在进入环境后能够长期存在。现有资料表明,在欧洲发达国家的地表水中,检出TCPP的浓度在17~1 500 ng·L-1[6]。此外,在发展中国家中国的地表水中也能检测到TCPP,Hu等[7]对沿海地区地表水的检测结果表明,TCPP的浓度为84.12 ng·L-1。
随着OPFRs在全球范围内使用量的不断扩大,环境中TCPP的浓度也在急剧增加,因此这类化学品带来的环境风险越来越受到人们的关注。研究表明,这类化合物可能会对野生动物甚至人类产生毒性[8]。Laura等[9]发现TCPP、TCEP(磷酸三氯乙酯)和TDCPP(磷酸三(2,3-二氯丙基)酯)都可能影响生物的神经系统发育,并且提出它们的毒性作用可能由多种机制组成。此外,研究还表明TCPP、TCEP和TDCPP与已知或疑似神经毒物(例如毒死蜱)的毒性效力相当或更高。由此可见,OPFRs的环境风险不容忽视。然而目前对OPFRs的环境及生态毒理学研究还处于起步阶段,特别是针对水生脊椎动物的研究。作为TCPP的同系物,对TDCPP的研究有较为丰富的资料,低浓度的TDCPP可能会对鱼类产生发育毒性,影响斑马鱼体节、快肌和软骨的形成[10]。低浓度的TDCPP会影响斑马鱼的小丘脑-垂体-性腺轴,从而导致其繁殖能力大幅下降[11]。此外,TDCPP还对斑马鱼具有一定的发育毒性[12],研究发现TDCPP会引起胚胎和仔鱼体内甲状腺激素含量异常的现象,从而导致不正常的发育,这可能与TDCPP影响鱼类下丘脑-垂体-甲状腺轴的正常发育有关[13]。然而,鲜有对TCPP的生态毒理学研究,特别是对鱼类的亚慢性毒性效应。
斑马鱼作为国际标准试验动物,其具有体型小、性成熟快、易于饲养,在实验室内可全年连续产卵等特点[14]。因此,本研究选用标准试验动物斑马鱼(Danio rerio)作为受试生物,研究TCPP对成鱼和胚胎的急性毒性效应以及亚慢性毒性效应,比较斑马鱼在不同生命阶段对TCPP的敏感程度,探索在非致命浓度下长期暴露对斑马鱼成鱼健康产生的影响及其作用机理。
1 材料与方法 (Materials and methods)
1.1 实验材料
斑马鱼(Danio rerio)种鱼购买自武汉水生生物研究所,在本实验室饲养超过2年,试验中所用到的斑马鱼成鱼和胚胎均为其后代。
急性毒性试验均用3个月以上性成熟的健康斑马鱼成鱼,体长在(2.0±0.5) cm,体重为(0.120±0.010) g,14 d延长毒性试验使用5个月以上斑马鱼成鱼,体长在(5.5±0.4) cm,雌鱼体重为(0.95 ±0.7) g,雄鱼体重为(0.61±0.5) g。试验温度控制在(23.0±1.0) ℃,光黑暗比为12 h:12 h。试验用水为经活性炭净化的曝气自来水,水中溶解氧要维持在饱和溶解度80%以上,pH控制在(7.5±1.5),水中硬度在(85±10) mg CaCO3·L-1。成鱼在急性毒性正式试验开始前1天停止喂食。胚胎试验使用试验当天收集的透明健康胚胎。
磷酸三(2-氯丙基)酯(TCPP)纯度为99.5%,购自德国Dr. Ehrenstorfer GmbH。用于胚胎染毒的24孔细胞培养板购自浙江拱东医疗科技有限公司。斑马鱼专用卵黄蛋白原(vitellogenin, VTG)浓度和芳香化酶活性酶联免疫(ELISA)试剂盒购自上海通蔚实业有限公司。mRNA反转录试剂盒购自日本TaKaRa公司。
对胚胎的拍照和观察使用德国莱卡LEICA S8 APO型复消色差立体显微镜。实时定量PCR使用SYBR荧光显色PCR,采用美国BIO-RAD实时系统进行分析。微量风光光度计购自美国Quawell公司。
1.2 实验方法
1.2.1 成鱼急性毒性试验
称取0.377 g TCPP原药,溶解于1 L去离子水中,配制成375.0 mg·L-1的TCPP储备液。
急性毒性的试验方法主要参考经济合作与发展组织(Organization for Economic Co- operation and Development, OECD)化学品测试准则203[15]。由于TCPP在酸性和碱性条件下都不易分解[3],根据预实验结果,TCPP在试验开始96 h后,其实际浓度不低于添加浓度的80%,因此急性试验采用静态暴露法,96 h内不更换暴露溶液。试验共设置5个暴露浓度梯度,分别为:30.0、36.0、43.1、47.0和51.8 mg·L-1。另设置一个空白对照组(control, CK)。
试验使用无接缝圆形6 L玻璃缸,1缸为1重复,每缸放入5 L配制好浓度的供试品溶液,并使用15条受试鱼进行暴露。整个试验过程中每天对水中的温度和溶解氧进行监控,整个试验期间每隔12 h曝氧1 h,以维持水中溶氧度。试验期间,分别在6 h、12 h、24 h、48 h和96 h观察受试鱼的中毒症状和死亡情况,死亡标准为:用镊子轻戳受试鱼体无应激反应,并观察受试鱼腮部无呼吸活动,即判定为死亡。
1.2.2胚胎急性毒性试验
胚胎急性毒性试验参考OECD化学品测试准则236[16]。收集试验当天斑马鱼产出的胚胎,通过立体显微镜挑选出形状饱满,颜色透明的健康胚胎。以24孔细胞培养板作为染毒容器,每孔放置1枚胚胎,在其中的20个孔中加入2 mL暴露溶液,另外4孔加入2 mL洁净的曝气水作为板内空白对照组。1板为1重复,每浓度设2个重复组,此外单独设置1个空白对照组。同样采用静态暴露法,TCPP对斑马鱼胚胎的暴露浓度分别为:6.1、9.2、13.8、20.7、31.1和46.7 mg·L-1。试验开始后24 h、48 h、72 h和96 h使用立体显微镜观察胚胎的死亡、发育和孵化情况并拍照记录。
1.2.3 14 d延长毒性试验
14 d延长毒性试验参考OECD化学品测试准则204[17]。试验采用半静态法,每隔96 h更新1次暴露溶液,以无接缝圆形12 L玻璃缸作为暴露容器,设置受试物TCPP的浓度梯度为0.008、0.04、0.2、1.0和5.0 mg·L-1。使用5个月大性成熟的斑马鱼,每浓度梯度雌鱼和雄鱼各6尾。整个试验共进行14 d,每天对受试鱼的中毒症状进行观察和记录,并检查是否出现死亡。每日早晚各投喂1次饵料(周末减少为1次),投喂以固体漂浮饲料和新孵化的丰年虾为主。
试验结束后,使用间氨基苯甲酸乙酯甲磺酸盐(MS-222)安乐死所有受试鱼,逐一称重并记录。每浓度组解剖雌鱼和雄鱼各3尾,分离出它们的肝脏、性腺和大脑,称重肝脏和性腺计算性腺指数(GSI=100×[性腺重量(g)/体重(g)])和肝脏指数(HSI=100×[肝脏重量(g)/体重(g)]),并分别装入不同的离心管中,加入适量的磷酸盐缓冲液(PBS)(按组织:PBS=1:9的比例),冷藏于-20 ℃冰箱中,用于酶和卵黄蛋白原(VTG)的检测。将分离出的雌性和雄性的大脑分别放入离心管中,并迅速用液氮冷冻,冷藏于-80 ℃冰箱中,用于mRNA表达量的检测。
1.2.4 芳香化酶的检测
雌鱼和雄鱼肝脏中VTG的含量以及性腺中芳香化酶的活性均使用酶联免疫法(ELISA)试剂盒进行检测。
向每个装有组织和PBS的试管中放入1颗无菌小钢珠,使用震荡匀浆机充分研磨。用小型离心机,4 ℃,3 000 r·min-1离心15 min,取上清液。使用斑马鱼VTG专用ELISA试剂盒检测雌鱼和雄鱼肝脏中的VTG含量。
与肝脏的处理过程相同,将性腺匀浆后离心取上清,使用斑马鱼芳香化酶专用ELISA试剂盒检测卵巢和精巢中芳香化酶的活性。
1.2.5 大脑调控基因表达量的检测
使用TRIZOL法提取斑马鱼大脑中的总RNA,提取完毕后使用微量风光光度计检测总RNA的浓度,并通过1.3 %琼脂凝胶电泳检查提取RNA的质量。cDNA的合成使用TaKaRa反转录试剂盒。
PCR混合液(20 μL)由0.8 μL前、后引物,1 μL cDNA样品,10 μL 2×mixture SYBR和8.2 μL RNase-Free H2O组成。主要检测的目标基因包括:细胞色素P450 19(CYP19)、雌激素受体(ER)、ER2、黄体化激素(LH)、促卵泡激素(FSH)、促性腺激素释放激素3(GnRH3)、GnRH 2、GnRH 1、促性腺激素受体4(GnRHR4)、GnRHR3、GnRHR2和内参基因(Actin)(前后引物见附录中表1)。
荧光定量PCR反应的条件为:95 °C预变性2 min;95 °C变性20 s,55 °C退火25 s,72 °C延伸35 s共40个循环;从60 °C到95 °C每隔0.2 °C读取熔点曲线;72 °C延伸7 min。每个基因都做3个机械重复,以保证数据的可靠性。
1.3 数据统计与分析
计算成鱼和胚胎急性毒性24 h、48 h、72 h和96 h-LC50的值以及相应的95%置信区间使用软件DPS 7.05版。基因表达量的计算与分析使用IBM SPASS Statistics 21软件。
2 结果 (Results)
2.1 成鱼急性毒性试验结果
TCPP对斑马鱼成鱼24~96 h的LC50如表1所示。试验开始后的0~24 h,高浓度TCPP处理组会出现大量死亡,在24 h~96 h,死亡率趋于平缓,这表明TCPP会在短时间内对鱼类造成致命损伤。在未出现死亡的浓度组中,斑马鱼表现出不同程度的中毒症状,包括身体失衡、游动缓慢、沉底和腮部出血等。
2.2 胚胎毒性试验结果
2.2.1 致死效应
TCPP对斑马鱼胚胎24~96 h的LC50见表2。由图1可知,随着暴露浓度的增加,TCPP对斑马鱼胚胎的致死毒率也随之增加,这说明TCPP对斑马鱼胚胎的毒性具有剂量-效应关系。在斑马鱼胚胎最高暴露浓度(46.7 mg·L-1),胚胎死亡率会随着时间的延续而不断升高,最终在96 h达到最高值(60%),这说明在最高暴露浓度,斑马鱼胚胎的死亡率与暴露浓度之间存在时间-效应关系。然而,其他暴露浓度组(31.1~6.1 mg·L-1)只在0~24 h会导致
斑马鱼胚胎大量死亡,之后死亡率维持在较稳定水平,这表明在较低的浓度组中,TCPP对斑马鱼胚胎的致死毒性没有显著的时间-效应关系。
2.2.2 亚致死效应
斑马鱼的孵化时间一般在48 h~72 h,由图2可知TCPP对斑马鱼胚胎的孵化率无显著影响。胚胎经TCPP暴露后,孵化出的仔鱼会出现不同程度的畸形,主要表现为仔鱼和胚胎的发育畸形,且这种现象的发生几率会随着暴露浓度的增加而不断提高。由图2可知,受试鱼胚胎在96 h-46.7 mg·L-1TCPP的畸形率为80.0%,但在96 h-31.1 mg·L-1TCPP致畸率则只有10.0%。

图1 TCPP对斑马鱼的致死效应Fig. 1 Effect of TCPP on mortality of zebrafish
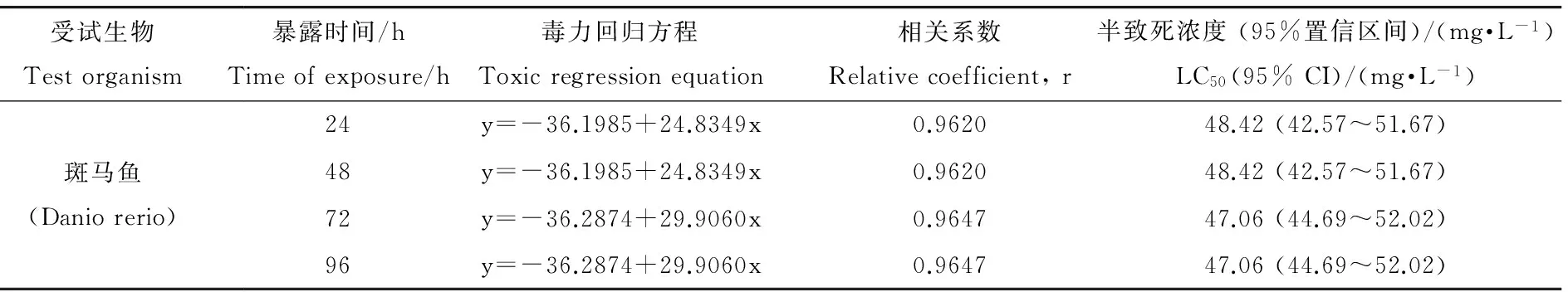
表1 TCPP对斑马鱼成鱼的急性毒性
表2 TCPP对斑马鱼胚胎的急性毒性
Table 2 Acute toxicity of TCPP to embryo of zebrafish

受试生物Testorganism暴露时间/hTimeofexposure/h毒力回归方程Toxicregressionequation相关系数Relativecoefficient,r半致死浓度(95%置信区间)/(mg·L-1)LC50(95%CI)/(mg·L-1)斑马鱼(Daniorerio)24y=-10.4038+9.7031x0.896542.32(19.89~81.59)48y=2.0958+1.5347x0.983379.00(58.360~116.88)72y=1.5792+2.3308x0.992230.82(26.11~34.56)96y=2.2249+2.0112x0.960126.01(18.46~32.71)

图2 TCPP对斑马鱼孵化率和致畸率的影响Fig. 2 Effect of TCPP on hatchability and teratogenic rate of zebrafish

图3 斑马鱼脊柱弯曲 注:a. 脊柱正常的仔鱼;b. 轻度脊柱弯曲的仔鱼;c. 重度脊柱弯曲的仔鱼(黑色箭头标注的位置即为脊柱弯曲)。Fig. 3 Spinal disorders of zebrafish Note: a. larvae with normal spine; b. larvae with slight spinal curvature; c. larvae with moderate spinal curvature.

图4 斑马鱼肝脏指数和性腺指数的变化Fig. 4 Effect of gonadosomatic index and hepatosomatic index of zebrafish
斑马鱼的发育畸形主要表现为仔鱼脊柱弯曲,如图3所示,a图为CK组中正常发育的仔鱼,b图为出现轻度脊柱弯曲的仔鱼,此时的仔鱼能够游动,但不能像正常发育的仔鱼那样保持身体平衡;c图中所示的仔鱼其脊柱弯曲程度较为严重,虽然在显微镜下能观察到心跳,但已失去基本游动能力。
2.3 14 d延长毒性试验结果
通过14 d的暴露,最高暴露浓度(5 mg·L-1)在第12天有出现斑马鱼死亡的现象,1.000 mg·L-1浓度组中的受试鱼未出现死亡,但能观察到游动缓慢、沉底、呼吸减缓等中毒症状,其他浓度组并未观察到明显的中毒症状。因此,TCPP对斑马鱼成鱼致死效应的最大无效应浓度(NOEC)为1 mg·L-1。
2.3.1 斑马鱼肝脏指数和性腺指数的变化
斑马鱼雌鱼和雄鱼肝脏指数和性腺指数的变化如图4所示。受到TCPP暴露后,雌鱼和雄鱼的肝脏指数随暴露浓度的增加而降低。雄鱼的性腺发育并未受到TCPP暴露的影响,在试验结束后受试组的性腺指数与对照组相比无明显变化,但雌鱼在受到暴露后,各暴露组受试鱼的性腺指数与对照组相比都有略微下降。2.3.2 肝脏中VTG的含量与性腺中芳香化酶的活性
经不同浓度TCPP暴露后,斑马鱼肝脏中VTG的含量变化如图5所示。与对照组相比,雄鱼肝脏中VTG的含量在受到较高的3个浓度暴露后会有所升高。而雌鱼肝脏内VTG含量会随TCPP暴露浓度的增加而急剧升高,特别是最高暴露浓度组(1.000 mg·L-1)中雌鱼肝脏VTG的含量甚至超过对照组2倍以上。在精巢中,受暴露的雄鱼芳香化酶的活性并没有发生显著的变化,只是随TCPP暴露浓度的增加而略微有上升。而在卵巢中,芳香化酶的活性与受试组相比显著升高,特别是在较高的2个浓度组中。

图5 斑马鱼肝脏中VTG的含量与性腺中芳香化酶的活性Fig. 5 Vitellogenin in liver and aromatase activity in gonad of zebrafish


图6 斑马鱼大脑调控基因表达量的变化Fig. 6 Changes of relative genetic expression in brain of zebrafish
2.3.3 大脑中调控基因表达量分析
图6所示为大脑中下丘脑-垂体与调控性激素相关的基因表达量的变化,在受到TCPP暴露14 d后,雌鱼和雄鱼脑部接受血液中雌激素反馈信息的雌激素受体ER和ER2在受到较高浓度TCPP暴露后,其表达量与对照组相比发生显著正向调控。其次,雄鱼下丘脑中促性腺激素释放激素基因GnRH的表达量与对照组相比均表现为显著的负调控,雌鱼下丘脑中的GnRH-1的表达量未出现显著变化,而GnRH-2、GnRH-3的表达量与对照组相比也表现为显著的负调控。受此影响,雄鱼垂体中接受促性腺激素释放激素调控信息的促性腺激素释放激素受体基因(RnRHR)的表达量与对照组相比全部表现为显著的负调控,而雌鱼除RnRHR-2外,其余RnRHR基因的表达量也表现为显著的负调控,此结果与下丘脑中GnRH的表达量结果一致。但是,雌鱼黄体生成素基因(LH)和卵泡刺激素基因(FSH)的表达量与对照组相比则表现为显著的正调控,雄鱼LH基因表现为显著负调控,而FSH基因也表现为显著负调控,且表达量随暴露浓度的增加而不断提高。
3 讨论(Discussion)
由成鱼和胚胎急性毒性试验结果可知,斑马鱼成鱼(96-h LC50为47.06 mg·L-1)对TCPP的耐受性要远高于胚胎(96-h LC50为26.01 mg·L-1)。此外,成鱼和胚胎的致死效应与暴露时间之间均没有明显的时间-效应关系。各浓度组中存活下来的个体虽然会出现明显的中毒现象,如游动缓慢、失去平衡和沉底等现象,但会维持这些状态直至试验结束。这种在受到化合物短时间暴露就产生不可逆损伤的现象与有机磷农药对鱼类产生的毒性效应类似[18],因此,我们怀疑OPFRs作为一类有机磷酸酯类化合物可能与有机磷类农药有相似的致毒机理,且作用靶器官可能是乙酰胆碱酯酶较为丰富的脑部,但这一假设还有待于进一步的验证。
此外,未死亡的胚胎在孵化后会出现发育畸形的现象,特别是在较高的浓度中,这与其同系物TDCPP的实验结果相似。Sean等[12]用TDCPP对斑马鱼胚胎进行暴露实验,结果发现孵化出的幼鱼会出现脊柱向后弯曲和心包囊肿等现象,其认为TDCPP可能会干扰鱼类胚胎中成纤维细胞生长因子家族(fibroblast growth factors, FGFs)的正常功能,这是一类被认为在脊椎动物的胚胎发育过程中起非常关键作用的生长因子。由本研究结果可知,TCPP的暴露会产生相同的影响,因此,我们认为这类TCPP可能会在鱼类生命早期阶段干扰成纤维细胞生长因子家族并阻碍脊柱的正常发育。
通过14 d延长毒性试验的结果可知,在低于NOEC的浓度下,雌鱼和雄鱼肝脏指数与对照组相比并没有出现显著的变化,这表明在整个暴露过程中,受试鱼的肝脏并未受到影响,即肝脏没有出现病变且未出现大量分解肝糖原的现象[19]。雌鱼和雄鱼的性腺指数也未出现显著的变化,因此我们认为,在低浓度下TCPP不会对肝脏和性腺的发育产生影响。
在卵巢中,芳香化酶催化产生雌激素并释放到血液中,促使肝脏合成卵黄蛋白原,促进胚胎中卵黄的正常发育[20]。因此,芳香化酶的活性对鱼类卵母细胞的发育有重要作用[21]。试验结果表明,受到TCPP暴露后,雌鱼卵巢中芳香化酶的活性会显著升高,这导致雌鱼肝脏中VTG的含量也大幅上升。此外,通常情况下雄鱼体内并不会产生VTG,或VTG在较低的水平,但经TCPP暴露后,雄鱼肝脏中的VTG含量会随暴露浓度的增加而上升。大量研究表明[22-24],在受到外源性雌激素暴露后,雄鱼的内分泌系统会受到干扰,最重要的一个标志就是雄鱼体内VTG含量升高,这会造成雄鱼精子发育失常、第二性征退化、性行为频次降低,甚至出现性别反转的现象。因此,本试验的结果表明,TCPP可能具有类雌激素的效应。
内分泌调控研究表明,斑马鱼内分泌系统与哺乳动物类似,大脑中雌激素受体在接收到血液中雌激素含量变化的信号后,会向下丘脑发出反馈信号,之后下丘脑做出反应,增加或减少向垂体释放促性腺激素释放激素。垂体中的促性腺激素释放激素受体会依据接收到的信号做出正确的反应,合成促性腺激素进入血液循环并传递至性腺,从而调控体内性激素的含量,此过程即为下丘脑-垂体-性腺轴调控系统[25-26]。而通过分析本试验中相关调控基因表达量的变化发现,血液中性激素含量升高后,雌激素受体和下丘脑均做出了正确的反应,即性激素受体基因做出正向调控,下丘脑中促性腺激素释放激素调控基因受到抑制以减少促性腺激素释放激素的合成量,而垂体在促性腺激素释放激素信号减少的情况下,却做出错误的反应,继续不断增加促性腺激素基因的表达量,从而产生更多的促性腺激素进入血液,促进性腺分泌性激素,这势必导致整个内分泌系统紊乱(见图7)。研究结果表明,TCPP会干扰内分泌系统的调控功能,影响斑马鱼的正常发育,且其作用位点可能位于脑垂体中。

图7 雌性和雄性斑马鱼基因调控示意图Fig. 7 Diagram of gene regulation in female and male zebrafish
Liu等[11]有关TDCPP和TPP(磷酸三苯酯)对斑马鱼繁殖毒性效应的研究表明,成年斑马鱼在经过21 d暴露后,其累积产卵量会显著减少。同时,血液中17β-雌二醇和VTG的含量都显著升高。同时,根据对大脑和性腺中相关基因的检测结果发现,下丘脑中促性腺激素释放激素的调控基因与对照组相比均表现为负调控或无变化,而脑垂体促性腺激素则主要表现为正调控,从而导致内分泌系统的紊乱。这与本研究中得到的结果一致,这表明OPFRs这类化合物可能都会对内分泌系统产生影响。
TCPP作为一种新兴的阻燃剂,它的使用量和使用范围正在逐年扩大,而目前有关TCPP的毒理学研究还非常匮乏。因此,本研究能够为政府部门有效管理这类化学品提供科学支持。
[1] Rahman F, Langford K H, Scrimshaw M D, et al. Polybrominated diphenyl ether (PBDE) flame retardants [J]. Science of the Total Environment, 2001, 275(1-3): 1-17
[2] Amani F, Doug C, Suzanne C, et al. In ovo effects of two organophosphate flame retardants—TCPP and TDCPP—on pipping success, development, mRNA expression, and thyroid hormone levels in chicken embryos [J]. Toxicological Sciences, 2013, 134(1): 92-102
[3] Ike V D V, Jacob D B. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis [J]. Chemosphere, 2012, 88(10): 1119-1153
[4] World Health Organization. Flame retardants: Tris-(chloropropyl) phosphate and tris-(2-chloroethyl) phosphate [R]. Geneva: WHO, 1998
[5] Luo Y L, Guo W S, Ngo H H, et al. A review on the occurrence of micropollutants in the aquatic environment and their fate and removal during wastewater treatment [J]. Science of the Total Environment, 2014, 473-474: 619-641
[6] Andresen J A, Grundmann A, Bester K. Organophosphorus flame retardants and plasticisers in surface waters [J]. Science of the Total Environment, 2004, 332(1-3): 155
[7] Hu M Y, Li J, Zhang B B, et al. Regional distribution of halogenated organophosphate flame retardants in seawater samples from three coastal cities in China [J]. Marine Pollution Bulletin, 2014, 86(1-2): 569-574
[8] Hoffman K, Daniels J L, Stapleton H M. Urinary metabolites of organophosphate flame retardants and their variability in pregnant women [J]. Environment International, 2014, 63(3): 169-172
[9] Laura V D, Christina M P, Ian T R, et al. Is the pentaBDE replacement, tris (1,3-dichloropropyl) phosphate (TDCPP), a developmental neurotoxicant? Studies in PC12 cells [J]. Toxicology and Applied Pharmacology, 2011, 256(3): 281-289
[10] Fu J, Han J, Zhou B S, et al. Toxicogenomic responses of zebrafish embryos/larvae to tris(1,3-dichloro -2-propyl) phosphate (TDCPP) reveal possible molecular mechanisms of developmental toxicity [J]. Environmental Science & Technology, 2013, 47(18): 10574-10582
[11] Liu X S, Ji K, Jo A, et al. Effects of TDCPP or TPP on gene transcriptions and hormones of HPG axis, and their consequences on reproduction in adult zebrafish [J]. Aquatic Toxicology, 2013, 134-135: 104-111
[12] Sean P M, Ellen M C, Heather M S, et al. Early zebrafish embryogenesis is susceptible to developmental TDCPP exposure [J]. Environmental Health Perspectives, 2012, 120(11): 1585-1591
[13] Wang Q W, Liang K, Liu J F, et al. Exposure of zebrafish embryos/larvae to TDCPP alters concentrations of thyroid hormones and transcriptions of genes involved in the hypothalamic-pituitary-thyroid axis [J]. Aquatic Toxicology, 2013, 126: 207-213
[14] Wibke B, Karen D, Martina F, et al. The zebrafish embryo model in toxicology and teratology, September 2-3, 2010, Karlsruhe, Germany [J]. Reproductive Toxicology, 2011, 31(4): 585-588
[15] Organization for Economic Co-operation and Development (OECD). Test No. 203: Fish, Acute Toxicity Test [S]. Medmenham: OECD, 1992
[16] Organization for Economic Co-operation and Development (OECD). Test No. 236: Fish Embryo Acute Toxicity (FET) Test [S]. Paris: OECD, 2013
[17] Organization for Economic Co-operation and Development (OECD). Test No. 204:Fish, Prolonged Toxicity Test: 14-day Study [S]. Paris: OECD, 1984
[18] Milesoki B E, Chambers J E, Chen W L, et al. Common mechanism of toxicity: A cause study of organophosphorus pesticides [J]. Toxicological Sciences, 1998, 41(1): 8-20
[19] 吴迪, 单正军, 韩志华, 等. 林丹短期暴露对斑马鱼生长发育和繁殖的影响[J]. 生态与农村环境学报, 2011, 27(1): 49-53
Wu D, Shan Z J, Han Z H, et al. Effects of short-term exposure to lindaneon growth and reproduction of zebrafish [J]. Journal of Ecology and Rural Environment, 2011, 27(1): 49-53 (in Chinese)
[20] Gopi R A, Sathya T N, Goparaju A, et al. Endocrine disrupting effect of fenvalerate 20% EC and mancozeb 80% WP in adult zebra fish (Danio rerio) using vitellogenin as a biomarker [J]. Bulletin of Environment, Pharmacology and Life Sciences, 2012, 1(6): 66-72
[21] Simpson E R, Mahendroo M S, Means G D, et al. Aromatase cytochrome P450, the enzyme responsible for estrogen biosynthesis [J]. Endocrine Reviews, 1994, 15(3): 342-355
[22] Afonso L O, Wassermann G J, Terezinha D, et al. Sex reversal in Nile tilapia (Oreochromis niloficus) using a nonsteroidal aromatase inhibitor [J]. Journal of Experimental Zoology, 2001, 290(2): 177-181
[23] Schwaigera J, Mallowa U, Ferlinga H, et al. How estrogenic is nonylphenol? A transgenerational study using rainbow trout (Oncorhynchus mykiss) as a test organism [J]. Aquatic Toxicology, 2002, 59(3-4): 177-189
[24] Sun L W, Zha J M, Wang Z J, et al. Effects of binary mixtures of estrogen and antiestrogens on Japanese medaka (Oryzias latipes) [J]. Aquatic Toxicology, 2009, 93(1): 83-89
[25] Peter R E, Yu K L. Neuroendocrine regulation of ovulation in fishes: Basic and applied aspects [J]. Reviews in Fish Biology & Fisheries, 1997, 7(2): 173-197
[26] Liang Y Q, Huang G Y, Ying G G, et al. The effects of progesterone on transcriptional expression profiles of genes associated with hypothalamic-pituitary-gonadal and hypothalamic-pituitary-adrenal axes during the early development of zebrafish (Danio rerio) [J]. Chemosphere, 2015, 128(1): 199-206
◆
附录(Appendix)
Toxicity Effects of A New Flame Retardant Tris(2-chloroisopropyl) Phosphate to Zebrafish (Daniorerio)
Pi Tianxing1,2, Cai Leiming2,*, Jiang Jinhua2, Zhao Xueping2, Wang Yanhua2, Wu Shenggan2, Su Lianshui2, Tang Tao2
1. College of Grassland and Environment Sciences, Xinjiang Agricultural University, Urumqi 830052, China 2. Institute of Quality and Standard of Agro-products, Zhejiang Academy of Agricultural Sciences, State Key Laboratory Breeding Base for Zhejiang Sustainable Pest and Disease Control/Key Laboratory for Pesticide Residue Detection of Ministry of Agriculture, Hangzhou 310021
To understand the ecological risk of fire retardant tris(2-chloropropyl) phosphate (TCPP), we investigated its toxic effects on adult zebrafish and zebrafish embryos. Acute toxicological study indicated that the LC50of TCPP for adult zebrafish in 96 h was 47.06 mg·L-1, and that for zebrafish embryos in 96 h was 26.01 mg·L-1. Moreover, TCPP could impair the embryo development, leading to deformed larvae. The 14-day chronic toxicity study indicated that the no observed effect concentration (NOEC) of TCPP towards adult zebrafish was 1.00 mg·L-1. The liver and gonad function index slightly declined with the chronic exposure of increased TCPP concentration. However, the levels of liver vitellogenin (VTG) and gonadal aromatase were increased. In addition, exposure to TCPP resulted in the increased expression of the genes involved in the biosynthesis of gonadotropin in the pituitary. Therefore, the acute toxicity of TCPP to adult zebrafish and its embryos was low toxicity grade. However, chronic exposure disrupted the endocrine system and affected the normal development of zebrafish.
tris(2-chloroisopropyl) phosphate (TCPP); zebrafish (Danio rerio); developmental toxicity

附表1 目标基因引物
10.7524/AJE.1673-5897.20150709002
农药助剂环境风险评估及管理研究(2013467026)
皮天星(1989-),男,硕士研究生,研究方向为环境毒理学,E-mail: ptx@163.com;
*通讯作者(Corresponding author), E-mail: hzcaileiming@foxmail.com
2015-07-09 录用日期:2015-12-25
1673-5897(2016)2-247-10
X171.5
A
简介:蔡磊明(1962—),男,博士,教授级高级工程师,主要研究方向为生态学、化学品安全评价及环境科学。
皮天星, 蔡磊明, 蒋金花, 等. 新型阻燃剂TCPP对斑马鱼的毒性研究[J]. 生态毒理学报,2016, 11(2): 247-256
Pi T X, Cai L M, Jiang J H, et al. Toxicity effects of a new flame retardant tris(2-chloroisopropyl) phosphate to zebrafish (Danio rerio) [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 247-256 (in Chinese)

