夹竹桃内生真菌R22的次生代谢产物研究
马养民, 乔 珂, 李梦云, 郭林新, 范 超
(陕西科技大学 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
夹竹桃内生真菌R22的次生代谢产物研究
马养民, 乔 珂, 李梦云, 郭林新, 范 超
(陕西科技大学 教育部轻化工助剂化学与技术重点实验室, 陕西 西安 710021)
为探究夹竹桃内生真菌R22次生代谢产物的结构和活性,采用硅胶柱色谱、Sephadex LH-20柱色谱、重结晶等方法对该菌株的发酵产物进行分离、纯化,并结合所得化合物的理化性质和波谱数据鉴定其结构.通过二倍稀释法对其次生代谢产物进行抑菌活性测试.最终从其发酵产物中分离得到六个化合物.经鉴定分别为丁二酸(1)、十六烷酸α-单甘油酯(2)、3-甲基-4-喹唑啉酮(3),cyclopenol(4)、尿囊素(5)、腺苷(6).其中化合物3为首次从自然界中分离得到,化合物5对植物病原真菌具有一定的抑菌活性.
夹竹桃; 内生真菌; 青霉属; 次生代谢产物; 抑菌活性
0 引言
植物内生真菌的次生代谢产物具有抗菌[1]、抗炎[2]、抗氧化[3]、抗肿瘤[4,5]等生物活性,为新药研发提供了强大的物质基础[6,7].由于药用植物内生真菌次生代谢产物更具独特性[8],因而近年来药用植物内生真菌代谢产物的研究越来越受到人们的重视[9].夹竹桃(Neriumindicum)为我国民间常用中药,具有强心利尿、抗麻风、杀虫、祛痰定喘、镇痛的药理功能[10].目前,国内外对夹竹桃活性成分研究报道多集中于其植物方面[11,12],而对其内生真菌次生代谢产物的研究报道较少.本课题以从夹竹桃根部分离得到的一株内生真菌(编号为R22)为研究对象,对其进行固态发酵,从其发酵产物中分离得到6个化合物,并对所得化合物进行了抑菌活性测试,以期为进一步开发和利用夹竹桃内生真菌奠定理论基础.
1 材料与方法
1.1 菌株
从秦岭地区的夹竹桃根部分离得到内生真菌R22,在4 ℃下用PDA培养基保存于实验室.活性测试菌株:革兰氏阳性菌(金黄色葡萄球菌、乳酸链球菌),革兰氏阴性菌(大肠杆菌、绿脓杆菌),植物病原真菌(苹果腐烂病菌、油菜菌核病菌、小麦赤霉病菌 、番茄灰霉病菌、烟草赤星病菌、白菜黑斑病菌、玉米大斑病菌、葡萄炭疽病菌、辣椒疫霉病菌、芍药炭疽病菌).以上测试菌均保存于实验室.
1.2 仪器、培养基与试剂
(1)仪器:RE52CS-1旋转蒸发仪,上海亚荣生化仪器厂;Bruker avance Ⅲ-400 MHz型核磁共振仪,德国布鲁克公司;柱色谱硅胶200~300目,青岛海洋化工厂分厂;薄层色谱硅胶G,青岛海浪硅胶干燥剂厂;柱色谱凝胶Sephadex LH-20,青岛海浪硅胶干燥剂厂.
(2)培养基与试剂:察氏培养基(葡萄糖30 g/L,KH2PO41.0 g/L,MgSO4·7H2O 0.5 g/L,NaNO33.0 g/L, KCl 0.5 g/L, FeSO40.01 g/L),牛肉膏蛋白胨液体培养基(牛肉膏5 g,蛋白胨10 g,NaCl 5 g,H2O 1 000 mL,pH 7.0),马铃薯葡萄糖(PDA)培养基(20 %马铃薯浸汁1 000 mL,葡萄糖20 g,琼脂20 g,自然pH),所用试剂均为国产分析纯.
1.3 菌种鉴定
(1)形态学鉴定:将菌株R22接种于PDA平板上,于28 ℃下培养5 d,至孢子成熟,观察记录菌落、菌丝生长状态.
(2)分子生物学鉴定:将菌株R22接种于PDA斜面培养基,在28 ℃下培养5 d至孢子成熟,利用CTAB法提取菌丝体基因组DNA做为模板,通过引物ITS1和ITS4扩增目标菌株的18S rDNA的ITS区[13].将测序获得的ITS序列在Genbank数据库中进行Blast分析,采用软件MEGA 5.0(邻接法NJ)构建系统发育进化树,对菌株R22与数据库中登陆的近源菌株系统发育进化树关系进行分析.
1.4 发酵与代谢产物的分离
(1)内生真菌的发酵:菌株R22经过活化后,从斜面接种到装有400 mL察氏培养基的1 000 mL锥形瓶中,在28 ℃、120 r/min下振荡培养5 d制备成种子培养液.将装好大米培养基(75 g大米,90 mL无糖察氏培养基)的发酵瓶于120 ℃下灭菌20 min,然后按照10%的(2)接种量将种子培养液接种于上述大米培养基中,共计接种420瓶,在28 ℃下静置培养30 d.
(2)代谢产物的提取与分离:将阴干的发酵产物(15.9 kg)用乙酸乙酯和甲醇分别反复提取,提取液经减压蒸馏得到浸膏2000 g.采用硅胶柱色谱对粗浸膏进行分离,以石油醚、石油醚/乙酸乙酯=1∶1、乙酸乙酯、乙酸乙酯/甲醇=1∶1、甲醇为溶剂进行梯度洗脱,得到5个部分(Fr. A~E).Fr B(145 g)以石油醚/乙酸乙酯/甲醇为溶剂进行梯度洗脱,重结晶得到化合物1(100 mg)、2(100 mg)、3(120 mg)、4(2.5 g),Fr.D(1 260 g)以乙酸乙酯/甲醇为溶剂进行梯度洗脱并采用Sephadex LH-20柱色谱法分离得到化合物5(100 mg)、6(200 mg).所有化合物经过1H-NMR和13C-NMR分析确定其结构.
1.5 抑菌活性测试
细菌培养基为牛肉膏蛋白胨液体培养基,植物病原真菌培养基为PDA(不加琼脂)培养基.根据二倍稀释法[14],将待测化合物溶解于DMSO溶剂中,配成质量浓度为1 mg/mL的样品溶液.将培养基按照每孔100μL的量依次加入到96孔板中,再向第1个孔中加入上述样品溶液100μL混合均匀,从第1孔中吸取100μL于第2孔中混合均匀,再从第2孔中吸取100μL于第3孔中混合均匀,依此法连续稀释至第10孔,从第10孔中吸取100μL弃去,第11孔和第12孔分别作为培养基和DMSO溶剂阴性对照.第1~10孔中化合物的质量浓度依次为500μg/mL、250μg/mL、125μg/mL、62.5μg/mL、31.2μg/mL、15.6μg/mL、7.8μg/mL、3.9μg/mL、1.95μg/mL和0.98μg/mL.用培养基配制浓度为106CFU/mL的活性测试菌悬液,向每孔中加入100μL菌悬液.选用青霉素钠作为革兰氏阳性菌的阳性对照,硫酸链霉素作为革兰氏阴性菌的阳性对照,多菌灵作为植物病原真菌的阳性对照.上述每组进行3次平行试验,将细菌试验组的96孔板置于37 ℃培养24 h、植物病原真菌试验组的96孔板置于28 ℃培养48 h后观察并记录结果.
2 结果与讨论
2.1 菌株R22的鉴定
对菌株R22进行形态学鉴定,其菌落外观初期为白色,随后变成翠绿色,后期为墨绿色;显微镜下能够明显观察到其分生孢子梗形如扫帚,因此初步确定菌株R22为青霉属,如图1所示.对其进行分子生物学鉴定,PCR扩增片段经测序表明,目标菌种的ITS序列同GenBank的基因序列相对比,与青霉属(Penicillium)的同源率达到98%(内生真菌R22的GenBank序列号为KU359776,基因序列为:GTAGGTGAACCTGCGGAAGGATCATTACCGA
GTGAGGGCCCTTTGGGTCCAACCTCCCACCC
GTGTTTATTTTACCTTGTTGCTTTGGCGGGCC
CGCCTTTACTGGCCGCCGGGGGGCTCACGCC
CCCGGGCCCGCGCCCGCCGAAGACACCCCC
GAACTCTGTCTGAAGATTGAAGTCTGAGTGA
AAATATAAATTATTTAAAACTTTCAACAACGG
ATCTCTTGGTTCCGGCATCGATGAAGAACGC
AGCGAAATGCGATACGTAATGTGAATTGCAA
ATTCAGTGAATCATCGAGTCTTTGAACGCAC
ATTGCGCCCCCTGGTATTCCGGGGGGCATGC
CTGTCCGAGCGTCATTGCTGCCCTCAAGCCC
GGCTTGTGTGTTGGGCCCCGTCCTCCGATTC
CGGGGGACGGGCCCGAAAGGCAGCGGCGG
CACCGCGTCCGGTCCTCGAGCGTATGGGGCT
TTGTCACCCGCTCTGTAGGCCCGGCCGGCGC
TTGCCGATCAACCCAAATTTTTATCCAGGTTGACCTCGGATCAGTAGGGATACCCG).综合形态学特征和ITS序列分析结果如图2所示,最终确定菌株R22为青霉属Penicillium.

图1 菌株R22的形态学特征
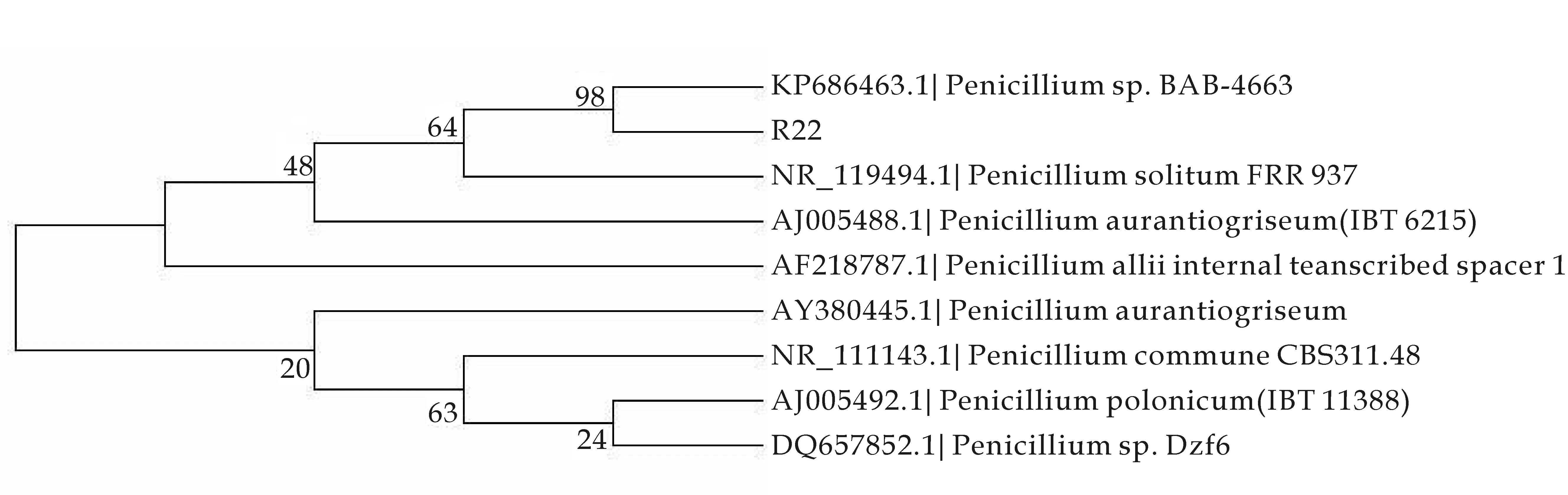
图2 基于ITS序列基础上的菌株R22系统发育分析
2.2 化合物结构鉴定
从菌株R22的固体发酵物中共分离得到6个化合物,分别为丁二酸(1)、十六烷酸α-单甘油酯(2)、3-甲基-4-喹唑啉酮(3),cyclopenol(4)、尿囊素(5)、腺苷(6).化合物1~6的结构式如图3所示.
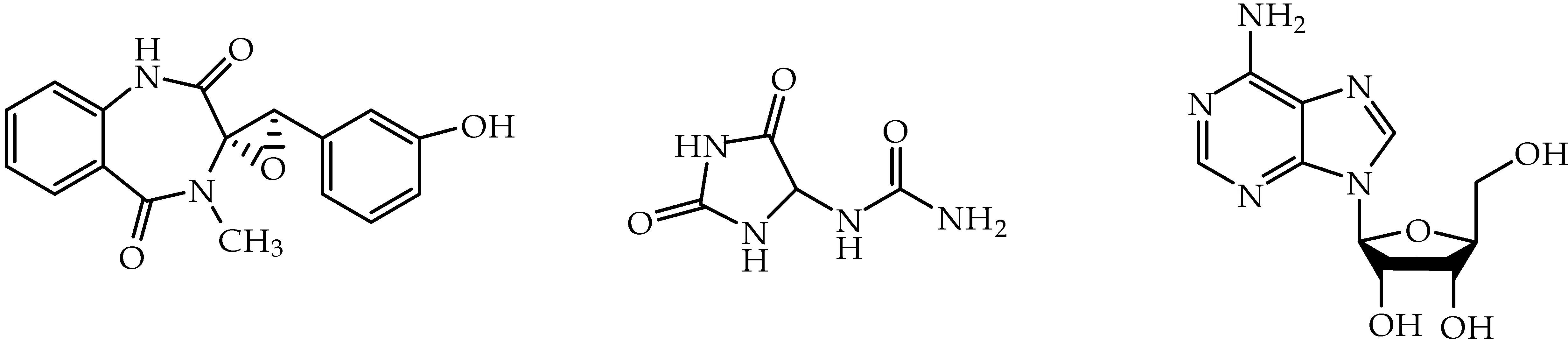
化合物4 化合物5 化合物6图3 化合物1~6的化学结构
化合物1:无色针状结晶(甲醇),mp:189 ℃~ 190 ℃.1H-NMR(400 MHz,DMSO-d6)δ(ppm):12.16(2H,s,H-COOH),2.42(4H,s,2-H,3-H);13C-NMR(100 MHz,DMSO-d6)δ(ppm):173.56(C-COOH),28.72(2-C,3-C).核磁数据与文献[15]一致,确定化合物1为丁二酸.
化合物2:白色块状结晶(氯仿),mp:68 ℃~ 69 ℃.1H-NMR(400MHz,DMSO-d6)δ(ppm):4.21(2H,m,1-H),3.96(1H,m,2-H),3.71(2H,m,3-H),2.37(2H,t,5-H),1.27(26H,m),0.9(3H,t,20-H);13C-NMR(100 MHz,DMSO-d6)δ(ppm):173.90(4-C),69.76(2-C),64.66(1-C),62.82(3-C),33.67(5-C),22.21 ~ 33.67(6 ~ 19-C),13.64(20-C).核磁数据与文献[16]一致,确定化合物2为十六烷酸α-单甘油酯.
化合物3:白色固体(甲醇),mp:104 ℃~ 105 ℃.1H-NMR(400 MHz,DMSO-d6)δ(ppm):8.43(1H,s,6-H),8.19(1H,d,J=8.4 Hz,2-H),7.79(1H,d,J=6.7 Hz,9-H),7.78-7.84(1H,m,8-H),7.55(1H,t,J=7.6 Hz,7-H),3.65(3H,s);13C-NMR(100 MHz,DMSO-d6)δ(ppm):160.97(4-C),147.36(5-C),146.39(2-C),133.81(9-C),126.96(10-C),126.71(8-C),126.11(7-C),121.36(6-C),33.71(3-CH3).核磁数据与文献[17]一致,确定化合物3为3-甲基-4-喹唑啉酮.
化合物4:白色结晶(甲醇),mp:215 ℃~ 217 ℃.1H-NMR(400 MHz,DMSO-d6)δ(ppm):10.84(1H,s,1-H),9.46(1H,s,15-OH),7.54(1H,t,J=7.7 Hz,8-H),7.15(1H,d,J=7.8 Hz,9-H),7.11(1H,t,J=7.5 Hz,7-H),7.02(1H,m,6-H),6.98(1H,t,J=7.8 Hz,17-H),6.71-6.64(1H,m,16-H),6.12(1H,t,J=1.9 Hz,14-H),6.00(1H,d,J=7.6 Hz,18-H),4.26(1H,s,10-H),3.07(3H,s,4-CH3);13C-NMR(100 MHz,DMSO-d6)δ(ppm):165.92(2-C),165.3(5-C),156.83(15-C),135.03(11-C),132.3(8-C),132.28(13-C),130.47(6-C),128.86(4′-C),126.4(12-C),124.19(7-C),121.01(9-C),116.92(18-C),115.63(15-C),112.68(14-C),70.08(3-C),63.67(10-C),30.83(4-CH3).核磁数据与文献[18]一致,确定化合物4为cyclopenol.
化合物5:白色粉末(甲醇),mp:226 ℃~ 228 ℃.1H-NMR(400 MHz,DMSO-d6)δ(ppm):10.56(1H,s,1-NH),8.08(1H,s,3-NH),6.91(1H,d,J=8.1 Hz,6-NH),5.81(2H,s,8-NH2),5.26(1H,d,J=8.1 Hz,4-H);13C-NMR(100 MHz,DMSO-d6)δ(ppm):173.55(5-C),157.29(7-C),156.71(2-C),62.36(4-C).核磁数据与文献[19]一致,确定化合物5为尿囊素.
化合物6:无色晶体(甲醇),mp:234 ℃~ 236 ℃.1H-NMR(400 MHz,DMSO-d6)δ(ppm):8.36(1H,s,8-H),8.14(1H,s,2-H),7.38(2H,s,6-NH2),5.88(1H,d,J=6.0 Hz,1′-H),5.48(1H,d,J=6.0 Hz,4′-OH),5.44(1H,dd,J=6.0 Hz,4.5 Hz,5′-OH),5.21(1H,t,J=4.2 Hz,3′-OH),4.62(1H,m,2′-H),4.13(1H,m,3′-H),3.97(1H,m,4′-H),3.55 ~ 3.67(2H,m,5′-H);13C-NMR(100 MHz,DMSO-d6)δ(ppm):156.12(6-C),152.33(2-C),148.98(4-C),139.88(8-C),119.31(5-C),87.83(1′-C),85.85(4′-C),73.35(2′-C),70.63(3′-C),61.63(5′-C).核磁数据与文献[20]一致,确定化合物6为腺苷.
2.3 化合物抑菌活性
以4株细菌和10株植物病原真菌为测试菌,对6个单体化合物进行抑菌活性测试,测试结果如表1所示.测试结果与阳性对照相比显示化合物5对植物病原真菌具有一定的抑菌活性,尤其对葡萄炭疽病菌、玉米大斑病菌、烟草赤星病菌、白菜黑斑病菌和油菜菌核病菌的最小抑菌浓度为62.5μg/mL,与阳性对照结果相当.
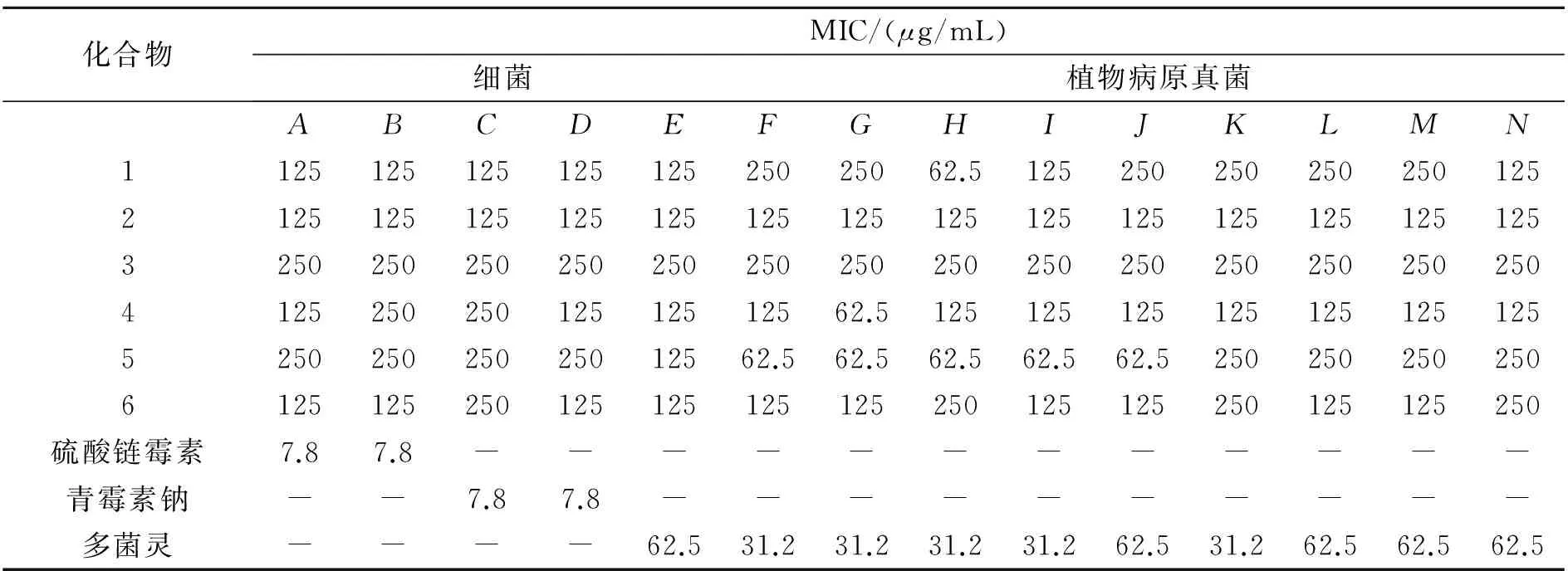
表1 化合物1~6对各测试菌的最小抑菌浓度
注:A:大肠杆菌(Escherichiacoli),B:绿脓杆菌(Pseudomonasaeruginosa),C:金黄色葡萄球菌(Staphylococcusaureus),D:乳酸链球菌(Streptococcuslactis),E:小麦赤霉病菌(Fusariumgraminearum),F:葡萄炭疽病菌(Colletotrichumghoeosporioides),G:玉米大斑病菌(Setosphaeriaturcica),H:烟草赤星病菌(Alteranrialongipes),I:白菜黑斑病菌(Alternariabrassicae),J:油菜菌核病菌(Solerotonidsclerotiorum),K:番茄灰霉病菌(Botrytiscinerea),L:辣椒疫霉病菌(Phytophthoracapsic),M:苹果腐烂病菌(Valsamali),N:芍药炭疽病菌(Peonylongipes),“-”:未设置试验.
3 结论
从夹竹桃内生真菌R22的发酵物中分离得到6个化合物,分别为丁二酸、十六烷酸α-单甘油酯、3-甲基-4-喹唑啉酮、cyclopenol、尿囊素、腺苷,其中化合物3为首次从自然界中分离得到,表明内生真菌R22的代谢产物具有多样性.抑菌测试结果表明尿囊素具有一定的抑菌作用.
[1] Luo J,Yan Z Y,Guo X H,et al.Isolation,identification and the antibacterial activity of endophytic fungi in euphorbia nematocypha hand[J].Mazz.Huaxi Yaoxue Zazhi,2007,22(4):380-382.
[2] Weber D,Sterner O,Anke T,et al.Phomol,a new antiinflammatory metabolite from an endophyte of the medicinal plant Erythrina crista-galli[J].Antibiot,2004,57(9):559-563.
[3] Strobel G,Ford E,Worapong J,et al.Isopestacin,an isobenzofuranone from pestalotiopsis microspora,possessing antifungal and antioxidant activities[J].Phytochemistry,2002,60(2):179-183.
[4] Ma W,Liu W,Li J,et al.Study on the antibacterial and antitumor activity of the metabolites which come from the endophytic fungi SY-25 by different ways of fermentation[J].Zhejiang Zhongyiyao Daxue Xuebao,2014,38(10):1 212-1 216.
[5] Deng C M,S X,Huang C H,et al.Secondary metabolites of a mangrove endophytic fungus Aspergillus terreus (No.GX7-3B) from the South China Sea[J].Mar.Drugs,2013,11(7):2 616-2 624.
[6] Schulz B,Boyle C,Draeger S,et al.Endophytic fungi:A source of novel biologically active secondary metabolites[J].Mycological Research,2002,106(9):996-1 004.
[7] Rodriguez R J,White J F J, Arnold A E, et al. Fungal endophytes:Diversity and functional roles[J].New Phytol,2009,182(2):314-326.
[8] 易晓华.植物内生真菌次生代谢产物研究进展[J].中国农学通报,2009,25(21):255-260.
[9] 刘蕴哲,何 劲,张 杰,等.植物内生真菌及其活性代谢产物研究进展[J].菌物研究,2005,3(4):30-36.
[10] 邢晓娟.夹竹桃的药理作用与临床应用[J].现代医药卫生,2007,23(16):2 466.
[11] Vinayagam A,Sudha P N.Separation and identification of phenolic acid and flavonoids fromNeriumindicumflowers.[J].Indian Chem.Soc,2015,92(7):1 143-1 148.
[12] Derwich E,Benziane Z,Boukir A.Antibacterial activity and chemical composition of the essential oil from flowers of nerium oleander[J].Ejeafche,Electron.J.Environ.,Agric.Food Chem,2010,9(6):1 074-1 084.
[13] 曹永军, 程 萍,喻国辉,等.利用ITS1和ITS4通用引物扩增香蕉枯萎病菌核酸片段鉴定其生理小种[J].热带作物学报,2010,31(7):1 098-1 102.
[14] Bharate S B,Khan S I,Yunus N A M,et al.Antiprotozoal and antimicrobial activities of O-alkylated and formylated acylphloroglucinols[J].Bioorg.Med.Chem,2007,15(1):87-96.
[15] Zhang J,Hou F,Lu M,et al.Rmacokinetics-pharmacology disconnection of herbal medicines and its potential solutions with cellular pharmacokinetic-pharmacodynamic strategy[J].Curr. Drug Metab.,2012,13(5):558-576.
[16] 刘劲松,王 刚,董 超,等.花生茎叶化学成分研究[J].中成药,2008,30(3):419-421.[17] Rao K R,Raghunadh A,Mekala R,et al.Glyoxylic acid in the reaction of isatoic anhydride with amines:A rapid synthesis of 3-(un)substituted quinazolin-4(3H)-ones leading to rutaecarpine and evodiamine[J].Tetrahedron Lett,2014,55(43):6 004-6 006.
[18] Fremlin L J,Piggott A M,Lacey E,et al.Cottoquinazoline A and cotteslosins A and B,metabolites from an
Australian marine-derived strain of Aspergillus versicolor[J].J Nat Prod,2009,72(4):666-670.
[19] 周 琴,李 宁,邢亚超,等.角果藜化学成分的分离与鉴定[J].沈阳药科大学学报,2013,30(9):674-676,682.
[20] 于 洋,宋卫霞,郭庆兰,等.金银花水提取物的化学成分研究[J].中国中药杂志,2015,40(17):3 496-3 504.
【责任编辑:蒋亚儒】
Studies of secondary metabolites from an endophytic fungi R22 ofNeriumindicum
MA Yang-min, QIAO Ke, LI Meng-yun, GUO Lin-xin, FAN Chao
(Key Laboratory of Auxiliary Chemistry & Technology for Chemical Industry, Ministry of Education, Shaanxi University of Science & Technology, Xi′an 710021, China)
To explore the structure and activity of secondary metabolites of endophytic fungus from R22 strain inNeriumindicum,the secondary metabolities from R22 were isolated by silica gel column,Sephadex LH-20 column chromatography,recrystallization, and so on.Their structures were determined by their physicochemical properties and spectrum data.And an MIC method was used in antibacterial activity test.Six compounds from fermentation of R22 were identified as succinicacid (1),daturic acid-2,3-dihydroxypropylester (2),3-methylquinazolin-4(3H)-one (3), cyclopenol(4),allantoin(5),adenosine(6).Compound 3 was isolated from the natural world for the first time.Compound 5 revealed some antimicrobial activity against the phytopathogeic fungi.
Neriumindicum; endophytic fungus;Penicillium; secondary metabolites; antimicrobial activities
2016-09-23
陕西省科技厅自然科学基础研究计划项目(2014JZ003)
马养民(1963-),男,陕西咸阳人,教授,博士生导师,研究方向:天然产物化学
1000-5811(2016)06-0125-05
O629
A

