高效液相色谱法测定水产品中15种多环芳烃
汤水粉,钱卓真,罗方方,王丽娟
(福建省水产研究所,福建 厦门 361013)
高效液相色谱法测定水产品中15种多环芳烃
汤水粉,钱卓真,罗方方,王丽娟
(福建省水产研究所,福建 厦门 361013)
本文采用QuEChERS 技术,对前处理条件进行改进,然后通过对色谱条件的优化,实现水产品中15种PAHs的高效液相色谱法检测。在优化条件下,15种PAHs线性范围为1~50 ng/mL,线性相关系数大于0.995;以信噪比(S/N)≥3 确定各组分的检出限,15种PAHs的检出限在0.1~2.0 μg/kg之间。对对虾样品进行15种PAHs污染物的加标实验,回收率在75.8%~101%范围内,相对标准偏差小于15.0%。最后,将QuEChERS-高效液相色谱法应用于实际样品中15种PAHs的检测,结果证明,该方法操作简便、灵敏度高,适用于水产品中PAHs污染物的检测。
多环芳烃(PAHs);水产品; 高效液相色谱; QuEChERS
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是由二至七个不等的苯环组成的芳香族化合物,为人们熟知的持久性有机污染物之一,也是世界上最早发现的对人类有致癌效应的一类污染物,具有潜在致癌、致畸、致突变效应等特点[1-2]。PAHs主要通过废水排放、大气沉降、地表径流及原油泄露等多种途径进入水体,对水生生物造成不利影响,并通过饮水、皮肤接触及水产品食用等途径危害人体健康。近年来,国内外均有报道PAHs在不同食品中的检出,其中蔬菜、水果、油品、谷类及烟熏肉制品等食品中均有PAHs检出[3-6]。世界各国对PAHs都有严格限制,美国EPA 将16 种多环芳烃列入优先控制污染物名单,欧盟以及WHO 也采取了限制PAHs 的措施[7],中国GB 2762—2005《食品中污染物限量》标准规定熏烤肉、粮食中苯并(a)芘限值5 μg/kg、植物油中为10 μg/kg[8]。因此,研究水体及水产品PAHs的污染特征及其健康风险具有重要意义。
目前,PAHs的检测方法主要有气相色谱-质谱联用法(GC-MS)[9-10]和高效液相色谱法[11-12]。分光光度法仅适用于某种特定PAHs的测定,且基质干扰较大,灵敏度达不到检测要求。GC-MS法引入特征碎片离子,对多组分具有较好的确证能力,但是提取过程繁琐,且三种苯并荧蒽难以用气相色谱法分离,重质PAHs的回收率较低[2]。高效液相色谱法操作简单,灵敏度高,且具有较好的选择性和准确性[13],是目前水产品药物残留检测的主要方法。因此,研究采用QuEChERS技术,对前处理条件进行改进,然后通过对色谱条件的优化,旨在实现水产品中15种PAHs的高效液相色谱法检测。
1 材料与方法
1.1 实验材料
鱼取背部肌肉;虾、蟹类等取可食部分。用绞肉机绞成浆状,装入洁净塑封袋,-18℃贮存。
1.2 仪器与试剂
Waters 2695液相色谱仪、Waters 2475荧光检测器、Empower工作站软件:Waters公司;漩涡振荡器:德国IKA;旋转蒸发仪:上海申生科技有限公司;低速离心机、高速离心机:上海安亭科学仪器厂。
PAHs标准品:德国Dr.Ehrenstorfer,纯度≥98%;Florisil/C18固相萃取小柱:北京振翔科技有限公司;无水硫酸钠,无水硫酸镁:国药集团化学试剂有限公司,分析纯;乙腈:美国Tedia,色谱纯;实验用水为Millipore Academic 制备的超纯水。
1.3 样品前处理方法
称取(5.00±0.05)g已均质的组织样品于50 mL具塞离心管中,加入5 mL超纯水,混合振摇1 min,然后加入15 mL乙腈剧烈振摇1 min,接着加入6 g无水硫酸镁和1.5 g无水乙酸钠,涡漩1 min,6 000 r/min离心5 min,使有机相和水相分层,有机相即样液。
Florisil/C18小柱用5 mL乙腈预淋洗,再准确移取5 mL样液上样,用5 mL乙腈洗脱三次,收集全部流出液于100 mL鸡心瓶中,旋蒸至近干,乙腈定容至1 mL,过0.2 μm滤膜后,供高效液相色谱分析。
1.4 仪器分析条件
色谱柱:Thermo HYPERSIL Green PAH,5 μm,4.6 mm× 150 mm;
流动相流速:1.0 mL/min;柱温:30℃;流动相为水(A)、乙腈(B)的混合溶液。梯度条件见表1。

表1 流动相梯度洗脱程序
1.5 标准曲线绘制
吸取适量的PAHs标准溶液,用乙腈-水配制成浓度为1.0、2.0、5.0、10.0、20.0、50.0 ng/mL的系列标准溶液,各吸取50 μL系列标准溶液进样分析,据各组分的响应峰面积与相应的质量浓度进行线性回归,绘制标准曲线。
1.6 回收率与精密度
称取(5.00±0.05)g匀浆后的样品,加入一定量不同浓度的PAHs标准溶液,然后按同样的样品前处理方法进行提取、净化以及高效液相色谱检测,计算各种多环芳烃的回收率及相对标准偏差。
2 实验结果与讨论
2.1 梯度洗脱条件的选择
结合参考PAHs色谱分析方法的文献报道[14-15],PAHs流动相主要是乙腈-水混合溶液,由于流动相的比例直接影响样品保留时间和峰面积,实验通过不同的有机相配比,即有机相浓度分别为40%、45%、51%、60%,对样品组分保留时间与目标峰的分离进行优化。实验结果发现,有机相太小,保留时间靠前的PAHs如萘、苊、芴菲、蒽不能较好的分离;有机相比例越大,保留时间靠前的13种PAHs组分分离较好,而高分子量的PAHs保留时间长且峰形差。因此,本实验经过优化,选择梯度程序进行洗脱,确保15种多环芳烃物质的有效分离。
2.2 检测波长的选择
相对紫外检测法,荧光检测法受杂质的干扰较小,灵敏度较高,因此采用荧光法测定15种PAHs污染物。参考相关的文献报道[16-17],同时根据15 种PAHs 的保留时间和最佳激发波长、发射波长,确定各个物质的测定波长(表2)。在优化的检测条件下,各种PAHs污染物能够很好的分离,且基线平稳、峰形好(图1)。

表2 PAHs的荧光检测波长程序

2.3 提取净化方法的选择
目前,针对食品样品基质中PAHs的前处理技术主要有液液萃取、固相萃取、固相微萃取、超临界流体萃取法等。
由于PAHs属于亲脂性物质,容易在样品的脂质组分中扩散,并存在于组织细胞内部[18],因此必须选择合适的提取方法才能有效分离萃取PAHs。实验分别考察了正己烷-二氯甲烷、甲醇-氢氧化钾-环己烷以及QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe) 技术等几种前处理方法对PAHs提取效率的影响。实验结果发现,当用正己烷-二氯甲烷提取时,回收率不能满足要求;用甲醇-氢氧化钾-环己烷提取步骤繁琐;QuEChERS 技术通过乙腈沉降蛋白,无水乙酸钠和无水硫酸镁进行盐析脱水,再用Florisil /C18固相萃取柱去除脂肪,实验发现,当采用QuEChERS 技术对水产品中15种PAHs进行提取时,基质干扰小、回收率高,能满足水产品中农药残留检测要求。因此,实验采用QuEChERS 技术对水产品中15种多环芳烃进行提取。
然而在用Florisil /C18固相萃取柱除脂过程中发现,当用乙腈进行一次洗脱时,回收率很低,进而进行二次洗脱。实验结果表明,第二次洗脱液中仍有部分待测物,两次洗脱后回收率仍达不到要求。因此,本实验采用三次洗脱并收集全部流出液的方法进行除脂净化。
2.4 浓缩过程的优化
PAHs是挥发性碳氢化合物,所以在浓缩过程中可能会有挥发损失。实验也发现,在旋蒸浓缩时,如果完全蒸干,对低碳的物质尤其是PAHs中萘的回收率有很大影响,这可能就是因为PAHs沸点较低,过分蒸干导致目标物挥发。因此,为了防止易挥发组分在浓缩过程中挥发损失,在实验中,待测组分旋转蒸发浓缩至近干,然后用乙腈定容至1 mL。再过0.22 μm有机滤膜,待测。
2.5 线性相关和检出限
吸取适量PAHs标准溶液,用乙腈-水配制成浓度为1.0、2.0、5.0、10.0、20.0、50.0 ng/mL的系列标准溶液,各吸取50 μL进样分析,据各组分的响应峰面积与相应的质量浓度进行线性回归,绘制标准曲线,结果见表 2。以信噪比(S/N)≥3 确定各组分的检出限,萘的检出限为2.0 μg/kg,芴、芘、苯并(a)蒽、苯并(k)荧蒽为0.1 μg/kg,苯并(a)芘为0.5 μg/kg,其它PAHs为1.0 μg/kg。可见15 种PAHs 的线性良好,灵敏度较高,说明高效液相色谱法可用于水产品中15种PAHs含量的测定。

表3 15种多环芳烃的线性方程及相关系数
2.6 方法准确性
以虾、蟹、鱼等样品为研究对象,在相同的样品处理条件下对15种PAHs污染物进行加标回收和精密度实验。图2为对虾样品和加标样品的色谱图,以考察方法的准确度和重现性;实验结果见表4。从表4可知,在不同浓度的加标浓度下,样品的回收率均在75.8%~101%之间,相对标准偏均差在15.0%以下。从试验结果可以看出,高效液相色谱法的准确度和精密度满足水产品中PAHs污染物残留检测的要求。


表4 对虾加标样的回收率和相对标准偏差
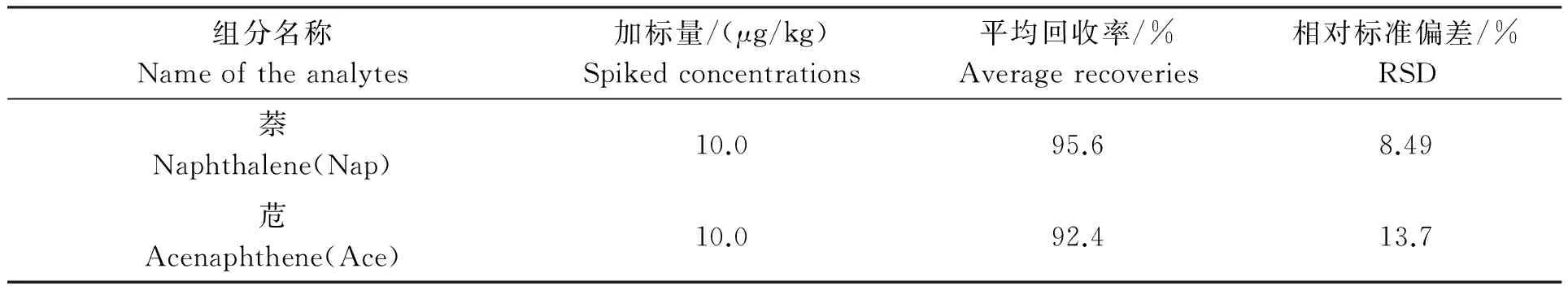
组分名称Nameoftheanalytes加标量/(μg/kg)Spikedconcentrations平均回收率/%Averagerecoveries相对标准偏差/%RSD萘Naphthalene(Nap)10.095.68.49苊Acenaphthene(Ace)10.092.413.7

续表4
3 实际样品应用
实验应用QuEChERS技术结合高效液相色谱法,对2014年采集的60个虾、蟹样品进行分析,实验结果表明,该方法准确度高、实用性强,适用于水产品中PAHs的检测,该方法为进一步排查水产中PAHs的隐患和风险评估提供技术支持。
4 结论
实验通过对前处理条件及检测条件的优化,实现水产品中15种PAHs污染物残留的同时测定。在提取过程中,采用QuEChERS技术提取样品中的PAHs;而在色谱检测时,采用荧光法,通过多梯度程序和检测波长的优化,实现水产品中15种PAHs的有效分离。
在本实验检测条件下,15种PAHs线性范围为1~50 ng/mL,线性相关系数均大于0.995。以信噪比(S/N)≥3确定各组分的检出限,萘的检出限为2.0 μg/kg,芴、芘、苯并(a)蒽、苯并(k)荧蒽为0.1 μg/kg,苯并(a)芘为0.5 μg/kg,其它PAHs为1.0 μg/kg。对对虾样品进行加标实验,当加标量为10 μg/kg时,回收率在75.8%~101%之间,相对标准偏差均在15.0%以下。QuEChERS-高效液相色谱法与其他常用提取方法相比,能有效提高水产品中PAHs的回收率,而且设备简单、操作简便、灵敏度高,适用于水产品中PAHs污染物的检测。
[1]秦宁,何伟,王雁,等.巢湖水体和水产品中多环芳烃的含量与健康风险[J].环境科学学报,2013,33(1):230-230.
[2]王丽,金芬,张雪莲,等.食品中多环芳烃及卤代多环芳烃的研究进展[J].食品工业科技,2012,33(10):369-377.
[3]Veyrand B,Brosseaud A,Ludovic S.Innovative method for determination of 19 polycyclic aromatic hydrocarbons in food and oil samples using gas chromatography coupled to tandem mass spectrometry based on an isotope dilution approach[J].Journal of chromatography A,2007,1149(2):333-344.
[4]XIA Z H,DUAN X L,QIU W X,et al.Health risk assessment on dietary exposure to polycyclic aromatic hydrocarbons(PAHs)in Taiyuan,China[J].Science of the Total Environment,2010,408(22):5331-5337.
[5]Guillen M D,Goicoechea E,Palencia G,et al.Evidence of the formation of light polycyclic aromatic hydrocarbons during the oxidation of edible oils in closed containers at room temperature[J].Journal of Agricultural and Food Chemistry,2008,56(6):2028-2033.
[6]Purcaro G,Moret S,Conte L S.Optimisation of microwave assisted extraction(MAE)for polycyclic aromatic hydrocarbon(PAH)determination in smoked meat[J].Meat Science,2009,81(1):275-280.
[7]肖海清,王星,王超,等.超高效液相色谱法测定塑料中的多环芳烃塑料中16 种多环芳烃的测定[J].分析试验室,2008,27(S2):225-229.
[8]吴永宁,王绪卿,杨惠芬,等.GB 2762—2005 食品中污染物限量[S].北京:中华人民共和国卫生部,2005.
[9]尹怡,郑光明,朱新平,等.分散固相萃取/气相色谱-质谱联用法快速测定鱼、虾中的16种多环芳烃[J].分析测试学报,2011,30(10):1107-1112.
[10]钟惠英,郑丹,杨家锋,等.SC/T 3042—2008水产品中16种多环芳烃的测定气相色谱-质谱法[S].北京:中华人民共和国农业部,2008.
[11]杨帆,翟毓秀,任丹丹,等.高效液相色谱-荧光-紫外串联测定海洋沉积物中16种多环芳烃[J].渔业科学进展,2013,34(5):104-111.
[12]孙福生.反相高效液相色谱测定土壤中多环芳烃[J].苏州城建环保学院学报,2000,13(3):24-30.
[13]Rupert S,Sonja P,Elke A.Validation(in-house and collaborative)of a method based on liquid chromatography for the quantitation of 15 European-priority polycyclic aromatic hydrocarbons in smoke flavourings:HPLC-method validation for 15 EU priority PAH in smoke condensates[J].Food Chemistry,2007,104(2):876-887.
[14]Serpe F P,Esposito M,Gallo P,et al.Optimisation and validation of an HPLC method for determination of polycyclic aromatic hydrocarbons(PAHs)in mussels[J].Food Chemistry,2010,122(3):920-925.
[15]ZHANG H,XUE M,DAI Z Y.Determination of polycyclic aromatic hydrocarbons in aquatic products by HPLC-fluorescence[J].Journal of Food Composition and Analysis,2010,23(5):469-474.
[16]Ramalhosa M J,Paiga P,Morais S,et al.Analysis of polycyclic aromatic hydrocarbons in fish:evaluation of a quick,easy,cheap,effective,rugged and safe extraction method[J].Journal of Separation Science,2009,32(20):3529-3538.
[17]Pensado L,Casais M C,Mejuto M C,et al.Application of matrix solid-phase dispersion in the analysis of priority polycyclic aromatic hydrocarbons in fish samples[J].Journal of Chromatography A,2005,1077(2):103-109.
[18]孙秀梅,胡红美,梅光明.高效液相色谱-荧光检测法测定贝类中15 种多环芳烃[J].广州化工,2014,42(13):123-125.
Determination of 15 polycyclic aromatic hydrocarbons(PAHs)residues in aquatic products by high performance liquid chromatography
TANG Shuifen,QIAN Zhuozhen,LUO Fangfang,WANG Lijuan
(Fisheries Research Institute of Fujian,Xiamen 361013,China)
The testing conditions were optimizing and improving based on QuEChERS technique combined with high performance liquid chromatography(HPLC),which is frequently used for pesticide detection in aquatic products.In the optimized conditions,15 polycyclic aromatic hydrocarbons(PAHs)residues in aquatic products were separated and detected by HPLC.The calibration curves were linear in a concentrations range of 1~50 ng/mL for 15 PAHs with correlation coefficients over 0.995.As(S/N)≥3,the limits of detection was 0.1~2.0 μg/kg.The average recovery ranged from 75.8% to 101% and the relative standard deviation was below 15.0% for spiked shrimp sample with PAHs.Finally,QuEChERS-HPLC was applied for PAHs detecting in practical samples and presented that this method was simple and sensitive to be suitable for PAHs determination in aquatic products.
polycyclic aromatic hydrocarbons(PAHs);aquatic products;high performance liquid chromatography;QuEChERS
2016-08-11 资助项目:福建省省属公益类科研院所基本科研专项(2014R1003-13);闽台重要海洋生物资源高值化开发技术公共服务平台(2014FJPT01);福建重要海洋经济生物种质库与资源高效开发技术公共服务平台(14PZY017NF17).
汤水粉(1985-)女,工程师,主要从事水产品质量安全检测.E-mail:powder2005@126.com
O656.31
A
1006-5601(2016)05-0394-08
汤水粉,钱卓真,罗方方,等.高效液相色谱法测定水产品中15种多环芳烃[J].渔业研究,2016,38(5):394-401.

