原发性胆汁性胆管炎的预后评估
陈丹丹 梁庆升 孙颖 邹正升
·综 述·
原发性胆汁性胆管炎的预后评估
陈丹丹 梁庆升 孙颖 邹正升
原发性胆汁性胆管炎(primary biliary cholangititis, PBC,原名原发性汁性肝硬化)是一种以慢性、非化脓性、破坏性肝内小胆管炎为特征的自身免疫性肝病,主要发生在中年女性。随着对PBC认识的深入,目前发现该病有逐年增多的趋势,很多患者在无症状期或在疾病较早阶段就被确诊,肝硬化只是该病进展到晚期的表现。PBC患者的总体生存寿命显著低于一般人群,但是基于个体而言,疾病的进程和预后变化甚大[1]。目前熊去氧胆酸(UDCA)是唯一被认可的治疗PBC的药物,而肝移植仍然是终末期PBC患者唯一有效的治疗手段[2]。准确地评估PBC患者的预后对于临床病情的判断及治疗方案的确定至关重要。本文为阐明PBC患者的预后影响因素及介绍常用的评估PBC预后的模型进行如下综述。
一、决定PBC预后的因素
正确评估PBC患者的预后对于临床治疗至关重要。目前认为影响疾病进展的因素主要包括:男性,青年时被确诊为PBC,组织学存在肝硬化,随着肝纤维化进展而迅速出现的胆管缺失,高胆红素血症,血清白蛋白降低,碱性磷酸酶升高,食管静脉曲张,肝细胞癌,对熊去氧胆酸(UDCA)生化学应答欠佳。确诊PBC时患者具有的症状对于疾病预后的影响意义尚不明确,但给予熊去氧胆酸治疗及肝移植手术可显著改善PBC患者的预后。

表1 与PBC预后不良的相关因素
二、组织学相关的预后因素
组织学评价PBC的疾病严重程度基于Scheuer和Ludwig评分系统,两种评分系统均将PBC分为四期。最初发现组织学分期与PBC预后具有相关性的是一项有关青霉胺的临床试验[3]。由于青霉胺并不能延缓PBC患者的组织学进展,研究发现,青霉胺治疗三年后,大约80%的患者在组织学分期上出现了至少一期的进展,31%的I期PBC患者在4年内进展至肝硬化期。但在 UDCA治疗 PBC患者的研究中发现,经UDCA治疗的I期PBC患者在随访5年时仅有4% 发生肝硬化[4]。 研究发现组织学处于早期的PBC患者预后较好, 一旦发展至肝硬化期,则发生失代偿及肝癌的风险显著增加[2], UDCA治疗能延缓PBC患者的组织学进展[4]。但对于PBC的特殊类型,PBC变异的患者,其在无肝硬化阶段即出现胆管消失,这类患者表现为严重的胆管炎、进行性黄疸、高胆固醇血症,病情进展迅速,可能需要在发生肝硬化之前进行肝移植[5]。
除组织学分期,还有一些组织学特征,如存在小叶中央区及汇管区胆汁淤积[6],汇管区细胞碎屑样坏死[4],界面炎以及胆管消失[7]等均与 PBC预后不良密切相关。
三、治疗疗效相关预后因素
PBC治疗方案的选择是有限的。UDCA是目前唯一被随机对照试验证实安全有效的药物,对于UDCA治疗无应答而病情进展的患者,肝移植能显著提高生存率, 是目前唯一治疗终末期PBC患者有效的方法[8]。一项来自安慰剂对照、双盲研究的数据分析显示,PBC患者经UDCA治疗4年,可显著改善其生存率[9], 接受UDCA治疗的早期PBC患者,其生存率与正常人群相当,但进展期患者,相比同年龄同性别的正常健康对照人群,其生存率是降低的。PBC患者的肝纤维化不能逆转,但经过UDCA治疗可延缓患者的组织学进展[10]。一项Meta分析显示,在安慰剂对照、长期随访(超过2年)或大样本量(病例数超过100例)的研究中,使用UDCA治疗的PBC患者不仅血清生化指标得到了改善,而且降低了肝移植手术和死亡的风险[11]。因此可以认为未经UDCA治疗以及进展期才接受UDCA治疗的PBC患者预后较差。
四、性别及确诊PBC的年龄
性别和年龄在决定PBC预后方面亦具有重要意义,英国的一项具有里程碑意义的研究发现[12],在2 353例PBC患者的队列研究中,男性出现UDCA生化应答的较少,其预后相对较差。而PBC的确诊 年龄与UDCA发生生化应答的几率呈负相关,这一结论证实了性别与确诊年龄在预测PBC进展中的重要性。
五、确诊时患者的症状
大多研究以为,无症状的PBC患者与有症状者相比,前者的组织学通常处于早期,而其生化指标通常较好,胆红素水平较低、血清蛋白水平较高。随着时间的推移,大部分无症状患者会逐渐出现临床症状[13-17]。 95%左右的无症状患者在20年后均会发展为有症状患者[18]。无症状患者一旦出现症状,其生存率便与初始有症状的患者相当[15, 19]。
六、血清学相关预后因素
抗线粒体抗体(AMA)对于诊断PBC具有高度特异性,超过95%的PBC患者AMA阳性,对于AMA阳性,但肝脏生化学指标正常和无症状的人群,随着时间的推移可能会逐渐发展为PBC。通常研究认为AMA与PBC的预后无显著相关性[20],但Klein等[21]的研究发现, AMA亚型可能与PBC的预后具有相关性,单纯AMA-M9阳性及AMA-M2阳性,或AMA-M2伴有AMA-M9阳性的患者预后较好,但AMA-M2阳性的患者如伴有AMA-M4,AMA-M8阳性,则预后较差。 对于AMA及其亚型与PBC预后的相关性仍需要进一步研究 。
抗核抗体(ANA)可出现在50%左右的PBC患者的血清中。针对核点型靶抗原蛋白(Sp100)和抗核孔复合体(Gp210)的抗核抗体对于PBC患者具有高度的特异性,尤其在AMA阴性的患者中更具有诊断价值[22]。而Gp210抗体阳性的患者可能更容易出现疾病活动和肝衰竭[23],是疾病预后不良的预测因素。
七、生化学相关预后因素
PBC诊断的重要生化学指标是血清碱性磷酸酶(ALP)水平升高,可伴或不伴有谷氨酰转肽酶(γ-GT)的升高,当仅有 ALP和γ-GT升高时提示PBC处于胆汁淤积的早期,而当总胆红素升高时,则预示疾病处于进展期[24]。血清胆红素水平是一项重要的PBC预后的预测因子,大多数PBC评分和预测模型都包含了此项指标。Shapiro等[25]提出了胆红素在PBC进展中的两阶段模式,在第一阶段血清胆红素呈持续稳定状态,这一阶段可维持多年,第二阶段胆红素呈急剧上升,被称为“加速期”,当多次检测血清胆红素大于2 mg/mL时,则预示着PBC进入晚期阶段,数年后将会死亡。在接受UDCA治疗及安慰剂治疗的血清胆红素正常的PBC患者,两组PBC患者的非移植生存率是无显著性差异的[26];而胆红素异常的PBC患者,UDCA治疗组与安慰剂治疗组,二者生存状况也是无显著性差异的。也就是说,不论治疗与否,血清胆红素水平都是一个强有力的临床终点事件的预测指标,对于评估PBC的预后具有重要价值。血清ALP水平对于非肝移植PBC患者的生存预测具有独立以及补充的的预测价值。白蛋白也是一个重要的预测PBC失代偿的生化因子。血清白蛋白降低被认为是发展为肝硬化和死亡的独立预测因子。
研究UDCA治疗不同时间点,血清胆红素、白蛋白、碱性磷酸酶、谷草转氨酶和(或)谷氨酰转肽酶水平的下降值,可能对于预测非肝移植PBC患者的 生存情况具有重要的意义。 目前有多个评价PBC治疗生化应答的标准(见表2),这些标准对于评估PBC预后具有较好的临床应用价值,已被广泛接受。
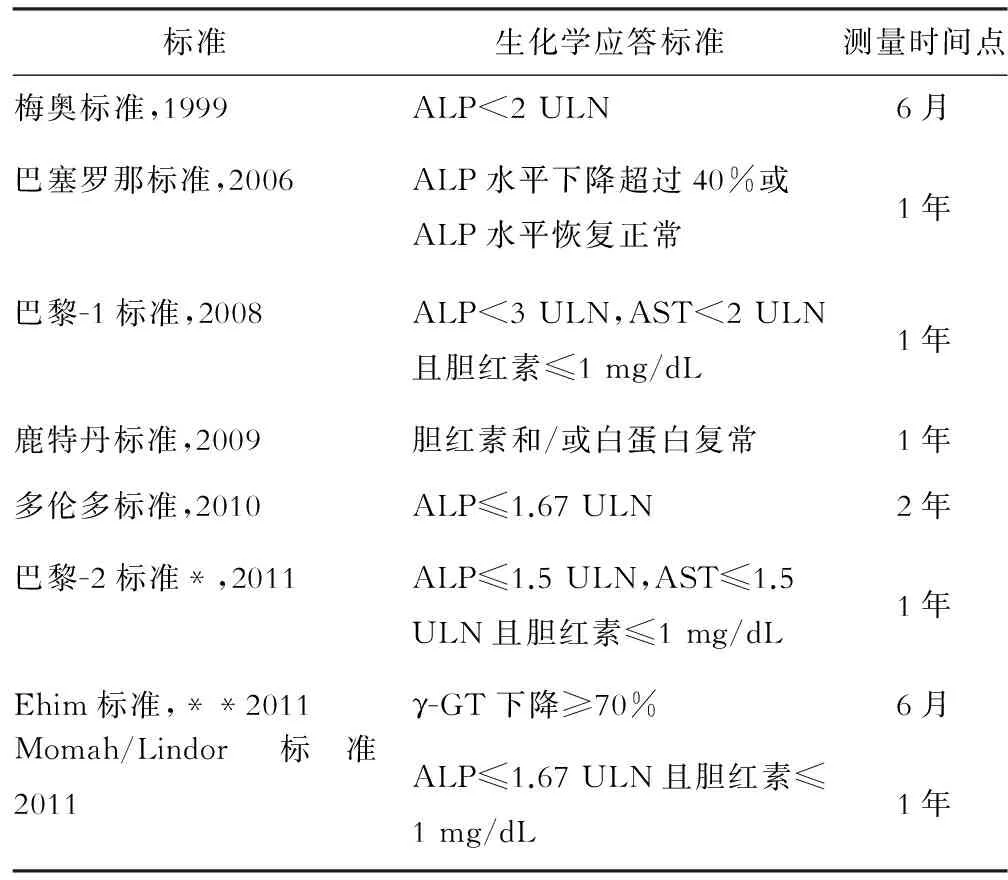
表2 常用UDCA治疗生化学应答标准
注:*仅适用于早期PBC患者,**日本人群
八、非肝移植生存的预后模型
建立PBC预后模型、准确估计PBC患者的生存情况,对于指导临床策略的制订及筛选肝移植手术等待患者具有重要的意义。目前使用生化学指标、临床特征和(或)组织学特征建立的数字预测模型均能较好的预测PBC的生存率,而在这些模型中,血清胆红素和年龄均为模型的重要组成部分。Roll等[27]研究表明,确诊PBC时的年龄、肝肿大的水平、血清胆红素水平升高都是与生存相关的独立因素,也有研究显示[28],胆红素的log值、曲张静脉破裂出血、白蛋白、年龄和腹水是预测PBC预后的独立因素。
欧洲模型和梅奥风险素评分是目前两个重要的PBC预测模型(表3)。欧洲模型是Christensen等[29]在1985年发表的文章中提出的。这个模型包含了确诊时的年龄、胆红素水平、白蛋白水平、肝硬化、小叶中央胆汁淤积和基线的硫唑嘌呤的使用情况。1993年这个研究团队又提出了时间依赖的模型,模型认为高胆红素血症,低蛋白血症,腹水,消化道出血,高龄这些时间依赖性的变量均是独立预测PBC预后不良的风险因子,而肝硬化,小叶中央区胆汁淤积组织学特征以及免疫球蛋白IgM低水平可能也是PBC预后不良的预测因素。
梅奥模型是另一个常用的预测PBC患者生存可能性的评分模型。该模型最初是1989年提出的[30],该模型包含临床和生化变量,如患者年龄、血清胆红素水平、白蛋白水平、凝血酶原时间、水肿的严重程度。该模型最大的优点是变量中不包含肝脏组织学特征,但缺点是该模型变量是基于基线特征,而非时间依赖性,使得其对预测生存的价值下降。1994年提出了改良的梅奥模型,可以对PBC疾病进程的任意阶段进行生存预测,该模型使用最近一次随访时的预测变量,使得其预测短期生存率较原始的梅奥模型更为有效,对于预测短期生存率具有较大的优势,提高了预测PBC患者2年内存活率的精确度。

表3 PBC重要的预后模型
2000年又提出了梅奥PBC自然史模型[31],该模型适用用于PBC肝移植的筛选。该模型的评分与 Child-Turcotte-Pugh 评分相似,包含5个变量:年龄(<38岁, 0 分,38~62岁1 分, ≥63 岁,2 分),总胆红素(<1 mg/dL, 0 分;1~1.7 mg/dL,1分; 1.7~-6.4 mg/dL,2分; >6.4 mg/dL,3分),评分超过6分,凝血酶原时间(正常为1分,延长为2分),水肿(无水肿为0分,有水肿为1分) 。当该评分达到6分时,Kaplan-Meier生存评估提示90.6%的PBC患者仅能存活1年,因此该模型适用于肝移植等待人群的筛选。
除上述模型以外,一些肝脏预测评分如终末期肝脏疾病模型(MELD)评分、Child-Pugh 评分、白蛋白/胆红素评分(AlbI)评分也可用于PBC患者的预后评估。
九、门脉高压(Portal hypertension)和食管静脉曲张(Esophageal varices)的预测
与其他原因所致肝硬化不同,PBC患者在疾病的早期可能即出现门脉高压的表现,不论有无肝硬化失代偿,均可出现食管静脉曲张[32]。出现食管静脉曲张的PBC患者预后较差,有食管静脉曲张的 PBC患者其5年生存率显著低于和无食管静脉曲张的患者(分别为63%和91%)[32]。存在食管静脉曲张的PBC患者预后差,可能与这部分患者更易出现曲张静脉破裂出血而增加死亡风险有关。因此,及时诊断和预防性治疗食管静脉曲张对于改善PBC患者的预后具有重要的临床意义。
发生食管静脉曲张的患者,93%梅奥风险评分≥4.0[33],而梅奥风险评分≥4.5同时血小板<140×109/L是发生食管静脉曲张的独立危险因素[34]。2009年美国肝病研究学会(AASLD)PBC指南推荐对血小板<140×109/L,梅奥风险评分>4.1分的PBC患者需密切监测有无食管静脉的曲张[2]。
最近,有人提出PBC的Newcastle静脉曲张评分用来预测食管静脉曲张[32],这一评分认为低蛋白血症、血小板减少、ALP水平异常、脾肿大都是静脉曲张进展的独立预测因素。
十、肝细胞癌(HCC)的预测
一项新近的系统回顾和Meta分析显示,PBC患者与一般人群相比,发生HCC的 相对危险度为18.8(95%可信区间为10.81~26.79),HCC是PBC患者最常见的肿瘤[35]。发生肝细胞癌的PBC患者预后是极差的。
疾病早期阶段的患者发生HCC的相对少见[36],PBC进展期患者更易发生HCC[37]。Jones等[38]对667例早期(I期或II期)和晚期(III期和IV期)患者进行随访,两组患者随访时间相仿。该研究的16例发生HCC的PBC病例均发生在疾病的进展期(III期和IV期,而在疾病早期患者中无一例发生HCC。然而,日本的一项新的对178名HCC患者的一项研究发现,在PBC的4个组织学分期中均可发生HCC[39],特别是在男性患者。女性患者一旦发生肝硬化,其发生HCC的危险则显著增加, 男性、女性PBC患者的10年HCC发生率分别为6.5%和2.0%(P<0.0001)。
肝癌相关危险因素中男性及PBC进展期是最多被报道的危险因素。通常认为高龄、男性、输血史、具有门脉高压表现、肝硬化患者更易发生HCC[36],而UDCA治疗无生化应答的患者可能是HCC的另一重要危险因素[40]。UDCA治疗生化学无应答是HCC发生的最强的预测危险因子。建立PBC患者的监控策略,特别是对于老年男性PBC患者的密切监测随访,有助于早期发现HCC,从而改善其预后[2]。
综上所述,与PBC疾病进展及预后不良相关的因素主要包括: 确诊PBC时的年龄较小,男性,组织学上存在肝硬化,肝纤维化程度相关的显著胆管发育不良,高胆红素血症,血清白蛋白降低,碱性磷酸酶升高,存在食管静脉曲张,肝细胞癌,以及对熊去氧胆酸(UDCA)生化学应答欠佳。确诊PBC时患者具有的症状对于预后的意义尚不明确。男性、肝硬化、特别是对熊去氧胆酸无应答是进展为肝细胞癌的危险因素。熊去氧胆酸治疗及肝移植手术可显著改善PBC患者的预后。
[ 1 ] Floreani A, Caroli D, Variola A, et al. A 35-year follow-up of a large cohort of patients with primary biliary cirrhosis seen at a single centre. Liver Int, 2011,31:361-368.
[ 2 ] Lindor KD, Gershwin ME, Poupon R, et al. Primary biliary cirrhosis. Hepatology, 2009,50:291-308.
[ 3 ] Gong Y, Frederiksen SL, Gluud C. D-penicillamine for primary biliary cirrhosis. Cochrane Database Syst Rev, 2004:CD004789.
[ 4 ] Corpechot C, Carrat F, Poupon R, et al. Primary biliary cirrhosis: incidence and predictive factors of cirrhosis development in ursodiol-treated patients. Gastroenterology, 2002,122:652-658.
[ 5 ] Vleggaar FP, van Buuren HR, Zondervan PE, et al. Jaundice in non-cirrhotic primary biliary cirrhosis: the premature ductopenic variant. Gut, 2001,49:276-281.
[ 6 ] Christensen E, Neuberger J, Crowe J, et al. Beneficial effect of azathioprine and prediction of prognosis in primary biliary cirrhosis. Final results of an international trial. Gastroenterology, 1985,89:1084-1091.
[ 7 ] Corpechot C, Carrat F, Bonnand AM, et al. The effect of ursodeoxycholic acid therapy on liver fibrosis progression in primary biliary cirrhosis. Hepatology, 2000,32:1196-1199.
[ 8 ] Liermann GRF, Evangelista GC, McMaster P, et al. Transplantation for primary biliary cirrhosis: retrospective analysis of 400 patients in a single center. Hepatology, 2001,33:22-27.
[ 9 ] Poupon RE, Lindor KD, Cauch-Dudek K, et al. Combined analysis of randomized controlled trials of ursodeoxycholic acid in primary biliary cirrhosis. Gastroenterology, 1997,113:884-890.
[10] Corpechot C, Carrat F, Bahr A, et al. The effect of ursodeoxycholic acid therapy on the natural course of primary biliary cirrhosis. Gastroenterology, 2005,128:297-303.
[11] Shi J, Wu C, Lin Y, et al. Long-term effects of mid-dose ursodeoxycholic acid in primary biliary cirrhosis: a meta-analysis of randomized controlled trials. Am J Gastroenterol, 2006,101:1529-1538.
[12] Carbone M, Mells GF, Pells G, et al. Sex and age are determinants of the clinical phenotype of primary biliary cirrhosis and response to ursodeoxycholic acid. Gastroenterology, 2013,144:560-569.e7; quiz e13-14.
[13] Balasubramaniam K, Grambsch PM, Wiesner RH, et al. Diminished survival in asymptomatic primary biliary cirrhosis. A prospective study. Gastroenterology, 1990,98:1567-1571.
[14] Prince M, Chetwynd A, Newman W, et al. Survival and symptom progression in a geographically based cohort of patients with primary biliary cirrhosis: follow-up for up to 28 years. Gastroenterology, 2002,123:1044-1051.
[15] Mitchison HC, Lucey MR, Kelly PJ, et al. Symptom development and prognosis in primary biliary cirrhosis: a study in two centers. Gastroenterology, 1990,99:778-784.
[16] Metcalf JV, Mitchison HC, Palmer JM, et al. Natural history of early primary biliary cirrhosis. Lancet, 1996,348:1399-1402.
[17] Springer J, Cauch-Dudek K, O'Rourke K, et al. Asymptomatic primary biliary cirrhosis: a study of its natural history and prognosis. Am J Gastroenterol, 1999,94:47-53.
[18] Prince MI, Chetwynd A, Craig WL, et al. Asymptomatic primary biliary cirrhosis: clinical features, prognosis, and symptom progression in a large population based cohort. Gut, 2004,53:865-870.
[19] Mahl TC, Shockcor W, Boyer JL. Primary biliary cirrhosis: survival of a large cohort of symptomatic and asymptomatic patients followed for 24 years. J Hepatol, 1994,20:707-713.
[20] Vleggaar FP, van Buuren HR. No prognostic significance of antimitochondrial antibody profile testing in primary biliary cirrhosis. Hepatogastroenterology, 2004,51:937-940.
[21] Klein R, Pointner H, Zilly W, et al. Antimitochondrial antibody profiles in primary biliary cirrhosis distinguish at early stages between a benign and a progressive course: a prospective study on 200 patients followed for 10 years. Liver, 1997,17:119-128.
[22] Invernizzi P, Selmi C, Ranftler C, et al. Antinuclear antibodies in primary biliary cirrhosis. Semin Liver Dis, 2005,25:298-310.
[23] Nakamura M, Kondo H, Mori T, et al. Anti-gp210 and anti-centromere antibodies are different risk factors for the progression of primary biliary cirrhosis. Hepatology, 2007,45:118-127.
[24] Corpechot C, Poujol-Robert A, Wendum D, et al. Biochemical markers of liver fibrosis and lymphocytic piecemeal necrosis in UDCA-treated patients with primary biliary cirrhosis. Liver Int, 2004,24:187-193.
[25] Shapiro JM, Smith H, Schaffner F. Serum bilirubin: a prognostic factor in primary biliary cirrhosis. Gut, 1979,20:137-140.
[26] Bonnand AM, Heathcote EJ, Lindor KD, et al. Clinical significance of serum bilirubin levels under ursodeoxycholic acid therapy in patients with primary biliary cirrhosis. Hepatology, 1999,29:39-43.
[27] Roll J, Boyer JL, Barry D, et al. The prognostic importance of clinical and histologic features in asymptomatic and symptomatic primary biliary cirrhosis. N Engl J Med, 1983,308:1-7.
[28] Rydning A, Schrumpf E, Abdelnoor M, et al. Factors of prognostic importance in primary biliary cirrhosis. Scand J Gastroenterol, 1990,25:119-126.
[29] Christensen E, Neuberger J, Crowe J, et al. Beneficial effect of azathioprine and prediction of prognosis in primary biliary cirrhosis. Final results of an international trial. Gastroenterology, 1985,89:1084-1091.
[30] Dickson ER, Grambsch PM, Fleming TR, et al. Prognosis in primary biliary cirrhosis: model for decision making. Hepatology, 1989,10:1-7.
[31] Kim WR, Wiesner RH, Poterucha JJ, et al. Adaptation of the Mayo primary biliary cirrhosis natural history model for application in liver transplant candidates. Liver Transpl, 2000,6:489-494.
[32] Patanwala I, McMeekin P, Walters R, et al. A validated clinical tool for the prediction of varices in PBC: the Newcastle Varices in PBC Score. J Hepatol, 2013,59:327-335.
[33] Angulo P, Lindor KD, Therneau TM, et al. Utilization of the Mayo risk score in patients with primary biliary cirrhosis receiving ursodeoxycholic acid. Liver, 1999,19:115-121.
[34] Levy C, Zein CO, Gomez J, et al. Prevalence and predictors of esophageal varices in patients with primary biliary cirrhosis. Clin Gastroenterol Hepatol, 2007,5:803-808.
[35] Liang Y, Yang Z, Zhong R. Primary biliary cirrhosis and cancer risk: a systematic review and meta-analysis. Hepatology, 2012,56:1409-1417.
[36] Suzuki A, Lymp J, Donlinger J, et al. Clinical predictors for hepatocellular carcinoma in patients with primary biliary cirrhosis. Clin Gastroenterol Hepatol, 2007,5:259-264.
[37] Kuiper EM, Hansen BE, de Vries RA, et al. Improved prognosis of patients with primary biliary cirrhosis that have a biochemical response to ursodeoxycholic acid. Gastroenterology, 2009,136:1281-1287.
[38] Jones DE, Metcalf JV, Collier JD, et al. Hepatocellular carcinoma in primary biliary cirrhosis and its impact on outcomes. Hepatology, 1997,26:1138-1142.
[39] Harada K, Hirohara J, Ueno Y, et al. Incidence of and risk factors for hepatocellular carcinoma in primary biliary cirrhosis: national data from Japan. Hepatology, 2013,57:1942-1949.
[40] Kuiper EM, Hansen BE, Adang RP, et al. Relatively high risk for hepatocellular carcinoma in patients with primary biliary cirrhosis not responding to ursodeoxycholic acid. Eur J Gastroenterol Hepatol, 2010,22:1495-1502.
(本文编辑:张苗)
国家自然科学基金资助项目(81641065)
434000 湖北 荆州市第二人民医院肝病二科(陈丹丹);解放军第三〇二医院非感染性肝病诊疗与研究中心(梁庆升,孙颖,邹正升)
孙颖,Email:sunying302@yahoo.com;邹正升,Email:zszou302@163.com
2016-08-18)
共同第一作者:梁庆升

