不同配方高脂饲料构建SD大鼠肥胖模型的实验研究
朱磊路瑛丽冯连世张辉
1国家体育总局体育科学研究所(北京 100061)2曲阜师范大学
不同配方高脂饲料构建SD大鼠肥胖模型的实验研究
朱磊1,2路瑛丽1冯连世1张辉2
1国家体育总局体育科学研究所(北京 100061)2曲阜师范大学
目的:研究不同配方高脂饲料对构建SD大鼠肥胖模型成功率的影响。方法:40只5周龄雄性SD大鼠随机分成4组:C组(SPF级繁殖鼠料),H1组(40%自配高脂饲料)、H2组(45%高脂饲料)、H3组(60%高脂饲料),每组10只。每周称量大鼠体重,饲养11周后大鼠麻醉处死,测量每只大鼠的体长、脂肪重量(肾周脂肪和附睾脂肪),计算其脂体比、BMI和Lee’s指数;检测大鼠的血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)浓度。分析各组间上述指标的差异性,综合评估不同配方饲料对SD大鼠肥胖的影响。结果:(1)H2组大鼠自第8周体重显著高于对照组(P<0.05),且建模效率最高;(2)45%高脂饲料显著升高大鼠血清TC、TG和LDL-C浓度,而显著降低HDL-C浓度(P<0.05);(3)60%高脂饲料极显著升高大鼠血清TC和TG浓度(P<0.01),显著升高LDL-C浓度(P<0.05),而极显著降低HDL浓度(P<0.01);H2和H3组大鼠肾周脂肪重量、附睾脂肪重量、脂体比和Lee’s指数显著高于对照组。结论:(1)构建SD大鼠肥胖模型成功的判断标准:高脂饲料组体重显著增加,TC、TG、LDL-C显著升高,HDL-C显著降低,脂体比显著增加,Lee’s指数显著升高;且个体体重超过对照组平均体重20%。(2)喂饲6周是利用45%脂供能高脂饲料构建SD大鼠肥胖模型最经济的建模周期。
SD大鼠;高脂饲料;肥胖模型
目前研究肥胖的动物模型主要有高脂饮食诱导肥胖模型、遗传性肥胖的转基因动物模型、下丘脑性肥胖模型(谷氨酸钠或金硫葡萄糖)、内分泌性肥胖模型(去卵巢、注射胰岛素)等[1]。因为人类肥胖大多与过多摄入高脂、高能的食品密切相关,因此,利用高脂、高能饮食诱导的肥胖动物模型是研究人类肥胖的首选模型,而此模型构建成功率主要取决于高脂饲料的配方。欧美研究一般会选择Research Diets、Harlan Teklad等公司的纯化饲料[2],但是这些纯化饲料昂贵的价格制约了其在我国的推广和应用。国内科研工作者多采用模拟上述公司高脂饲料配方或者在基础饲料中添加猪油的方法,该方法具有价格优势而被广泛应用,但是建模效果参差不齐。本研究通过目前国内外研究中主要选用的啮齿类高脂饲料构建成年SD大鼠肥胖模型,比较不同配方高脂饲料的建模效果,以期为构建SD大鼠肥胖模型标准及提高建模成功率提供实验依据。
1 材料与方法
1.1实验动物与分组
SPF级5周龄雄性Sprague Dawley(SD)大鼠40只,体重218.05±20.73 g,北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001,饲养人员证书编号:1115032300009。40只SD大鼠被随机分成4组:C组(SPF级繁殖鼠料),H1组(自配高脂饲料,40%脂供能)、H2组(Research Diets-D12451,45%脂供能高脂饲料)、H3组(Research Diets-D12492,60%脂供能高脂饲料),每组10只。国家体育总局体育科学研究所ABSL-3级动物房饲养,每个鼠笼饲养5只大鼠,自由饮食,室温22±1℃,湿度55%±2%,动物房装有昼夜明暗交替照明系统,每12小时轮转照明。
1.2饲料配方
1.2.1SPF级繁殖鼠料(g%):H2O(7.08)、粗蛋白(22. 10)、粗脂肪(5.28)、粗灰分(5.20)、粗纤维(4.12)、无氮浸出物(52.00)、钙(1.24)、磷(0.92)、赖氨酸(1.34)、蛋氨酸和胱氨酸(0.72)。
1.2.240%脂供能自配高脂饲料(g%):繁殖鼠料(54. 50)、猪油(16.90)、蔗糖(14.00)、酪蛋白(10.20)、麦芽糖糊精(2.20)、预混料(2.20)。
1.2.345%脂供能高脂饲料(g%):H2O(14.19)、酪蛋白(20.00)、胱氨酸(0.30)、玉米粉(7.28)、麦芽糖糊精(10. 00)、蔗糖(17.28)、纤维素(5.00)、豆油(2.5)、猪油(17. 75)、无机盐(1.00)、磷酸钙(1.30)、碳酸钙(0.55)、柠檬酸钾(1.65)、维生素(1.00)、重酒石酸胆碱(0.20)。
1.2.460%脂供能高脂饲料(g%):H2O(22.62)、酪蛋白(20.00)、胱氨酸(0.30)、麦芽糖糊精(12.50)、蔗糖(6. 88)、纤维素(5.00)、豆油(2.5)、猪油(24.50)、无机盐(1. 00)、磷酸钙(1.30)、碳酸钙(0.55)、柠檬酸钾(1.65)、维生素(1.00)、重酒石酸胆碱(0.20)。
1.3检测指标和方法
每日观察并记录大鼠精神状态、活动欲、饮水量、排尿量、粪便及毛发光亮度。
每周一测量大鼠体重(g),记录并绘制大鼠体重增长曲线。
每天测量5只大鼠/笼总摄食量,据此计算出各组大鼠每日平均摄食量并绘制曲线。
喂饲11周后所有大鼠统一取材,取材前12小时断粮。测量大鼠鼻尖至肛门长度(身长)、称量大鼠体重,腹腔注射10%水合氯醛(0.4 ml/100 g体重)麻醉后腹主动脉取血,离心后取血清。大鼠开腹后取肾周脂肪和附睾脂肪称重。根据公式计算脂体比、BMI和Lee’s指数。

半自动生化分析仪测量血清总胆固醇(TC)浓度、甘油三酯(TG)浓度、低密度脂蛋白胆固醇(LDL-C)浓度和高密度脂蛋白胆固醇(HDL-C)浓度。
1.4统计学分析
所有数据通过SPSS20.0统计软件进行统计学处理。所有数据符合正态分布,结果用平均值±标准差表示,采用单因素方差分析比较各组均值的差异是否具有统计学意义。以P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果
2.1不同配方高脂饲料对大鼠外观及行为的影响
造模初始1周,各高脂饲料组大鼠食欲较对照组差,这可能与大鼠不适应高脂饮食有关。但1周后各高脂饲料组大鼠逐渐适应了饮食,进食量逐渐增加,但仍低于对照组。与对照组比较,各高脂饲料组大鼠毛发更加油顺、光亮,排尿量和排便量明显较少,粪便较对照组干、硬(H2组呈浅褐色,H3组呈淡绿色),因此高脂饲料组更换垫料的频率明显低于对照组。8~11周各高
脂饲料组大鼠饮水量及尿量均明显增多,毛发光亮度减退,脱毛现象加重,精神状态及活跃度均差于对照组。
2.2不同配方高脂饲料对大鼠摄食量的影响
在11周的饲养过程中,各高脂饲料组大鼠摄食量均低于对照组,而且4组呈现出相似的变化趋势。

图1 各组大鼠每日平均摄食量
2.3不同配方高脂饲料对大鼠体重影响的时序性变化
如表1所示,第0周随机分组后,各组大鼠体重无显著差异;第1周至第3周H1组大鼠体重显著低于对照组(P<0.05);第8周H2组大鼠体重显著高于对照组(P<0.05);第9周、10周H2组大鼠体重极显著高于对照组(P<0.01);第10周H3组大鼠体重显著高于对照组(P<0.05);第11周H2组大鼠体重显著高于对照组(P<0.05)。

表1 各组大鼠每周体重(g,n=10)
2.4不同配方高脂饲料对大鼠建模成功率的影响
第11周称重前经过12小时断粮处理,导致该时间点大鼠体重不能作为判断建模成功率标准,故最终只统计前10周数据判定建模成功率。结果发现,经过10周的高脂饲料喂养,无论是以体重超过对照组平均体重10%为建模成功标准(如图2A),还是以体重超过对照组平均体重20%为建模成功标准(如图2B):H1和H3组建模周期长,且成功率均较低,而H2组建模效率高,成功率和时间大致呈近60度线性关系。
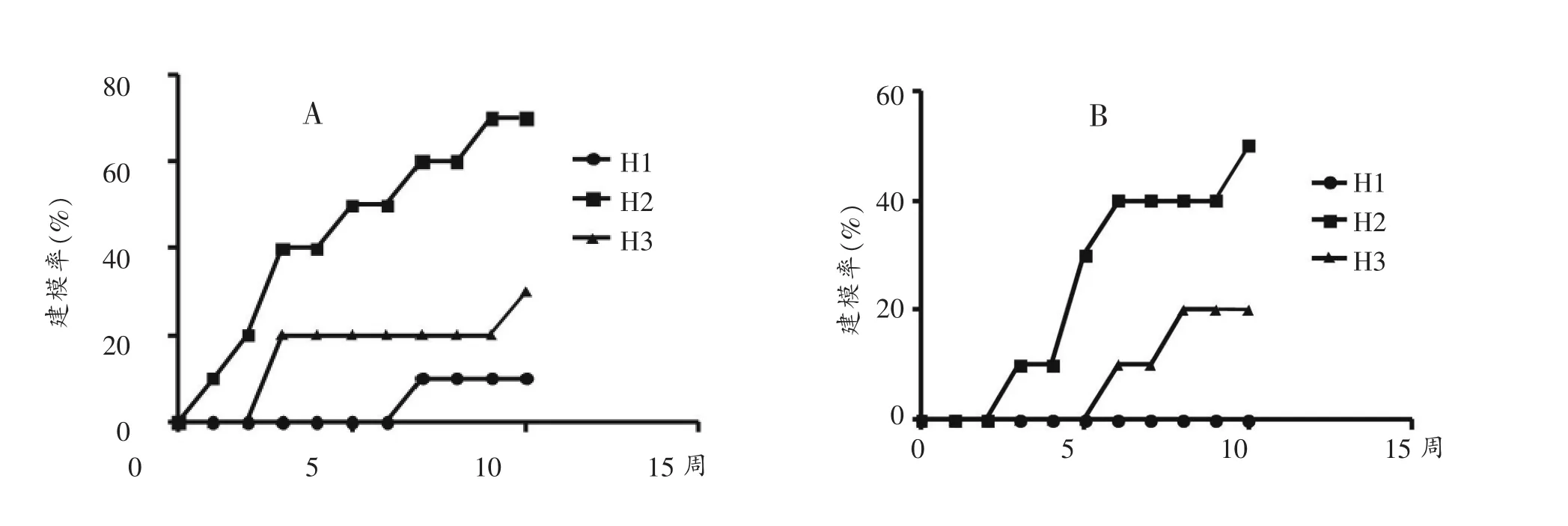
图2 A:超过对照组平均体重10%的建模率;B:超过对照组平均体重20%的建模率
2.5 不同配方高脂饲料对大鼠血清相关生物化学指标的影响
如表2所示,H2组大鼠血清TC、TG和LDL-C浓度较对照组显著升高(P<0.05),而HDL-C浓度显著降低(P<0.05);H3组TC和TG浓度较对照组极显著升高(P<0.01),LDL-C浓度显著升高(P<0.05),而HDL-C浓度极显著降低(P<0.01);H1组大鼠血清LDL-C浓度较对照组显著升高(P<0.05)。

表2 各组大鼠血清TC、TG、HDL-C和LDL-C浓度(mmol/L,n=10)
2.6不同配方高脂饲料对大鼠形态学指标的影响
如表3所示,H2组大鼠身长较对照组显著增加(P<0.05);H1组大鼠肾周脂肪重量、附睾脂肪重量和脂体比均显著高于对照组(P<0.05),H2组和H3组均极显著高于对照组(P<0.01);H3组大鼠BMI值较对照组显著升高(P<0.05);大鼠Lee’s指数H2组和H3组较对照组显著增加(P<0.05)。

表3 各组大鼠身长、肾周脂肪重量、附睾脂肪重量、脂体比、BMI和Lee’s指数(n=10)
3 讨论
摄入高热量的脂肪过多导致能量过剩是目前人类肥胖最主要的原因。因此,利用高脂、高能饮食诱导的肥胖动物是研究肥胖及其相关课题的首选模型[3]。由于给予SD大鼠高脂饮食,易构建出与人类肥胖发生过程十分相似的肥胖模型[4,5],而且SD大鼠体型适中便于取材,又具有建模时间短、成功率高的特点,所以科研工作者经常利用高脂饲料诱导SD大鼠构建肥胖模型[6]。实践中发现,高脂饲料配方和SD大鼠肥胖模型构建成功率密切相关。目前国内构建大鼠肥胖模型所使用的高脂饲料多是在繁殖鼠料基础上添加猪油、胆固醇、胆盐等,配方种类较多,效果良莠不齐,本实验结合相关文献自配高脂饲料。
3.1不同配方高脂饲料对大鼠摄食量的影响
造模初始1周,各高脂饲料组大鼠食欲较对照组差,这可能与大鼠初始不适应高脂饮食有关。路瑛丽等[7]构建的肥胖大鼠模型中也出现喂饲高脂饲料之初饮食量减少的现象,这与本实验结果相一致,其它文献也有类似报道,并建议大鼠经过1周的混合饲料喂养而后过渡到全部高脂饲料。
3.2不同配方高脂饲料对大鼠体重影响的时序性变化
第1周H1组大鼠体重显著性低于对照组,可能是由于高脂饲料完全替换普通饲料,大鼠对其口味不适应,进而食量减少导致大鼠体重显著降低(P<0.05),其他两组未出现显著性变化则可能是因为45%脂供能高脂饲料和60%脂供能高脂饲料相对于40%自配高脂饲料来说更利于大鼠接受;第8周H2组大鼠体重显著高于对照组(P<0.05),提示45%脂供能高脂饲料高脂饲料对于SD大鼠体重指标影响具有显著性差异。Hagerkvist等[8]采用高脂饲料(Research Diets-D12492,60%脂供能)喂养大鼠8周后,高脂组体重显著高于对照组(P<0.05),这与本实验结果相同。Yang等[9]研究决明方对肥胖大鼠影响时,首先利用高脂饲料(基础饲料60%,猪油15%,鸡蛋黄粉10%,脱脂奶粉8%,干酪素5%,白砂糖2%)构建了SD大鼠肥胖模型,结果发现经过8周的高脂饲料喂养,高脂饲料组体重高于对照组(P<0.01)。第10周H3组大鼠体重相对于对照组也出
现显著增高(P<0.05),说明60%脂供能高脂饲料同样对SD大鼠体重指标具有显著性影响,但其效率低于45%脂供能高脂饲料。
3.3不同配方高脂饲料对大鼠建模成功率的影响
目前国内外没有判定肥胖动物建模成功的金标准。一部分实验采用体重超过对照组平均体重10%为建模成功标准,另一部分实验要求更加严谨,体重超过对照组平均体重20%才可视为建模成功[10]。本研究采用不同配方高脂饲料喂养大鼠10周,若以体重超过对照组平均体重10%为建模成功,则实验结果表明:自配高脂饲料配方构建SD大鼠肥胖模型的效率极低;45%脂供能高脂饲料构建SD大鼠肥胖模型的建模率较高,建模成功率与饲养周期呈线性关系;60%脂供能高脂饲料建模速度较快,但是建模效率较低;若以体重超过对照组平均体重20%为建模成功,则实验结果提示:实验选用的自配高脂饲料在11周内无法构建SD大鼠肥胖模型;45%脂供能高脂饲料具有建模快,而且建模率较高的特点。特别是第4~6周增长较快,第6周建模成功率达40%,综合考虑饲料价格和建模周期,建议45%脂供能高脂饲料喂养SD大鼠6周是最经济的构建SD大鼠肥胖模型时间点;60%脂供能高脂饲料虽然脂含量高达60%,但是单独从体重参数评价,其并不是理想的构建SD大鼠肥胖模型的饲料。本实验所选用的自配高脂饲料构建肥胖模型效果较差,可能是因为该高脂饲料配方是在基础饲料中添加大油、胆固醇、胆盐等,这样很容易造成饲料中各种营养素特别是蛋白质被稀释,进而直接影响建模成功率;Sutherland等[11]报道给予高脂饮食2周后大鼠体质量已经明显增加,诱导4周后各种症状更加明显。而本实验饲养2周后,H2和H3组大鼠体重增加百分比高于对照组,这与Sutherland等的研究结果一致。
3.4不同配方高脂饲料对大鼠血清相关生物化学指标的影响
目前,血清中TC、TG、LDL-C和HDL-C含量是研究血液脂代谢异常的常用指标。本实验结果显示:H1组大鼠血清除LDL-C略高于对照组外(P<0.05),其余生化指标相比对照组无显著差异,说明实验选用的自配高脂饲料对于大鼠血清中与脂代谢紊乱相关指标影响不大,这也与前期该组大鼠建模成功率较低相一致;Nishida等[12]采用高脂饲料构建大鼠肥胖模型时,观察到高脂饲料组大鼠血浆中TG含量显著高于对照组。Sripradha R等[13]给予雄性Wistar大鼠10周高脂饲料(含脂量30%),结果发现高脂饮食导致大鼠血浆中TC、TG、LDL-C和MDA含量升高,而HDL-C和TAS的含量出现显著性下降。Amin等[14]采用含脂量35%的高脂饲料喂饲大鼠12周,发现长期喂饲大鼠高脂饲料可以降低血浆NO含量,升高血糖、LDL-C、TG、TC和MDA含量。与上述学者研究结果一致,本实验H2组各生化指标与对照组相比均出现显著性差异(P<0.05),对照H组无显著性变化,也说明45%脂供能高脂饲料比40%自配高脂饲料更利于构建肥胖模型;H3组大鼠血清各指标变化趋势与H2组相同,且TC、TG和HDL-C为极显著性变化(P<0.01),说明60%脂供能高脂饲料比45%脂供能高脂饲料对于大鼠血清各脂代谢相关指标影响更大。本实验H2组和H3组血清LDL-C和TC含量变化呈正相关,可能是因为LDL主要作用是作为载体与肝脏生成的胆固醇结合形成LDL-C,将TC从肝内转运到肝外组织,进入动脉壁并沉积于内膜,故本实验结果显示LDL-C水平升高时,表面LDL将更多的胆固醇由肝脏运载入血,进而引起血液中总胆固醇浓度的相应升高;而本实验结果显示H2组和H3组血清HDL-C和TC含量变化呈明显的负相关,可能是因为HDL的作用机理与LDL正好相反,它可以作为载体把血液中的胆固醇逆向转运到肝脏中进行代谢后排出体外,故本实验结果显示,HDL-C水平降低提示血液中HDL运载胆固醇代谢的能力降低,因此血液中滞留的胆固醇增多,导致血液中总胆固醇浓度的升高。
3.5不同配方高脂饲料对大鼠形态学指标的影响
大鼠经过11周饲养,仅有H2组身长显著大于对照组(P<0.05),实验结果提示45%脂供能高脂饲料营养搭配相对更加合理,更适于SD大鼠生长发育。由于内脏脂肪是反映肥胖与否的重要体质指标,因此,本实验称取了肾周和附睾脂肪重量,并结合体重计算出体脂比。实验结果显示,无论是肾周脂肪、附睾脂肪还是脂体比,H1组均显著增加(P<0.05),而H2和H3组极显著增加(P<0.01),提示3种配方高脂饲料均可以引起内脏脂肪的显著变化,特别是60%脂供能高脂饲料饲养SD大鼠内脏脂肪含量极显著增加,说明该高脂饲料更适于构建SD大鼠内脏型肥胖模型。Amin等[14]采用含脂量35%的高脂饲料构建肥胖大鼠模型,经过12周高脂饲料建模,高脂组大鼠体重、BMI、肾周和附睾脂肪量均显著高于对照组,本实验高脂饲料组大鼠也呈现出类似的变化。Lee’s指数可以更加客观地评价动物肥胖程度,本研究显示H2和H3组大鼠Lee’s指数均显著高于对照组,且与肾周脂肪含量、附睾脂肪脂肪含量及脂体比呈正相关性,这与Bermardis等[15]研究结果一致。此外,Chauhan等[16]采用高脂饲料喂饲大鼠8周,也有与本实验类似的结果,他发现高脂饲料组与对照组相比,体重、BMI、Lee’s指数、肾周脂肪、附睾脂肪、肝脏重量、血糖、瘦素水平、TC、LDL-C、VLDL、胆固醇含量、ALT等显著升高。此外,实验过程中观察到各高
脂饲料组大鼠后期脱毛现象加重,这可能是由于高脂喂饲导致SD大鼠皮脂分泌过旺而形成脂溢性脱毛。
目前国内研究大多以超对照组平均体重百分比、脂体比、Lee’s指数等单一指标作为判定建模是否成功的标准。但是通过对本实验结果的综合分析,发现并非所有指标都具有完全的一致性。例如H1组单纯从超对照组平均体重百分比或者生化指标判断,构建肥胖模型是失败的,但是其体脂比显示两组具有显著性差异;又如单纯考虑超对照组平均体重百分比,发现虽然H3组建模成功率低,但是其脂代谢相关生化指标、脂体比及Lee’s指数变化大于H2组,说明H3组大鼠内脏脂肪增加量大于其他组,提示H3组选用的高脂饲料更适于构建SD大鼠内脏型肥胖模型。
4 结论
1)构建SD大鼠肥胖模型成功的判断标准:与对照组相比体重超20%,体重显著性增加,TC、TG、LDL-C显著升高,HDL-C显著降低,脂体比显著增加,Lee’s指数显著升高。
2)喂饲6周是利用45%脂供能高脂饲料构建SD大鼠肥胖模型最经济的建模周期。
[1]汤锦花,严海东.营养性肥胖大鼠模型的建立及评价[J].同济大学学报,2010,31(1):32-34.
[2]Jackman MR,MacLean PS,Bessesen DH.energy expenditure in obesity-prone and obesity -resistantrats before and after? the introduction of a high-fat diet[J].Am J Physiol Regul Integr Comp Physiol,2010,299(4):1097-1105.
[3]West DB,York B.Dietary fat,genetic predisposition,and? obesity:lessons from animal models[J]Am J Clin Nutr,1998,67(3):505-512.
[4]Lin S,Thomas TC,Storlien LH,et al.Developmentofh -ighfatdiet-inducedobesity and leptinresistancein C57Bl/6J mice [J].Int J Obes Relat Metab Disord,2000,24(5):639-646.
[5]Woods SC,Seeley RJ,Rushing PA,et al.Acontrolledhigh-fatdietinducesanobesesyndromeinrats[J].J Nutr,2003,133(4):1081-1087.
[6]Buettner R,Scholmerich J,Bollheimer L.C.High-fat diets:modeling the metabolic disorders of human obesity in rodents[J]. Obesity(Silver Spring),2007,15(4):798-808.
[7]路瑛丽,张漓,冯连世,等.高脂饮食大鼠高住高练模型的建立[J].中国运动医学杂志,2002,31(5):438-442.
[8]Hagerkvist R,Jansson L,Welsh N.Imatinib mesylate improves insulin sensitivity and glucose disposal rates in rats fed a high-fat diet[J].Clin Sci(Lond),2008,114(1):65-71.
[9]Yang L,Lu K,Wen XY,et al.Jueming Prescription reduces body weight by increasing the mRNA expressions of beta3-adrenergic receptor and uncoupling protein-2 in adipose tissue of diet-induced obese rats[J].Chin J Integr Med,2012,18(10):775-781.
[10]Yang SY,Zhao NJ,Li XJ,et al.Ping-tang Recipe improves insulin resistance and attenuates hepatic steatosis in high-fat diet-induced obese rats[J].Chin J Integr Med,2012,18(4):262-268.
[11]Sutherland LN,Capozzi LC,Turchinsky NJ,et al.Time course of high-fat diet-induced reductions in adipose tissue mitochondrialproteins:potential mechanisms and the relationship to glucose intolerance[J].Am J Physiol Endocrinol Metab,2008,295(5):1076-1083.
[12]Nishida M,Kondo M,Shimizu T,et al.Anti-hyperlipidemic effect of Acanthopanax senticosus(Rupr.et Maxim)Harms leaves in high-fat diet fed mice[J].J Sci Food Agric,2015,17.
[13]Sripradha R,Sridhar MG,Maithilikarpagaselvi N.Antihyper-lipidemic and antioxidant activities of the ethanolic extract of Garcinia cambogia on?high fat diet-fed rats[J].J Complement Integr Med,2016,13(1):9-16.
[14]Amin KA,Kamel HH,Abd Eltawab MA.Protective effect of Garcinia against renal oxidative stress and biomarkers induced by high fat and sucrose diet[J].Lipids Health Dis,2011,14;10-16.
[15]Bermardis LL,Patterson DB.Correlation between“Lee Index”and careass fat content in weanling and adult female rats with hypothalamic lesions[J].J Endocrinol,1968,40:527-528.
[16]ChauhanY,GoyalR,KhahS,etal.Mildalcoholintake exacerbates metabolic syndrome in rodents:a putative role of GSK-3β[J].J Recept Signal Transduct Res,2015,35(6):592-599.
Experimental Study on Establishing Obese Model of Male SD Rat with Different Fat Percentages in High-fat Diet
Zhu Lei1,2,Lu Yingli1,Feng Lianshi1,Zhang Hui2
1 China Institute of Sport Science,Beijing,China 100061 2 Qufu Normal University,Shandong,China 273165 Corresponding Author:Feng Lianshi,Fengls98@126.com
Objective To study the effects of different high-fat diets(HFD)on the establishment of an obese model of male SD rat.Methods 40 5-week old male SD rats were randomly and equally divided into four groups:C group(SPF normal chow diet,NCD),H1 group(feeding with HFD containing 40%of fat),H2 group(feeding with HFD containing 45%of fat),H3(feeding with HFD containing 60%of fat).The body weight of the 4 groups was monitored once a week throughout the experiment.At the end of the 11th week, the rats were decapitated under anesthesia,their body length,perirenal and epididymal fat mass were detected,and the ratio of fat mass/body weight,BMI and Lee’s index were calculated.The serum levels of TC, TG,LDL-C and HDL-C were determined.Results(1)The body weight of H2 group was significantly higher than C group(P<0.05).(2)The highest incidence of obesity appeared in H2 group.(3)There were higher levels of TC,TG and LDL-C,and lower levels of HDL-C in rats that fed with diet containing 45%and 60%of fat as compared with the C group(P<0.05,P<0.01).(4)The ratio of fat mass/body weight and Lee’s index in H2 and H3 groups were significantly higher than in C group(P<0.05 and P<0.01).Conclusion(1)It is concluded
SD rat,high-fat diet,obese model
2016.02.01
国家自然科学基金(31471139);国家体育总局体育科学研究所基本科研业务经费(基本16-27)
冯连世,Email:Fengls98@126.com
that the criteria for obese model of male SD rat should include 20%of overweight,higher levels of TC,TG and LDL-C,lower levels of HDL-C,and higher ratio of fat mass/body weight and Lee's index.(2)Obesity of SD rat can be efficiently established by feeding diet containing 45%fat for 6 weeks.

