益肾生精胶囊对邻苯二甲酸二丁酯所致大鼠生殖功能损害的影响*
李俊涛,曲晓伟,张蜀武,李郑生,张培海
(1.河南中医药大学第一附属医院男科,河南 郑州 450000; 2.郑州人民医院泌尿外科,河南 郑州 450003; 3.四川省中西医结合医院男科,四川 成都 610041)
·实验研究·
益肾生精胶囊对邻苯二甲酸二丁酯所致大鼠生殖功能损害的影响*
李俊涛1,曲晓伟2,张蜀武3,李郑生1,张培海3
(1.河南中医药大学第一附属医院男科,河南 郑州 450000; 2.郑州人民医院泌尿外科,河南 郑州 450003; 3.四川省中西医结合医院男科,四川 成都 610041)
目的:探讨益肾生精胶囊对邻苯二甲酸二丁酯所致大鼠生殖功能损害的作用机制。方法:以邻苯二甲酸二丁酯制备大鼠生殖功能损害模型;将大鼠分为空白对照组、模型对照组和益肾生精胶囊高、中、低剂量组;益肾生精胶囊高、中、低剂量组大鼠依次给予0.178,0.089,0.044 g/mL益肾生精胶囊混悬液10 μL/g灌胃,空白对照组、模型对照组大鼠给予生理盐水10 μL/g灌胃,1 d 1次,连续用药4周。4周后处死各组大鼠,检测睾丸指数、附睾指数和睾丸基因Dzip1、Cat1 、Fas、C-jun的表达情况。结果:模型对照组、益肾生精胶囊低剂量组大鼠睾丸指数和附睾指数较空白对照组差别有统计学意义(P<0.01);益肾生精胶囊高剂量组、中剂量组大鼠睾丸指数和附睾指数较模型对照组差别有统计学意义(P<0.01);模型对照组、益肾生精胶囊低剂量组大鼠睾丸指数和附睾指数较益肾生精胶囊高剂量组差别有统计学意义(P<0.01)。除益肾生精胶囊高剂量组外,各组大鼠睾丸基因Cat1、C-jun、Fas、Dzip1表达较空白对照组差别有统计学意义(P<0.01);益肾生精胶囊高、中剂量组上述基因表达较模型对照组差别有统计学意义(P<0.01);益肾生精胶囊中、低剂量组上述基因表达较益肾生精胶囊高剂量组差别有统计学意义(P<0.01)。结论:邻苯二甲酸二丁酯可致大鼠睾丸与附睾指数下降,基因Cat1和Dzip1表达下调,C-jun、Fas表达上调;益肾生精胶囊可提高大鼠睾丸指数、附睾指数,上调Dzip1和Cat1表达,下调Fas、C-jun表达。
不育症;益肾生精胶囊/药效学;邻苯二甲酸二丁酯;Dzip1;Cat1;Fas;C-jun;动物;大鼠
邻苯二甲酸二丁酯(di-butyl phthalate,DBP)是当前工作和生活中存在较多的环境毒物,作为增塑剂和软化剂被广泛应用于食品包装材料、医学仪器、室内装潢材料、塑料、容器等[1]。研究表明:DBP可造成生殖器官发育畸形、生精功能障碍、雄激素水平下降等[2-4]。因此,研究有关DBP所致不育发病机制和药物干预机制具有重要意义。传统中医药在改善男性生殖能力方面具有确切疗效。本研究制备DBP致青春期Wistar雄性大鼠生殖功能损伤动物模型,以大鼠睾丸、附睾指数和睾丸生殖相关基因为检测指标,研究DBP对青春期Wistar雄性大鼠生殖功能的损害作用,以及中药复方益肾生精胶囊对其的干预作用,探讨益贤生精脑囊可能的作用机制为男性不育症临床用药提供理论依据。
1 材料与方法
1.1 动 物
清洁级 2月龄青春期雄性Wistar大鼠100只,体质量180~220 g,购自山东鲁抗医药公司实验中心,质量合格证号:SCXF(鲁)2008-0002。实验期间饲养于室温(20±3.0)℃、相对湿度40%~60%、光照12 h∶12 h(光:暗)环境中,自由摄食、饮水。
1.2 药品与试剂
益肾生精胶囊由以山茱萸、熟地黄、山药、桑葚、枸杞子、五味子、鳖甲胶、淫羊藿、牡丹皮、川牛膝、酒大黄、败酱草等药物组成,0.33 g/粒,由河南中医药大学第一附属医院中药房提供,批号121112。质量分数为99.7%的邻苯二甲酸二丁酯,东莞市泰耀化工有限公司的产品,批号为130809;TRIZOL试剂盒、Super Quick RT cDNA试剂盒、Ultra SYBR Mixture试剂盒,均由康为世纪生物有限公司提供,批号依次为20130715,20130713,20130611。
1.3 模型的建立、分组与给药
参照参考文献[5-6]方法,以DBP灌胃来制备生殖功能损伤大鼠模型。将100只大鼠随机分为空白对照组(20只)和造模组(80只)。以花生油溶解DBP,配制成100 g/L的混悬液。造模组大鼠灌胃体积为5 μL/g体质量,灌胃剂量为500 μg/(g·d);空白对照组大鼠给予等量花生油灌胃;1 d 1次,连续灌胃4周。4周后,随机抽取造模组和空白组大鼠各8只,麻醉处死,收集附睾精液,测定精子浓度、活力与畸形率;另取睾丸组织,使用显微测微器测量睾丸横切面曲细经管直径、生精上皮高度。将两组大鼠实验数据进行对比,差别有统计学意义(P<0.01),提示造模成功。 将造模成功的64只大鼠随机分为模型对照组和益肾生精胶囊高、中、低剂量组4组,每组16只。益肾生精胶囊高、中、低剂量组大鼠依次给予0.178,0.089,0.044 g/mL益肾生精胶囊混悬液10 μL/g灌胃,空白对照组、模型对照组大鼠给予生理盐水10 μL/g灌胃,1 d 1次,连续用药4周。
1.4 检测指标标本采集
用药4周后,称量大鼠体质量;麻醉,固定,腹部备皮;局部皮肤消毒,切开阴囊皮肤、皮下组织,摘取双侧睾丸、附睾,称量质量,并详细记录;使用双面刀将右侧睾丸组织沿其最大切面切开,放入实验标本冻存管中,以液氮保存备用。
1.4.1 睾丸指数和附睾指数
计算公式:睾丸指数=睾丸质量(mg)/体质量(g);附睾指数=附睾质量(mg)/体质量(g)。
1.4.2 睾丸生殖相关基因检测
每份睾丸组织剪取50~100 mg,放入研钵中,以眼科剪剪碎,并加入液氮,研磨为粉末状;加1 mL Trizol试剂,研磨至均匀混悬液;将上述混悬液转入1.5 mL EP管中,室温中放置5 min;加200 μL 氯仿,混匀30 s,室温放置3 min;以低温高速离心机(4 ℃,12 000 g)离心15 min后,将上层水相轻轻转入另一支1.5 mL EP管中;加入500 μL 4 ℃ 预冷的异丙醇溶液,手动颠倒轻轻混匀,室温中放置10 min;以低温高速离心机(4 ℃,12 000 g)离心10 min后,可见白色胶状沉淀物即为RNA;加入1 mL 预冷的750 mL/L乙醇溶液(以无菌1mL /L DEPC水配制),温和振荡离心管,悬浮沉淀;于低温高速离心机(4 ℃,7 500 g)离心5 min;洗涤RNA,弃上清;于低温高速离心机(4 ℃,7 500 g)离心2 min,重复洗涤RNA,枪头吸弃上清,室温干燥5 min;加入20 μL 无菌的1mL/L DEPC水,56 ℃助溶5 min;于-76 ℃冷藏保存以备用。睾丸生殖相关基因Dzip1、Cat1、 Fas、C-jun检测均按照试剂盒说明书进行。
1.5 统计学方法
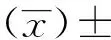
2 结 果
2.1 大鼠一般情况
造模过程中因灌胃操作失误致大鼠死亡9只,其中空白组1只,造模组8只。药物干预过程中因灌胃操作失误、大鼠斗咬致死等致大鼠死亡8只,其中模型对照组3只,益肾生精胶囊高剂量组3只,益肾生精胶囊中、低剂量组各1只。
2.2 各组大鼠睾丸指数和附睾指数对比
模型对照组、益肾生精胶囊低剂量组大鼠睾丸与附睾指数明显降低,较空白对照组差别有统计学意义(P<0.01)。益肾生精胶囊高、中剂量组大鼠睾丸与附睾指数明显增大,较模型对照组差别有统计学意义(P<0.01);模型对照组、益肾生精胶囊低剂量组大鼠睾丸与附睾指数明显降低,较益肾生精高剂量组差别有统计学意义(P<0.01)。见表1。
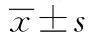

组 别动物数睾丸指数附睾指数空白对照组1110.35±0.821.98±0.36模型对照组137.54±0.44**△△1.37±0.31**△△益肾生精胶囊高剂量组1310.41±0.79##2.03±0.35##益肾生精胶囊中剂量组159.98±0.75##1.89±0.32##△△益肾生精胶囊低剂量组157.67±0.46**△△1.39±0.48**△△
注:与空白对照组对比,** P<0.01;与模型对照组对比,## P<0.01;与益肾生精胶囊高剂量组对比,△△ P<0.01。
2.3 各组大鼠睾丸生殖相关基因Dzip1、Cat1、Fas、C-jun表达对比
2.3.1 标准曲线
本实验采用2-ΔΔCt法,分别对目的基因和参比基因绘制标准曲线(以Cat1基因为例,见图1、图2)。

图1 Cat1标准曲线

图2 GAPDH标准曲线
2.3.2 扩增曲线和溶解曲线
各样品同时扩增目的基因和参比基因,每次实验均设置对照组。扩增曲线初始为比较低平直线;当循环达到阈值后,开始陡然升高,并随循环数增加呈现指数型递增;当荧光强度达最大值后,循环数虽不断增加,荧光强度不变;各曲线变化相似,未检测到非特异曲线,扩增效率较高。融解曲线初始为平台型;当达到一定温度后,急速上升,并随温度增加而升高;当温度达到Tm值后,随着温度继续增加,曲线下降;当降到与初始水平相近时,曲线则保持恒定不变;各曲线变化相似,荧光峰值陡峭而尖锐,无非特异峰。以4例样本为例,下图为各个目的基因及参比基因的扩增曲线和溶解曲线。见图3~图10。

左侧为GAPDH扩增线;右侧为Cat1扩增线

左侧为Cat1溶解曲线;右侧为GAPDH溶解曲线

左侧为GAPDH扩增线;右侧为C-jun扩增线

左侧为C-jun溶解曲线;右侧为GAPDH溶解曲线

左侧为GAPDH扩增线;右侧为Dzip1扩增线

左侧为Dzip1溶解曲线;右侧为GAPDH溶解曲线

左侧为GAPDH扩增线;右侧为Fas扩增线

左侧为Fas溶解曲线;右侧为GAPDH溶解曲线
2.3.3 统计分析结果
见表2。
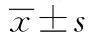

组 别动物数Dzip1Cat1FasC-jun空白对照组111.17±0.171.24±0.171.07±0.171.08±0.17模型对照组130.47±0.16**0.56±0.13**1.88±0.17**1.75±0.15**益肾生精胶囊高剂量组130.98±0.14##1.09±0.15##1.04±0.16##1.05±0.18##益肾生精胶囊中剂量组150.76±0.15**##△△0.78±0.17**##△△1.35±0.14**##△△1.38±0.17**##△△益肾生精胶囊低剂量组150.58±0.16**△△0.57±0.17**△△1.57±0.17**△△1.56±0.18**△△
注:与空白对照组对比,**P<0.01;与模型对照组对比,##P<0.01;与益肾生精胶囊高剂量组对比,△△P<0.01。
3 讨 论
脏器指数是较常用的毒理实验指标,可在一定程度上反映组织器官的损伤或修复情况,敏感、有效,且检测简单易行。正常情况下,脏器指数为固定值。动物染毒之后,脏器一旦受到损伤,其质量可发生变化,脏器指数亦可发生改变。反映雄性动物生育功能的最直接、最重要器官为睾丸与附睾,其中睾丸是产生精子的重要器官,附睾是精子成熟的重要场所,故本研究选定睾丸指数、附睾指数作为观测指标。
Cat1特异性表达于睾丸与精子,对鞭毛鞭打运动起着一定调节作用,维持精子前向直线运动的能力,对维持精子运动起着重要的作用[7-9]。Fas基因属于肿瘤坏死因子、神经坏死因子受体超家族。有研究表明:支持细胞FasL高表达,可以启动表达Fas基因的生精细胞凋亡性死亡过程,进而调控生精细胞增值、分化、精子数量。C-jun原癌基因位于人类染色体1p31~32,对维持细胞正常的生理功能具有重要的作用,在生精细胞的增值分化中,尤其是对减数分裂、精子变态具有重要的调节作用[10]。Dzip1基因特异性表达于睾丸组织与生精细胞[11]。
本研究结果显示:模型对照组大鼠睾丸、附睾指数明显下降,睾丸基因Dzip1、Cat1表达下调,Fas、C-jun表达上调。由此笔者推断:DBP可导致大鼠的睾丸和附睾损伤,并影响相关生殖基因表达,致生殖功能下降。
男性不育症属中医学“无子”“无嗣”等范畴。《黄帝内经》中指出“肾藏精”,主生殖与发育。男性不育症主要为肾精亏损,辨证以肾虚为主。肾为生殖之根本,肾中精气直接关系男性的生殖能力。肾精亏虚是男性不育的主要病理环节;DBP作为一种致病“疫毒”邪气,从口、鼻、皮肤而入,渐而蓄积成毒,久而内舍脏腑,留滞经脉;因此,肾虚精亏、瘀毒留滞是DBP所致男性不育的主要病机,治疗应以补肾填精、祛瘀解毒为根本大法。益肾生精胶囊以山茱萸、熟地黄、山药、桑葚、枸杞子、五味子、鳖甲胶、淫羊藿等补肾填精为主,佐以牡丹皮、川牛膝、酒大黄、败酱草等祛瘀解毒,具有补肾益精、祛瘀解毒标本兼顾之功效。
本实验结果表明:益肾生精胶囊可明显改善DBP对大鼠睾丸、附睾造成的损伤,改善其生殖功能,能上调Dzip1、Cat1的表达,下调Fas、C-jun的表达。因此,我们推测益肾生精胶囊提高生育能力机制可能为:改善睾丸附睾指数,通过上调Dzip1、Catsper1表达,下调Fas、C-jun表达,促进受损睾丸生精功能的恢复,而保证精子的正常发生和成熟。
此外,睾丸生精细胞凋亡、附睾精子成熟等过程都是极其复杂的,需要诸多分子协调、共同参与完成,而中药复方具有多种药理作用和生物活性,对生殖功能的调节作用是极其广泛的,有多系统、多靶点的作用特点;因此,益肾生精胶囊改善生殖功能的具体作用环节尚有待进一步深入研究。
[1]BARR DB, SILVA MJ,KATO K,et al.Assessing human exposure to phthalates using monoesters and their oxidized metabolites as biomarkers[J]. Environ Health Perspect,2003,111(9):1148-1151.
[2]王玉邦,宋玲,陈建锋,等.邻苯二甲酸二丁酯对大鼠精子运动能力及氧化应激的影响[J].中华男科学杂志,2004,10(4):253-256.
[3]龙廷,田二坡,秦达念,等.青春期前邻苯二甲酸二丁酯持续暴露对大鼠睾丸发育的影响[J].中华男科学杂志,2008,14(9):779-785.
[4]ZHU YJ, JIANG JT, MA L, et al. Molecular and toxicologic research in newborn hypospadiac male rats following in utero exposure to di-n-butyl phthalate (DBP)[J].Toxicology,2009,260(1-3):120-125.
[5]HARRIS CA,HENTTU P, PARKER MG, et al. The estrogenic activity of phthalate esters in vitro[J].Environ Health Perspect,1997,105(8):802-811.
[6]张晓峰,李百祥.邻苯二甲酸二丁酯的环境暴露及对雄性生殖系统的损害[J].中国男科学杂志,2005,19(3):70-72.
[7]QUILL TA, REN D,CLAPHAM DE, et al. Avotage-gated in channel expressed specifically in spermatozoa[J]. Proc Natl Acad Sci U S A,2001,98(22):12527-12531.
[8]QUILL TA,SUGDEN SA, ROSSI KL, et al. Hyperactivated sperm motility driven by Catsper2 is required for fertilization[J]. Proc Natl Acad Sci USA,2003,100(25):14869-14874.
[9]JIN JL, O'DOHERTY AM, WANG S, et al.Catsper 3 and Catsper 4 encode two cation channel-like proteins exclusively expressed in the testis [J].Biol Reprod,2005,73(6):1235-1242.
[10]VAN DER HOOM FA,SPIEGE JE, MAYLIE(é)-PFENNINGER MF,et al. A 43 kD c-mos protein is only expressed before meiosis during rat spermato genesis[J]. Oncogene,1991,6(6):929-932.
[11]SEBOUN E,BARBAUX S,BOURGERON T,et al. Gene sequence, localization, and evolutionary conservation of DAZLA, a candidate male sterility gene[J]. Genomics,1997,41(2):227-235.
(编辑 陶 珠)
1001-6910(2016)11-0070-06
R698+.2
B
10.3969/j.issn.1001-6910.2016.11.29
李俊涛(1978-),男(汉族),河南洛阳人,主治医师,医学博士,从事男科学基础与临床研究工作。
曲晓伟,主治医师,医学博士, qu0371@126.com
四川省教育厅课题(12ZA033)
2016-08-24;
2016-10-19

