跑台运动对脑缺血大鼠学习记忆能力及纹状体BDNF表达的影响
唐 伟,王 霆
跑台运动对脑缺血大鼠学习记忆能力及纹状体BDNF表达的影响
唐 伟1,王 霆2
跑台运动可以改善脑卒中大鼠的学习记忆能力,然而机制尚不清楚。因此,通过观察4周强迫跑台运动对短暂大脑中动脉(MCAO,middle cerebral artery occlusion)栓塞大鼠空间学习记忆能力、血浆皮质酮(Cort)及纹状体氨基酸水平和脑源性神经营养因子BDNF(brain-derived neurotrophic factor)表达的影响,研究跑台运动改善MCAO大鼠学习记忆功能的可能机制。方法:45只SD大鼠随机分为假手术组、脑缺血模型组及脑缺血运动组,脑缺血模型组及运动组大鼠制备MCAO短暂缺血模型,随后脑缺血运动组大鼠进行4周跑台运动。跑台运动结束后通过水迷宫实验测试所有大鼠学习记忆能力的变化,随后放射免疫法测试大鼠血浆Cort含量,采用高效液相-电化学方法检测纹状体Glu、GABA的含量,用免疫组织化学结合图像半定量方法对纹状体BDNF神经元的数量及面积进行测量和分析。结论:大脑中动脉(MCAO)短暂缺血大鼠的学习记忆能力可以通过进行长期跑台运动得到改善,其原理极有可能与长期跑台运动上调纹状体BDNF的表达,拮抗HPA轴功能亢进及兴奋性氨基酸的毒性,抑制神经元的坏死及凋亡,促进脑缺血后损伤神经元的修复有关。
跑台运动;大脑中动脉栓塞大鼠;学习记忆;皮质酮;氨基酸;纹状体
脑卒中是世界上死亡率及致残率最高的疾病之一,其中脑梗塞最为常见。大脑中动脉(MCAO)栓塞是脑卒中的常见原因,因此,大脑中动脉栓塞再灌注模型可以较好地模拟临床脑卒中的病理过程而常被使用。研究发现[1-3]:跑台训练对脑缺血有保护作用,然而具体机制尚不清楚。
在中枢神经系统中,纹状体是缺血性卒中比较敏感的核心区域之一,且纹状体Glu(谷氨酸)、GABA神经元含量较多[4]。许多研究证实,脑缺血过程中脑内特别是缺血中心区域氨基酸类神经递质尤其是兴奋性氨基酸,例如谷氨酸(G1u)的过量释放是缺血性脑损伤的重要因素之一,在脑缺血神经功能的损害中起着关键作用[5]。脑源性神经营养因子BDNF属于神经营养因子家族成员,研究报道,BDNF不仅涉及神经发育,而且在脑卒中后损伤神经元再生修复方面发挥重要作用[6]。近年来,围绕脑缺血急性期大脑BDNF的变化研究较多[7];但是有关脑缺血后BDNF后期变化相关文献较少,而且长期有氧运动改善脑缺血大鼠学习记忆能力的机制尚不清楚,因此本实验通过复制大鼠大脑中动脉(MACO)栓塞再灌注模型,观察长期跑台训练对MCAO模型大鼠空间学习记忆能力、纹状体氨基酸水平及BDNF表达的变化,探讨跑台运动增强MCAO模型大鼠空间学习记忆能力的可能机制。
1 材料及方法
1.1 实验动物及具体分组
健康雄性SD大鼠45只,鼠龄3个月,体质量220~230 g,室温(25±1)℃,湿度(55±10)%,大鼠自由摄食、饮水。将45只大鼠随机分为假手术组(SO),脑缺血模型组(CM)及脑缺血运动组(CE)。
1.2 动物MCAO模型制备
模型组和运动组大鼠制作MCAO动物模型[8]。水合氯醛(4%,10 mL/kg)麻醉大鼠后,大鼠颈部正中被切开,分离右侧颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA)。结扎右侧ECA远心端,斜剪一切口,将预先处理过的直径0.25 mm的尼龙线圆钝端沿切口插入近心端,将尼龙线沿右侧颈内动脉走向缓慢推进18~20 mm,直至尼龙线顶端有阻塞感,以阻断右大脑中动脉入口,造成右侧大脑中动脉供血区的缺血,90 min后缓慢退出尼龙线实施再灌流。在实验过程中,大鼠肛温控制在(37±0.5)℃,待清醒后放回笼中。假手术组除不阻塞大脑中动脉,其他手术步骤同脑缺血模型组。
参考Longa方法评价模型是否成功的分级标准:无神经损伤症状(0分),不能完全伸展左侧前爪(1分),向左侧转圈(2分),向左侧倾倒(3分),不能自发行走,意识丧失(4分)。剔除0分、4分及死亡大鼠,1~3分的大鼠入选本次实验。
1.3 训练方案
MCAO模型组与假手术组大鼠置于普通笼内常规饲养,期间可自由活动,进食饮水。MCAO运动组大鼠在术后4 d予以强迫跑台训练,连续4周,每天30 min,跑台坡度为0°。跑速如下:第1天4 m/min,第2天8m/min,接下来每天12 m/min[9]。
1.4 水迷宫实验(MWM)
跑台训练结束后第2天,用Morris水迷宫评估大鼠的学习记忆能力。水迷宫为圆形水槽,直径150 cm,直径14 cm的平台放在水池西北象限的中央,平台低于水面l cm,水温24 ℃,实验程序包括5 d定位航行实验,定位航行实验结束后24 h测试大鼠空间探索实验,迷宫上方安置摄像机记录大鼠游泳轨迹[10]。
1)定位航行实验:为了让实验大鼠熟悉迷宫环境,要在实验前1天将其放进没有平台的水槽中让其自由游泳2 min,随后进行5 d的定位航行实验,要求每天将大鼠面向池壁,从东、西、南、北4个入水点下水,共训练4次,每只大鼠允许其在2 min内找到平台,如果在2 min后大鼠仍未找到平台,就将逃避潜伏期记作2 min,并协助引导其到平台上停留15 s后用吹风机吹干大鼠放进鼠笼,10~15 min后进行下一次实验。最后要统计4次训练后大鼠逃避潜伏期成绩的平均值来作为当日的最终成绩。
3)空间探索实验:完成定位航行实验后的第2天,从水中撤出平台,由4个入水点中任一入水点将实验大鼠放入水中,并记录每只大鼠2 min跨越原平台的次数及在原平台象限停留的时间。
1.5 大鼠脑组织纹状体谷氨酸及γ-氨基丁酸含量测定
每组6只大鼠水迷宫行为测试结束后即刻断头取脑,首先于冰盘上迅速分离纹状体(大脑右侧),称重,然后在冰上制备大鼠大脑组织纹状体的匀浆,需要加入0.1 mol/L磷酸盐缓冲液,随后进行15 min(3 500 r/min)的离心,接着提取出清液1 mL,最后根据在试剂盒上的具体说明测定实验大鼠大脑组织的纹状体组织匀浆中Glu及GABA的具体含量。
1.6 纹状体BDNF取材与切片
每组剩余5只大鼠行为测试结束后即刻,经腹腔注射戊巴比妥钠(100 mg/kg)麻醉,开胸,用4%多聚甲醛常规灌注,去除大脑,蔗糖溶液后固定。在固定后使用石蜡包埋,然后将脑组织进行冠状位切片,片厚5 μm,接着对BDNF免疫组织进行化学染色。将石蜡切片置于65 ℃烤箱中烘烤1 h,二甲苯脱蜡2次,加入3%的双氧水-甲醇液在室温下孵育10 min,随后再滴加脑源性神经营养因子兔抗鼠血清第1抗体(配比1∶50,37 ℃孵育1 h),PBS液洗3次,每次5 min,随后加入生物素标记的羊抗兔第2抗体50 μL,37 ℃孵育1 h;接着DAB室温显色15 min,再进行苏木素复染并裱片,然后梯度酒精脱水、透明,最后封片。
1.7 大鼠血浆皮质酮含量测试
在行为测试即刻结束后,腹腔注射戊巴比妥钠(100 mg/kg)麻醉,在进行灌注和断头取脑时,从每只大鼠的左心室取血2 mL,4 ℃下进行3 500 r/min的离心10 min,吸弃掉上清液并分离血浆后,置于-70 ℃的低温冰箱中冷冻保存,严格按照操作说明书来测定实验大鼠血浆皮质酮的含量。
1.8 实验图像分析及统计学处理
采用数码高倍生物显微镜拍摄并借助形态学显微图像分析系统进行分析,参照大鼠脑立体定位图谱随机选取纹状体相同区域的5个视野,对大鼠缺血侧纹状体区BDNF(400倍)的阳性细胞进行计数及面积的测定,如图1、2所示。
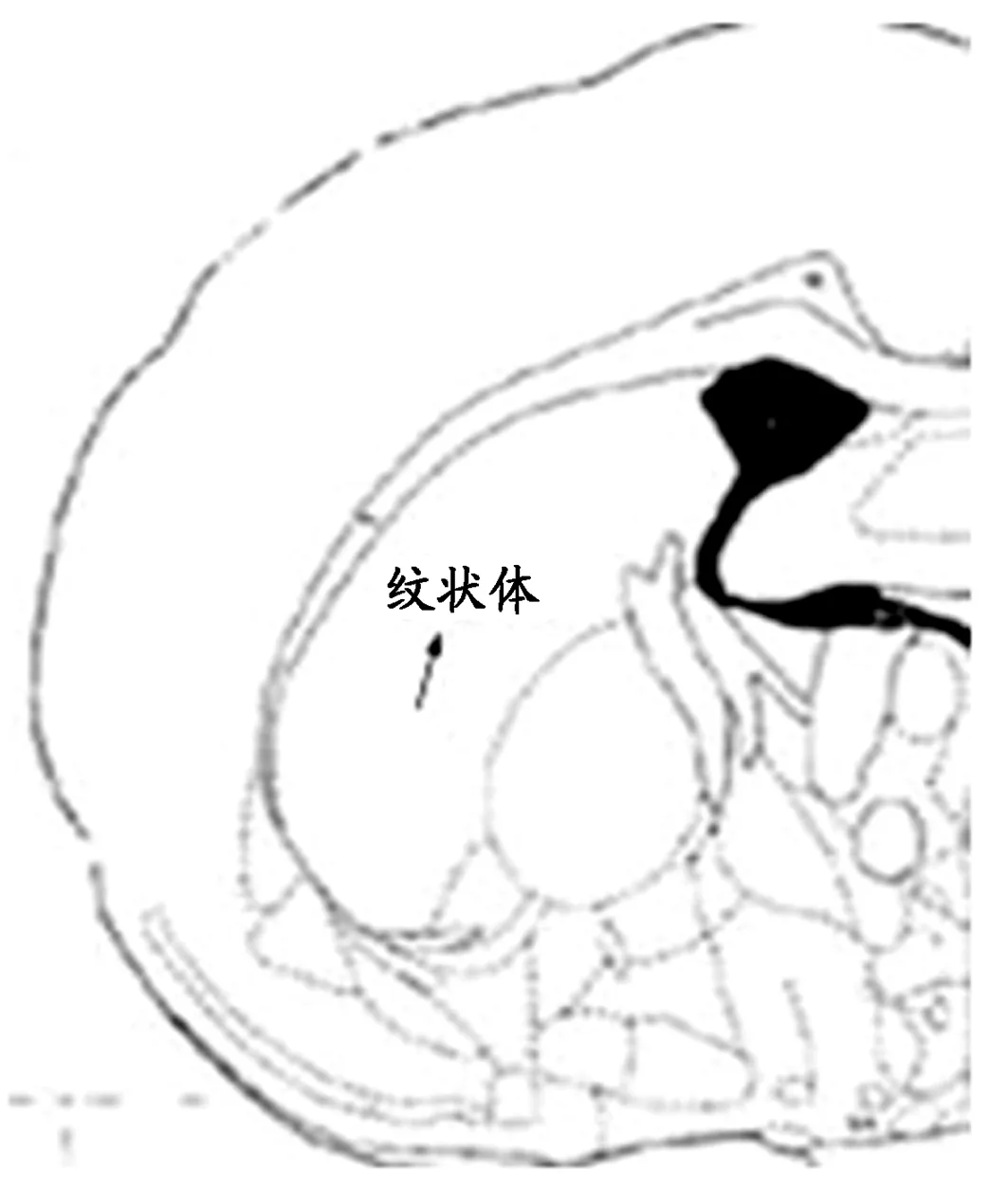
图 1 冠状位下纹状体截面,箭头所示(→)

图 2 纹状体BDNF阳性神经元分布(10×10,10×40)
2 研究结果
2.1 术后大鼠观察
MCAO术后多数大鼠于1~2 h内清醒,对照组清醒后进
食及活动很好,未见明显神经功能缺损症状,术后24 h所有MCAO大鼠均可自由饮水及摄食,术后48 h MCAO大鼠神经功能下降有所恢复,72 h后大部分大鼠神经功能缺失表现不明显,术中及术后2 d脑缺血模型组及运动组大鼠各死亡2只。
2.2 跑台运动对MCAO大鼠水迷宫实验测试指标的结果
2.2.1 跑台运动对MCAO大鼠定位航行实验逃避潜伏期的影响
如图3所示,由表1可知,各组大鼠5 d内寻找平台的时间越来越短,表明大鼠在5 d的游泳训练中对寻找隐藏在水中的平台均有一定的记忆能力。假手术组大鼠平均逃避潜伏期很快下降,而脑缺血模型组及运动组大鼠平均逃避潜伏期缓慢下降,且波动很大。每组大鼠纵向数据表明:从水迷宫训练的第l天起,脑缺血模型组大鼠比假手术组大鼠逃避潜伏期明显延长(P<0.01)。脑缺血运动组大鼠水迷宫训练的第l~3天逃避潜伏期显著高于假手术组(P<0.01),第4~5天开始差异较稳定,但仍具有显著性(P<0.05);脑缺血模型组大鼠从水迷宫训练的第4~5天逃避潜伏期明显短于模型组大鼠(P<0.05)。
表 1 大鼠Morris水迷宫定位航行实验结果 s
注:与脑缺血模型组比较,*为P<0.05,**P<0.01;与假手术组比较,#为P<0.05,##为P<0.01。下同。
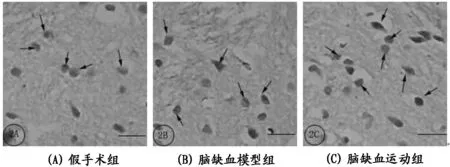
注:免疫组织化学结果显示脑缺血模型组大鼠纹状体BDNF阳性神经元表达(→)与假手术组比较无统计学意义;跑台运动4周后运动组大鼠纹状体BDNF免疫阳性神经元表达与模型组比较显著增强(→)。
bar=50 μm (2AC)。
图 3 缺血侧纹状体BDNF阳性神经元分布
2.2.2 跑台运动对MCAO大鼠空间探索实验指标的影响
由表2可知:2 min内,与假手术组大鼠比较,脑缺血模型组大鼠初次找到原平台的时间延长(P<0.01),延长幅度为105%,穿越站台次数较假手术组均明显减少(P<0.01),减少幅度为65%;与模型组比较,脑缺血运动组大鼠初次找到原平台的时间显著缩短(P<0.05),缩短幅度为30%,穿越站台次数显著增多(P<0.01),增加幅度为74%。
2.3 各组大鼠血浆皮质酮及纹状体Glu及GABA测试结果
表3结果显示:与假手术组比较,模型组大鼠纹状体Glu含量显著增加2.09倍(P<0.01),GABA含量显著下降(P<0.01),下降幅度为40%;脑缺血运动组大鼠Glu含量与模型组相比显著下降(P<0.01),下降幅度为41%,GABA含量比模型组显著增高(P<0.05),增加幅度为31%。脑缺血模型组大鼠与假手术组比较血浆Cort含量显著增加(P<0.05),上升幅度为42%;脑缺血运动组大鼠血浆Cort含量与假手术组比较,无统计学意义(P>0.05);经过4周跑台运动,与脑缺血模型组比较,脑缺血运动组大鼠血浆Cort含量显著下降(P<0.05),下降幅度为28%。

表 2 大鼠Morris水迷宫空间探索实验结果
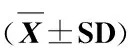
表 3 各组大鼠血浆Cort及纹状体谷氨酸及
2.4 各组大鼠缺血侧纹状体BDNF表达结果
图2所示,光镜下可见纹状体内分布有大量的BDNF,低倍镜下为褐色小圆点(如图2A所示),高倍镜下BDNF神经元大小不一,胞核淡染,胞浆染色为深褐色,胞体形态多种多样呈椭圆形或圆形(如图2B所示)。
图像分析结果显示(见表4,并如图3所示):脑缺血模型组大鼠缺血侧纹状体BDNF阳性细胞表达与假手术组比较,无统计学意义(P>0.05);与假手术组比较,脑缺血运动组大鼠纹状体BDNF数量及面积均显著增多(P<0.01,P<0.01),增加幅度分别为75%及72%;与脑缺血模型组大鼠比较,脑缺血运动组大鼠纹状体BDNF阳性细胞数量及面积均显著增加(P<0.01,P<0.01),增加幅度分别为45%及47%。

表 4 各组大鼠右侧纹状体BDNF阳性细胞数和
3 讨论
本研究通过水迷宫实验证实:短暂大脑中动脉栓塞严重削弱了大鼠学习记忆能力,而4周跑台运动显著增强了脑缺血大鼠的学习记忆能力,具体表现为水迷宫实验中脑缺血运动组大鼠逃避潜伏期缩短,平台停留时间延长,穿越站台次数增加,与前期学者研究结果一致[11]。皮质酮是HPA轴的重要激素,Milot等[12]采用结扎双侧颈总动脉和造成大鼠脑缺血再灌注模型,皮质酮过度分泌一直延续到缺血后1个星期,说明脑缺血再灌注后伴发HPA轴功能紊乱,导致皮质酮含量增高对脑功能造成一定损害,与脑缺血引起的学习记忆能力下降有关。我们的实验发现,大鼠单侧(右侧)大脑中动脉栓塞28 d大鼠Cort水平显著高于假手术组,学习记忆能力下降,可能与应激激素Cort 的过度分泌有关。研究认为,25~30 m/min的跑台运动可提高脑缺血大鼠的血清皮质酮水平[11],并且Kim等研究认为,9 m/min的跑台运动可以恢复应激障碍等疾病引起的HPA轴失调[13];因此,为了避免跑台运动对脑缺血大鼠的应激刺激本实验大鼠的跑台速度为4、8、12 m/min。结果发现脑缺血运动组大鼠血浆皮质酮水平显著低于脑缺血组大鼠,因此,可以认为4周跑台运动改善脑缺血大鼠学习记忆能力与血浆皮质酮水平下降有关。
关于脑缺血导致学习记忆能力下降的机制目前还在研究阶段,脑内Glu/GABA 调节系统是近年研究的热点[14]。在中枢神经系统中氨基酸递质可分为兴奋性(主要是Glu)和抑制性(主要是GABA)2类。Glu在学习记忆、尤其在诱导LTP的过程中起关键作用,并且成为成人大脑损伤的重要机制[15]。Campos等[16]研究发现脑缺血时Glu释放量与缺血时间呈正相关,即缺血时间愈长,神经细胞和胶质细胞谷氨酸释放量愈多。GABA是抑制性氨基酸的重要成员之一,是脑内主要的抑制性神经递质,可拮抗Glu的毒性,对脑缺血神经元损伤有保护作用。研究认为:在慢性脑缺血损伤早期,Glu升高的同时,突触前谷氨酸受体可以增加GABA的释放,可通过突触前抑制作用,减少Glu的释放,减轻其兴奋性毒性作用[17];但在脑缺血持续的病理损伤过程中,GABA的合成会被关闭,继之GABA逐渐耗竭[18]。本研究发现,大鼠短暂大脑中动脉栓塞28 d后,纹状体Glu含量显著增加,同时GABA水平显著下降。临床及动物实验证实,体育锻炼具有神经保护作用,动物实验显示长期运动可以通过减弱脑缺血大鼠的氧化应激、改善脑血流量、维护神经与血管的完整性增强大鼠学习记忆能力[19],而Zhang等[20]认为跑台运动预干预可以防止脑缺血引起的脑细胞后续损害,减轻炎症反应,抑制谷氨酸过多释放,保护血脑屏障,抑制细胞凋亡。本实验结果发现经过4周跑台运动,脑缺血运动组大鼠纹状体Glu水平减少,GABA水平增加,并且脑缺血运动组大鼠学习记忆能力显著增强,可能是因为升高的GABA抑制性的影响谷氨酸调节的神经活动,降低其神经毒性,从而增强脑缺血大鼠的学习记忆能力。
纹状体是小脑基底神经节中的一个核团,在学习和记忆等高级神经活动中起关键作用,纹状体神经元对大脑中动脉栓塞引起的脑缺血非常敏感,是脑卒中的易发部位之一[21]。脑源性神经营养因子BDNF由海马和纹状体等区域的神经细胞分泌,通过作用于受体激酶促进神经组织的生存和分化,并且在参与脑缺血损伤的再生修复等方面发挥重要作用。大量研究表明,脑缺血会导致大脑BDNF的表达,并且BDNF的表达与脑缺血后梗死面积及脑缺血后损伤的神经功能恢复有关,并且有时间依赖性[22]。国内徐正东等研究发现,即MCAO后6 h在大脑皮质表达增强,l d 达高峰,在以后的时间点逐渐下降,7 d之后仍有表达,但低于对照组,证明了大鼠脑缺血后早期可诱发BDNF的大脑皮质表达增加,对受损神经元修复起一定作用[23]。在本研究中,我们通过免疫组织化学染色法测试了大鼠纹状体BDNF的表达,发现大鼠单侧(右侧)大脑中动脉栓塞28 d模型组大鼠纹状体缺血侧BDNF表达与假手术组比较无统计学意义,提示脑缺血状态下纹状体BDNF的应激性高表达难以维持较长时间,随着脑缺血-再灌注时间的延长纹状体在脑缺血损伤过程中组织自我修复能力低下有关,这可能是脑缺血大鼠学习记忆能力下降的机制之一。
国外学者研究认为,自愿运动及强迫跑台运动均可通过上调海马BDNF表达增强大鼠认知能力[24],且研究表明低强度跑台运动可改善大脑中动脉栓塞大鼠的学习记忆能力[25];而Kima等[26]发现2周的跑台运动增加了脑缺血大鼠海马BDNF mRNA的水平,但对大鼠的运动功能及空间学习记忆能力没有改善。因此,本实验设计的跑台运动为4周,结果发现,MCAO模型大鼠经过4周中等强度跑台运动缺血侧纹状体BDNF表达明显增强,提示脑缺血大鼠经过长期跑台运动认知能力改善可能与纹状体BDNF表达增强,促进缺血后损伤神经元的修复有关。最近研究报道脑缺血后高表达的BDNF可以通过下调NMDA受体功能,减少谷氨酸的分泌从而削弱谷氨酸的神经毒性,参与脑缺血损伤保护过程[27];因此,本实验中跑台训练在大鼠脑缺血神经元损伤后学习记忆能力增强的机制之一,可能是通过上调纹状体BDNF的表达,拮抗HPA轴功能亢进及兴奋性氨基酸的毒性,抑制脑缺血神经元的坏死及凋亡,促进损伤神经元的修复而起到脑保护作用,具体原理需进一步研究。
4 结论
4周跑台锻炼可以增强MCAO大鼠的学习记忆能力,可能与此运动上调脑缺血大鼠纹状体BDNF的表达,拮抗HPA轴功能亢进及兴奋性氨基酸的毒性,抑制缺血神经元的坏死及凋亡,促进脑缺血后损伤神经元的修复有关,提示纹状体可能是运动增强脑缺血大鼠学习记忆能力的作用脑区之一,且这一作用可能是由跑台运动调节脑缺血大鼠纹状体Glu、GABA水平使其保持兴奋-抑制平衡及上调纹状体BDNF共同介导的。
[1]EVZEL'MAN M A,ALEKSANDROVA N A.Cognitive disorders and their correction in patients with ischemic stroke[J].Zh Nevrol Psikhiatr Im SS Korsakova,2013,113(10):36.
[2]IHARA M,OKAMOTO Y,HASE Y,et al.Association of physical activity with the visuospatial /executive functions of the montreal cognitive assessment in patients with vascular cognitive impairment[J].J Stroke Cerebrovasc Dis,2013,22(7):146.
[3]SHIMADA H,HAMAKAWA M,ISHIDA A,et al.Low-speed treadmill running exercise improves memory function after transient middle cerebral artery occlusion in rats[J].Behav Brain Res,2013,(243):21.
[4]OUYANG C,GUO L,LU Q,et al.Enhanced activity of GABA receptors inhibits glutamate release induced by focal cerebral ischemia in rat striatum[J].Neuroscience Letters,2007,420(2):174.
[5]HWANG I K,YOO K Y,NAM Y S,et al.Mineralocorticoid and glucocorticoid receptor expressions in astrocytes and microglia in the gerbil hippocampal CA1 region after ischemic insult.Neurosci Res[J].2006,54(4):319.
[6]ZHENG P,ZHANG J,LIU H,et al.Angelica injection reduces cognitive impairment during chroniccerebral hypoperfusion through brain-derived neurotrophic factor and nerve growth factor[J].Curr Neurovasc Res,2008,5(1):13.
[7]TANAKA S,TSUCHIDA A,KIUCHI Y,et al.GABAergic modulation of hippocampal glutamatergitc neurons:an in vivo microdialysis study.Eur J Pharmacol[J].Eur J Pharmacol,2003,465(1/2):61.[8]KAGIYAMA T,KAGIYAMA S,PHILLIPS M I.Expression of angiotensin type 1 and 2 recepors in brain after transient middle cerebral artery occlusion in rats[J].Regul Pept,2003,110(3):241.
[9]LIU N,HUANG H,LIN F,et al.Effects of treadmill exercise on the expression of netrin-1 and its receptorsin rat brain after cerebral ischemia[J].Neuroscience,2011(194):349.
[10]AMOS-KROOHS R M,WILLIAMS M T,VORHEES C V.Neonatal methylphenidate does not impair adult spatial learning in the Morris water maze in rats[J].Neuroscience Letters,2011,502(3):152.
[11]SHIH P C,YANG Y R,WANG R Y.Effects of exercise intensity on spatial memory performance and hippocampal synaptic plasticity in transient brain ischemic rats[J].PLoS One,2013,8(10):1175.
[12]MILOT M,PLAMONDON H.Changes in HPA reactivity and noradrenergic functions regulate spatialmemory impairments at delayed time intervals following cerebral ischemia[J].Horm Behav,2011,59(4):594.
[13]HONG G K,LIM E Y,JUNG W R,et al.Effects of treadmill exercise on hypoactivity of the hypothalamo-pituitary-adrenal axis induced by chronic administration of corticosterone in rats[J].Neuroscience Letters,2008,434(1):46.
[14]GAO J,YANG G,CHEN C,et al.Determination of endogenous amino acids in brain tissues aftercerebral ischemia by RRLC-QQQ[J].Zhongguo Zhong Yao Za Zhi,2013,38(5):748.
[15]SCHUBERT M,ALBRECHT D.Activation of kainate GLU(K5) transmission rescues kindling-Induced impairment of LTP in the rat lateral amygdala[J].Neuropsychopharmacology,2008,33(10):2524.
[16]CAMPOS F,PÉREZ-MATO M,AGULLA J,et al.Glutamate Excitoxicity Is the Key Molecular Mechanism Which Is Influenced by Body Temperature during the Acute Phase of Brain Stroke[J].PLoS One,2012,7(8):44191.
[17]SARANSAARI P,OJA S.Characteristics of GABA release induced by free radicals in mouse hippocampal slices[J].Neurochemical Research,2008,33(3):384.
[18]JIA J,HU YS,WU Y,et al.Pre-ischemic treadmill training affects glutamate and gamma aminobutyric acid levels in the striatal dialysate of a rat model of cerebral ischemia[J].Life Sci,2009,84(15/16):505.
[19]ZHANG Q,ZHANG L,YANG X,et al.The effects of exercise preconditioning on cerebral blood flow change and endothelin-1 expression after cerebral ischemia in rats[J].J Stroke Cerebrovasc,2014(3):1696.
[20]ZHANG F,WU Y,JIA J.Exercise preconditioning and brain ischemic tolerance[J].Neuroscience,2011,177(17):170.
[21]OHE Y,HAYASHI T,UCHINO A,et al.Secondary degeneration of the substantia nigra after cerebral infarctions including the striatum[J].Brain Nerve,2013,65 (3):289.
[22]BÉJOT Y,PRIGENT-TESSIER A,CACHIA C,et al.Time-dependent contribution of non neuronal cells to BDNF production afterischemic stroke in rats[J].Neurochem Int,2011,58(1):102.
[23]徐正东,李贯绯.BDNF、NGF在大鼠局灶性脑缺血的表达变化及葛根素对其影响的实验研究[J].中国实验诊断学,2005,9(4):578.
[24]ALOMARI M A,KHABOUR O F,ALZOUBI K H,et al.Forced and voluntary exercises equally improve spatial learning and memory and hippocampal BDNF levels[J].Behavioural Brain Research,2013(247):34.
[25]SHIMADA H,HAMAKAWA M,ISHIDA A,et al.Low-speed treadmill running exercise improves memory function after transient middle cerebral artery occlusion in rats[J].Behavioural Brain Research,2013(243):21.
[26]KIMA M W,BANG M S,HAN T R,et al.Exercise increased BDNF and trkB in the contralateral hemisphere of the ischemic rat brain[J].Brain Research,2005,1052(1):16.
[27]PREHN J H.Marked diversity in the action of growth factors on N -methyl- d-aspartate -induced neuronal degeneration[J].Eur J Pharmacol,1996(306):81.
Effects of Treadmill Training on Learning and Memory and BDNF Expression within Striatum after Cerebral Ischemia Rats
TANG Wei1,WANG Ting2
Treadmill exercise may enhance the recovery of impaired memory function in stroke rats.However,the mechanisms underlying these beneficial effects are not yet known.Therefore,the purpose of this study was to investigate the effects of the 4-week forced treadmill exercise on the learning and memory,the blood plasma cort content,amino acid levels and BDNF expression within striatum of brain after MCAO(transient middle cerebral artery occlusion) rats,inquiring into the possible mechanism of treadmill exercise improving learning and memory of MCAO rats.Methods:45 male SD rats were randomly allocated to 3 groups,sham operation group(SO),cerebral ischemia model group(CM) and cerebral ischemia exercise group(CE).The rats of CM and CE group rats were submitted to the transient middle cerebral artery occlusion,and then the CE group rats received 4-week forced treadmill exercise.Then all rats were submitted to behavioral testing for spatial memory by the Morris water maze;then the blood plasma cort content was detected by radioimmunoassay.Subsequently the concentration of Glu and GABA were examined by high performance liquid- electrochemical detection and BDNF expression within striatum was detected and analysised by using immuneohistochemical method.Conclusion:Treadmill exercise may improve the learning and memory ability after MCAO rats,its mechanism might be that treadmill exercise upregulate BDNF expression,overactive HPA axis antagonism and decrease Glu neurotoxicity within striatum,inhibit neuronal necrosis and apoptosis and promote the repair of damage neurons.
treadmill exercise;MCAO model rats;learning and memory;Cort;amino acid;BDNF
2015-09-16
中北大学科学基金(2015—2016)。
唐伟(1980-),男,山东莱州市人,硕士,讲师,研究方向为运动人体科学。
1.中北大学体育学院,山西 太原 030051;2.山西大学体育学院,山西 太原 030006
1.School of Sport and Physical Education,North University of China,Taiyuan 030051,China;2.School of Physical Education,Shanxi University,Taiyuan 030006,China.
G 804.2
1009-783X(2016)06-0572-05
A

