抗生素保存褐马鸡粪便分泌型免疫球蛋白A的时效性研究
周冉, 齐磊, 王文霞, 胡德夫, 隋金玲
(北京林业大学自然保护区学院,北京100083)
抗生素保存褐马鸡粪便分泌型免疫球蛋白A的时效性研究
周冉, 齐磊, 王文霞, 胡德夫, 隋金玲*
(北京林业大学自然保护区学院,北京100083)
粪便免疫球蛋白是衡量野生动物健康状况及生存状态的有效手段之一,其中粪便的保存问题是关键。为探索抗生素对粪便分泌型免疫球蛋白A(SIgA)的保存时效性,采用酶联免疫吸附法对4种常用抗生素(利福平、四环素、卡那霉素和庆大霉素)的3种不同浓度(1 μg·mL-1、25 μg·mL-1、50 μg·mL-1)保存的褐马鸡Crossoptilonmantchuricum粪便SIgA的含量进行了测定。结果表明,25 μg·mL-1的利福平保存的褐马鸡粪便SIgA效果最佳,其次是50 μg·mL-1的四环素和50 μg·mL-1的卡那霉素,庆大霉素保存效果最差。
褐马鸡;抗生素;粪便分泌型免疫球蛋白A;保存时效
褐马鸡Crossoptilonmantchuricum是中国特有珍稀鸟类,国家Ⅰ级重点保护野生动物,世界易危鸟类之一。目前,褐马鸡野生种群主要分布在山西吕梁山、河北小五台山和北京东灵山、陕西黄龙山等地的局部地区(郑光美,王歧山,1998;雷忻,廉振民,2008)。迄今为止,该物种的生态习性、种群生态、繁殖生物学习性及保护生物学等方面研究取得了一些成果(柳明来,党太合,1999;郑建旭等,2000;张国刚等,2005;武玉珍,冯睿芝,2013),但该物种免疫生理学的报道甚少。究其原因,该濒危动物种群数量少、应激生理反应较高、捕捉难度大,导致采集血液及组织等样本十分困难,这严重阻碍了该领域的研究。近年来,通过收集野生动物的粪便、尿液、毛发、唾液等遗留物,即非损伤的取样方法,拓展了野生动物免疫生理学的研究途径(Terioetal.,2002)。分泌型免疫球蛋白A(SIgA)是外分泌液中存在的一种主要抗体,是粘膜免疫系统主要的免疫防线(Ushidaetal.,2008)。其中,粪便SIgA是监测野生动物健康状况及生存状态有效而直观的生理指标之一(Paramastrietal.,2007;Yuetal.,2011;Curryaetal.,2012),其含量的测定有助于及时预防野生动物种群的疾病,为自然保护区管理人员对野生动物进行补饲和有效管护提供依据。因此,粪便SIgA成为研究野生动物机体所处状态的一种有效手段。
野外或圈养条件下采集的新鲜粪便均需要保存并运输至实验室才能进一步测定。动物的排泄物中含有大量的胃肠细菌,新鲜粪便若没有及时提取或低温保存处理,则粪便中的待测物质很容易被微生物分解,造成测定结果的不准确或无法检测出目标物质。目前比较常用的保存方法是冷冻保存法、有机溶剂保存法和干燥保存法。但野外采集的粪便很难进行及时冷冻,且冷冻保存也不利于远距离采样操作。粪便类固醇激素的保存时效研究多采用甲醇、乙醇等有机溶剂法(Khanetal.,2002;郎冬梅等,2011),而甲醇或乙醇等有机溶剂易使蛋白质变性失活,无法应用于粪便中免疫球蛋白的保存。因此,如何有效保存粪便内免疫球蛋白,无疑成为开展免疫生理研究工作必须解决的首要问题。抗生素可抑制粪便中微生物的活性,增强免疫球蛋白的稳定性。本文通过研究不同浓度的4种常用抗生素对褐马鸡粪便中SIgA的保存效果,探讨了抗生素对粪便免疫球蛋白保存的可行性,以期为野外条件下野生动物的免疫生理生态研究提供理论依据。
1 材料与方法
1.1 实验材料及药品
实验材料为山西庞泉沟国家级自然保护区人工饲养的5只雌性健康成年褐马鸡的新鲜粪便,共75份。
抗生素包括利福平(广东华南药业集团有限公司)、四环素(广东华南药业集团有限公司)、卡那霉素(西南药业股份有限公司)、庆大霉素(福建古田药业有限公司)。
1.2 样品处理
将所有粪便充分混匀,以消除个体和采样时间的差异。将混合后的粪样分成130份(13份/时间段×10时间段),每份0.5 g。取其中10份样品作为对照组(不加抗生素),其余120份样品作为抗生素组,分别用利福平、四环素、庆大霉素、卡那霉素4种抗生素的3种浓度(1 μg·mL-1、25 μg·mL-1、50 μg·mL-1)处理粪便(0.5 g粪便∶1 mL抗生素),然后在恒温箱(20 ℃±3 ℃)条件下保存。保存时间设定为0 d、2 d、4 d、6 d、8 d、10 d、12 d、14 d、16 d、18 d,共10个时间段,每个时间段分别取出13份样品(12个抗生素组和1个对照组)进行SIgA的提取与测定。
1.3 粪便SIgA的提取与测定
参照Peters等(2004)和Ushida等(2008)提取粪便免疫球蛋白的方法,并略作改进。具体步骤如下:将0.5 g湿粪和5 mL提取缓冲液(0.01 M PBS,0.05% Tween 20,pH=7.2)加入离心管中,涡旋仪器旋转萃取5 min,2000 rmp/min常温离心20 min。取上清液1 mL于2 mL离心管内,再次10 000 rmp/min低温(4 ℃)冷冻离心20 min。最后,取上清液于1.5 mL离心管内进行分装,填写标号,并置于-20 ℃冰箱中冷冻待测。
采用酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)测定粪便SIgA含量,酶联免疫诊断试剂盒为上海越研生物科技有限公司生产。
1.4 数据统计与分析
使用Excel对实验数据进行预处理,Sigmaplot 12.5进行数据绘图,SPSS 20.0对数据进行单因素方差分析(One-Way ANOVA)和多重比较,显著水平设置为α=0.05。
2 结果与分析
2.1 对照组粪便SIgA含量的测定
不同保存时间下对照组粪便SIgA含量如图1所示,可见未进行保存处理的粪便SIgA含量随时间的延长下降迅速。2 d时SIgA含量降至0 d时的72.71%;4 d时SIgA含量降至0 d时的40.9%,8 d时降至0,即对照组粪便SIgA含量在8 d时被完全降解。
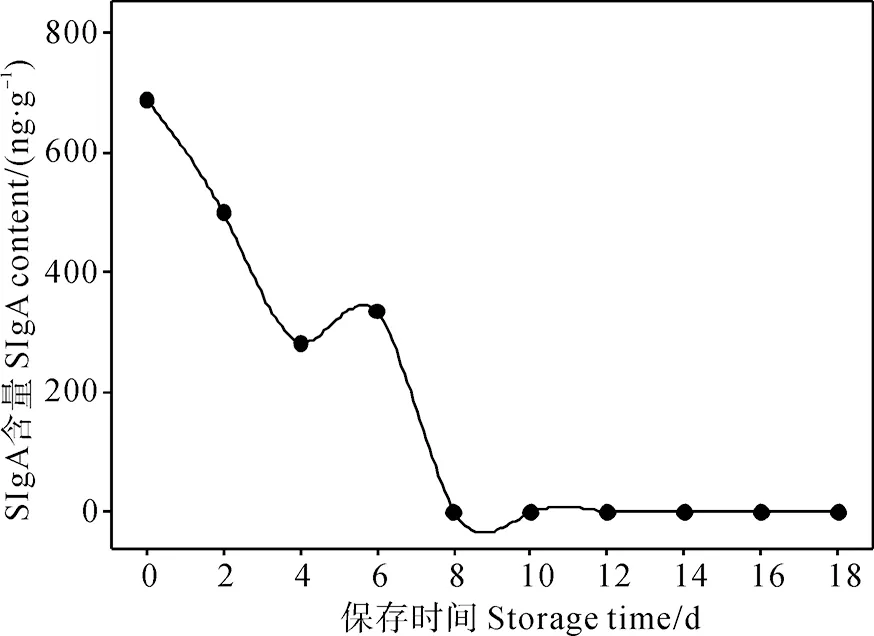
图1 对照组粪便SIgA含量随时间变化图
2.2 抗生素组粪便SIgA含量的测定
2.2.1 利福平保存粪便SIgA含量的测定 不同浓度利福平保存的粪便SIgA含量随时间变化如图2。3种浓度的利福平保存下的粪便SIgA含量在16 d内呈缓慢下降趋势,16 d后SIgA含量迅速降低,18 d时降至0,且明显比对照组下降缓慢。25 μg·mL-1利福平保存粪便效果较对照组差异有高度统计学意义(P<0.01),其他浓度较对照组差异有统计学意义(P<0.05)。其中,16 d时,1 μg·mL-1利福平保存的粪便SIgA含量降至0 d时的63.00%;25 μg·mL-1利福平保存的粪便SIgA含量降至0 d时的66.03%,下降趋势较平缓;50 μg·mL-1利福平保存的粪便SIgA含量降至0 d时的42.69%,相对于其他浓度呈较快的下降趋势。
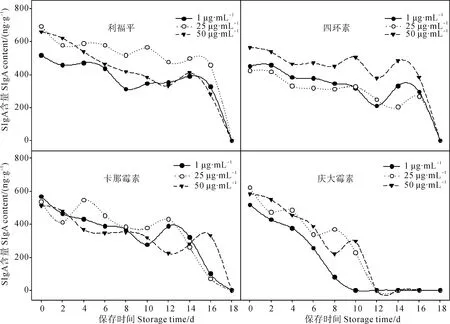
图2 不同抗生素保存下粪便SIgA含量的变化图
Fig. 2 The change of fecal SIgA content in the groups treated by different antibiotics
2.2.2 四环素保存粪便SIgA含量的测定 不同浓度四环素保存的粪便SIgA含量随时间变化如图2。3种浓度的四环素保存下的粪便SIgA含量在16 d内呈下降趋势,16 d后SIgA含量迅速降低,至18 d时降为0,且比对照组下降缓慢,50 μg·mL-1较对照组差异有高度统计学意义(P<0.01),其他2个浓度较对照组差异无统计学意义(P>0.05)。其中,16 d时,1 μg·mL-1四环素保存的粪便SIgA含量降至0 d时的60.66%;25 μg·mL-1保存粪便SIgA含量降至0 d时的63.23%;50 μg·mL-1保存的粪便SIgA含量降至0 d时的68.12%,相对于其他2个浓度呈缓慢下降趋势。
2.2.3 卡那霉素保存粪便SIgA含量的测定 不同浓度卡那霉素保存的粪便SIgA含量随时间变化如图2。3种浓度的卡那霉素保存的粪便SIgA含量在16 d内均有下降趋势、波动幅度较大,1 μg·mL-1、25 μg·mL-1、50 μg·mL-1保存的粪便SIgA含量分别在14 d、14 d、16 d后迅速降低,至18 d时降为0,且比对照组下降缓慢,但较对照组差异无统计学意义(P>0.05)。其中,14 d时,1 μg·mL-1保存的粪便SIgA含量降至0 d时的56.63%;25 μg·mL-1保存的粪便SIgA含量降至0 d时的48.73%。16 d时,1 μg·mL-1保存的粪便SIgA含量降至0 d时的17.71%;25 μg·mL-1保存的粪便SIgA含量降至0 d时的13.08%;50 μg·mL-1保存的粪便SIgA含量降至0 d时的65.86%。
2.2.4 庆大霉素保存粪便SIgA含量的测定 不同浓度庆大霉素保存的粪便SIgA含量随时间变化如图2。3种浓度的庆大霉素保存的粪便SIgA含量在10 d内呈下降趋势,1 μg·mL-1、25 μg·mL-1、50 μg·mL-1保存的粪便SIgA含量分别在6 d、10 d、10 d后迅速降低,分别至10 d、12 d、12 d时降为0。SIgA含量下降比对照组略微缓慢,但较对照组差异无统计学意义(P>0.05)。其中,6 d时,1 μg·mL-1保存的粪便SIgA含量降至0 d时的49.44%。10 d时,25 μg·mL-1保存的粪便SIgA含量降至0 d时的36.59%;50 μg·mL-1保存的粪便SIgA含量降至0 d时的50.95%。
3 结论与讨论
本研究表明,利福平对粪便SIgA保存有效,其中25 μg·mL-1利福平效果最好,但保存时间最长不应超过16 d。四环素对粪便SIgA保存亦有效,其中50 μg·mL-1四环素效果最好,但保存时间最长不应超过16 d。卡那霉素对粪便SIgA保存一般,其中50 μg·mL-1卡那霉素的效果更好。庆大霉素对粪便SIgA的保存效果最差。经进一步分析发现,25 μg·mL-1利福平保存效果与50 μg·mL-1四环素、50 μg·mL-1卡那霉素保存效果差异有统计学意义(P<0.05)。在16 d时,25 μg·mL-1利福平、50 μg·mL-1四环素、50 μg·mL-1卡那霉素保存的粪便SIgA含量分别降至0 d时的66.03%、68.12%、65.86%,且25 μg·mL-1利福平下降趋势较50 μg·mL-1四环素、50 μg·mL-1卡那霉素平缓,波动幅度较小,50 μg·mL-1四环素下降趋势较50 μg·mL-1卡那霉素平缓。本研究分析指出,25 μg·mL-1利福平保存褐马鸡粪便SIgA效果最佳,其次为50 μg·mL-1四环素和50 μg·mL-1卡那霉素,庆大霉素保存效果最差。
利福平为利福霉素类半合成广谱抗菌剂,对多种病原微生物均有抗菌活性,通过抑制依赖DNA的RNA聚合酶,使聚合酶失去活性,从而影响细菌的RNA合成,起到抑菌和杀菌作用。四环素为广谱抑菌剂,通过干扰氨酰-tRNA与核糖体的结合而抑制细菌蛋白质的合成;卡那霉素和庆大霉素为氨基糖苷类抗生素,通过与细菌核糖体或其反应底物(如tRNA、mRNA)相互作用,从而抑制蛋白质的合成。结果证实利福霉素、四环素广谱抗菌剂对褐马鸡粪便SIgA的保存效果较卡那霉素和庆大霉素等氨基糖苷类抗生素效果好。但研究中利福平、四环素、卡那霉素和庆大霉素保存的粪便SIgA在18 d后的含量迅速降至0,这可能是由于抗生素失效,导致微生物滋生,SIgA被完全降解。
粪便类固醇保存时效研究指出,微生物分解代谢类固醇激素可能影响免疫测定时待测激素与抗体之间的亲和率或引起免疫测定时的交叉反应,造成激素测定值的明显改变(Wasser,1988;Yamauchi,1999)。在抗生素保存粪便SIgA的过程中,SIgA含量出现不同程度的增加情况。推测出现这种情况可能的原因是:(1)粪便及外界环境中存在大量细菌,其分泌的IgA蛋白酶不仅识别出现IgA铰链区序列,而且也识别连接IgA蛋白酶区和beta区的可变区。各种细菌产生的IgA蛋白酶对IgA的切除位点不同,且分泌型IgA抗原结合价为4,可能是由于IgA蛋白酶裂解,使不同的抗原结合部位暴露出来,检测时与多余的抗体结合,导致粪便IgA含量升高。(2)IgA的糖基化异常也会影响到它对IgA蛋白酶的敏感性,因此在IgA肾病中,IgA糖基化的异常可能是导致IgA升高的原因之一(李青等,2010)。
本研究初次探讨抗生素对褐马鸡粪便SIgA的保存时效性,发现抗生素对褐马鸡粪便SIgA有一定的保存效果,但抗生素的种类和浓度对粪便SIgA保存效果有极大的影响,因此在野外研究中采用适当的抗生素和合适的浓度处理样品,将有利于开展对野生褐马鸡健康状况的评价。而关于不同抗生素保存褐马鸡粪便SIgA的机制,以及抗生素对其他鸟类粪便SIgA保存的有效性,仍需做进一步探讨。
郎冬梅, 刘文华, 胡德夫, 等. 2011. 圈养林麝粪便类固醇激素保存时效性研究[J]. 四川动物, 30(3): 357-361.
雷忻, 廉振民. 2008. 陕西黄龙山褐马鸡生存现状研究[J]. 科技导报, 26(14): 58-60.
李青, 张紫媛, 樊均明. 2010. 各种细菌产生的SIgA蛋白酶的结构、性质及作用[J]. 中国中西医结合肾病杂志, (8): 740-742.
柳明来, 党太合. 1999. 褐马鸡的生态习性及其保护意义[J]. 陕西林业科技, 3: 49-50.
武玉珍, 冯睿芝. 2013. 褐马鸡的濒危原因及保护措施[J]. 中国家禽, 35(8): 49-50.
张国刚, 郑光美, 张正旺. 2005. 栖息地特征对褐马鸡种群密度和集群行为的影响[J]. 生物多样性, 25(13): 162-167.
郑光美, 王歧山. 1998. 中国濒危动物红皮书(鸟类)[M]. 北京: 科学出版社: 242-243.
郑建旭, 安春林, 郭书彬. 2000. 小五台山自然保护区珍禽褐马鸡繁殖生物学习性研究[J]. 河北林业科技, (4): 5-7.
Currya E, Stoopsa MA, Rotha TL. 2012. Non-invasive detection of candidate pregnancy protein biomarkers in the feces of captive polar bears (Ursusmaritimus)[J]. Theriogenology, 78(2): 308-314.
Khan MZ, Altmann J, Isani SS,etal. 2002. A matter of time: evaluating the storage of fecal samples for steroid analysis[J]. General and Comparative Endocrinology, 128(1): 57-64.
Paramastri Y, Royo F, Eberova J,etal. 2007. Urinary and fecal immunoglobulin A, cortisol and 11-17 dioxoandrostanes, and serum cortisol in metabolic cage housed female cynomolgus monkeys (Macacafascicularis)[J]. Journal of Medical Primatology, 36(6): 355-364.
Peters I, Calvert E, Hall E,etal. 2004. Measurement of immunoglobulin concentrations in the feces of healthy dogs[J]. Clinical and Diagnostic Laboratory Immunology, 11(5): 841-848.
Terio KA, Brown JL, Moreland R,etal. 2002. Comparison of different drying and storage methods on quantifiable concentrations of fecal steroids in the cheetah[J]. Zoo Biology, 21(3): 215-222.
Ushida K, Kameue C, Tsukahara T,etal. 2008. Decreasing traits of fecal immunoglobulin A in neonatal and weaning piglets[J]. Journal of Veterinary Medical Science, 70(8): 849-852.
Wasser SK, Risler L, Steiner RA. 1988. Excreted steroids in primate feces over the menstrual cycle and pregnancy[J]. Biology of Reproduction, 39(4): 862-872.
Yamauchi K, Hamasaki S, Takeuchi Y,etal. 1999. Application of enzyme immunoassay to fecal steroid analysis in sika deer (Cervusnippon)[J]. Journal of Reproduction and Development, 45(6): 429-434.
Yu XJ, Hu DF, Jin XL,etal. 2011. Non-invasive determination of fecal steroid hormones relating to conservation practice in giant panda (Ailuropodamelanoleuca)[J]. Animal Biology, 61(3): 335-347.
Effects of Antibiotics on the Storage of Fecal Secretory Immunoglobulin A of Brown-eared Pheasant
ZHOU Ran, QI Lei, WANG Wenxia, HU Defu, SUI Jinling*
(School of Nature Conservation, Beijing Forestry University, Beijing 100083, China)
Evaluation of fecal immunoglobulin level is an effective means of monitoring health and survival situation in wildlife, and this method requires the storage of feces in an appropriate way. In the present study, four antibiotics including rifampicin, tetracycline, kanamycin and gentamicin were used to investigate the efficiency for preservation of fecal secretory immunoglobulin A (SIgA) of brown-eared pheasant (Crossoptilonmantchuricum) at three different concentrations (1 μg·mL-1, 25 μg·mL-1, 50 μg·mL-1). The content of SIgA was measured by enzyme linked immunosorbent assay. The results showed that rifampicin at concentration of 25 μg·mL-1was optimal for SIgA preservation, followed by 50 μg·mL-1tetracycline and 50 μg·mL-1kanamycin, whereas the storage effect of gentamicin was the worst.
Crossoptilonmantchuricum; antibiotics; fecal secretory immunoglobulin A; storage time
10.11984/j.issn.1000-7083.20150190
2015-05-22 接受日期:2015-08-25 基金项目:全国第二次陆生野生动物资源调查——北京市常规调查项目(YBZ2015-003)
周冉(1989—), 女, 硕士研究生, 研究方向为野生动物保护与利用, E-mail:zhou_ran@126.com
*通信作者Corresponding author, 副教授, E-mail:jlsui@126.com
Q955
A
1000-7083(2016)01-0058-04

