活性氧在异烟肼诱导L-02细胞DNA损伤中的作用及槲皮素的保护效应
陈廷玉,孙 洁,杨 玉,朱秋双,苗 智,钟堂武,卢春凤*
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
活性氧在异烟肼诱导L-02细胞DNA损伤中的作用及槲皮素的保护效应
陈廷玉,孙 洁,杨 玉,朱秋双,苗 智,钟堂武,卢春凤*
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
异烟肼(isoniazid,INH)是抗结核杆菌的主要用药之一,有很多不良反应,最严重的是肝脏损伤,但到目前为止其肝脏毒性的具体机制尚未阐明[1-4]。槲皮素(quercetin)是植物界分布最广的黄酮类化合物,广泛存在于水果、蔬菜以及一些中草药中,是人类饮食中最主要的生物类黄酮。近年来,随着人们对槲皮素了解的深入,槲皮素的广泛生理及药理作用已引起国内外学者的高度重视[5-8]。因此,本实验以体外培养的人肝细胞L-02为研究对象,研究活性氧(reactive oxygen species,ROS)介导的线粒体损伤在INH诱导L-02细胞DNA损伤中的作用,及槲皮素的保护效应和机制,以期为临床INH肝脏毒性的防治提供一定的实验依据。
1 材料与方法
1.1 主要试剂
槲皮素、异烟肼、2,7-二氯荧光素二乙酸酯(2',7'-dichlorodihydrofluorescein diacetate,DCFH-DA)和罗丹明123(Rhodamine123,Rh123)均为美国Sigma公司产品;正常熔点琼脂糖、低熔点琼脂糖均为美国Amresco公司产品。
1.2 细胞培养及处理
用含10%胎牛血清的DMEM培养基常规培养L-02细胞(购自中国科学院上海细胞生物研究所),24h后,将细胞分为4组:空白对照组(加入等体积的无血清培养基);INH组(10mmol/L INH);槲皮素低剂量组(10mmol/L INH+25μmol/L槲皮素);槲皮素高剂量组(10mmol/L INH+50μmol/L槲皮素)。各组细胞分别经上述处理24h后,进行相关指标检测。
1.3 彗星试验检测L-02细胞DNA损伤
L-02细胞用胰酶消化并制成单细胞悬液,密度为5×104/mL。将100μL正常熔点琼脂(0.5%)铺在磨砂载玻片上,盖上盖玻片,4℃放置10min凝固后为第1层胶。取下盖玻片,吸取80μL含约104个细胞的低熔点琼脂(0.75%)铺在第1层胶上,盖上盖玻片,4℃放置10min凝固后为第2层胶;在第2层胶上滴加80μL 0.75%低熔点琼脂糖溶液,盖好盖玻片,4℃放置10min凝固后为第3层胶。揭去盖玻片,将玻片浸入新配的碱性细胞裂解液中,4℃裂解1.5h。裂解后用PBS洗3次,将玻片置于新配的碱性电泳液中4℃解旋20min后,在25 V、300mA下避光电泳25min。取出玻片用Tris-HCl缓冲液(pH=7.5)中和15min后,加50μL碘化丙啶(PI)染色,盖上盖玻片,15min后于荧光显微镜下观察。计数观察的细胞,每片随机观察100个细胞,采集到的图像用CASP彗星图像软件进行分析,分析指标有彗星尾部DNA百分含量(tail DNA,%)、尾长(tail length)和尾矩(tailm oment)。
1.4 差速离心法制备L-02细胞线粒体
将L-02细胞用胰酶消化并制成单细胞悬液,细胞数为5×105/mL。将细胞悬液接种于培养瓶中培养24h后,按上述分组处理细胞,继续培养24h。然后将细胞消化吹打成单细胞悬液,离心去上清。加含250mmo1/L 蔗糖的细胞裂解液3mL,吹打均匀后于4℃、6 000 r/min离心10min,取上清再于4℃、13 500 r/min离心10min,所得沉淀即为线粒体。
1.5 荧光探针DCFH-DA检测L-02细胞内ROS水平
将上述各组细胞线粒体用HEPES缓冲液重悬,制成线粒体悬液,加入DCFH-DA,使其终浓度为2μg/mL,于培养箱中继续孵育20min。吸去培养液,用冷PBS洗3遍,并弃去残液,以去除非特异性荧光,然后在荧光显微镜下观察细胞内DCF荧光强度并拍照。利用Image-Pro Plus 6.0软件进行荧光强度分析,并计算平均荧光强度。
1.6 Rh123检测L-02细胞线粒体膜电位
将上述各组细胞线粒体用HEPES缓冲液重悬,制成线粒体悬液,加入Rh123染色液,使其终浓度为5mg/L,于培养箱内避光孵育20min;冷PBS洗3遍去除非特异性荧光后,用激光共聚焦测定激发波长488 nm下的荧光强度值,并拍照。利用Image-Pro Plus 6.0软件进行荧光强度分析,并计算平均荧光强度。
1.7 统计学分析
2 结果
2.1 INH和槲皮素对L-02细胞DNA损伤的影响
彗星试验结果见图1。INH和槲皮素处理细胞24h后,空白对照组细胞的DNA大部分呈圆形荧光团,无拖尾现象;INH组细胞DNA有拖尾现象,呈现不同程度的头尾分明的典型彗星图像;槲皮素组细胞DNA拖尾现象明显减轻,高剂量槲皮素组的效果更明显。应用CASP彗星分析软件进行图像分析,结果见表1,与空白对照组相比,INH组细胞尾部DNA百分含量、尾长和尾矩均显著增加(P<0.01),表明INH诱导了细胞DNA损伤;低和高剂量槲皮素组细胞的尾部DNA百分含量、尾长和尾矩均较INH组明显减少(P<0.05或P<0.01),表明槲皮素对L-02细胞DNA损伤有保护作用,且高剂量组的保护作用更显著。

图1 彗星试验检测L-02细胞DNA损伤(×200)
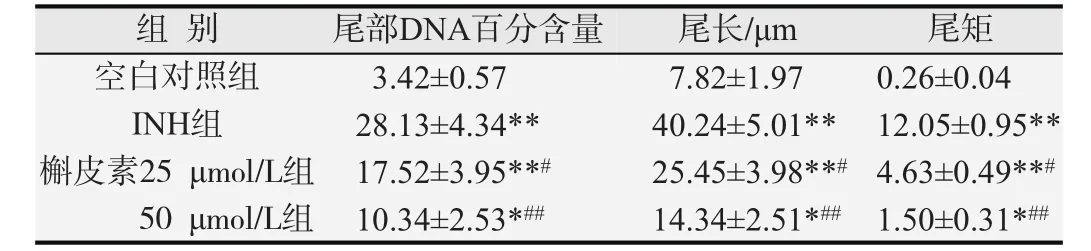
表1 INH和槲皮素对L-02细胞尾部DNA百分含量、尾长和尾矩的影响
2.2 INH和槲皮素对L-02细胞内ROS水平的影响
荧光探针DCFH-DA检测结果见图2。与空白对照组相比,INH处理24h后,细胞线粒体ROS水平显著升高(P<0.01),表明INH可诱导线粒体ROS的生成;与INH组相比,低和高剂量槲皮素组细胞线粒体ROS水平均明显降低,差异均有统计学意义(P<0.05或P<0.01),表明槲皮素可抑制细胞线粒体ROS的生成,高剂量组抑制细胞线粒体ROS生成的作用更显著,且高剂量组ROS水平与空白对照组间的差异无统计学意义(P>0.05)。
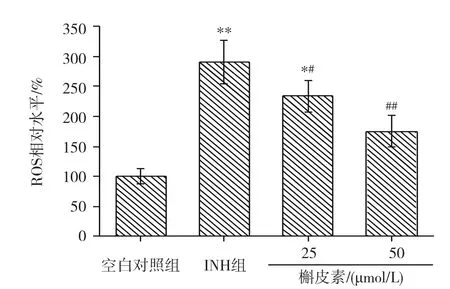
图2 L-02细胞ROS水平
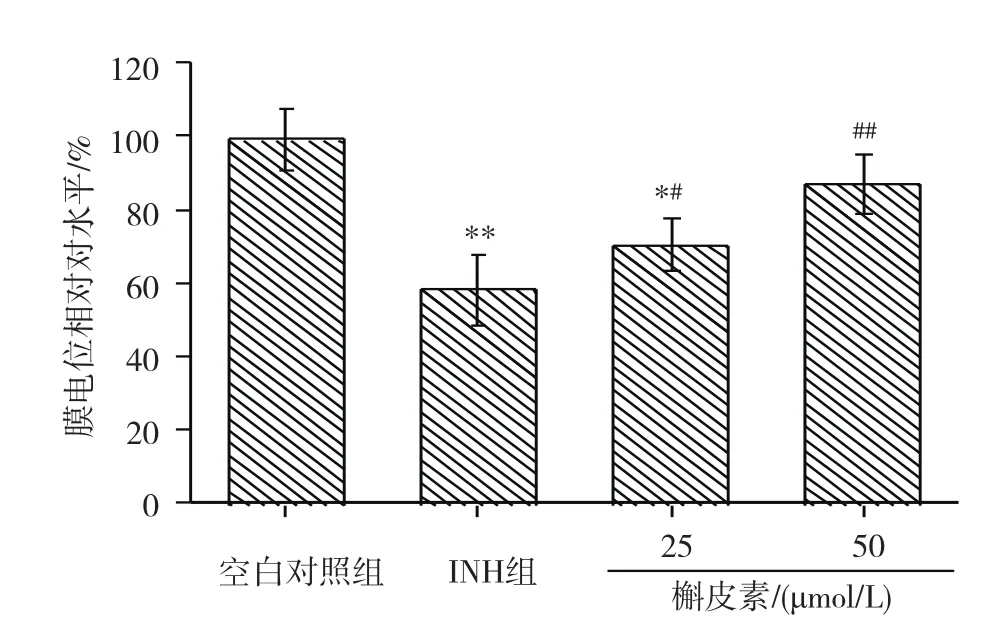
图3 L-02细胞线粒体膜电位
2.3 INH和槲皮素对L-02细胞线粒体膜电位的影响
Rh123检测结果见图3。INH处理L-02细胞24h后,与空白对照组相比,细胞线粒体膜电位显著降低(P<0.01),表明INH可造成线粒体损伤;低和高剂量槲皮素组细胞线粒体膜电位均明显增高,与INH组相比差异均有统计学意义(P<0.05或P<0.01),表明槲皮素对线粒体有保护作用,高剂量组对线粒体的保护作用更明显,且高剂量组线粒体膜电位与空白对照组间的差异无统计学意义(P>0.05)。
3 讨 论
研究表明INH在体内和体外均可导致细胞发生氧化损伤[9-10],而且Zhang等[11]研究发现槲皮素对四氯化碳诱导的小鼠急性肝损伤有保护作用,其机制可能与槲皮素具有保护氧化应激损伤作用有关;李坚等[12]研究发现槲皮素对内毒素性心肌损伤具有保护作用,其机制也与槲皮素具有抗氧化作用相关。线粒体是细胞产生ROS的主要场所,也是多数有毒化合物攻击的主要靶点[13-14]。研究表明,ROS过多生成可损伤线粒体膜,导致线粒体膜电位降低[15]。因此,本实验以人肝细胞L-02为研究对象,从细胞DNA氧化损伤角度研究INH细胞毒性,重点探讨ROS介导的线粒体损伤在INH诱导L-02细胞DNA氧化损伤中的作用,以及槲皮素对INH所致细胞DNA氧化损伤的保护作用及可能机制。我们利用彗星试验检测了细胞DNA损伤情况,实验结果显示,INH能显著增加细胞尾部DNA百分含量、尾长和尾矩,表明INH诱导了L-02细胞DNA损伤。Shayakhmetova等[16]研究也发现INH可诱导雄性大鼠睾丸细胞发生氧化应激反应导致脂质过氧化产物增加、谷胱甘肽含量降低、DNA损伤等。Barcelos等[17-18]研究发现槲皮素对甲基汞诱导的大鼠肝细胞DNA损伤和人源性肝细胞的DNA损伤均有保护作用。本实验中我们还发现槲皮素能显著减少细胞尾部DNA百分含量、尾长和尾矩,表明槲皮素对L-02细胞DNA损伤有保护作用,这与Barcelos等的研究结果一致。Bournival 等[19]研究也发现槲皮素对高糖诱导的PC12细胞的DNA氧化损伤和凋亡有保护作用。
那么对于INH诱导L-02细胞DNA损伤是否与ROS诱导的线粒体损伤有关这一问题,本实验检测了线粒体ROS水平及线粒体膜电位。ROS是细胞内主要的氧自由基,它的水平能反映细胞内氧化系统的情况;线粒体膜电位是反映线粒体功能的关键指标,线粒体膜电位降低,提示细胞发生线粒体损伤[20]。本实验结果发现,L-02细胞经INH处理后,线粒体ROS生成显著增多,线粒体膜电位明显降低;提示INH能促进细胞线粒体ROS生成,导致细胞线粒体损伤,引起线粒体膜电位降低。Hassan等[21]研究发现INH可引起大鼠肝细胞ROS生成增多,诱导肝细胞发生氧化应激反应,导致肝损伤,本文的研究结果与Hassan等[21]的研究结果一致。大量研究表明,槲皮素在体外可通过清除氧自由基、抑制DNA损伤、与金属离子结合等发挥抗氧化作用[22-27]。除此之外,体内实验证实槲皮素可通过降低脂质过氧化物水平、增加抗氧化物含量及提高抗氧化酶活性对肝脏氧化损伤发挥保护作用[28]。本研究中,我们的实验结果显示,槲皮素能明显降低细胞线粒体ROS水平,表明槲皮素可减少细胞线粒体ROS的生成,并且槲皮素能明显提高细胞线粒体膜电位,表明槲皮素对线粒体膜有保护作用,提示槲皮素对INH诱导的细胞线粒体损伤具有保护作用。本文的研究结果与Tang等[29]研究表明槲皮素对乙醇诱导的线粒体氧化损伤具有保护作用结果相似。张佳君等[30]研究也发现槲皮素对H2O2诱导视网膜色素细胞氧化应激损伤具有保护作用,可能是槲皮素通过改善抗氧化酶活性、增强ROS清除能力从而发挥其对细胞氧化损伤的保护作用。结合本实验中发现槲皮素对INH诱导的L-02细胞DNA损伤有保护效应,推测其可能是通过清除线粒体ROS,抑制线粒体损伤,从而发挥保护L-02细胞DNA损伤的作用。提示,ROS介导的线粒体损伤是槲皮素对INH诱导L-02细胞DNA损伤发挥保护效应的主要机制之一。
综上所述,在本实验条件下,INH能诱导L-02细胞DNA损伤,可能是通过大量生成的ROS造成线粒体损伤,使线粒体膜电位降低,导致细胞DNA损伤,提示ROS介导的线粒体损伤在INH诱导L-02细胞DNA损伤的过程中发挥了重要作用;槲皮素对INH诱导L-02细胞DNA损伤具有保护效应,可能与其抑制ROS介导的线粒体损伤有关。
[1] Gourishankar A,Navarrof,DebRoy AN,etal.Isoniazidhepatotoxicity with clinical andhistopathology correlate[J].Ann Clin Lab Sci,2014,44(1):87-90.
[2] Chang SH,Nahid P,Eitzman SR.Hepatotoxicity in children receiving isoniazid therapy for latent tuberculosisinfection[J].J Ped Infect Dis,2014,3(3):221-227.
[3] Alcobiam,Carvalhom,Villarm,etal.Identifying genetic susceptibility to isoniazid-inducedhepatitis[J].Eur Respir J,2013,42(Sup 57):1403.
[4] Sotsuka T,Sasaki Y,Hirai S,etal.Associationof isoniazidmetabolizingenzyme genotypes and isoniazid-inducedhepatotoxicity in tuberculosis patients[J].In Vivo,2011,25(5):803-812.
[5] Egert S,Wolffram S,Bosy-Westphal A,etal.Daily quercetin supplementation dose-dependently increases plasma quercetin concentrationsinhealthyhumans[J].J Nutr,2008,138(9):1615-1621.
[6] Dajas F.Life or death:neuroprotective and anticancer effects of quercetin[J].J Ethnopharmacol,2012,143(2):383-396.
[7] Li Y,Deng Y,Tang Y,etal.Quercetin protects rathepatocytes from oxidative damage induced by ethanol and iron
bymaintaining intercellular liable iron pool[J].Hum Exp Toxicol,2014,33(5):534-541.
[8] da Silva CR,de Andrade Neto JB,de Sousa Campos R,etal.Synergistic effectof the flavonoid catechin,quercetin,or epigallocatechin gallate with fluconazole induces apoptosisin candida tropicalis resistant tofluconazole[J].Antimicrob Agents Chemother,2014,58(3):1468-1478.
[9] Palanisamy N,Manian S.Protective effects of Asparagus racemosus onoxidative damage in isoniazid-inducedhepatotoxic rats:an in vivo study[J].Toxicolhealth,2012,28(1):238-244.
[10] Enriquez-Cortina C,Almonte-Becerrilm,Clavijo-Cornejo D,etal.Hepatocyte growth factor protects against isoniazid/ rifampicin-induced oxidative liver damage[J].Toxicol Sci,2013,135(1):26-36.
[11] Zhang JQ,Liang SH,Xu XN,etal.Therapeutic detoxificationof quercetin against carbon tetrachloride-induced acute liver injury inmice and itsmechanism[J].J Zhejiang Univ Sci B,2014,15(12):1039-1047.
[12] 李坚,张剑,董欣敏,等.槲皮素对内毒素性心肌损伤的保护作用及机制[J].南方医科大学学报,2015,35(7):1068-1072.
[13] BhattmP,Lim YC,Kim YM,etal.C-peptide activates AMPKαand prevents ROS-mediatedmitochondrial fission and endothelial apoptosisin diabetes[J].Diabetes,2013,62(11):3851-3862.
[14] Zorov DB,Juhaszovam,Sollott SJ.Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J].Physiol Rev,2014,94(3):909-950.
[15] Nabbenm ,Shabalina I G,Moonen-Kornips E ,eta l.U ncoupled respiration,ROS production,acute lipotoxicity and oxidative damage in isolated skeletalmusclemitochondria from UCP3-ablatedmice[J].Biochim Biophys Acta,2011,1807(9):1095-1105.
[16] Shayakhmetova GM,Bondarenko LB,Kovalenko VM.Damage of testicular cellmacromolecules and reproductive capacity ofmale rats following co-administrationof ethambutol,rifampicin,isoniazid and pyrazinamide[J].Interdiscip Toxicol,2012,5(1):9-14.
[17] Barcelos GR,Grotto D,Serpeloni JM,etal.Protective properties of quercetin against DNA damage and oxidative stressinduced bymethylmercury in rats[J].Arch Toxicol,2011,85(9):1151-1157.
[18] Barcelos GR,Angeli JP,Serpeloni JM,etal.Quercetin protectshuman-derived liver cells againstmercury-induced DNA-damage and alterations of the redox status[J].Mutat Res,2011,726(2):109-115.
[19] Bournival J,FrancoeurmA,Renaud J,etal.Quercetin and sesamin protect neuronal PC12 cells fromhigh-glucose-induced oxidation,nitrosative stress,and apoptosis[J].Rejuvenat Res,2012,15(3):322-333.
[20] Gong SS,Peng YY,Jiang PP,etal.A deafness-associated tRNAHismutation alters themitochondrial function,ROS production andmembrane potential[J].Nucleic Acids Res,2014,42(12):8039-8048.
[21]hassanhM,Guoh,Yousef BA,etal.Role of inflammatory and oxidative stress,cytochrome P450 2E1,and bile acid disturbance in rat liver injury induced by isoniazid and lipopolysaccharide cotreatment[J].Antimicrob Agents Chemother,2016,60(9):5285-5293.
[22] Liu CM,Ma JQ,Sun YZ.Quercetin protects the rat kidney againstoxidative stress-mediated DNA damage and apoptosisinduced by lead[J].Environ Toxicol Pharmacol,2010,30(3):264-271.
[23] Celikh,Arinc E.Evaluationof the protective effects of quercetin,rutin,naringenin,resveratrol and trolox against idarubicin-induced DNA damage[J].J Pharm Pharm Sci,2010,13(2):231-241.
[24] TsenghL,Li CJ,Huang LH,etal.Quercetin 3-O-methyl ether protects FL83B cells from copper induced oxidative stress through the PI3K/AktandmAPK/Erk pathway[J].Toxicol Appl Pharmacol,2012,264(1):104-113.
[25] Sharma DR,Wani WY,Sunkaria A,etal.Quercetin protects against chronic aluminum-induced oxidative stress and ensuing biochemical,cholinergic,and neurobehavioral impairmentsin rats[J].Neurotox Res,2013,23(4):336-357.
[26] Yoon JS,LeehJ,ChaemK,etal.Cigarette smoke extractinduced adipogenesisin Graves' orbital fibroblastsisinhibited by quercetin via reduction inoxidative stress[J].J Endocrinol,2013,216(2):145-156.
[27] Li Y,Deng Y,Tang Y,etal.Quercetin protects rathepatocytes from oxidative damage induced by ethanol and iron bymaintaining intercellular liable iron pool[J].Hum Exp Toxicol,2014,33(5):534-541.
[28] Zerin T,Kim YS,Hong SY,etal.Quercetin reduces oxidative damage induced by paraquat viamodulatingexpressionof antioxidant genesin A549 cells[J].J Appl Toxicol,2013,33(12):1460-1467.
[29] Tang Y,Gao C,Xingm,etal.Quercetin prevents ethanolinduced dyslipidemia andmitochondrial oxidative damage[J].Food Chem Toxicol,2012,50(5):1194-1200.
[30] 张佳君,厉新新,陈宝石,等.槲皮素对H2O2诱导人RPE 细胞氧化应激损伤的保护作用[J].国际眼科杂志,2016,16(11):2010-2013.
The role of reactive oxygen speciesin isoniazid-induced DNA damage in L-02 cells and the protective effectof quercetin
CHEN Tingyu,SUN Jie,YANG Yu,ZHU Qiushuang,MIAO Zhi,ZHONG Tangwu,LU Chunfeng*
(Basicmedical College, Jiamusi University, Jiamusi 154007,heilongjiang, China)
目的: 探讨活性氧(ROS)在异烟肼(INH)诱导的L-02细胞DNA损伤中的作用及槲皮素的保护效应。方法:将L-02细胞分为空白对照组、INH组(10mmol/L INH);槲皮素低剂量组(10mmol/L INH+25μmol/L槲皮素);槲皮素高剂量组(10mmol/L INH+50μmol/L槲皮素)。细胞处理24h后,采用彗星试验检测细胞DNA损伤情况;分别应用荧光探针DCFH-DA和Rhodamine123检测细胞ROS水平及线粒体膜电位。结果:与空白对照组比较,L-02细胞经INH和槲皮素处理后,INH组细胞尾部DNA百分含量、尾长和尾矩均显著增加(P<0.01);与INH组相比,低和高剂量槲皮素组细胞的尾部DNA百分含量、尾长和尾矩均明显减少(P<0.05或P<0.01)。INH组细胞线粒体ROS水平比空白对照组显著升高(P<0.01);而低和高剂量槲皮素组细胞线粒体ROS水平比INH组明显降低(P<0.05或P<0.01)。INH组细胞线粒体膜电位显著低于空白对照组(P<0.01),而低和高剂量槲皮素组细胞线粒体膜电位明显高于INH组(P<0.05或P<0.01)。结论:INH能诱导L-02细胞DNA损伤,ROS介导的线粒体损伤在INH诱导L-02细胞DNA损伤的过程中发挥了重要作用;槲皮素对INH诱导L-02细胞DNA损伤具有保护效应,可能与其抑制ROS介导的线粒体损伤有关。
活性氧;异烟肼;槲皮素;DNA损伤
OBJECTIVE:To investigate the role of reactive oxygen species (ROS) in isoniazid (INH)-induced DNA damage in L-02 cells and the protection by quercetin.METHODS:L-02 cells were divided into several groups:blank control,INH (10mmol/L),quercetin low dose (10mmol/L INH +25μmol/L quercetin) andhigh dose (10mmol/L INH +50μmol/L quercetin).After cells were treated for 24hours,DNA damage was detected by using the Comet test;ROS generation andmitochondrialmembrane potential were evaluated by applicationof fluorescent probes DCFHDA and Rhodamine123.RESULTS:Compared with the blank control group,the percentages of tail DNA,tail length and tailmoment (from the Cometassay) of the INH group were significantly increased (P<0.01).Compared with the INH group,the percentages of tail DNA,tail length and tailmomentof the lowandhigh dose quercetin groups were significantly reduced (P<0.05 and P<0.01,respectively).The levels ofmitochondrial ROsin cells of the INH group were significantly increased over the blank control group (P<0.01);the levels ofmitochondrial ROsin the lowandhigh dose quercetin groups were significantly decreased than thatof the INH group (P<0.05 and P<0.01,respectively).Themitochondrialmembrane potential of the INH group was significantly lower than thatof the blank control group (P<0.01).Themitochondrialmembrane potential of the lowandhigh dose quercetin groups were significantlyhigher than thatof the INH group (P<0.05 and P<0.01,respectively).CONCLUSION:INH can induce DNA damage in the L-02 cells and the damagemay involve ROS-mediatedmitochondrial damage.Quercetinhas a protective effectagainst the INH-inductionof DNA damage and the effectmay be related to itsinhibitionof ROS-mediatedmitochondrial damage.
reactive oxygen species;isoniazid;quercetin;DNA damage
R965;R332
A
1004-616X(2016)06-0472-05
1 0.3969/j.issn.1004-616x.2016.06.012
2016-08-28;
2016-10-14
国家自然科学基金资助项目(81373497)
作者信息: 陈廷玉,E-mail:chenty123@163.com。*通信作者,卢春凤,E-mail:luchunfengchen@126.com

