BRCA1在DNA损伤应激反应中的研究进展
池林峰,杨 军
( 1.浙 江中医药大学,浙江 杭州 310053;2.浙 江大学医学院,浙江 杭州 310058;3.杭 州师范大学,浙江 杭州 310036 )
BRCA1在DNA损伤应激反应中的研究进展
池林峰1,杨 军2,3,*
( 1.浙 江中医药大学,浙江 杭州 310053;2.浙 江大学医学院,浙江 杭州 310058;3.杭 州师范大学,浙江 杭州 310036 )
乳腺癌易感基因BRCA1与乳腺癌、卵巢癌等肿瘤的发生紧密相关。此外,BRCA1还参与了许多重要的细胞信号通路,包括DNA损伤所诱发的细胞应激反应,如DNA损伤导致的细胞周期检验点的激活、DNA损伤修复、染色体重塑及细胞凋亡等。本文对BRCA1在DNA损伤应激反应中的研究进展,尤其是它在DNA双链断裂修复的两种模式(非同源末端连接和同源重组)中的作用作一综述。
BRCA1;DNA损伤应激反应;同源重组;非同源末端连接
乳腺癌是女性癌症中最普遍的一种,5%~10%的乳腺癌具有遗传倾向,约2%与乳腺癌易感基因(breast cancer susceptibility protein 1,BRCA1)的突变相关[1]。BRCA1位于人类染色体17q21上[2],由24个外显子组成,编码1 863个氨基酸,其中第11号外显子是其最大的外显子,编码60%以上的氨基酸。BRCA1具有两个功能结构域:氨基端具有E3泛素连接酶活性的指环结构域和羧基末端促进蛋白结合的串联的BRCT(BRCA1 C Terminus)结构域。多种肿瘤相关BRCA1突变位点均发生在这两个结构域,暗示着这两个结构域对抑制乳腺癌的发生具有重要作用[3]。
除了在肿瘤发生中的作用,越来越多的研究也表明BRCA1可在另一类重要的细胞反应,即DNA损伤应激反应(DNA damage response,DDR)中同样具有重要作用。人类的遗传物质DNA不断受到诸如化学物质、电离辐射、紫外光和X射线等外源因素和细胞正常代谢所产生的活性氧(reactive oxygen species,ROS)等内源性因素的损伤。这些损伤可以导致碱基修饰、单链断裂(single strand break,SSB)、双链断裂(double strand break,DSB)、链内交联(intrastrand crosslinks)、链间交联(interstrand crosslinks)等多种DNA损伤。为了应对这些DNA损伤,在进化过程中细胞形成了特异性的DDR以保证细胞正常的生长和有机体的存活[4]。未修复的断裂DNA会随着有丝分裂传递给子代细胞,造成遗传物质的不稳定并最终导致肿瘤的发生[5]。已有的研究结果表明,当细胞正常表达BRCA1时,可以帮助细胞感知DNA损伤并修复DNA以保持遗传物质的稳定和抑制肿瘤的发生;而当BRCA1发生突变时则会破坏细胞内正常的DDR。因此BRCA1在DDR中的重要作用为其如何抑制癌症的发生提供了部分理论依据。
当遭受不同类型的DNA损伤时,细胞会启动相应的DNA修复机制,比如非同源末端连接 (nonhomologous end joining,NHEJ)和同源重组(homologous recombination,HR)主要针对DSB进行修复;核苷酸切除修复(nucleotide excision repair,NER)针对链间交联、紫外线导致的嘧啶二聚体等;碱基切除修复(base excision repair,BER)针对点突变;错配修复(mismatch repair,MMR)针对复制过程中产生的碱基错配等[6]。NHEJ和HR是真核生物进行DSB修复的主要形式[7],目前研究结果已证明BRCA1在这两条通路中都发挥重要作用。本文将简述BRCA1在DDR中的研究进展,尤其是在NHEJ和HR中的作用。
1 DNA损伤应激反应的过程
DDR是一个非常复杂的过程,并且针对不同的DNA损伤形式细胞会启用不同的信号通路,参与的细胞成分也不尽相同[8]。DDR是一系列的信号转导过程,包括以下几个关键步骤:当细胞遭受DNA损伤时,首先由感受器(sensor)感受DNA损伤,然后由传递分子(transducer/mediator)将信号传递到下游,再由执行者(effector)完成损伤修复等功能;最后,一般还有一个信号终止(signal attenuation/termination)的过程[8-9]。例如,在DSB的DDR中,MRN复合物(Mre11/Rad50/Nbs1 Complex)在感受DSB中起着关键作用[10]。被MRN复合物活化的磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)家族的成员,包括共济失调毛细血管扩张突变基因(ataxia telangiectasismutated,ATM)、Rad3相关蛋白(ATM and Rad3-related,ATR)和DNA依赖性蛋白激酶(DNA-dependent protein kinase,DNA-PK),它们通过直接或间接地磷酸化功能执行分子如CHK1、CHK2[11],最终导致细胞周期停滞以利于通过HR或NHEJ对DNA DSB进行修复[12]。此外,多聚(ADP-核糖)聚合酶[poly(ADP-ribose) polymerase,
PARP]家族成员主要识别SSB[13],而范可尼贫血(Fanconi anemia,FA)家族成员则参与链间交联的识别[14]。
2 DNA双链断裂修复的机制
DSB是细胞所遭受的最严重的损伤之一,可由内源(细胞代谢物)或外源(电离辐射、化疗药物)的因素造成[15]。未修复或错误修复的DSB会导致染色体变异、细胞死亡,或最终导致癌症的发生。真核生物形成了一系列的DSB修复机制,其中NHEJ和HR是最主要的两种形式[16]。NHEJ不需要同源模板的存在而直接将断裂的DNA末端连接起来,主要发生在G1和早期的S期细胞中[17],其核心成分是DNA-PK。在这一过程中,当DNA双链发生断裂时,Ku70/Ku80以二聚体的形式结合到DNA双链断裂的末端,并召集DNA蛋白激酶催化亚基(DNA-PK catalytic subunit,DNA-PKcs)聚集到DNA末端。两个DNA-PKcs/Ku/DNA形成DNA-PK聚合体结构,从而将断裂的DNA末端紧紧联系在一起,接着X射线修复交叉互补蛋白4(X ray cross complementing protein 4,XRCC4)和DNA连接酶IV(DNA ligase IV)复合物在XRCC4类因子(XRCC4-like factor,XLF)的帮助下介导DSB末端的连接,从而完成NHEJ修复过程[18]。
与NHEJ不同,HR的发生需要同源姐妹染色单体的参与,因此一般只发生在S期细胞和G2期细胞[19]。DSB的5´端的末端剪切是HR发生的关键一步,由MRN复合体(Mre11/Rad50/ Nbs1 complex)、CtIP(CtBP interacting protein)[20]及BLM(bloom)参与调控[21]。此种修复模式下,DSB末端首先经过末端剪切形成突出的3´端并马上被复制蛋白A(replication protein A,RPA)所包被,然后多种蛋白介导下被Rad51所替代,并发起同源染色体配对、末端侵入和链交换,从而完成HR[22-23]。
3 BRCA1与NHEJ
NHEJ是真核细胞DNA修复的最主要形式。NHEJ可以不使用同源模板把几乎任何类型的DSB末端直接连接到一起,因此它可以发生于任一细胞周期,在G1期占优势[24]。BRCA1在NHEJ中的作用还具有争议性,不同的研究表明BRCA1能促进NHEJ、抑制NHEJ或者对NHEJ无明显影响[25-27]。比如,在G1期BRCA1与Ku80相互作用并使其更加紧密地结合在DSB的末端,表明在G1期BRCA1可能促进NHEJ的发生[28]。而在BRCA1缺失的小鼠胚胎成纤维细胞和人体细胞HCC1937中,NHEJ修复通路缺失[26]。这些结果支持BRCA1对NHEJ的促进作用。但也有研究结果表明NHEJ修复通路可能不需要BRCA1的参与,例如,利用脉冲场凝胶电泳检测DSB的修复动力学时发现在BRCA1缺失的细胞系HCC1937和野生型细胞中,DSB的修复动力学曲线无显著差异[29]。而BRCA1与NHEJ因子53BP1的竞争性假说则暗示着BRCA1在DSB修复通路的选择中可能更倾向于HR。在BRCA1缺失的小鼠模型中,低表达53BP1可以增加HR的比例及基因组的稳定性[30]。在G1期,53BP1可以抑制BRCA1聚集到DSB末端,从而促进NHEJ的发生[31]。围绕BRCA1在NHEJ中的作用,我们也展开了相关研究。我们的实验结果表明,在S期BRCA1与DNAPKcs发生相互作用,抑制了DNA-PKcs S2056的自磷酸化,从而抑制了NHEJ的发生[32-33]。以上结果提示我们BRCA1与NHEJ的关系还需要更进一步的研究来确定。
4 BRCA1与HR
与NHEJ不同,HR被认为只发生在姐妹染色单体存在的S和G2期。HR始于ATM和MRN复合物决定的末端剪切而形成单链DNA(single strand DNA,ssDNA),ssDNA迅速被RPA包被,在多种蛋白的介导下被RAD51替换并发生同源染色体配对、末端侵入和链连接。1999年Moynahan等[34]首次发现BRCA1在HR中发挥作用。后续研究表明BRCA1主要通过与诸多蛋白的相互作用(图1)而在HR中发挥作用以保持遗传物质的稳定性[35]。
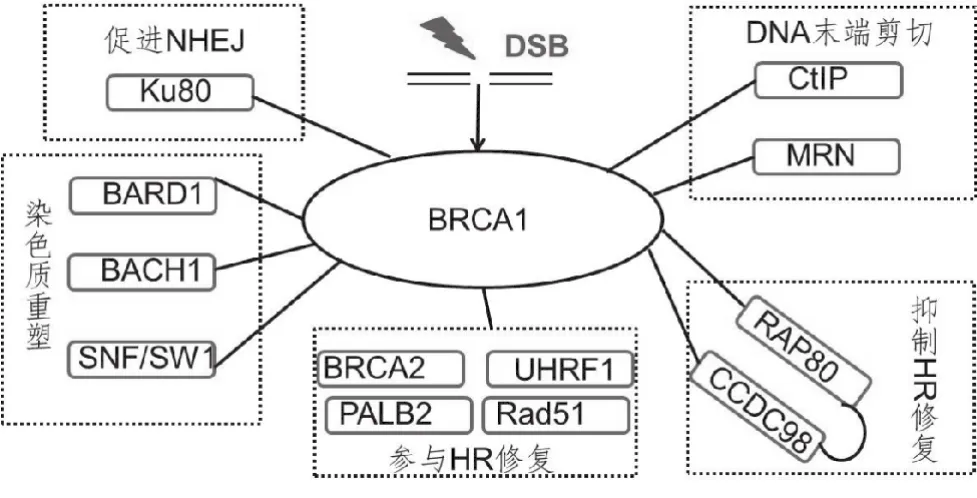
图1 在DNA双链断裂的HR修复过程中与BRCA1发生相互作用的蛋白[35]
4.1 CtIP
CtIP与BRCA1羧基端的氨基酸残基1 651~1 863发生相互作用,它们之间的相互作用是细胞周期依赖的,只发生在G2期。在DNA损伤发生后,ATM可以磷酸化CtIP的氨基酸残基Ser327,磷酸化后的CtIP可以与BRCA1的BRCT结构域发生相互作用[36]。BRCA1和CtIP的相互作用与细胞周期检验点G2/M相关,它们的相互作用可以激活CHK1。此外它们之间的相互作用与S/G2检验点也相关,CtIP与BRCA1、MRN的相互作用可以增强MRN的酶活力,促进末端剪切的进行从而促进HR的发生并抑制NHEJ[37]。最近研究表明不仅BRCA1与CtIP的相互作用能促进HR,CtIP的二聚体对HR的发生也具有重要作用。在人类细胞中CtIP可以形成二聚体,CtIP的突变株由于不能形成二聚体严重影响了HR的发生[38]。
4.2 Rad51
在S期细胞中,BRCA1和Rad51可以共同位于DNA损伤位点并形成焦点。这两个蛋白均与HR相关,但是至今研究人员还不确定它们的相互作用是直接的还是间接的。Scully等[39]发现Rad51与BRCA1的758~1 064氨基酸残基发生相互作用,而Garcia 等[40]发现Rad51与BRCA1的相互作用是通过MRN复合物发生的。在DNA损伤修复过程中,Rad51可以在DNA周围形成丝状的螺旋核酸蛋白,但具体的形成机制尚不明确。这些丝状的螺旋核酸蛋白可以促进Rad51依赖的同源识别和ATP依赖的链交换反应[41]。研究表明BRCA1可以保持BACH1的酶活力以防止Rad51过早移位,从而保证HR的顺利进行[42]。
4.3 BARD1
BRCA1相关环状蛋白(BRCA1-associated ring domain,BARD1)与BRCA1的指环结构域发生相互作用。当BARD1缺失
时,BRCA1不能稳定存在而迅速降解;反之,BARD1也需要BRCA1的存在才能稳定存在于细胞内[43]。BRCA1和BARD1在结构上非常相似,它们都有一个在氨基端的指环结构域和在羧基端的串联BRCT结构域[44]。当DNA损伤发生时,BRCA1-BARD1复合物可以泛素化E3激酶,从而引起其他参与DNA损伤修复蛋白的泛素化,包括CtIP和H2AX[45-46]。泛素化的CtIP可以结合到染色体并调节G2/M检验点;泛素化的H2AX可以使染色体重组并启动DNA修复[45]。
4.4 CCDC98及RAP80
卷曲螺旋结构域蛋白98(coiled-coil domain-containing protein 98,CCDC98)(也被称作Abraxas)与BRCA1的BRCT结构域发生相互作用[47]。由于CCDC98和BRCA1的结合位点与CtIP和BRCA1的结合位点相同,因此当CCDC98和BRCA1相互作用后,BRCA1不能与CtIP结合从而抑制了DNA的末端剪切[48]。CCDC98可以招募RAP80与BRCA1形成复合体,从而影响BRCA1对DNA损伤位点的识别和对HR通路的调节[49]。研究者认为BRCA1-RAP80复合体在调节DNA修复通路的选择中发挥重要作用[50]。
4.5 PALB2
乳腺癌易感基因相关蛋白2(partner and localizerof BRCA2,PALB2)与BRCA1的BRCT结构域发生相互作用[51-52]。在细胞周期S期,PALB2与BRCA1和BRCA2均发生结合,被认为是这两个蛋白之间的桥梁[51]。研究表明PALB2与BRCA1的相互作用参与HR的调节。在细胞中表达PALB2突变体,PALB2突变体不能与BRCA1发生相互作用,导致细胞对丝裂霉素C的敏感性增加[52]。
4.6 BACH1
BACH1氨基端与BRCA1的羧基端(aa1529~1863)发生相互作用[45,53]。与CtIP和BRCA1的作用方式相似,BACH1与BRCA1的相互作用也是磷酸化依赖的[45]。BACH1的氨基酸残基S990的磷酸化对其与BRCA1的结合具有调节作用[54]。在细胞周期S和G2期,BACH1可以与BRCA共同聚集到DSB位点形成焦点。当DNA损伤发生时,BRCA1与BACH1的相互作用可以促使BACH1结合到DNA,从而阻止Rad51与DNA的结合使细胞倾向于使用NHEJ修复通路[42,55]。
4.7 UHRF1
泛素样蛋白含有脯氨酸羟化酶与环指结构域1(ubiquitinlike,with PHD and RING finger domains 1,UHRF1)与BRCA1的BRCT结构域在S期发生相互作用[56]。在S期,UHRF1的Ser674被BRCA1磷酸化,从而调节RIF1的泛素化,导致RIF1从53BP1解聚,促进HR的进行[56]。
5 总结与展望
BRCA1是DNA损伤修复通路中的关键蛋白,越来越多的研究发现其在调节DNA修复通路中具有重要作用,但仍有很多问题悬而未决。比如BRCA1是否参与调控NHEJ相关因子,影响它们在DSB的聚集和动力学特征;BRCA1在DSB修复通路选择中的作用机制;BRCA1在范可尼修复通路中的作用机制等。通过研究BRCA1的不同突变特性以及BRCA1的相互作用蛋白和相关通路,阐明其在DNA损伤修复中的作用,有利于发现其在乳腺癌等肿瘤发生发展中的作用机制,为肿瘤的防治提供理论基础。
[1] Brewster A,Helzlsouer K.Breast cancer epidemiology,prevention,and early detection[J].Curropinoncol,2001,13(6):420-425.
[2]hall JM,LeemK,Newman B,etal.Linkage of early-onset familial breast cancer to chromosome 17q21[J].Science,1990,250(4988):1684-1689.
[3]monteiro AN,Augusta,Hanafusah.Evidence for a transcriptional activation functionof BRCA1 C-terminal region[J].Proc Natl Acad Sci USA,1996,93(24):13595-13599.
[4] Al-Ejeh F,Kumar R,Wiegmans A,etal.Harnessing the complexity of DNA-damage response pathways to improve cancer treatmentoutcomes[J].Oncogene,2010,29(46):6085-6098.
[5]hoeijmakers JH.DNA damage,aging,and cancer[J].N Engl Jmed,2009,361(15):1475-1485.
[6] Bernstein C,Bernsteinh,Payne CM,etal.DNA repair/proapoptotic dual-role proteinsin fivemajor DNA repair pathways:failsafe protection against carcinogenesis[J].Mutat Res,2002,511(2):145-178.
[7] Shrivastavm,Deharo LP,Nickoloff JA.Regulationof DNA doublestrand b reak r epair p athway choice[J].C ell R es,2008,18(1):134-147.
[8] Yang J,Yu Y,HamrickhE,etal.ATM,ATR and DNAPK:initiators of the cellular genotoxic stress responses[J].Carcinogenesis,2003,24(10):1571-1580.
[9] Jackson SP,Bartek J.The DNA-damage response inhuman biology and disease[J].Nature,2009,461(7267):1071-1078.
[10] Stracker TH,Petrini JH.ThemRE11 complex:starting from the ends [J].Nat Revmol Cell Biol,2011,12(2):90-103.
[11]marechal A,Zou L.DNA damage sensing by the ATM and ATR kinases [J].Cold Springharb Perspect Biol,2013,5(9):a012716.
[12] Ljungmanm.The DNA damage response—repairor despair?[J].Environmolmutagen,2010,51(8/9):879-889.
[13] Schreiber V,Dantzer F,Ame JC,etal.Poly(ADP-ribose):novel functions for anoldmolecule[J].Nat Revmol Cell Biol,2006,7(7):517-528.
[14]moldovan GL,D'Andrea AD.How the fanconi anemia pathway guards the genome[J].Annu Rev Genet,2009,43:223-249.
[15] Khanna KK,Jackson SP.DNA double-strand breaks:signaling, repair and the c ancer c onnection[J].N at genet,2001,27(3):247-254.
[16] Burma S,Chen BP,Chen DJ.Role of non-homologous end joining (NHEJ) inmaintaining genomicintegrity[J].DNA Repair (Amst),2006,5(9/10):1042-1048.
[17] Goodarzi AA,Jeggo PA.The repair and signaling responses to DNA double-strand breaks[J].Adv Genet,2013,82:1-45.
[18] Davis AJ,Chen DJ.DNA double strand break repair via nonhomologous end-joining[J].Transl Cancer Res,2013,2(3):130-143.
[19] Shibata A,Conrad S,Birraux J,etal.Factors determining DNA double-strand break repair pathway choice in G2 phase[J].EMBO J,2011,30(6):1079-1092.
[20] Sartori AA,Lukas C,Coates J,etal.Human CtIP promotes DNA end
resection[J].Nature,2007,450(7169):509-514.
[21] Nimonkar AV,Genschel J,Kinoshita E,etal.BLM-DNA2-RPAMRN and EXO1-BLM-RPA-MRN constitute two DNA end resectionmachineries forhuman DNA break repair[J].Genes Dev,2011,25(4):350-362.
[22]huertas P.DNA resection in eukaryotes:decidinghow tofix the break[J].Nat Structmol Biol,2010,17(1):11-16.
[23]moynahanmE,Jasinm.Mitotichomologous recombinationmaintains genomic stability and suppresses tumorigenesis[J].Nat Revmol Cell Biol,2010,11(3):196-207.
[24] Chapman JR,TaylormR,Boulton SJ.Playing the end game:DNA double-strand break repair pathway choice[J].Mol Cell,2012,47(4):497-510.
[25] Durant ST,Nickoloff JA.Good timing in the cell cycle for precise DNA repair by BRCA1[J].Cell Cycle,2005,4(9):1216-1222.
[26] Bau DT,Mau YC,Shen CY.The role of BRCA1 in non-homologous end-joining[J].Cancer Lett,2006,240(1):1-8.
[27] YangeS,Xia F.BRCA1 16 years later:DNA damage-induced BRCA1 shuttling[J].FEBS J,2010,277(15):3079-3085.
[28] Jiang G,Plo I,Wang T,etal.BRCA1-Ku80 protein interaction enhances end-joining fidelity of chromosomal double-strand breaksin the G1 phase of the c ell c ycle[J].J B iol Chem,2013,288(13):8966-8976.
[29] Wangh,Zeng ZC,Bui TA,etal.Nonhomologous end-joining of ionizing radiation-induced DNA double-stranded breaksinhuman tumor cells deficient in BRCA1 or BRCA2[J].Cancer Res,2001,61(1):270-277.
[30] Bunting SF,Callen E,Wong N,etal.53BP1 inhibitshomologous recombination in Brca1-deficient cells by blocking resectionof DNA breaks[J].Cell,2010,141(2):243-254.
[31] Escribano-Diaz C,Orthwein A,Fradet-Turcotte A,etal.A cell cycle-dependent regulatory circuit composed of 53BP1-RIF1 and BRCA1-CtIP controls DNA repair pathway choice[J].Mol Cell,2013,49(5):872-883.
[32] Davis AJ,Chi L,So S,etal.BRCA1modulates the autophosphorylation status of DNA-PKcsin S phase of the cell cycle[J].Nucleic Acids Res,2014,42(18):11487-11501.
[33] Saha J,Davis AJ.Unsolvedmystery:the role of BRCA1 in DNA endjoining[J].J Radiat Res,2016,57 Suppl 1:i18-i24
[34]moynahanmE,Chiu JW,Koller BH,etal.BRCA1 controlshomologydirected DNA repair[J].Mol Cell,1999,4(4):511-518.
[35]huenmS,Sy SM,Chen J.BRCA1 and its toolbox for themaintenance of genome integrity[J].Nat Revmol Cell Biol,2010,11(2):138-148.[36] Yu X,Chen J.DNA damage-induced cell cycle checkpoint control requires CtIP,a phosphorylation-dependent binding partnerof BRCA1 C-terminal domains[J].Mol Cell Biol,2004,24(21):9478-9486.
[37] Chen L,Nievera CJ,Lee AY,etal.Cell cycle-dependent complex formationof BRCA1.CtIP.MRN isimportant for DNA double-strand break repair[J].J Biol Chem,2008,283(12):7713-7720.
[38] Wangh,Shao Z,Shi LZ,etal.CtIP protein dimerization is critical for its recruitment to chromosomal DNA double-stranded breaks[J].J Biol Chem,2012,287(25):21471-21480.
[39] Scully R,Chen J,Plug A,etal.Associationof BRCA1 with Rad51 inmitotic andmeiotic cells[J].Cell,1997,88(2):265-275.
[40] Garcia-Higuera I,Taniguchi T,Ganesan S,etal.Interactionof the Fanconi anemia proteins and BRCA1 in a common pathway[J].Mol Cell,2001,7(2):249-262.
[41] Bhattacharyya A,Ear US,Koller BH,etal.The breast cancer susceptibility gene BRCA1 is required for subnuclear assembly of Rad51 and survival following treatment with the DNA cross-linking agent cisplatin[J].J Biol Chem,2000,275(31):23899-23903.
[42] Cantor SB,Andreassen PR.Assessing the link between BACH1 and BRCA1 in the FA pathway[J].Cell Cycle,2006,5(2):164-167.
[43] Joukov V,Chen J,Fox EA,etal.Functional communication between endogenous BRCA1 and its partner,BARD1,during Xenopus laevis development[J].P roc N atl A cad S ci U SA,2001,98(21):12078-12083.
[44] Ayi TC,Tsan JT,Hwang LY,etal.Conservationof function and primary structure in the BRCA1-associated RING domain (BARD1) protein[J].Oncogene,1998,17(16):2143-2148.
[45] Yu X,Chini CC,Hem,etal.The BRCT domain is a phosphoprotein binding domain[J].Science,2003,302(5645):639-642.
[46]morris JR,Solomon E.BRCA1 :BARD1 induces the formationof conjugated ubiquitin structures,dependenton K6 of ubiquitin,in cells during DNA replication and repair[J].Hummol Genet,2004,13(8):807-817.
[47] Kimh,Huang J,Chen J.CCDC98 is a BRCA1-BRCT domainbinding protein involved in the DNA damage response[J].Nat Structmol Biol,2007,14(8):710-715.
[48] Wang B,Matsuoka S,Ballif BA,etal.Abraxas and RAP80 form a BRCA1 protein complex required for the DNA damage response[J].Science,2007,316(5828):1194-1198.
[49] Kimh,Chen J,Yu X.Ubiquitin-binding protein RAP80mediates BRCA1-dependent DNA damage response[J].Science,2007,316 (5828):1202-1205.
[50] Coleman KA,Greenberg RA.The BRCA1-RAP80 complex regulates DNA repairmechanism utilization by restrictingend resection[J].J Biol Chem,2011,286(15):13669-13680.
[51] Xia B,Sheng Q,Nakanishi K,etal.Control of BRCA2 cellular and clinical functions by a nuclear partner,PALB2[J].Mol Cell,2006,22(6):719-729.
[52] Sy SM,HuenmS,Chen J.PALB2 is an integral componentof the BRCA complex required forhomologous recombination repair[J].Proc Natl Acad Sci USA,2009,106(17):7155-7160.
[53] Cantor SB,Bell DW,Ganesan S,etal.BACH1,a novelhelicaselike protein,interacts directly with BRCA1 and contributes to its DNA repair function[J].Cell,2001,105(1):149-160.
[54] Shiozaki EN,Gu L,Yan N,etal.Structure of the BRCT repeats of BRCA1 bound to a BACH1 phosphopeptide:implications for signaling[J].Mol Cell,2004,14(3):405-412.
[55] Baumann P,Benson FE,West SC.Human Rad51 protein promotes ATP-dependenthomologous pairing and strand transfer reactionsin vitro[J].Cell,1996,87(4):757-766.
[56] Zhangh,Liuh,Chen Y,etal.A cell cycle-dependent BRCA1-UHRF1 cascade regulates DNA double-strand break repair pathway choice[J].Nat Commun,2016,7:10201.
R344+.1
A
1004-616X(2016)06-0494-04
1 0.3969/j.issn.1004-616x.2016.06.018
2016-06-17;
2016-10-11
国家自然科学基金(81172692,81373036,81502752);浙江省自然科学基金( LQ16H220001)
作者信息: 池林峰,E-mail:linfengchi2014@163.com。*通信作者,杨 军, E-mail:gastate@zju.edu.cn
——紫 苏

