叶酸在MNNG影响哈萨克族食管上皮细胞DNMT1酶活性及表达中的作用
李旭峰,张慧霞,凯德丽艳·阿布都外力,陈 艳,2,*
(1. 新疆医科大学公共卫生学院卫生毒理学教研室,新疆 乌鲁木齐 830011;2.浙江省嘉兴学院医学院,浙江 嘉兴 314001)
叶酸在MNNG影响哈萨克族食管上皮细胞DNMT1酶活性及表达中的作用
李旭峰1,张慧霞1,凯德丽艳·阿布都外力1,陈 艳1,2,*
(1. 新疆医科大学公共卫生学院卫生毒理学教研室,新疆 乌鲁木齐 830011;2.浙江省嘉兴学院医学院,浙江 嘉兴 314001)
食管癌(esophageal cancer,EC)是发生于食管上皮组织的常见消化系统恶性肿瘤,最早期的变化特征是上皮细胞增生异常,在食管癌发生的分子机制中,遗传学的改变是不可逆的,而表观遗传学的改变在一定的条件下是可以逆转的,其中DNA甲基化是肿瘤发生的表观学遗传机制之一[1]。叶酸维持基因组正常甲基化的功能,主要与S-腺苷甲硫氨酸的合成有关。S-腺苷甲硫氨酸是细胞内各种甲基化反应的通用供体,它最主要的合成途径是通过同型半胱氨酸接受5-甲基四氢叶酸的甲基基团生成甲硫氨酸,甲硫氨酸在腺苷转移酶的作用下转变成S-腺苷甲硫氨酸。因此,一旦叶酸缺乏将造成甲基来源不足而影响核酸的甲基化。DNA甲基化是通过DNA甲基转移酶(DNAmethyltransferases,DNMTs)将甲基从S-腺苷甲硫氨酸转移到胞嘧啶来完成的。DNA异常甲基化过程总是伴随着DNMTs的异常表达[2]。DNMT1的功能是使仅有一条链甲基化的DNA的双链完全甲基化,其作为持续性DNA甲基转移酶,可参与DNA新合成链的甲基化,直接与组蛋白去乙酰基转移酶联合作用阻断转录。在DNA复制和修复中维持其甲基化,这种维持作用可以将DNA甲基化信息传递给子代细胞。我国是食管癌发病率和死亡率最高的国家,而新疆则是哈萨克族食管癌高发区[3],可能的原因之一是腌制食物食用过多,而腌制食物中的亚硝胺类物质是一种与肿瘤发生密切相关的外源性化学物[4]。甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)是一种人工合成的亚硝胺类化合物。我们前期的研究结果发现喜烫茶,经常喝奶茶、吃酸奶疙瘩、吃熏肉、蔬菜水果摄入量低以及吃烫饭和食速快是食管癌的危险因素,而经常喝酸奶和多吃新鲜蔬菜则是食管癌的保护因素[5]。众所周知蔬菜水果是叶酸的主要来源,而叶酸缺乏则与多种癌症有关[6]。因此,本实验应用MNNG对哈萨克族食管上皮细胞染毒,观察不同叶酸浓度对MNNG致哈萨克族食管上皮细胞DNMT1酶活性及表达水平的影响,为探讨食管癌的发生机制以及预防提供理论基础。
1 材料与方法
1.1 细胞及主要仪器
哈萨克族食管上皮细胞(自制)[7]。CO2恒温培养箱
购自日本SANYO公司;低温离心机购自日本SONY 公司;实时荧光定量PCR仪购自美国ABI公司;酶标仪购自上海新振仪器有限公司;磁力搅拌器购自中国温州医疗电器厂;DYY-8型稳压稳流电泳仪购自上海琪特公司;凝胶成像系统购自上海复日科公司。
1.2 试剂
叶酸购自美国Sigma公司;EpiCM-2培养基购自美国ScienCell公司;MethylCodeTMBisulfite Conversion Kit购自美国Invitrogen公司;SYBR Premix Ex TaqTMII购自美国TaKaRa公司;MNNG购自日本TCI公司;EPiQuikTMOne-Step DNAhydrolysis,EPiQuikTMNuclear Extraction KitⅠ、EPiQuikTMDNMT1 Assay Kit均购自美国EPigentek公司;E.Z.N.ATMTissue DNA Kit购自美国Omega公司。
1.3 实验方法
1.3.1 细胞培养及细胞染毒方法 哈萨克族食管上皮细胞常规培养于1×EpicM-2(含叶酸)与1×EpicM-2(无叶酸)无血清培养基中。37℃、CO2体积分数为5%的孵育箱中培养,当细胞生长至汇合度约为90%时按1∶1或1∶2传代培养。采用3因素3水平(3×3)析因设计将体外培养的哈萨克族食管上皮细胞分别暴露于不同浓度叶酸(0.000、0.400、0.800μg/mL)和MNNG (0.000、0.750、1.500μg/mL)的培养液中作用48、72和96h。
1.3.2 ELISA法检测DNA甲基转移酶1的活性 分别使用核蛋白提取试剂盒和蛋白浓度测定试剂盒提取细胞核蛋白并进行蛋白浓度测定。标准曲线建立,取0.8mL蛋白标准配置液加入到1管蛋白标准品(20mg BSA)中,充分消融后即为25mg/mL蛋白标准溶液,于-20℃长期保存。按50∶1的比例配制BCA工作液,充分混匀。将标准品按0、1、2、4、8、12、16、20μL依次加入到96孔板中,加PBS至每孔体积为20μL。加10μL核蛋白样品到96孔板中,每个样品重复3次,加PBS至终体积20μL。加入200μL BCA工作液,37℃孵育30min后于562 nm波长处检测各孔D(562)值。DNA甲
基转移酶1(DNMT1)活性的检测按照酶活性检测试剂盒进行,采用双波长检测法在2~10min于450 nm波长处(参比波长655 nm)检测各孔吸光度D(450)值。
DNMT1活性=[实验组D(450)值-空白孔D(450)值]/[对照组D(450)值-空白孔D(450)值]×100%
1.4 DNMT1mRNA及蛋白表达水平检测
1.4.1 细胞内总RNA抽提、完整性及纯度检测 细胞内的抽提采用总RNA提取试剂盒,收集细胞,用3mL PBS洗涤细胞2次,弃上清。加入1mL Trizol充分匀浆,室温静置5min。加入0.2mL氯仿,剧烈振荡15 s,静置3min。4℃、12 000 r/min离心10min,取上清。加入0.5mL异丙醇,混匀,冰上静置20~30min。4℃、12 000 r/min离心10min,弃上清。加入1mL 75%乙醇,洗涤沉淀。4℃、300 r /min离心5min,弃上清。室温放置晾干吹干,加入适量的RNase-freeh2O溶解。将提取的RNA进行1.5%琼脂糖凝胶电泳检测完整性。核酸分析仪检测在波长260和280 nm处的吸光度比值[D(260)/D(280)],确定RNA的纯度及浓度。
1.4.2 cDNA合成 采用第一链cDNA合成试剂盒合成cDNA。将其混匀后37℃温浴5min,42℃温浴60min,70℃温浴10min,终止反应,将上述溶液-20℃保存。
1.4.3 PCR引物 逆转录PCR所使用的引物采用Primer Premier 5.0软件设计,由上海生工公司合成,以管家基因GAPDH为内参。引物序列见表1。

表1 逆转录PCR引物序列
1.4.4 实时荧光定量PCR法检测DNMT1mRNA PCR仪自动分析结果,根据阴性对照调整阈值和基线以确定各个标本的CT值 ,并根据熔解曲线确定该CT值是否有效。将结果导出,采用2-△△CT法分析目的基因在对照组和各浓度组之间的表达差异,计算公式如下:△CT= CT,目的基因-CT,内参,再求得对照组△CT的 平均值,记为△CT,对照,用各组的△CT分别减去△CT,对照,求得△△CT值 ,即△△CT=△CT,样本-△CT,对照,再计算各组2-△△CT值,即为各组中基因的相对表达量。
1.4.5 Western blot法检测DNMT1蛋白表达 采用BCA法对所提取的蛋白定量。配制10%的分离胶8mL及5%的浓缩胶4mL,立即用去离子水缓慢覆盖胶面室温放置约40min至分离胶凝固。倒掉去离子水,加入5%浓缩胶液,插入样品梳,加样。经离心后取上清,用考马斯亮蓝试剂盒经紫外可见分光光度计测定蛋白浓度。根据蛋白定量结果,加入相应体积的总蛋白样品与4×蛋白质凝胶电泳上样缓冲液,混合,95℃变性10min,室温平衡。电泳仪进行电泳。电泳结束后,使用PVDF进行转膜,然后分别用非标记一抗及辣根过氧化物酶标记的二抗对其进行孵育、检测。经显影定影液显色,根据条带的亮度以及背景情况可以再次选择曝光时间进行二次曝光。
1.5 统计学处理
采用SPSS 17.0软件进行统计学分析,测得的DNMT1酶活性、RNA及蛋白水平数据用(±s)表示,独立实验均重复3次,采用3因素3水平析因设计的方差分析进行统计分析,采用LSD法进行两两比较,以α=0.05 为检验水准。
2 结果
2.1 DNA甲基转移酶活性
2.1.1 核蛋白浓度检测和标准方程的建立 根据核蛋白标准品建立标准曲线和二元一次方程,标准曲线和标准方程为y=0.921x+0.095,[y为D(450)值,x为核蛋白浓度,单位mg/mL]按照标准方程算出各组细胞提取的核蛋白浓度均大于2.10mg/mL,满足检测甲基转移酶1活性所需浓度要求。
2.1.2 叶酸及MNNG作用后细胞DNMT1酶活性的改变 ELISA法检测DNMT1酶活性指标的结果见表2。不同浓度叶酸、MNNG作用细胞不同时间后,在固定MNNG浓度和时间因素下,随着叶酸浓度的增加DNMT1酶活性逐渐降低,差异有统计学意义(F= 175.246,P< 0.01);在固定叶酸浓度和时间,不同MNNG浓度作用下的哈萨克族食管上皮细胞DNMT1酶活性不同,随着MNNG浓度的增加DNMT1酶活性逐渐升高,差异有统计学意义(F=826.553,P<0.01);固定MNNG和叶酸浓度,不同时间点作用下的哈萨克族食管上皮细胞DNMT1酶活性不同,随着干预时间的延长DNMT1酶活性逐渐升高,差异有统计学意义(F= 106.392,P< 0.01)。叶酸浓度与MNNG浓度之间、MNNG浓度与作用时间之间均存在交互作用,差异有统计学意义(F=38.003,P<0.01;F=21.459,P<0.01); 不同叶酸浓度与不同作用时间之间差异无统计学意义(F=2.371,P>0.05);叶酸浓度、MNNG浓度及作用时间之间不存在交互作用,差异无统计学意义(F=0.737, P>0.05)。为更好的体现叶酸在细胞DNMT1酶活性中的作用,表中可看出虽然细胞DNMT1酶活性随MNNG浓度增高及
时间延长而逐渐增高,但叶酸具有改善作用,且随着叶酸浓度的增加改善作用更加明显(P<0.05 或P<0.01)。
2.2 叶酸及MNNG作用后细胞DNMT1m RNA的表达
2.2.1 RNA完整性检测 哈萨克族食管上皮细胞经不同浓度叶酸和不同浓度MNNG作用48、72、96h后,分别提取的总RNA经1.5%琼脂糖凝胶电泳,可见两条清晰的RNA条带:18 S和28 S,说明RNA提取成功,RNA完整性好,无降解。波长260和280 nm处的吸光度比值[D(260)/D(280)]均在1.9~2.1之间,提取的RNA浓度在200~600 ng/L之间。
2.2.2 DNMT1mRNA表达水平 实时荧光定量PCR法检测DNMT1酶mRNA指标的结果见表3。固定MNNG浓度和作用时间,不同叶酸浓度作用下的哈萨克族食管上皮细胞DNMT1mRNA表达水平不同,随着叶酸浓度的增加DNMT1mRNA 表达水平逐渐降低,差异有统计学意义(F=217.462,P<0.01);固定叶酸浓度和时间,不同MNNG浓度作用下的哈萨克族食管上皮细胞DNMT1mRNA表达水平不同,随着MNNG浓度的增加DNMT1mRNA表达水平逐渐升高,差异有统计学意义(F=1 118.042,P<0.01);固定MNNG和叶酸浓度,不同作用时间下的哈萨克族食管上皮细胞DNMT1mRNA表达水平不同,随着干预时间的延长DNMT1mRNA表达水平逐渐升高,差异有统计学意义(F= 105.384,P< 0.01)。叶酸浓度与MNNG浓度之间、MNNG浓度与作用时间之间存在交互作用,差异有统计学意义(F=62.023,P<0.01;F=20.421,P<0.01);不同叶酸浓度与不同作用时间之间差异无统计学意义(F=2.304, P>0.05)。叶酸浓度、MNNG浓度及作用时间之间不存在交互作用,差异无统计学意义(F=0.518,P>0.05); 为更好的体现叶酸在细胞DNMT1mRNA表达水平中的作用,表中可看出虽然细胞DNMT1mRNA表达水平随MNNG浓度增高及时间延长而逐渐增高,但叶酸具有改善作用,且随着叶酸浓度的增加改善作用更加明显(P<0.05,P<0.01)。
表2 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1酶活性的改变(n=3,±s)
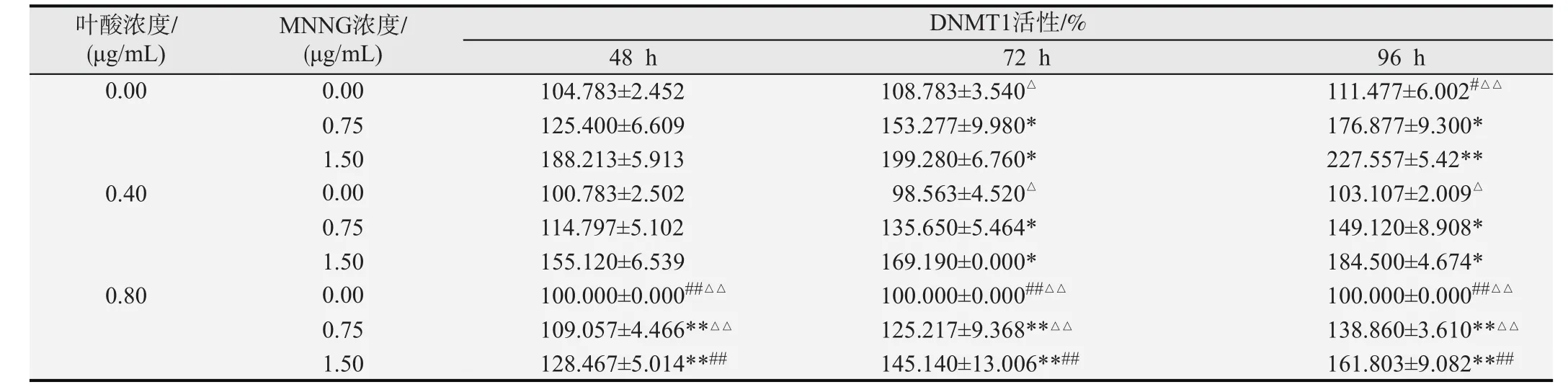
表2 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1酶活性的改变(n=3,±s)
在固定MNNG浓度及作用时间的条件下:与0.00μg/mL叶酸组比较,*P<0.05、**P<0.01;与0.40μg/ml叶酸组比较,#P<0.05、##P<0.01;与0.80μg/mL叶酸组比较,△P<0.05、△△P<0.01.
表3 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1mRNA相对表达水平的改变(n=3,±s)
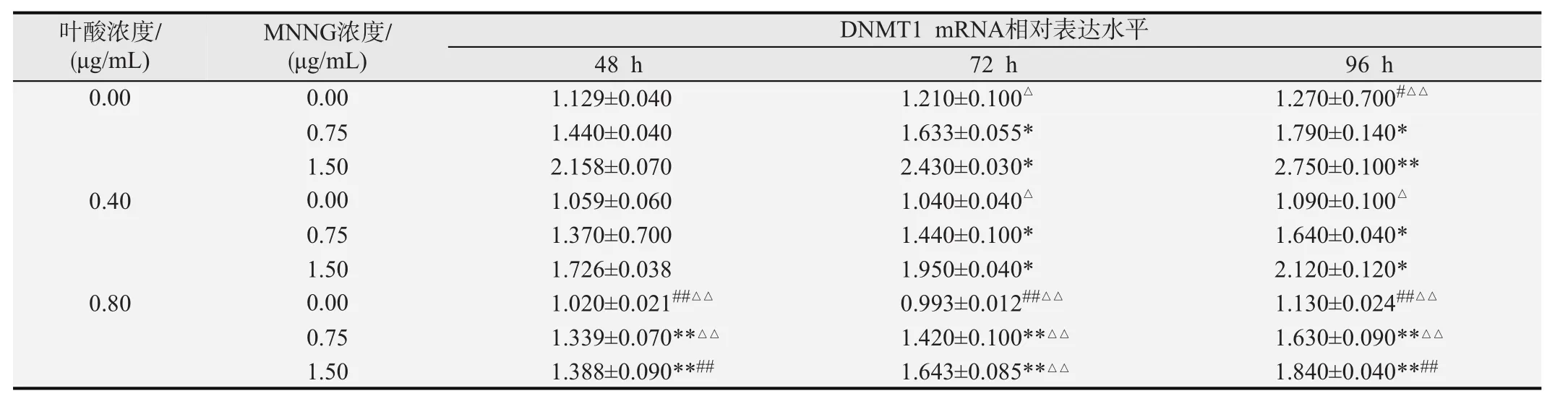
表3 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1mRNA相对表达水平的改变(n=3,±s)
在固定MNNG浓度及作用时间的条件下:与0.00μg/mL叶酸组比较,*P<0.05、**P<0.01;与0.40μg/mL叶酸组比较,#P<0.05、##P<0.01;与0.80μg/mL叶酸组比较,△P<0.05、△△P<0.01.
2.3 叶酸及MNNG作用后DNMT1蛋白的表达水平
Western blot法检测DNMT1蛋白指标的结果见图1和表4。固定MNNG浓度和时间,不同叶酸浓度作用下的哈萨克族食管上皮细胞DNMT1蛋白表达水平不同,随着叶酸浓度的增加DNMT1蛋白表达水平逐渐降低,差异有统计学意义(F=7 138.952,P<0.01);固定
叶酸浓度和时间,不同MNNG浓度作用下的哈萨克族食管上皮细胞DNMT1蛋白表达水平不同,随着MNNG浓度的增加DNMT1 蛋白表达水平逐渐升高,差异有统计学意义(F=1 251.658,P<0.01);固定MNNG和叶酸浓度,不同时间点作用下的哈萨克族食管上皮细胞DNMT1蛋白表达水平不同,随着干预时间的延长DNMT1蛋白表达水平逐渐升高,差异有统计学意义(F=3 045.419,P<0.01)。不同叶酸浓度与不同MNNG浓度之间、不同叶酸浓度与不同作用时间之间、不同MNNG浓度与不同作用时间之间差异均有统计学意义(F=53.613,P<0.05;F=62.818,P<0.05;F=66.389,P <0.05),叶酸浓度、MNNG浓度及作用时间之间均存在交互作用,差异有统计学意义(F= 69.530,P<0.05)。为更好的体现叶酸在细胞DNMT1蛋白表达水平中的作用,表中可看出虽然细胞DNMT1蛋白表达水平随MNNG浓度增高及时间延长而逐渐增高,但叶酸具有改善作用,且随着叶酸浓度的增加改善作用更加明显(P<0.05或P<0.01)。

图1 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1蛋白表达水平的改变
表4 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1蛋白表达水平的改变(n=3,±s)
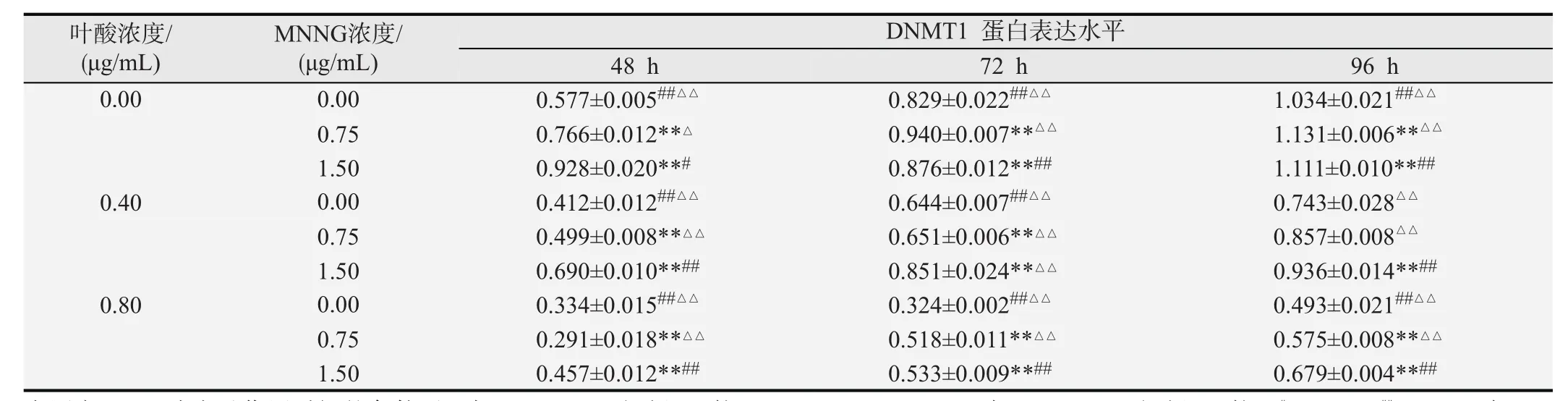
表4 不同浓度叶酸及MNNG作用细胞不同时间后DNMT1蛋白表达水平的改变(n=3,±s)
在固定MNNG浓度及作用时间的条件下:与0.00μg/mL叶酸组比较,*P<0.05、**P<0.01;与0.40μg/mL叶酸组比较,#P<0.05、##P<0.01;与0.80μg/mL叶酸组比较,△P<0.05、△△P<0.01.
3 讨 论
叶酸是一种体内广泛分布的B族维生素,叶酸水平的低下能引起DNA甲基化紊乱,减低DNA修复和合成效率,从而引起抑癌基因和癌基因表达异常,导致肿瘤的发生和发展[8]。目前认为叶酸预防恶性肿瘤的机制主要与其维持DNA正常甲基化有关[9]。有关于叶酸与食管癌关系的Meta分析表明,血清叶酸水平与食管癌的危险性呈负相关[10]。郝婷等[11]对哈萨克族食管癌患者血清维生素含量的研究结果显示哈萨克族食管癌患者血清叶酸水平普遍偏低。近年来有学者[12]提出亚硝酸胺类化合物可能是引起食管癌的病因之一,N-甲基-N'-硝基-N-亚硝基胍(MNNG)是一种人工合成的亚硝胺类化合物,通常使用亚硝胺类化合物作为诱发肿瘤实验的研究。本次实验在经叶酸干预后,叶酸可通过与MNNG发生拮抗作用而抑制致癌物对食管上皮的进一步损伤,但随着时间的增加,这种拮抗作用也会减弱。单一叶酸缺乏能够抑制哈萨克族食管上皮细胞生长,但并不明显。
本次试验通过检测DNMT1酶活性,结果显示,经不同浓度MNNG染毒48、72、96h后,随着MNNG浓度的增加以及作用时间的延长,哈萨克族食管上皮细胞DNMT1酶活性均逐渐升高,同时还发现叶酸与MNNG
之间存在一定的交互作用,充足的叶酸可能通过影响DNMT1活性从而达到减少毒物的损伤作用,进而起到降低食管上皮细胞癌变的可能性。
高波等[13]对原发性肝癌患者肝组织和肝癌细胞系的DNMTsmRNA表达的差异,发现在肝癌组织和肝癌细胞系中DNMT1的mRNA水平升高。Derya等[14]分别取18例新诊断的白血病患儿和18例健康儿童的外周血检测DNMT1mRNA表达水平,发现白血病患儿的DNMT1mRNA表达水平高于健康儿童。已有较多研究表明,叶酸可以调控DNMT1的表达,然而叶酸水平究竟上调还是抑制DNMT1表达尚存在争议。本次试验通过qPCR和Western blot法分别检测各组哈萨克族食管上皮细胞DNMT1mRNA及蛋白表达水平。结果显示无叶酸无MNNG组叶酸缺乏能够促使细胞DNMT1mRNA及蛋白表达上调,再经MNNG染毒48、72及96h后,哈萨克族食管上皮细胞DNMT1mRNA及蛋白表达水平均表达上调,且随MNNG浓度的增高及作用时间的延长DNMT1mRNA及蛋白表达水平也逐渐上调,但同等条件下叶酸充足组细胞DNMT1mRNA及蛋白表达水平均明显低于叶酸缺乏组及无叶酸组。以此表明,叶酸的缺乏会加剧MNNG对细胞DNMT1mRNA及蛋白表达的影响,而充足的叶酸则可对MNNG的影响起到一定的抑制作用。
[1] Ishiguroh,Kimuram,Takahashih,etal.GADD45A expression is correlated with patient prognosisin esophageal cancer[J].Oncol Lett,2016,11(1):277-282.
[2] Farias N,Ho N,Butler S,etal.The effects of folic acid on global DNAmethylation and colonosphere formation in colon cancer cell lines[J].J Nutr Biochem,2015,26(8):818-826.
[3] 刘真群,张慧霞,陈艳.新疆伊犁哈族食管癌高发区饮用水“三氮”含量分析[J].中国公共卫生,2014,30(7):940-943.
[4] RobertmF,Morin SN,Gauthier F,etal.DNMT1 is required tomaintain CpGmethylation and aberrant gene silencing inhuman cancer cells[J].Nat Genet,2003,33(1):61-65.
[5] 张慧霞,陈艳,尹东,等.新疆哈萨克族食管癌危险因素的探讨[J].现 代预防医学,2009,36(10):1804-1806.
[6] 张广平,王立东,冯笑山.遗传与环境在食管癌发生发展中的作用[J].医 学与哲学,2008,29(5):35-36.
[7] 黄思语,阿尔孜古丽·吐尔逊,邓彦超,等.哈萨克族食管上皮细胞的原代培养方法[J].新疆医科大学学报,2014,37(3):277-279.
[8] 宋京翔.叶酸缺乏介导的肿瘤相关基因启动子区CpG岛甲基化状态异常与散发性结直肠癌发生的相关性研究[D].上海:第二军医大学,2010.
[9] Fang JY,Xiao SD.Folic acid,polymorphism ofmethyl-groupmetabolism genes,and DNAmethylation in relation to GI carcinogenesis[J].J Gastroenterol,2003,38(9):821-829.
[10] 尹钰,帕力达·托了汗,陈艳.叶酸水平与食管癌关系的Meta分析[J].新疆医科大学学报,2015(6):748-753.
[11] 郝婷,吐尔逊江·买买提明,王艳萍,等.新疆新源县234名哈萨克族居民营养状况及叶酸水平与食管癌关系的研究[J].新 疆医科大学学报,2011,34(4):429-431.
[12] Enzinger PC,Mayer RJ.Medical progress:esophageal cancer [J].N Engl Jmed,2003(23):2241-2252.
[13] 高波,李海平,余宗涛,等.原发性肝癌组织及细胞系中DNMTm RNA表达的检测及意义[J].检 验医学,2013,2 8(8):63-66.
[14] Derya BS,Halil GK,Ezer U,etal.Dnamethyltransferase expression differs with proliferation in childhood acute lymphoblastic leukemia[J].Mol Biol Rep,2010,37(5):2476-2471.
Effectof folic acid onmNNG-treated esophageal epithelial cells and expressionof DNMT1 enzyme activity
LI Xufeng1,ZHANGhuixia1,KADIRYA·Abduwali1,CHEN Yan1,2,*
(1.Departmentof Toxicology, College of Publichealth of Xinjiangmedical University, Urumqi 830011, Xinjiang; 2.Medicine School of Jiaxing University, Jiaxing 314001, Zhejiang, China)
目的: 探讨叶酸在N-甲基-N-硝基-N-亚硝基胍(MNNG)影响哈萨克族食管上皮细胞DNA甲基转移酶1(DNMT1)活性及表达中的作用,为食管癌的防治提供理论依据。方法:采用3因素3水平(3×3)析因设计将体外培养的哈萨克族食管上皮细胞分别暴露于不同浓度叶酸(0.000、0.400、0.800μg/mL)和MNNG(0.000、0.750、1.500μg/mL)的培养液中作用48、72和96h后,采用ELISA法检测DNMT1酶活性;采用RT-PCR的方法检测DNMT1mRNA表达水平;采用Western blot法检测DNMT1蛋白的表达水平。结果:不同浓度叶酸、MNNG作用细胞不同时间后,在固定MNNG浓度和时间因素下,随着叶酸浓度的增加DNMT1酶活性、DNMT1mRNA和蛋白表达水平均逐渐降低(P均<0.01);固定叶酸浓度和时间,随着MNNG浓度的增加DNMT1酶活性、DNMT1mRNA和蛋白表达水平均逐渐升高(P均<0.01);固定MNNG和叶酸浓度,随着干预时间的延长DNMT1 酶活性、DNMT1mRNA和蛋白表达水平均逐渐升高(P均<0.01);叶酸浓度与MNNG浓度之间、MNNG浓度与作用时间之间均存在交互作用(P<0.01)。不同叶酸浓度与不同MNNG浓度之间、不同叶酸浓度与不同作用时间之间、不同MNNG浓度与不同作用时间之间差异均有统计学意义(P<0.05)。结论:叶酸浓度降低对MNNG影响哈萨克族食管上皮细胞DNMT1酶活性及表达有一定的激发作用,对食管癌的发生有一定的促进作用,而保持充足的叶酸则对MNNG的损害起到一定的保护作用。
叶酸;MNNG;食管上皮细胞;DNA甲基转移酶1;哈萨克族
OBJECTIVE:To investigate the effects of folic acid on N-methyl-N-nitro-N'-nitrosoguanidine (MNNG)-treated esophageal epithelial cells,in expressionof DNMT1 activity and to provide a theoretical basis for the prevention and treatmentof esophageal cancer.METHODS:Using a 3 factors and 3 levels (3×3) factorial design,esophageal epithelial cellsin culture were exposed to different concentrations of folic acid (0.000,0.400,0.800μg/mL) andmNNG (0,0.750,1.500μg/mL) for 48,72 and 96h.DNAmethyltransferase activity was detected by ELISA; DNMT1mRNA expression by RT-PCR;DNMT1 protein expression by Western blotmethod.RESULTS: Treatmentof cells with different concentrations of folic acid andmNNG and in different times,ata fixedmNNG concentration and time factors,and with increasing concentrations of folic acid,the DNMT1 activity,DNMT1mRNA and protein expression levels all gradually decreased (P<0.01).By fixing folic acid concentrations and time,and with increasing concentrations ofmNNG,DNMT1 enzyme activity,DNMT1mRNA and protein expression levels all increased (P<0.01).By fixing themNNG and folic acid concentrations with intervention,the extensionof time of DNMT1 activity,DNMT1mRNA and protein expression levels all gradually
folic acid;MNNG;esophageal epithelial cells;DNAm ethyltransferases 1;Kazakh
R73-3
A
1004-616X(2016)06-0458-06
1 0.3969/j.issn.1004-616x.2016.06.009
2016-04-15;
2016-10-11
国家自然科学基金资助项目(81460502);新疆维吾尔自治区自然科学基金项目(医学联合基金)(2014211C002)
作者信息: 李旭峰,E-mail:lxftxdy@qq.com。*通信作者,陈 艳,E-mall:ychen88@sina.com
increased (P<0.01).There were interactions betweenmNNG concentrations and action time,and folic acid andmNNG concentrations (P<0.01).There were significant differences between different concentrations of folic acid and differentaction time,between differentmNNG concentrations and different time of action (P<0.05).CONCLUSION:Lower folate concentrationshad a negative impacton the expression and effectofmNNG on DNMT1 activity in esophageal epithelial cells.The results suggest that folic acid played a role in promoting the occurrence of esophageal carcinoma,andhad a protective effectagainstmNNG toxicity.

