基于TALE技术的哈萨克族食管上皮DNA甲基转移酶1高表达细胞株模型的构建
陈 艳,张慧霞
(1.嘉兴学院医学院,浙江 嘉兴 314001;2.新疆医科大学公共卫生学院,新疆 乌鲁木齐 830011)
基于TALE技术的哈萨克族食管上皮DNA甲基转移酶1高表达细胞株模型的构建
陈 艳1,2,张慧霞2
(1.嘉兴学院医学院,浙江 嘉兴 314001;2.新疆医科大学公共卫生学院,新疆 乌鲁木齐 830011)
食管癌(esophageal cancer)是全球第8大恶性肿瘤,80%发生在发展中国家[1]。中国是世界上食管癌发病率和死亡率最高的国家之一,每年死亡者约为15万人,几乎占全国恶性肿瘤死亡人数的1/4[2],占世界食管癌死亡人数的一半[3]。新疆哈萨克族居住区是我国食管癌六大高发区之一[4-5],发病率高达155.9/10万,死亡率(88.7/10万)远高于同地区其他民族(22.3/10万)[6]。目前研究发现,DNA CpG岛异常甲基化是肿瘤形成过程中的一个早期、频发事件,能使肿瘤相关基因失去功能表现为表遗传效应,是肿瘤发生中的一个重要因素[7],而DNA甲基转移酶1(DNAmethyltransferase 1,DNMT1)是调节DNA甲基化最重要的酶,主要参与维持
甲基化[8],其激活及过表达可以通过促进DNA高甲基化而导致肿瘤抑制基因表达沉默,从而参与肿瘤的发生和发展过程[9]。类转录激活因子(transcription-like effector,TALE)是植物致病菌黄单孢杆菌通过III型分泌系统注入到寄主细胞内的一类具有DNA结合活性的蛋白质,根据其识别DNA序列的特征,近年来已迅速发展成有效的基因组编辑工具[10]。因此,本研究利用TALE技术构建DNMT1高表达的哈萨克族食管上皮细胞株模型,为深入研究食管癌的发生机制提供研究工具。
1 材料与方法
1.1 材料
1.1.1 主要试剂 哈萨克族食管上皮细胞,来源于本课题组既往收集的哈萨克族食管癌患者的正常食管组织,采用中性蛋白酶和胰蛋白酶联合消化法成功培养出了哈族食管细胞,并对培养出来的细胞进行了鉴定,经鉴定上皮细胞来源大于95%[11];EpicM-2培养基(美国ScienCell公司);RPMI-1640培养液和胎牛血清(美国Gibco公司);PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒和SYBR®Premix Ex TaqTMII (Tli RNaseH Plus) PCR酶(TaKaRa公司);全蛋白提取试剂盒(上海生工);DNMT1 抗体(Abcam公司);Bsa I酶和T4 DNA连接酶(NEB公司)。
1.1.2 仪器 荧光倒置显微镜(Olympus);CO2恒温孵育箱(日本SANYO公司);低温离心机(日本SONY公司);酶标仪(上海新振仪器有限公司)。
1.2 实验方法
1.2.1 细胞培养 哈萨克族食管上皮细胞常规培养于1× EpicM-2无血清培养基中,37℃、CO2体积分数为5%的孵育箱中培养,当细胞生长汇合度至80%~90%时按1∶2传代培养。
1.2.2 DNMT1-TALE-VP64载体的构建 由于TALEs的可编辑属性,可在启动子近端区域内选择一段DNA序列作为靶序列,进行TALE识别模块构建。以下序列为DNMT1基因转录起始位点附近序列(方括号是转录起始位点)。
gagatgcagtttctctatgttacctaggctggtctaaaactcctgggctcaagcgatcctcccaccctggcctcccaaagtgctgggatgacaggcgtgagccacgtggtg cttaaaaaaggcaacaaaaaaccccccacacactgggtatagaagtggcatgggcctctatacactgtgagattcttggtactagctacaaattctgtgtatactcaagattttcta gagtaggtgcaattaccccgttttacagatgaggacacagaggctgagccgtagtgacccacctaaggtcgtatagccagcaaatagatggaggttggattggaactgaggactt tactcaagggctctcacaaacccttgggggcttctcgctgctttatccccatcacacctgaaagaatgaatgaatgaatgcctcgggcaccgtgcccacctcccagcaaaccgtg gagcttggacgagcccactgctccgcgtggggggggtgtgtgcccgccttgcgcatg cgtgttccctgggcatggcc[G]GCTCCGTTCCATCCTTCTGCACA GGGTATCGCCTCTCTCCGTTTGGTACATCCCCTCCTCC CCCACGCCCGGACTGGGGTGGTAGACGCCGCCTCCGC TCATCGCCCCTCCCCATCGGTTTCCGCGCGAAAAGCC GGGGCGCCTGCGCTGCCGCCGCCGCGTCTGCTGAAGCCTCCGAGATGCCGGCGCGTACCGCCCCAGCCCGGGTG CCCACACTGGCCGTCCCGGCCATCTCGCTGCCCGACGATGTCCGCAGGCG。
在转录起始位点周围600bp范围内搜索合适的TALE结合位置,排除如TATA-box等与转录关系的位点及潜在的CpG岛甲基化序列,构建靶点序列,然后按照C对应HD,T对应NG,A对应NI,G对应NN的关系设计对应的TALE队列。详见表1。

表1 构建DNMT1-TALE-VP64质粒的靶向序列和TALE对列表
按照设计的WV0132、WV0133和WV072 TALE队列从Addgene (http://www.addgene.org)模块库中选择合适的模块,通过Bsa I酶切作用和T4 DNA 连接酶连接获得含有WV0132、WV0133和WV072的TALE队列的表达质粒,命名为pXanthoTMV.basic.puro-WV0132(以下简称WV0132)、pXanthoTMV.basic.puro-WV0133(简称WV0133)和pXanthoTMV.basic.puro-WV072(转染载体pXanthoTMV.basic.puro后,阳性细胞具有嘌呤霉素抗性,简称WV072)。
1.2.3 质粒转染和稳定株筛选 将细胞培养于10 cm培养皿中,待细胞汇合率达80%~90%时(大部分细胞处于分裂期)常规消化,计数。按3×105/mL的密度接种于12孔板,每孔1mL。向一灭菌离心管中加入DNMT1-TALE-VP64质粒DNA 2μg,补充相应体积的Opti-MEM至50μL,混合均匀;将Lipofectamine 2000试剂轻柔摇匀,取2μL在另一管中与48μL Opti-MEM混合,在室温下温育5min。把稀释后的DNA与稀释后的Lipofectamine 2000混合,室温下温育20min,形成
DNA与Lipofectamine 2000的转染复合物。将转染复合物滴加到12孔板中,轻摇混匀后,放至培养箱中继续培养。
转染24h后,将培养基更换为含2μg/mL嘌呤霉素的完全培养基,放回细胞培养箱中继续培养。未转染的细胞将在2~3 d后开始死亡。期间正常换液,保持嘌呤霉素的浓度,直到未转染细胞全部死亡,待剩余细胞明显长成克隆或长满后进行传代培养,以获得足够的细胞用于目的基因的表达检测。
1.2.4 DNMT1mRNA表达水平的检测 按Trizol (Invitrogen公司)提取试剂说明书抽提细胞内总RNA,并确定RNA的纯度及浓度。再按Prime ScriptTMRT Reagent Kit with gDNA Eraser试剂盒说明书反转录合成cDNA。逆转录PCR所使用的引物由上海生工公司Primer Premier 5.0软件设计合成(Q-DNMT1-F:GCAAG AAGTGAAGCCCGTAG,Q-DNMT1-R:TGAACGCTtaGCCTCTCCAT)。然后按SYBR®P remix Ex TaqTMII试剂盒说明书进行实时荧光定量PCR实验。PCR扩增条件:预变性95℃、30 s,变性95℃、5 s,退火和延伸60℃、34 s,共扩增40循环。采用2-△△CT法分析DNMT1在各不同转染组的表达差异。
1.2.5 Western blot法检测DNMT1蛋白表达水平 BCA法对所提取的蛋白进行定量分析。在提取的蛋白中加入5×SDS上样缓冲液,混合均匀后,放入沸水中水浴5min,使蛋白变性,10% SDS-PAGE电泳,湿法转印PVDF膜,将膜用TBST漂洗3次,然后用5%的脱脂奶粉37℃缓慢震荡2h,与DNMT1和β-actin一抗、二抗孵育,曝光。目的蛋白的相对表达量为目的蛋白灰度值/内参蛋白灰度值。
1.3 统计学方法
采用SPSS 17.0软件进行统计学分析,测得的数据-用(±s)表示,多组间比较采用方差齐性检验和单因素方差分析,两两比较采用SNK(方差齐)或Games-Howell检验(方差不齐),以α=0.05为检验水准。
2 结果
2.1 转染效率
以哈萨克族食管上皮细胞为转染对象,经荧光和白光拍摄后发现,该种细胞无自发荧光产生,避免了细胞背景对实验的干扰(图1A)。将带有荧光标记的质粒转染至哈萨克族食管上皮细胞后,通过荧光显微镜观察发现,细胞转染效率较高(图1B)。在细胞密度基本一致和转染条件相同时,将带有WV0132的质粒转染至哈萨克族食管上皮细胞的转染效率也较高(图3C),同时通过嘌呤霉素对转染后的细胞进行筛选也证明了该细胞转染效率较高这一结果。
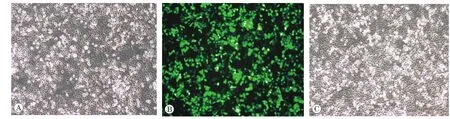
图1 细胞转染效率图(以转染WV0132质粒为例,×200)
2.2 DNMT1过表达稳定细胞株的筛选

图2 嘌呤霉素对不同质粒转染细胞筛选4 d后的细胞生长情况(×200)
见图2。转染24h后,在培养基中加入2μg/mL嘌
呤霉素对细胞进行筛选。对照组细胞不携带嘌呤霉素抗性标记,药物筛选4 d后细胞全部死亡(图2A)。实验组和转染阴性质粒组细胞携带嘌呤霉素抗性标记,筛选4 d后细胞生长状况良好(图2B和2C)。
2.3 DNMT1mRNA和蛋白表达水平的检测
WV0133和WV0132质粒转染组细胞DNMT1mRNA和蛋白表达水平均高于正常细胞组(P<0.01)。阴性质粒组与正常细胞组间的差异无统计学意义(P>0.05)。见表2和图3。
表2 不同质粒转染细胞后DNMT1mRNA和蛋白相对表达水平(±s)
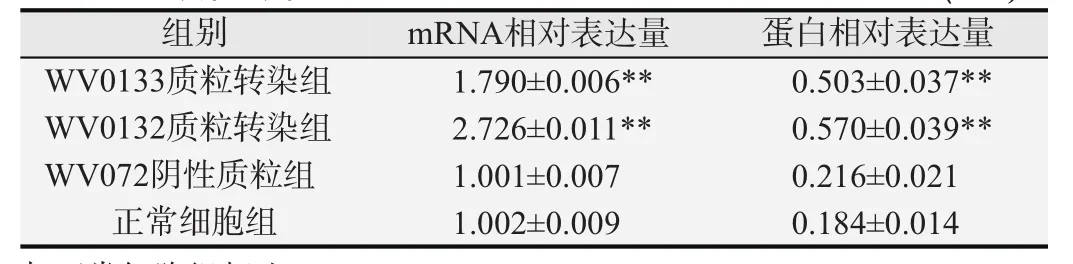
表2 不同质粒转染细胞后DNMT1mRNA和蛋白相对表达水平(±s)
与正常细胞组相比,**P<0.01.
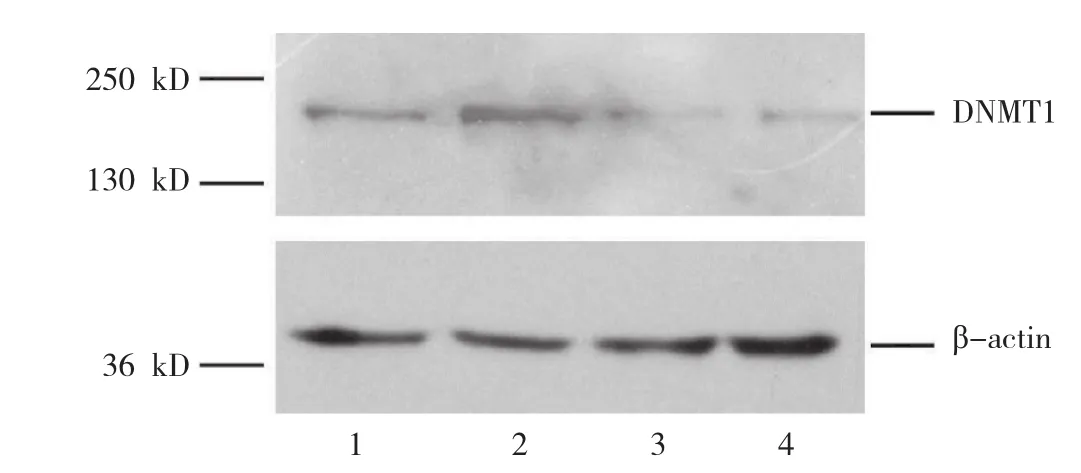
图3 不同质粒转染细胞后DNMT1蛋白表达的电泳图
3 讨 论
随着分子生物学技术的不断发展,外源基因转染真核细胞的转染技术也越来越多,其中最常见的是慢病毒感染法和脂质体介导的基因转染。慢病毒感染法虽可用于稳定转染,但其在包装过程中往往对基因长度有要求,一般要求基因长度在3 kb以下。而TALE技术则可用于任意目的基因的过表达,所过表达的对象是细胞内源性的目的基因,没有其他修饰和副产物的出现,特别适用于3 kb以上的大基因的过表达。现代肿瘤学理论认为,肿瘤的发生不仅与遗传学(genetic)有关,还与表观遗传学(epigenetics)有关,而表观遗传学机制中的DNA甲基化是目前研究最多和最清楚的机制之一,也是表观遗传修饰中最重要的修饰方式之一[12-13]。 DNA甲基化(DNAmethylation)是通过将S-腺苷甲硫氨酸作为甲基供体,并在DNA甲基转移酶(DNMTs)的催化下,CpG二核苷酸中的胞嘧啶环上5´位置的氢被活性甲基所取代,从而变成5-甲基胞嘧啶(5-mC)[14-15]。DNMTs主要有DNMT1和DNMT3(DNMT3a和 DNMT3b)家族,而DNMT1是最早发现,也是哺乳动物DNA甲基转移酶的主要类型。研究表明,外源性DNMT1在鼠和人的成纤维细胞内表达后能够促进细胞转化,包括接触抑制减少、甲基化水平上升、瘤源性增加以及纺锤体异常;而DNMT1在多种肿瘤中的高表达也成为其作为肿瘤表遗传治疗的重要靶点[16]。
因此,本实验利用TALE技术,用TALE-VP64 (VP64是一个转录激活结构域)与DNMT1基因启动子序列结合以增强DNMT1基因的转录水平,从而增加DNMT1基因表达,拟构建哈萨克族食管上皮DNMT1高表达细胞株模型。实验中,以带有荧光标记的质粒转染组为对照组,实验结果显示,细胞转染效率较高。通过在培养液中加入2μg/mL嘌呤霉素的方法,对转染细胞进行筛选,质粒转染成功的细胞在此培养液中可以存活,而未转染的细胞因不含嘌呤霉素抗性标记则死亡,筛选存活下来的细胞以克隆的方式进行扩大培养。采用qPCR和Western blot方法对各组细胞进行DNMT1基因转录水平和蛋白表达水平的检测。检测结果显示,WV0133和WV0132质粒转染组细胞DNMT1mRNA和蛋白表达水平均显著高于正常细胞组(P< 0.01),其中,WV0132质粒转染组细胞DNMT1mRNA和蛋白表达水平较高。本研究结果提示,利用TALE技术成功构建了哈萨克族食管上皮DNMT1高表达细胞株,为进一步深入研究食管癌的发生机制提供了研究工具。
[1] Pennathur A,GibsonmK,Jobe BA,etal.Oesophageal carcinoma[J].Lancet,2013,381(9864):400-412.
[2] Xiang W,Shi JF,Li P,etal.Estimationof cancer cases and deaths attributable to infection in China[J].Cancer Cause Control,2011,22(8):1153-1161.
[3] Parkin DM,Bray F,Ferlay J,etal.Global cancer statistics,2002[J].C A Cancer J Clin,2005,55(2):74-108.
[4] Cui XB,Pang XL,Li S,etal.Elevated expression patterns and tight correlationof the PLCE1 and NF-κB signaling in Kazakh patients with esophageal carcinoma[J].Med Oncol,2014,31(1):791.
[5] Cui XB,Chen YZ,Pang XL,etal.Multiple polymorphisms within the PLCE1 are associated with esophageal cancer via promoting the gene expression in a Chinese Kazakh population [J].Gene,2013,530(2):315-322.
[6] Shen T,Aneasi,Sakabe NJ,etal.Tbx20 regulates a genetic program essential to adultmouse cardiomyocyte function[J].JClin Invest,2011,121(12):4640-4654.
[7] Jones PA.Functions of DNAmethylation:islands,start sites,gene bodies and beyond[J].Nat Rev Genet,2012,13(7):484-492.
[8] Rhee I,Jair KW,Yen RW,etal.CpGmethylation ismaintained inhuman cancer cells lacking DNMT1[J].Nature,2000,404(6781):1003-1007.
[9] KimhJ,Kim JH,Chie EK,etal.DNMT (DNAmethyltransferase) inhibitors radiosensitizehuman cancer cells by suppressing DNA repair activity[J].Radiatoncol,2012,7 :39.
[10] Zhang F,Cong L,Lodato S,etal.Efficient constructionof sequence-specific TAL effectors formodulatingmammalian transcription[J].Nat Biotechnol,2011,29(2):149-153.
[11] 黄思语,阿尔孜古丽·吐尔逊,邓彦超,等.哈萨克族食管上皮细胞的原代培养方法[J].新疆医科大学学报,2014, 37(3):277-279.
[12] Carroll SL.Molecularmechanisms promoting the pathogenesis of Schwann cell neoplasms[J].Acta Neuropathol,2012,123(3):321-348.
[13] Wainfan E,Poirier LA.Methyl groupsin carcinogenesis:effects on DNAmethylation and gene expression[J].Cancer Res,1992,52(Sup7):2071-2077.
[14] Okanom,Bell DW,Haber DA,etal.DNAmethyltransferases Dnmt3a and Dnmt3b are essential for de novomethylation andmammalian development[J]. Cell,1999,99(3):247-257.
[15] Chen T,Li E.Structure and functionof eukaryotic DNAmethyltransferases[J].Curr Top Dev Biol,2004,60:55-89.
[16]manoharanm ,Ramachandran K ,Solowaym S,eta l.E pigenetic targetsin the diagnosis and treatmentof prostate cancer[J].Int Braz J Urol,2007,33(1):11-18.
Constructionof esophageal epithelial cell withhigh DNAmethyltransferase 1 expression
CHEN Yan1,2,ZHANGhuixia2
(1.College ofmedicine, Jiaxing University, Jiaxing 314001, Zhejiang; 2.School of Publichealth, Xinjiangmedical University, Urumqi 830011, Xinjiang, China)
目的: 构建哈萨克族食管上皮细胞DNA甲基转移酶1(DNMT1)高表达细胞株模型。方法:将构建的WV0133、WV0132和WV072质粒转染至哈萨克族食管上皮细胞,利用嘌呤霉素对DNMT1高表达细胞进行筛选,并通过荧光显微镜、实时荧光定量PCR(qPCR)和Western blot法检测细胞转染情况和目的基因DNMT1的表达情况。结果:WV0133 和WV0132质粒转染组细胞DNMT1mRNA表达水平是正常细胞组的1.786倍和2.721倍,DNMT1蛋白表达水平是正常细胞组的2.734倍和3.100倍,均显著高于正常细胞组(P<0.01)。其中,WV0132质粒转染组细胞DNMT1mRNA和蛋白表达水平较高。结论:成功构建了哈萨克族食管上皮DNMT1高表达细胞株模型,为深入研究食管癌的发生机制提供了研究工具。
DNA甲基转移酶1;食管上皮细胞;哈萨克族;TALE技术
OBJECTIVE:To construct esophageal epithelial cells which expresshigh levels of DNAmethyltransferase 1 (DNMT1).METHODS:Plasmids WV0133,WV0132 and WV0132 were constructed and transfected into esophageal epithelial cells.Transfectionof the cells was observed under the inverted fluorescencemicroscope.Cells that expressedhigh levels of DNMT1 were selected by puromycin.Expressions of DNMT1mRNA and protein were determined by using quantitative real-time PCR and Western blot. RESULTS:Compared with the normal cell group, themRNA expression levels were 1.786 times and 2.721 timesin the WV0133- and WV0132-transfected cells,respectively,and their protein expression levels were 2.734 times and 3.100 times,respectively.They were significantlyhigher than those in the normal cell group (P<0.01).CONCLUSION:An esophageal epithelial cell line which expressedhigh levels of DNMT1 was successfully constructed.The cell line can be a valuable tool to studymechanisms for esophageal cancer development.
DNAmethyltransferase 1;esophageal epithelial cell;Kazakh;TALEs
Q7;R73-35+4
A
1004-616X(2016)06-0428-05
10.3969/j.issn.1004-616x.2016.06.003
2016-08-28;
2016-10-13
国家自然科学基金(81460502)
作者信息: 陈 艳,E-mail:ychen88@sina.com

