全氟辛烷磺酸盐暴露对斑马鱼胚胎发育毒性与氧化应激的影响
赵雪松,任 新,段小月,罗州颖,朱 蓉
(吉林师范大学 环境科学与工程学院,吉林 四平 136000)
全氟辛烷磺酸盐暴露对斑马鱼胚胎发育毒性与氧化应激的影响
赵雪松,任 新,段小月,罗州颖,朱 蓉
(吉林师范大学 环境科学与工程学院,吉林 四平 136000)
探讨了全氟辛烷磺酸盐(PFOS)对斑马鱼胚胎的发育毒性与氧化应激的影响。将斑马鱼胚胎暴露于系列浓度(0.1 mg/L,0.5 mg/L,1 mg/L,5 mg/L,10 mg/L)的PFOS中,分别在胚胎受精后数小时(24 hpf,48 hpf,72 hpf,96 hpf,120 hpf)内统计急性发育毒性指标,包括存活率、畸形率、心率以及孵化率。同时在暴露结束的120 hpf,检测相关的抗氧化酶活性变化,主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(Gpx)以及脂质过氧化物(MDA)。结果显示,PFOS能够导致胚胎/幼鱼存活率降低,畸形率增加,心率加快以及孵化延迟;同时,胚胎SOD活性以及MDA水平增加,CAT与Gpx活性降低,表明PFOS能够诱发斑马鱼胚胎急性发育中毒,影响其抗氧化系统,导致胚胎产生氧化应激。
全氟辛烷磺酸盐(PFOS);斑马鱼胚胎;发育;氧化应激
全氟辛烷磺酸盐(PFOS)是全氟代有机化合物的典型代表,以其优良的热稳定性、化学稳定性,高表面活性及疏水性,被广泛地应用于工业生产和生活消费领域,如皮革、纺织品、造纸、室内装潢、电子产品和表面活性剂的加工[1]。PFOS具有难降解、远距离传播能力、生物蓄积性等特点,其广泛应用势必会导致大量环境残留,尤其是水体中的PFOS会在水生生物体中进行积累[2]。目前毒理学研究数据显示,PFOS类物质对生物具有显著的甲状腺毒性[3]、生长发育毒性[4]、生殖毒性[5]等,但是对水生生物的毒理学数据还有待完善。
斑马鱼(Danio rerio)是一种小型淡水硬骨鱼,原产于东印度恒河流域。其身体细长,成鱼体长约4~5 cm,身体两侧有竖向银蓝色条纹,如斑马状,故得名斑马鱼。斑马鱼饲养简单,繁殖周期短且能力强,是发育生物学、分子遗传学和毒理学的理想模型。随着环境毒理学这一学科的迅速发展,近年来,斑马鱼作为一种良好的实验模型,被越来越多地应用到毒性测试和独立研究中。
本文拟通过实验研究PFOS急性暴露对斑马鱼的发育毒性与氧化应激的影响,以获得具有现实意义的毒理学数据。
1 实验部分
1.1 斑马鱼的养殖与胚胎的收集
实验用斑马鱼购自中国科学研究院武汉水生所,体长约3~4 cm。将性成熟的斑马鱼养殖于经活性炭、珊瑚砂、陶粒过滤并由紫外线消毒的循环水中(其装置见图1),并在循环水中加入营养盐(64.75 mg/L NaHCO3,5.75 mg/L KCl,123.25 mg/L MgSO4·7H2O和294 mg/L CaCl2·2H2O)。水温保持在28±1 ℃,pH值为 6.85~7.0,光照黑暗周期为12 h明/12 h暗。选用体形正常成熟亲鱼,按照雌雄1∶2进行交配,并用筛网收集受精卵。在解剖镜下挑选受精后2 h内(2 hour post-fertilization,2 hpf)发育正常的胚胎进行暴露实验。

图1 斑马鱼养殖装置
1.2 PFOS暴露溶液的配制
实验选取PFOS作为染毒物质。PFOS购自于Sigma公司,纯度>99%。由于PFOS不溶于水,所以选取二甲基亚枫(DMSO)对PFOS粉末进行溶解。取100 mg干燥的PFOS粉末,溶于10 mL DMSO溶剂中,制成10 mg/mL浓度的PFOS储备液,并应用循环水依次释成为0.1 mg/L,0.5 mg/L,1 mg/L,5 mg/L,10 mg/L作为暴露溶液。将所得的这5种浓度的溶液分别装瓶并标注。
1.3 暴露实验
将收集到的受精卵进行清洗后,置于预先配制的暴露溶液中。具体步骤为:在直径为180 mm的结晶皿中分别倒入300 mL空白溶液, 0.1 mg/L,0.5 mg/L,1 mg/L,5 mg/L,10 mg/L PFOS溶液,每个暴露浓度放入200颗发育到囊胚期的胚胎,每个暴露浓度设置6个重复。为保证溶液中溶质的浓度,每天更换50%的暴露液。暴露实验开始后对急性发育指标进行考察,主要包括在24 hpf,48 hpf,72 hpf,96 hpf,120 hpf时间节点胚胎/幼鱼的存活率与畸形率;72 hpf与84 hpf胚胎/幼鱼的孵化率;48 hpf与84 hpf胚胎/幼鱼的心率。在暴露120 hpf后,对胚胎/幼鱼进行抗氧化系统指标的分析。
1.4 胚胎抗氧化系统指标分析
胚胎抗氧化系统指标分析主要测定抗氧化酶活性变化,包括超氧化歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(Gpx)以及丙二醛(MDA)的水平。测定方法如下:暴露120 hpf后,每个暴露浓度随机收集80个胚胎/幼鱼,用机械匀浆器进行匀浆,制成10%的匀浆液,然后根据南京建成生物有限公司测定试剂盒的操作规程对上述内容进行测定。
1.5 数据统计分析
实验数据使用Kolmogorov-Smirnov检验分析,并利用Levene’s检验分析方差的同质性。所有统计分析都通过SPSS 17.0软件(SPSS,Chicago USA)进行操作。当p<0.05时,判定存在显著性差异。实验数据以平均值±标准差(SEM)给出,采用Origin 8.0软件进行数据作图。
2 结果与讨论
2.1 PFOS对斑马鱼胚胎急性发育毒性的影响
将胚胎暴露于不同浓度的PFOS后,在24 hpf,48 hpf,72 hpf,96 hpf和120 hpf时间节点胚胎/幼鱼的存活率如图2所示。由图2可知胚胎/幼鱼的存活率24~48 hpf没有显著变化,随着暴露时间的延长,72~120 hpf胚胎/幼鱼的存活率呈现降低趋势,且与暴露浓度存在依赖关系。暴露时间由24 hpf延长至120 hpf,对照组存活率分别为88%和78%,0.1 mg/L PFOS暴露组的存活率由85%降至74%,而10 mg/L PFOS暴露组的存活率由80%显著降至40%。
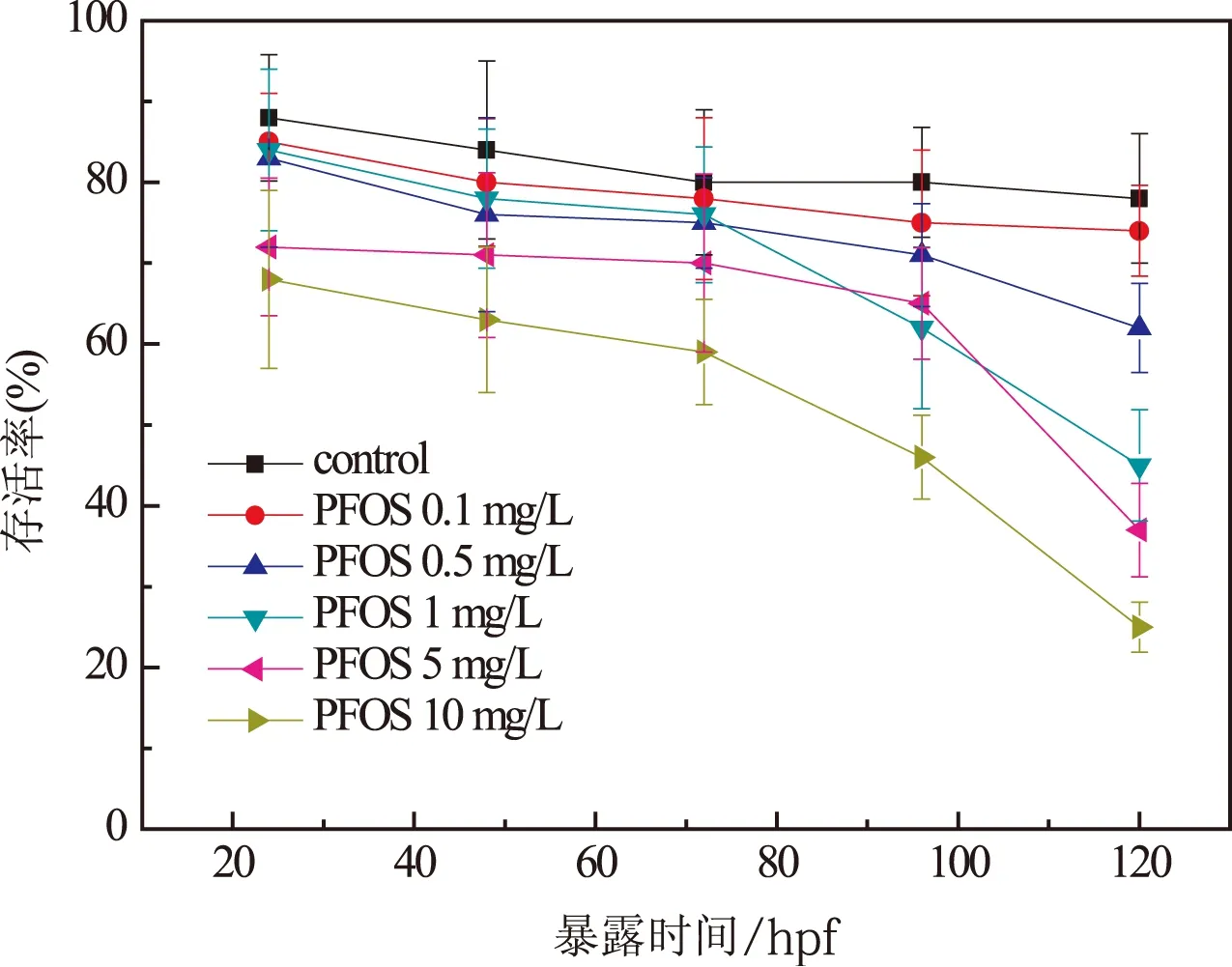
图2 PFOS急性暴露对斑马鱼 胚胎/幼鱼存活率的影响
在24 hpf,48 hpf,72 hpf,96 hpf和120 hpf时间节点统计的胚胎/幼鱼的畸形率如图3所示,由图3可知畸形率与PFOS暴露浓度存在显著的时间剂量依赖关系。随着暴露浓度的增加,1 mg/L,5 mg/L,10 mg/L PFOS暴露组畸形率显著增加。随着暴露时间由24 hpf延长至120 hpf,以上三组的畸形率分别由14%,15%,18%增加至45%,62%和75%。夏继刚等研究的PFOS对斑马鱼仔鱼急性暴露的结论与本研究得到的结论相似,即随着暴露时间的延长与暴露浓度的增加,仔鱼的死亡率与畸形率增加[6]。
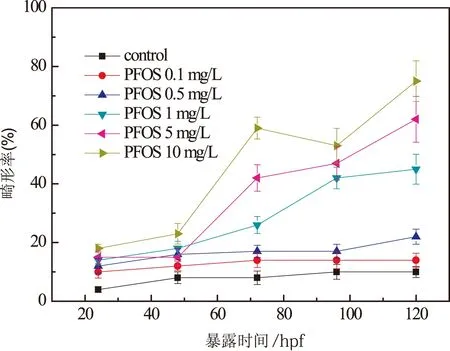
图3 PFOS急性暴露对斑马鱼 胚胎/幼鱼畸形率的影响
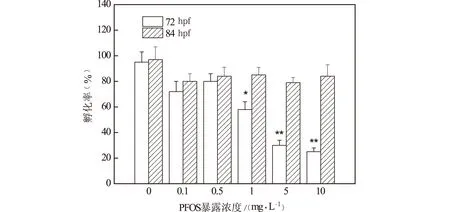
(注:*表示p<0.05;**表示p<0.01)图4 PFOS急性暴露对斑马鱼 胚胎/幼鱼孵化率的影响
孵化出壳是斑马鱼胚胎发育的一个重要阶段。72 hpf与84 hpf胚胎的孵化率如图4所示,对照组中超过90%的胚胎在72 hpf之前孵化出壳。在72 hpf1 mg/L,5 mg/L,10 mg/L PFOS暴露组与对照组相比孵化率显著降低(p<0.05),且呈现明显的剂量依赖关系,孵化率分别为58%,30%和25%。当暴露时间延长至84 hpf,PFOS各暴露组胚胎的孵化率有所增加,与对照组没有显著差异,说明PFOS浓度的增加虽延迟胚胎的孵化时间,但不影响胚胎成功孵化。
在48 hpf与84 hpf统计胚胎/幼鱼的心率由图5所示,各暴露组胚胎48 hpf心率与对照组没有显著差异,而在84 hpf1 mg/L,5 mg/L,10 mg/L PFOS暴露组幼鱼的心率显著增加,分别为198±6次/min,210±12次/min,235±24次/min,对照组却只有158±6次/min。
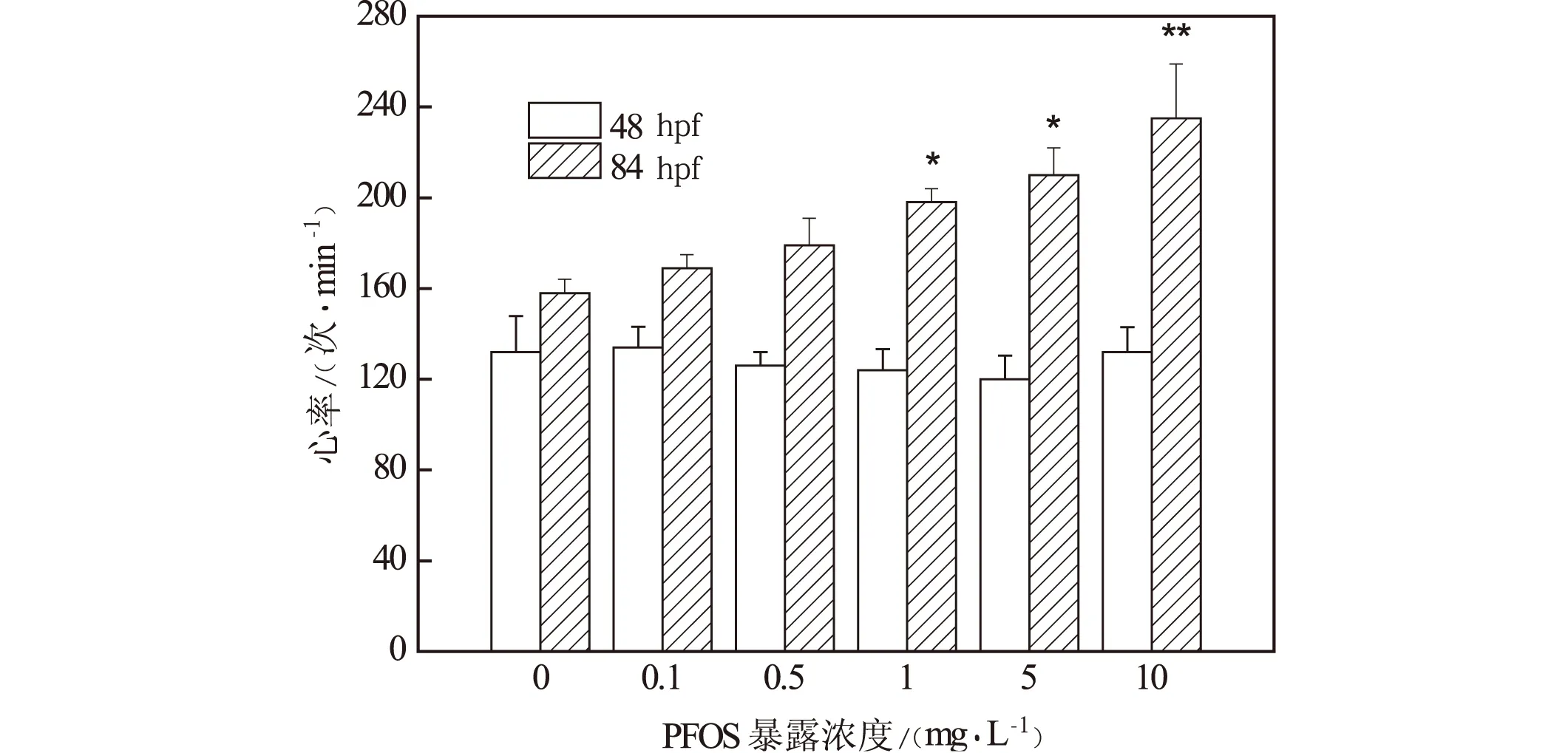
(注:*表示p<0.05;**表示p<0.01)图5 PFOS急性暴露对斑马鱼 胚胎/幼鱼心率的影响
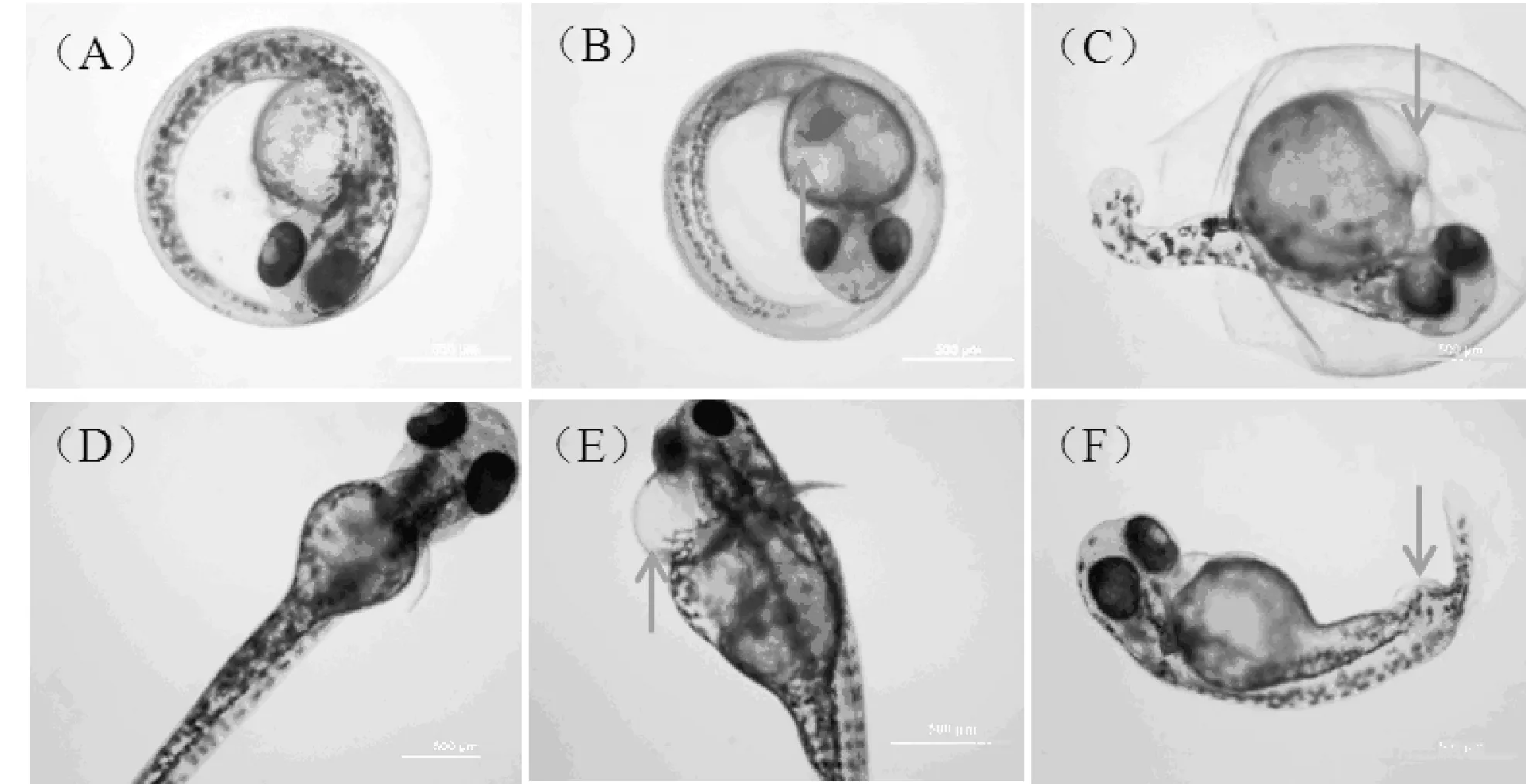
(A)48 hpf对照;(B)48 hpf充血;(C)48 hpf卵黄囊水肿;(D)96 hpf对照;(E)96 hpf心包水肿;(F)96 hpf尾部畸形图6 PFOS急性暴露后胚胎/幼鱼形态学异常
图6显示了PFOS急性暴露导致的胚胎/幼鱼发育的形态学异常表现,主要包括充血、卵黄囊水肿、心包水肿以及尾部畸形。胡芹的研究也发现PFOS能够导致幼鱼出现脊柱弯曲、卵黄囊水肿等异常[7]。2.2 PFOS对斑马鱼胚胎抗氧化系统的影响
氧化应激是诱导氧化损伤的一种常见途径,抗氧化系统是生物为了避免内外源化学物质的损害而通过长期进化形成的酶解系统。许多环境污染物都能够诱导生物体活性氧(ROS)的过量生成,但生物体有一套完整的抗氧化系统作为保护体系,主要用于清除机体内产生的多余的自由基,使机体免受氧化损伤。PFOS对斑马鱼胚胎抗氧化系统的影响如图7-10所示。
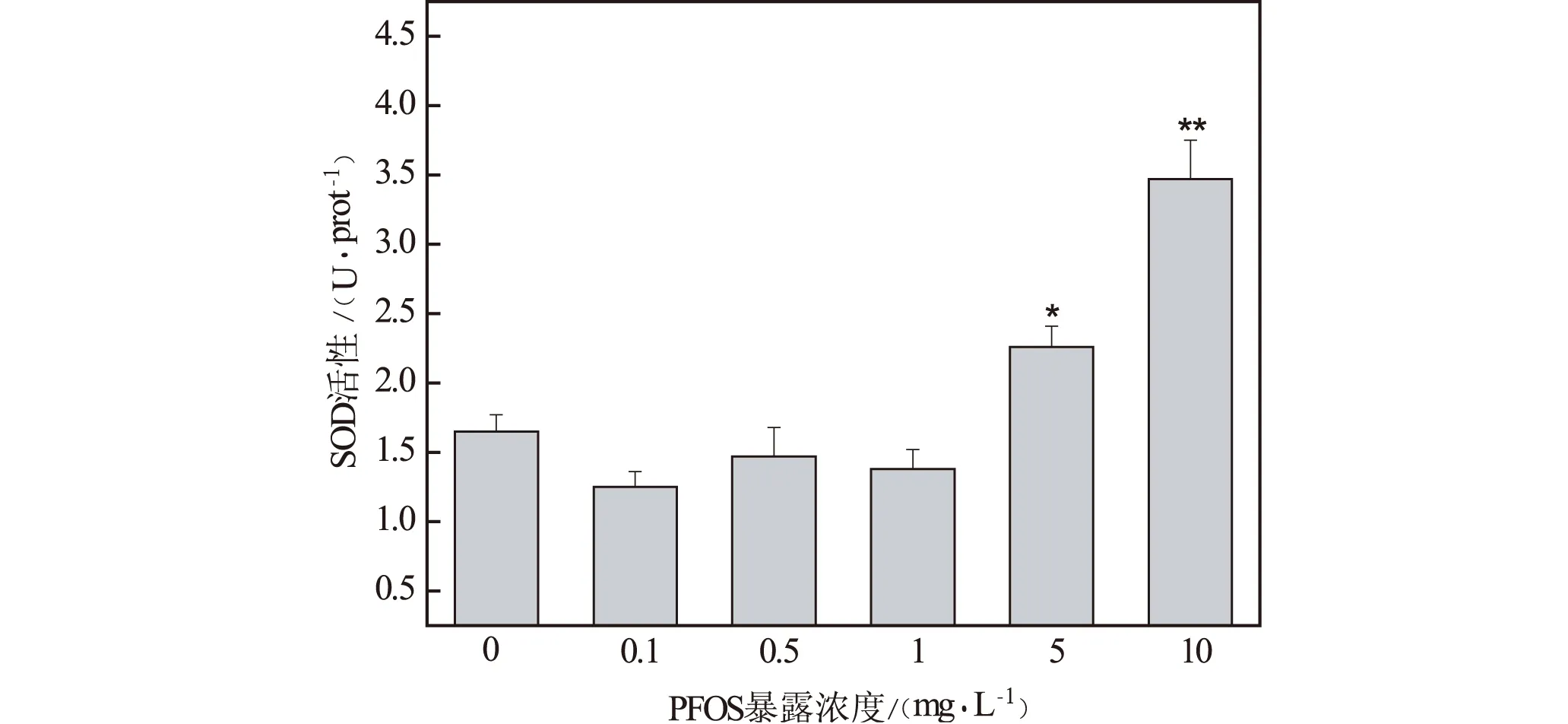
(注:*表示p<0.05;**表示p<0.01)图7 PFOS急性暴露对斑马鱼 胚胎SOD活性的影响

(注:*表示p<0.05)图8 PFOS急性暴露对斑马鱼 胚胎CAT活性的影响
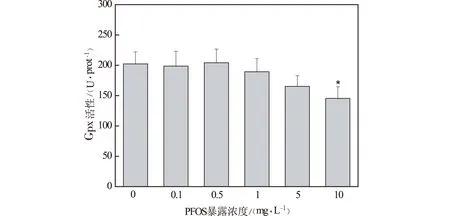
(注:*表示p<0.05)图9 PFOS急性暴露对斑马鱼 胚胎Gpx活性的影响
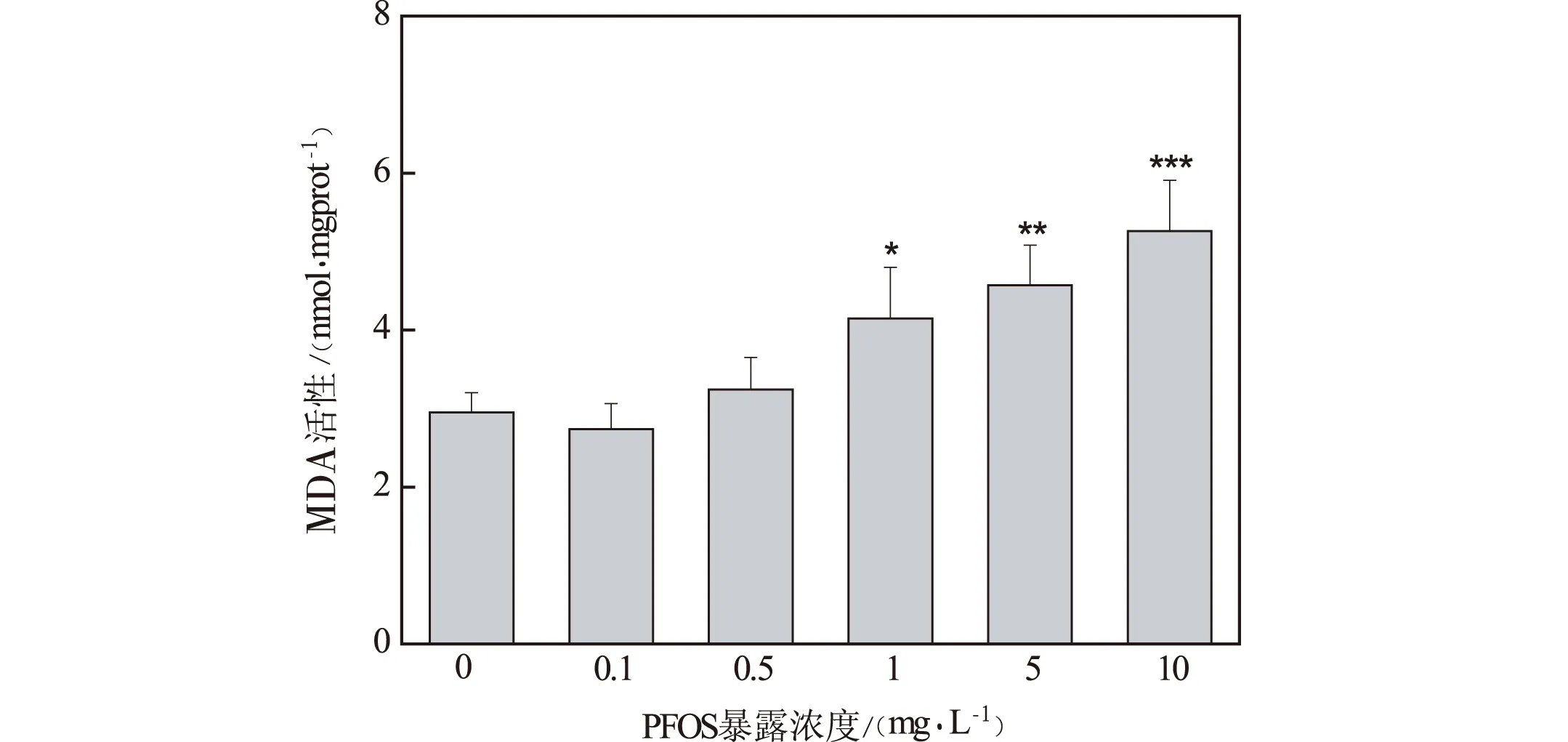
(注:*表示p<0.05;**表示p<0.01; ***表示p<0.001)图10 PFOS急性暴露对斑马鱼 胚胎MDA水平的影响
超氧化歧化酶(SOD)是一种源于生命体的活性物质,作为抗氧化系统的首道屏障能消除生物体中产生的有害物质。由图7可知,5 mg/L和10 mg/L暴露组SOD的活性显著增加(p<0.05),由对照组的1.65±0.12(U/prot)分别增加至2.26±0.15(U/prot)和3.47±0.28(U/prot)。表明5 mg/L和10 mg/L暴露组胚胎体内的自由基含量增加,SOD活性被显著诱导以抵御增加的自由基,使机体免受氧化损伤。过氧化氢酶(CAT)存在于红细胞及某些组织内的过氧化体中,它的主要作用就是催化H2O2分解为H2O与O2,使H2O2不与O2在铁螯合物作用下反应生成非常有害的-OH。由图8可知,与对照组相比,5 mg/L和10 mg/L暴露组CAT的活性显著降低(p<0.05),由对照组的2.95±0.12(U/prot)分别降低至2.37±0.15(U/prot)和2.42±0.28(U/prot)。杜佳的研究与本研究得到了一致性的结论,即PFOS急性暴露能够导致胚胎SOD活性增加、CAT活性降低[8]。
谷胱甘肽过氧化物酶(Gpx)是生物体内重要的非酶抗氧化剂。在外源物质的刺激下,Gpx会被诱导,有效地清除生理性的或病理性的氧自由基,同时作为必需的辅助因子参与Gpx相关酶调控氧化应激的状态[9]。由图9可知,PFOS暴露组胚胎Gpx活性与对照组相比基本呈现降低的趋势,10 mg/L暴露组降低显著(p<0.05),由对照组的202.36±19.87(U/prot)降低至145.43±19.24(U/prot)。这表明,经PFOS处理后斑马鱼胚胎的非酶抗氧化能力下降。丙二醛(MDA)是脂质过氧化的重要产物之一,其含量变化可以反映出机体内脂质过氧化的程度,从而间接地反映出细胞损害的程度,对于鱼类模型而言,MDA常作为环境污染物毒性效应的敏感指示物。由图10可知,0.1 mg/L暴露组MDA水平较对照组有数量上的降低但差异不显著。0.5~10 mg/L暴露组,随着暴露浓度的增加,MDA水平升高,呈现依赖关系。其中1 mg/L,5 mg/L和10 mg/L暴露组MDA水平较对照组显著增加(p<0.05),由对照组的2.95±0.25(nmol/mgprot)分别增至4.15±0.65(nmol/mgprot),4.57±0.51(nmol/mgprot)和5.26±0.65(nmol/mgprot)。这表明PFOS能够导致胚胎的脂质过氧化。袁璐瑶研究了PFOS对斑马鱼肝脏与肌肉的氧化应激反应,10 mg/L暴露组的肝脏与肌肉中MDA水平极显著增加[10],这与本研究得出了相似的结论。
3 结论
(1)PFOS急性暴露对斑马鱼胚胎产生发育毒性,表现为存活率降低、畸形率增加、心率加快以及孵化延迟。
(2)PFOS急性暴露导致胚胎抗氧化系统发生变化,SOD活性增加,CAT与Gpx活性降低,同时MDA水平增加,表明PFOS诱发胚胎发生了氧化应激反应。
[1] Solla S R, Silvaa O D, Letcher R J. Highly elevated levels of perfluorooctane sulfonate and other perfluorinated acids found in Biota and surface water downstream of an international airport, Hamilton, Ontario, Canada[J]. Environmental International,2012,39(1):19-26.
[2] 王亚韡,蔡亚岐,江桂斌.斯德哥尔摩公约新增持久性有机污染物的一些研究进展[J].中国科学,2010,40(2):99-123.
[3] Shi X J, Liu C S, Wu G Q, et al. Waterborne exposure to PFOS causes disruption of the hypothalamus-pituitary-thyroid axis in zebrafish larvae[J]. Chemosphere,2009,77,1010-1018.
[4] 任东凯,苏红巧,刘芃岩,等.全氟辛烷磺酸(PFOS)及其替代品对两栖类胚胎的发育毒性[J].生态毒理学报,2012,7(5):561-564.
[5] Chen T, Zhang L, Yue J Q, et al. Prenatal PFOS exposure induces oxidative stress and apoptosis in the lung of rat off-spring[J]. Reproductive Toxicology,2012,33:538-545.
[6] 夏继刚,牛翠娟,孙麓垠.PFOS对斑马鱼胚胎及仔鱼的生态毒理效应[J].生态学报,2013,33(23):7408-7416.[7] 胡芹.全氟辛烷磺酸(PFOS)对斑马鱼胚胎发育及成鱼的毒性效应研究[D].武汉:华中农业大学,2009.
[8] 杜佳,王树涛,刘征,等.全氟辛烷磺酸钾(PFOS)和纳米氧化锌(Nano-ZnO)单独与联合暴露对斑马鱼胚胎的氧化损伤和细胞凋亡的影响[J].生态毒理学报,2015,10(3):238-247.
[9] Ferrari A, Anguiano L, Lascano C, et al. Changes in the antioxidant metabolism in the embryonic development of the common South American toad Bufo arenarum: differential responses to pesticide in early embryos and autonomous-feeding larvae[J]. Journal of Biochemical and Molecular Toxicology.2008,22(4):259-267.[10] 袁璐瑶.全氟辛烷磺酸(PFOS)对斜生栅藻和斑马鱼生理生化指标的影响[D].上海:上海海洋大学,2015.
(责任编校:李秀荣)
On the Effect of PFOS on Developmental Toxicity and Oxidative Stress in Zebrafish Embryos
ZHAO Xue-song, REN Xin, DUAN Xiao-yue, LUO Zhou-ying, ZHU Rong
(School of Environmental Science and Engineering, Jilin Normal University, Siping 136000, China)
This paper is aimed at studying the effect of PFOS on developmental toxicity and oxidative stress in zebrafish embryos. In the experiments done by the authors, the zebrafish embryos were exposed to PFOS(0.1 mg/L,0.5 mg/L,1 mg/L,5 mg/L,10 mg/L), and acute developmental toxicity indexes at different hours after fertilization(24 hpf,48 hpf,72 hpf,96 hpf,120 hpf)were collected, including survial rate, malformation rate, heart rate and hatching rate. At the end of 120 hpf exposure, the changes in antioxidant enzyme activity were examined, including superoxide dismutase (SOD), catalase (CAT), glutathione peroxidase (Gpx) and lipid peroxidation Oxide (MDA). The results indicate that PFOS tends to decrease the survival rate of embryos and larvae, increase the rate of malformation, speed up the heart rate and delay the hatching. They also show that the activities of SOD and MDA in the embryo increase and those of CAT and Gpx decrease, indicating that PFOS can induce the acute developmental toxicity of zebrafish embryos, affect the antioxidant system and lead to embryonic oxidative stress.
perfluorooctanesul phonic acid potassium salt(PFOS); zebrafish embryos; development; oxidative stress
国家自然科学基金项目(21507039);吉林省教育厅“十三五”科学技术研究项目(吉教科合字[2016]第227号)
赵雪松(1983-),女,吉林双辽人,讲师,博士,主要从事环境毒理学研究。
X171.5
A
1672-349X(2016)06-0012-05
10.16160/j.cnki.tsxyxb.2016.06.004

