响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性
千春录,侯顺超,殷健东,林 晨,刘 笑,顾 林,金昌海,陈学好,李良俊,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.扬州大学园艺与植物保护学院,江苏 扬州 225009;3.扬州大学水生蔬菜研究室,江苏 扬州 225009)
响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性
千春录1,侯顺超1,殷健东1,林 晨1,刘 笑1,顾 林1,金昌海1,陈学好2,3,李良俊2,3,*
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.扬州大学园艺与植物保护学院,江苏 扬州 225009;3.扬州大学水生蔬菜研究室,江苏 扬州 225009)
以水芹为试材,采用超声波辅助方法提取其黄酮,在单因素试验的基础上,利用响应面法优化超声波辅助提取水芹黄酮工艺,最后对水芹黄酮抗氧化活性进行评估。结果表明:最佳工艺条件为料液比1∶38(g/mL)、超声时间62 min、超声温度69 ℃、乙醇体积分数80%,在此条件下,水芹叶黄酮提取量为8.201mg/g(鲜质量),该结果与预测值8.238 mg/g接近,表明所建数学模型与实际情况拟合较好。水芹叶黄酮含量远高于茎秆,且都有较强的抗氧化能力,其中茎秆黄酮抗氧化能力强于叶黄酮,这可能是茎秆和叶黄酮成分差异所致。
水芹;黄酮;超声提取;响应面法;抗氧化性
水芹(Oenanthe javanica)为伞形花科芹菜属2a生植物,富含抗坏血酸、维生素、膳食纤维、多酚、钙磷铁等多种矿质元素[1]。水芹的嫩茎和叶柄可作蔬菜食用[2],同时具有降血压、预防糖尿病、预防心脏病等病症的功能[3-7],是一种具有保健功能的药食同源蔬菜。水芹在国内多地都有分布,其栽培历史悠久,以中国的东部和南部居多,近年来在长江流域等地形成了特色的水芹产业,其栽培面积和消费量逐年增加。国内水芹主要用于鲜食,其功能成分分析和深加工需进一步研究。
黄酮类化合物普遍存在于植物体内,有调节生长、保护植物免受紫外线损伤的作用,且具有较高的抗氧化和清除自由基活性。黄酮类物质也是一种药用成分,可以抗癌、防癌,治疗心脑血管疾病,还可以降低血糖,增强非特异性免疫功能和体液免疫功能,以及具有抑制逆转录酶活性等广谱的药理活性,在药物资源上具有重要地位[8-11]。目前,黄酮类化合物提取方法主要有溶剂提取法、大孔吸附树脂法、超声波和微波辅助提取法、超临界流体提取法等[12-19]。超声波辅助提取操作方便、提取效率高、耗时短,已被广泛应用到各种黄酮类物质的提取,但在水芹黄酮提取中的应用鲜见报道。水芹含有多种生物活性物质,包括芹菜素及其糖苷、山奈酚、水蓼素、槲皮素及其糖苷、木犀草素等黄酮类物质以及咖啡酸、绿原酸等酚酸类物质[20-23]。水芹中黄酮类物质是水芹药用功能的活性物质,且含量较高[3-7,20-23],有效提取水芹黄酮类物质,是水芹深入开发的前提。本研究通过超声波辅助提取,利用单因素试验和响应面法分析对水芹黄酮提取工艺进行优化,并对水芹黄酮类物质抗氧化活性进行评价,以期为水芹功能成分分析和深加工提供理论依据。
1 材料与方法
1.1 材料与试剂
水芹(Oenanthe javanica (Bl.) DC. cv. Fuqin No. 1)宜兴市丰汇水芹专业合作社;乙醇、亚硝酸钠、硝酸铝、氢氧化钠、磷酸盐缓冲液、磷酸钠、钼酸铵、硫酸(H2SO4)、抗坏血酸(VC)(均为分析纯)国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司。
1.2 仪器与设备
BSA224S型电子天平 赛多利斯科学仪器(北京)有限公司;UV-7504c紫外-可见分光光度计 上海欣茂仪器有限公司;XH-2008D电脑智能温控低温超声波合成萃取仪 北京祥科技发展有限公司;HH-2数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 水芹黄酮的提取
将水芹叶和茎秆分开,每次准确称取水芹叶或茎秆2.000 g,加入1 mL的70%乙醇溶液碾磨成浆,加入一定体积分数的乙醇溶液,并调节料液比,置于超声萃取仪内,设定一定超声温度,水浴一定时间,期间进行超声波(功率60 W)辅助提取,将提取液减压抽滤,收集滤液,所得滤渣再次用前法提取,合并两次滤液,定容至100 mL,摇匀后测定黄酮的含量。
1.3.2 黄酮含量的测定
采用硝酸铝络合分光光度法测定黄酮含量[24]。
1.3.2.1 标准曲线的绘制
精确吸取芦丁标准溶液 0、0.50、1.00、2.00、3.00、4.00 mL,相当于芦丁0、75、150、300、450、600 μg移入10 mL刻度比色管中,加入80%乙醇溶液至4 mL,各加1 mL磷酸盐缓冲液和5%亚硝酸钠溶液0.3 mL,振摇后放置5 min,加入10%硝酸铝溶液0.3 mL,摇匀后放置6 min,加1.0 mol/L氢氧化钠溶液4 mL,用80%乙醇溶液定容至10 mL,混匀后放置10 min;以零管为空白,摇匀后用1 cm的比色杯在510 nm的波长处测定吸光度。由测定的吸光度和芦丁的标准含量,得到标准曲线Y=0.001 4X+0.013 6(X为芦丁质量/μg,Y为吸光度;R2=0.997 0)。
1.3.2.2 样品测定
准确吸取试样溶液1 mL,按上述标准曲线制作中的操作步骤,于510 nm波长处测定吸光度。根据标准曲线,求出试样吸光度相应的芦丁含量,按式(1)求出样品黄酮提取量:

式中:X1为样品的黄酮提取量/(mg/g);m1为依据标准曲线计算出待测液中黄酮含量/μg;V2为待测液的总体积/mL;m2为供试品取样量/g;V1为待测液移取的体积/mL。
1.3.3 单因素试验
1.3.3.1 料液比对黄酮提取量的影响
准确称取2.000 g水芹叶(茎秆),加入1 mL的70%乙醇溶液碾磨成浆,按1∶20、1∶25、1∶30、1∶35、1∶40(g/mL)的料液比分别加入70%乙醇溶液,在70 ℃条件下超声提取60 min后,抽滤得到提取液,定容至100 mL,测定黄酮含量。
1.3.3.2 超声时间对黄酮提取量的影响
准确称取2.000 g水芹叶(茎秆),加入1 mL的70%乙醇溶液碾磨成浆,按1∶35的料液比加入70%乙醇溶液,在70 ℃条件下,分别超声提取40、50、60、70、80 min后,抽滤得到提取液,定容至100 mL,测定黄酮含量。
准确称取2.000 g水芹叶(茎秆),加入1 mL的70%乙醇溶液碾磨成浆,按1∶35的料液比加入70%乙醇溶液,分别在50、60、70、80、90 ℃条件下,超声提取60 min后,抽滤得到提取液,定容至100 mL,测定黄酮含量。
1.3.3.4 乙醇体积分数对黄酮提取量的影响
准确称取2.000 g水芹叶(茎秆),加入1 mL的70%乙醇溶液碾磨成浆,按1∶35的料液比分别调整乙醇体积分数为50%、60%、70%、80%、90%,在70 ℃条件下超声提取60 min后,抽滤得到提取液,并定容至100 mL,测定黄酮含量。
1.3.4 响应面试验优化
采用Design-Expert 7.0.0软件中的Box-Behnken方法设计试验。根据单因素试验结果,选取料液比(A)、超声时间(B)、超声温度(C)3 个因素,以黄酮提取量为响应值,设计三因素三水平响应面优化试验。响应面试验各因素及水平见表1。由单因素试验可知水芹茎秆黄酮含量较低,且改变各因素条件其提取量变化不显著,所以用响应面法优化水芹叶黄酮的提取工艺。

表1 水芹叶黄酮提取响应面分析因素及水平Table 1 Variables and levels used in response surface design for fl avonoid extraction from Oenanthe javanica
1.3.5 总抗氧化能力的测 定
采用磷钼络合物法测定,配制终浓度为0.6 mol/L硫酸、28 mmol/L磷酸钠和4 mmol/L钼酸铵(16.5 mL硫酸、5.32 g磷酸钠、2.471 7 g钼酸铵,用蒸馏水溶解并定容至500 mL)的磷钼试剂。取不同质量浓度的样品溶液0.4 mL,加入4 mL磷钼试剂,置于95 ℃水浴锅90 min,在695 nm波长条件下测定其吸光度。用相同质量浓度的VC溶液作阳性对照,吸光度越高,总抗氧化活性越强。
1.3.6 DPPH自由基清除率的测定
有一天,老公下班回家看到我正和邻居大妈说这些,把这情景偷偷摄了下来。晚上,他拿出视频给我看。看着视频里的自己,我觉得好陌生。他说:“我一直觉得你知书达理,现在怎么会变成这样?”我自己也呆住了。
取不同质量浓度梯度的样品溶液3 mL,加入1 mL用无水乙醇配制的DPPH溶液,振荡混匀后置于暗处,室温条件下反应30 min,用无水乙醇调零,在517 nm波长条件下测定吸光度为Ax;空白组为用3 mL无水乙醇代替样品溶液,其余处理同上,在517 nm波长条件下测定吸光度为A0;对照组为1 mL无水乙醇代替DPPH溶液,其余处理同上,在517 nm波长条件下测定吸光度为Ax0;并以相同质量浓度的VC水溶液做对照,清除率按式(2)计算[25]:
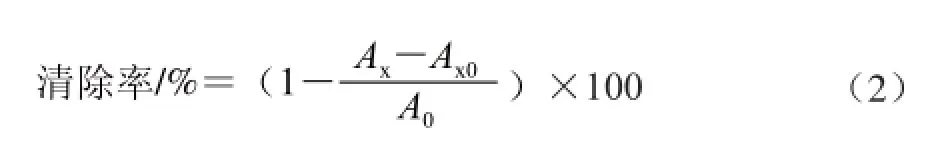
1.4 数据分析
应用SPSS 16.0统计软件进行方差分析,差异显著性测定采用Tukey多重比较法。
2 结果与分析
2.1 单因素试验结果

图1 料液比(a)、超声时间(b)、超声温度(c)、乙醇体积分数(d)对黄酮提取量的影响Fig. 1 Effect of solid-to-liquid ratio (a), ultrasonic time (b), temperature (c) and ethanol concentration (d) on fl avonoid yield
溶剂用量增加有利于黄酮物质溶解析出,但随溶剂用量增加,其对提取量增加效果减小,同时增加提取成本。由图1a可知,随着溶剂用量的增加,水芹叶黄酮提取量增加,在料液比1∶35时达到最大值,此后随着提取溶剂用量继续增大,水芹叶黄酮提取量不再增大。水
芹茎秆黄酮含量较低,其提取量随溶剂的比例增加而提高,在料液比1∶25时达到最大,但与其他料液比的水芹茎秆黄酮提取量差异不显著。
超声波能产生强烈空化效应和搅拌作用,从而增加溶剂穿透力,加速溶质析出,从而提高提取效率。由图1b可知,随着超声时间的延长,水芹叶黄酮提取量增加,在时间达到60 min时达到最大值,此后呈下降趋势。水芹茎秆黄酮提取量在50 min时达到最大值,但与其他超声时间的水芹茎秆黄酮提取量差异不显著。
超声温度升高可加快分子扩散速率,从而促进黄酮类物质析出,然而超声温度过高也会破坏部分黄酮的结构并增加其他非黄酮物质析出,影响黄酮活性和提取率。由图1c可知,随着超声温度升高,水芹叶黄酮提取量增加,当超声温度为70 ℃时水芹叶黄酮提取量达到最大值,超过70 ℃后显著(P<0.05)下降。水芹茎秆黄酮提取量也在70 ℃时达到最大,但与其他超声温度的水芹茎秆提取量差异不显著。
乙醇体积分数越高,其对组织细胞的穿透能力越强。由图1d可知,水芹叶黄酮在80%乙醇溶液中提取量达到最大值,水芹茎秆黄酮在60%乙醇溶液中提取量达到最大值,在一定乙醇体积分数范围内,叶和茎秆黄酮提取量变化不显著。
2.2 响应面试验结果
根据Box-Behnken响应面设计原理,在单因素试验基础上,确定乙醇为提取剂,以水芹叶黄酮提取量为响应值。响应面试验设计及结果见表2。
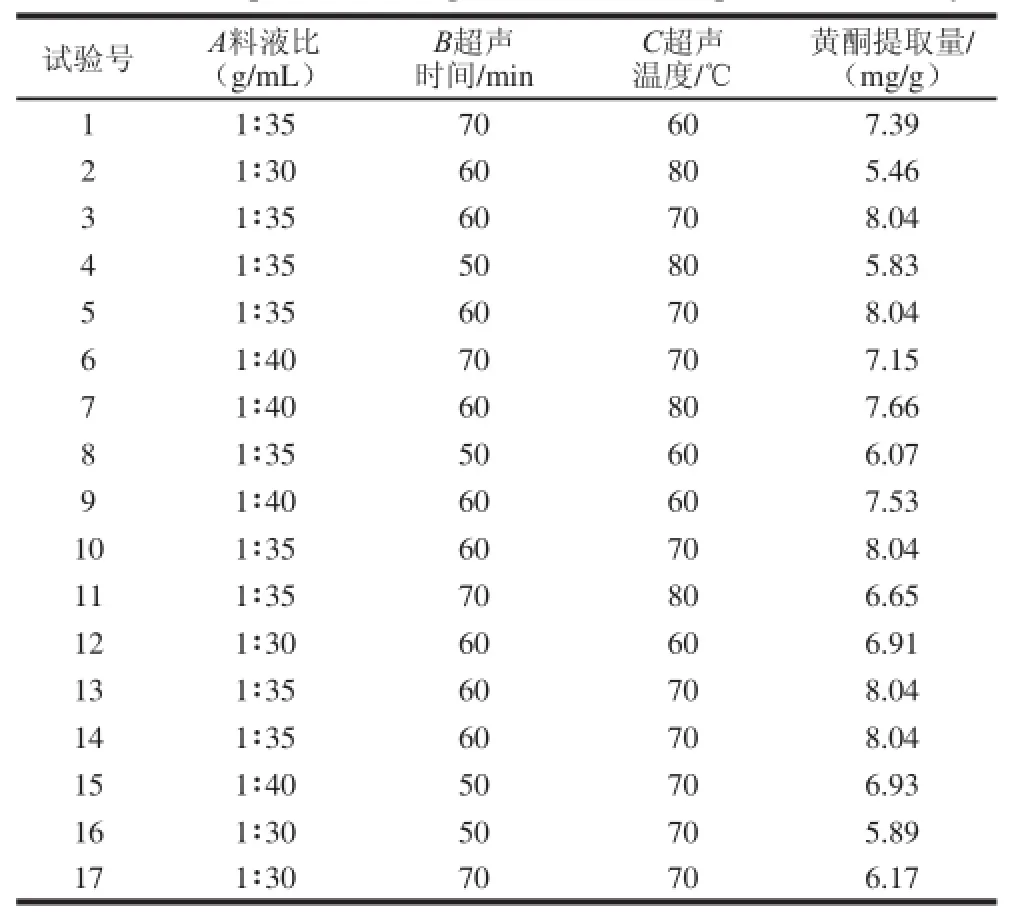
表2 响应面试验设计及结果Table 2 The experimental design and results for response surface analysis
采用响应面方法分析试验结果,得到以水芹叶黄酮提取量为响应值的回归方程:Y=8.044+0.61A+0.33B-0.29C-0.015AB+0.4AC-0.12BC-0.55A2-0.95B2-0.6C2。根据响应面分析建立的数学模型,得到最佳提取工艺条件是:料液比1∶37.58、超声时间61.75 min、超声温度69.11 ℃。在此条件下水芹叶黄酮提取量的预测值为8.238 mg/g(鲜质量,下同)。验证预测值,当料液比1∶38、超声时间62 min、超声温度69 ℃、乙醇体积分数80%时,得到的水芹叶黄酮提取量为8.201 mg/g,验证结果与预测值非常接近,说明所建模型与实际情况拟合较好。由此得到的超声波辅助提取水芹黄酮的最佳工艺参数,在该工艺条件下提取水芹茎秆黄酮提取量为0.986 mg/g,该结果与单因素试验结果差别不大。
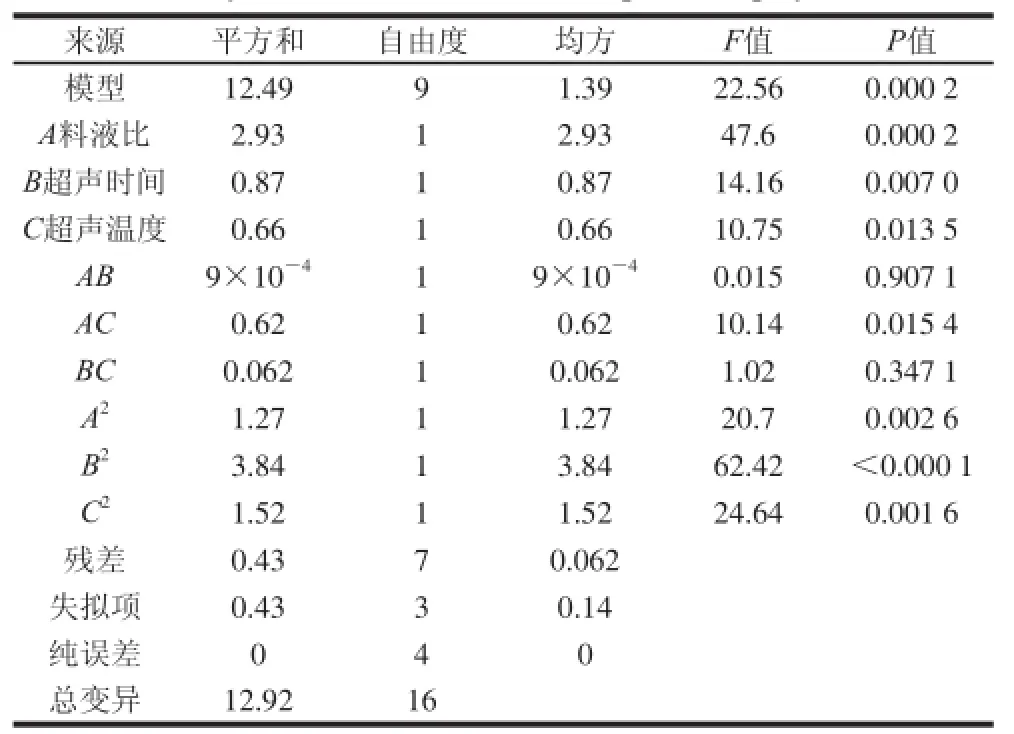
表3 回归模型的方差分析Table 3 Analysis of variance for the fi tted quadratic polynomial model

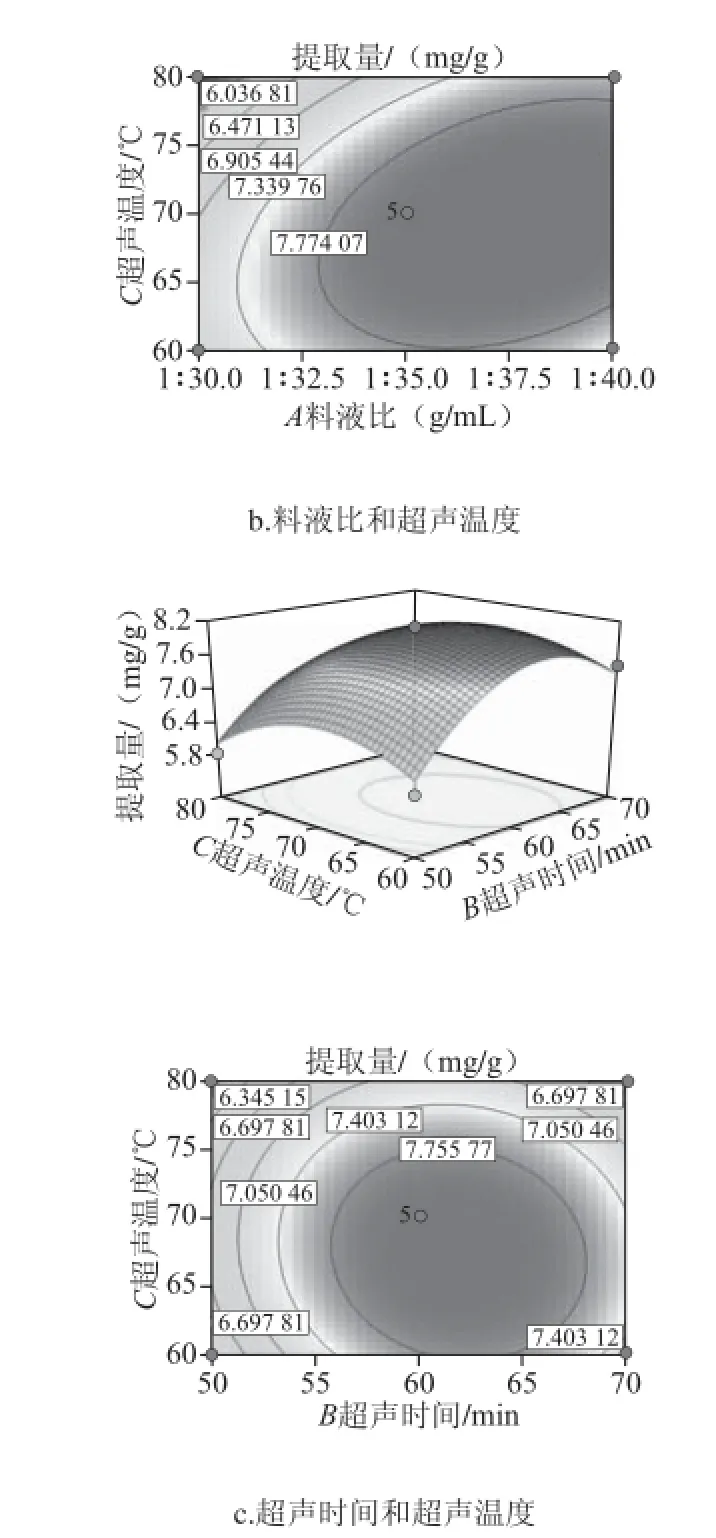
图2 各因素交互作用对黄酮提取量影响的响应面图Fig. 2 Response surface and corresponding contour plots showing the effect of solid-to-liquid ratio, ultrasonic time and extraction temperature on fl avonoid yield
由表3和图2可以看出,该模型P<0.01,为极显著,说明该回归方程与试验拟和程度较好。一次项A、B、C均达到显著水平;由3 个影响因素的F值大小可以得出,3个因素对水芹叶黄酮提取量影响大小的排序为:料液比>超声时间>超声温度。
2.3 抗氧化能力测定结果
由图3a可知,水芹黄酮的总抗氧化能力随其质量浓度增加逐步上升,表现出明显的量效关系,但明显低于VC的总抗氧化能力。水芹茎秆黄酮的总抗氧化能力要强于叶黄酮,可能是由于黄酮成分的差异所致。由图3b可知,水芹黄酮对DPPH自由基的清除作用随其质量浓度增加逐步上升,水芹茎秆黄酮对DPPH自由基清除能力要大于叶黄酮。当质量浓度达到35 mg/L时,叶黄酮对DPPH自由基的清除率达到82%,与VC对DPPH自由基的清除能力接近;茎秆黄酮对DPPH自由基的清除率达到90%,与VC对DPPH自由基的清除能力相当。
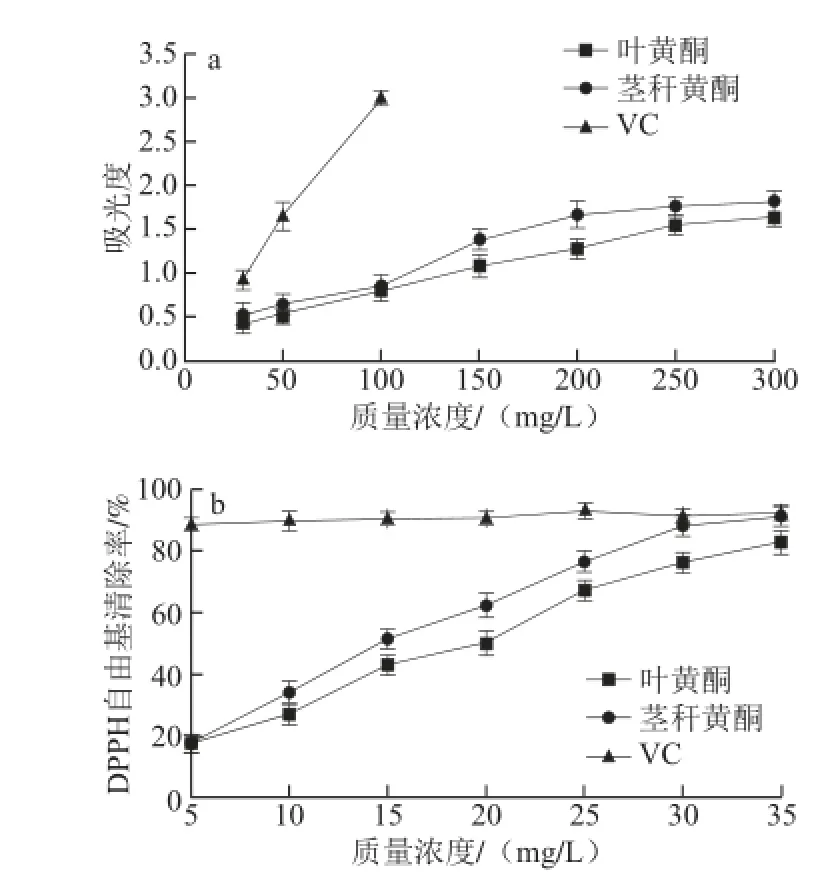
图3 水芹黄酮总抗氧化能力(a)和对DPPH自由基的清除能力(b)Fig. 3 Total antioxidant capacity (a) and DPPH-radical scavenging capacity (b) of fl avonoid from Oenanthe javanica
3 结 论
以水芹为试材,用超声波辅助法提取黄酮。单因素试验考察了料液比、超声时间、超声温度和乙醇体积分数4 个因素对水芹黄酮提取的影响。采用响应面优化试验条件,得到最佳工艺为料液比1∶38、超声时间62 min、超声温度69 ℃、乙醇体积分数80%,在此条件下水芹叶黄酮提取量为8.201 mg/g(接近预测值8.238 mg/g)。另外,水芹黄酮具有较强的抗氧化作用,在一定质量浓度范围内,水芹黄酮对DPPH自由基具有较强的清除能力。水芹茎秆黄酮含量远低于叶,但是同质量浓度水芹茎秆黄酮的总抗氧化能力和对DPPH自由基的清除能力要高于水芹叶黄酮。
[1] 周毅峰, 唐巧玉, 彭红, 等. 水芹菜多糖的提取及其成分分析[J]. 食品科学, 2012, 33(12): 138-142.
[2] 王雁, 江解增, 刘浩, 等. 湿栽水芹小叶和叶柄营养成分分析[J]. 中国蔬菜, 2007(11): 13-15.
[3] 李银姬, 朴惠善. 水芹的研究进展[J]. 延边医学院学报, 1996, 19(4): 243-245.
[4] 黄正明. 有关中草药水芹现代研究的若干探讨[J]. 世界华人消化杂志, 2001, 9(1): 1-5. DOI:10.3969/j.issn.1009-3079.2001.01.001.
[5] 黄正明, 杨新波, 曹文斌, 等. 中药水芹的药用研究[J]. 中国药理通讯, 2003, 20(1): 25-26.
[6] LEE C H, PARK J H, CHO J H, et al. Effect of Oenanthe javanica extract on antioxidant enzyme in the rat liver[J]. Chinese Medical Journal, 2015, 128(12): 1649-1654. DOI:10.4103/0366-6999.158363.
[7] YANG X B, HUANG Z M, CAO W B, et al. Antidiabetic effect of Oenanthe javanica flavone[J]. Acta Pharmacologica Sinica, 2000, 21(3): 239-242. DOI:10.1108/17488840610675555.
[8] YAMADA Y, HASHIMOTO T. Secondary products from tissue culture[J]. Applications of Genetic Engineering to Crop Improvement, 1984, 10: 561-604.
[9] 张德权, 台建祥, 付勤. 生物类黄酮的研究及应用概况[J]. 食品与发酵工业, 1999, 25(26): 52-56.
[10] 胡春. 黄酮类化合物的抗氧化性质[J]. 中国油脂, 1996, 21(4): 18-21.
[11] 谷利伟, 翁新楚. 食用天然抗氧化剂研究进展[J]. 中国油脂, 1997, 22(3): 37-40.
[12] 欧阳平, 张高勇, 康保安. 类黄酮提取的基本原理、影响因素和传统方法[J]. 中国食品添加剂, 2003(5): 54-57.
[13] LIU W, YU Y, YANG R, et al. Optimization of total flavonoid compound extraction from Gynura medica leaf using response surface methodology and chemical composition analysis[J]. Molecular Science, 2010, 11: 4750-4763. DOI:10.3390/ijms11114750.
[14] PRASAD K N, KONG K W, RAMANAN R N, et al. Determination and optimization of flavonoid and extract yield from brown mango using response surface methodology[J]. Separation Science and Technology, 2012, 47: 73-80. DOI:10.1080/01496395.2011.606257.
[15] KONG K W, ISMAIL A R, TAN S T, et al. Response surface optimization for the extraction of phenolics and fl avonoids from a pink guava puree industrial by-product[J]. International Journal of Food Science and Technology, 2010, 45: 1739-1745. DOI:10.1111/j.1365-2621.2010.02335.x.
[16] MOHAMMAD A, ELHAM K. Medicinal uses and chemistry of fl avonoid contents of some common edible tropical plants[J]. Journal of Paramedical Science, 2013, 4(3): 119-138.
[17] 陈况况, 帕塔尔·尼牙孜, 章宏慧, 等. 响应面法优化水芹黄酮提取工艺及其成分研究[J]. 中国食品学报, 2014, 14(11): 83-89.
[18] 何文兵, 夏光辉, 刘欢, 等. 野生水芹总黄酮提取工艺优化及抗氧化活性[J]. 北方园艺, 2015(1): 122-127.
[19] TANG Q Y, ZHOU Y F. Extraction processing of total flavonoids from Oenanthe javanica using accelerated solvent extraction method[J]. Food Science, 2010, 31(22): 190-193.
[20] CHOONG J M, KI Y L, EUN J J, et al. Persicarin from water dropwort (Oenanthe javanica) protects primary culturedrat cortical cells from glutamate-induced neurotoxicity[J]. Phototherapy Research, 2010, 24: 913-918. DOI:10.1002/ptr.3065.
[21] HEEJUNG C, YANGHEE Y, KWONTACK H, et al. Isolation and identifi cation of compound from dropwort (Oenanthe javanica) with protective potential against oxidative stress in HepG2cells[J]. Food Science and Biotechnology, 2011, 6(20): 1743-1746. DOI:10.1007/ s10068-011-0240-1.
[22] HWANG S J, PARK S J, KIM J D. Component analysis and antioxidant activity of Oenanthe javanica extracts[J]. Korean Journal of Food Science and Technology, 2013, 45(2): 227-234. DOI:10.9721/ KJFST.2013.45.2.227.
[23] HWANG C R, HWANG I G, KIM H Y, et al. Antioxidant component and activity of dropwort (Oenanthe javanica) ethanol extract[J]. Journal of the Korean Society of Food Science and Nutrition, 2011, 40(2): 316-320. DOI:10.3746/jkfn.2011.40.2.316.
[24] KIM D O, JEONG S W, LEE C Y. Antioxidant capacity of phenolic phytochemicals from various cultivars of plums[J]. Food Chemistry, 2003, 81(3): 321-326. DOI:10.1016/S0308-8146(02)00423-5.
[25] LAÇINE A, ERDI K, YASIN A, et al. Free radical scavenging activity, total phenolic content, total antioxidant status, and total oxidant status of endemic Thermopsis turcica[J]. Saudi Journal of Biological Science, 2013, 20: 235-239. DOI:10.1016/j.sjbs.2013.02.003.
Optimization of Ultrasonic-Assisted Extraction of Flavonoids from Oenanthe javanica and Their Antioxidant Activity
QIAN Chunlu1, HOU Shunchao1, YIN Jiandong1, LIN Chen1, LIU Xiao1, GU Lin1, JIN Changhai1, CHEN Xuehao2,3, LI Liangjun2,3,*
(1. College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, China; 2. School of Horticulture and Plant Protection, Yangzhou University, Yangzhou 225009, China; 3. Laboratory of Aquatic Vegetable, Yangzhou University, Yangzhou 225009, China)
This study aimed to optimize the ultrasonic-assisted extraction of flavonoids from Oenanthe javanica using single-factor experiments and response surface methodology. The antioxidant activity of the extracted flavonoids was evaluated. The optimal extraction conditions were determined as follows: the time of ultrasonic-assisted extraction, 62 min; temperature, 69 ℃; solid-to-liquid ratio, 1:38 (g/mL); and ethanol concentration, 80%. Under these conditions, the predicted and experimental extraction yield of fl avonoids from leaves was 8.238 and 8.201 mg/g mf, respectively. The good consistency indicated the mathematical model we built could fi t experimental data well. The content of fl avonoids in leaves of O. javanica was much higher than in stems. The fl avonoids extracted from both parts possessed high total antioxidant capacity and 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging ability and the fl avonoids from stems had stronger antioxidant ability than those in leave. This difference may be caused by the difference in the composition of fl avonoids extracted from stems and leaves.
Oenanthe javanica; fl avonoid; ultrasonic-assisted extraction; response surface methodology; antioxidant activity
10.7506/spkx1002-6630-201610013
S636.9
A
1002-6630(2016)10-0076-06
千春录, 侯顺超, 殷健东, 等. 响应面试验优化水芹黄酮超声波辅助提取工艺及其抗氧化性[J]. 食品科学, 2016, 37(10): 76-81. DOI:10.7506/spkx1002-6630-201610013. http://www.spkx.net.cn
QIAN Chunlu, HOU Shunchao, YIN Jiandong, et al. Optimization of ultrasonic-assisted extraction of flavonoids from Oenanthe javanica and their antioxidant activity[J]. Food Science, 2016, 37(10): 76-81. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610013. http://www.spkx.net.cn
2015-10-08
江苏省基础研究计划(自然科学基金)-青年基金项目(BK20140483);江苏省高校自然科学研究面上项目(14KJB210010);中国博士后科学基金面上项目(2014M560451);扬州大学科技创新培育基金项目(2014CXJ060)
千春录(1982—),男,讲师,博士,研究方向为食品科学。E-mail:clqian@yzu.edu.cn
*通信作者:李良俊(1969—),男,教授,博士,研究方向为水生蔬菜育种与开发。E-mail:ljli@yzu.edu.cn

