微波辅助提取澳洲坚果壳多糖的工艺优化及抗氧化性评价
杨申明,范树国,文美琼,王振吉*,谢 靖
(楚雄师范学院化学与生命科学学院,云南 楚雄 675000)
微波辅助提取澳洲坚果壳多糖的工艺优化及抗氧化性评价
杨申明,范树国,文美琼,王振吉*,谢 靖
(楚雄师范学院化学与生命科学学院,云南 楚雄 675000)
优化微波辅助提取澳洲坚果壳多糖的提取工艺,并测定其多糖的抗氧化性。在单因素试验的基础上,以多糖提取率为指标,通过L9(33)正交试验优化其多糖的提取工艺参数,并通过澳洲坚果壳多糖对•OH、1,1-苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和O2-•的清除来评价其抗氧化能力。结果表明,最佳提取工艺参数为微波功率200 W、微波时间2.5 min、料液比1∶50 (g/mL),在该条件下多糖的平均提取率为0.70%;多糖质量浓度为0.027 5 mg/mL时,对• OH、DPPH自由基和O2-•的清除率可分别达到63.11%、61.90%和80.09%,说明提取的澳洲坚果壳多糖对• OH、DPPH自由基和O2-•有较好的清除能力。
澳洲坚果壳;微波提取;多糖;抗氧化性
澳洲坚果属山龙眼科(Proteaceae)澳洲坚果属(Macadamia F. Muell.)多年生常绿果树[1-2]。在我国主要栽培地区是云南、广西,其中云南省是全国澳洲坚果栽培大省[3-4]。澳洲坚果营养丰富,经济价值很高,果仁
含有丰富的不饱和脂肪酸[5],同时还富含人体所需的可溶性总糖、淀粉、蛋白质、氨基酸和对人体有保健作用的Ca、Zn、Mg、Fe、Cu、Mn等矿物质,长期食用澳洲坚果可预防动脉粥样硬化、心血管疾病、降血糖、抗肿瘤、防癌症、抗衰老等多种疾病的发生[6-7]。
目前,国内外对澳洲坚果的研究多数集中在种植、病虫防治、生理生化、果仁成分营养、加工工艺等方面[6,8],而对澳洲坚果壳的研究相对较少。芦燕玲等[8]建立了微波萃取和顶空直接进样气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法对澳洲坚果壳的挥发性成分进行了分析研究,刘晓芳等[9-10]对澳洲坚果壳制备活性炭的工艺和澳洲坚果壳活性炭对重金属离子Cr(Ⅵ)的吸附特性进行研究,宁平等[11]对澳洲坚果壳活性炭制备的热解特性进行研究,石柳等[12]对澳洲坚果壳中纤维素和木质素成分进行了分析研究。其他有关澳洲坚果壳的研究鲜见报道,大部分澳洲坚果壳被当成燃料燃烧,甚至丢弃,既浪费了资源又给环境造成一定的污染。如果从果壳中提取其有效成分,既综合利用了资源,增加了澳洲坚果的附加值,又减少了环境的污染,具有一定的经济意义和价值。
近年来,植物多糖作为一种重要的功效成分,其应用范围正不断扩大,而对澳洲坚果壳中多糖类物质的提取和抗氧化性研究鲜见相关报道。本研究以澳洲坚果壳为材料,采用微波辅助提取澳洲坚果壳多糖,通过显色反应进行鉴定,并利用苯酚-浓硫酸比色法测定其含量,通过正交试验优化提取工艺参数,并对所提取的多糖从清除•OH、1,1-苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和O2-•的能力3 个方面评价其抗氧化性,这为更好地开发和利用澳洲坚果壳中多糖类物质提供了科学依据和参考。
1 材料与方法
1.1 材料与试剂
澳洲坚果壳:澳洲坚果产于云南德宏,手工剥壳后得澳洲坚果壳,备用。
葡萄糖标准品 天津市优谱化学试剂有限公司;DPPH 上海蓝季科技发展有限公司;抗坏血酸 昆山谱森实验室用品科技有限公司;其他所用试剂均为分析纯 天津市化学试剂厂。
1.2 仪器与设备
UV-2100紫外分光光度计 上海谱元仪器有限公司;G80F23CN3P-Q5(QO)型微波炉 广东格兰仕微波炉电器制造有限公司;CP224C电子天平 奥豪斯仪器上海有限公司;HH-S2型电热恒温水浴锅 金坛市大地自动化仪器厂;102型电热鼓风干燥箱 威瑞科教仪器有限公司。
1.3 方法
1.3.1 材料处理
将澳洲坚果壳置于60 ℃烘箱中烘干后,用粉碎机粉碎过60 目,得澳洲坚果壳干粉。将澳洲坚果壳干粉用滤纸包好,置索氏提取中,加入适量石油醚冷浸24 h,然后将其置于水浴中索氏提取,直到充分除去样品中脂类和脂溶性色素后,取出样品滤纸包风干至石油醚全部挥发,再将滤纸包置于60 ℃烘箱中烘干,得去除色素和油脂的澳洲坚果壳干粉,备用。
1.3.2 供试品溶液制备
准确称取1.00 g去除色素和油脂的澳洲坚果壳干粉,置于250 mL锥形瓶中,加入50 mL蒸馏水,在功率200 W的微波炉中提取2.5 min,减压抽滤,取上层清液,用Sevag法脱蛋白(氯仿与正丁醇的体积比为4∶1),激烈振荡10 min,转入分液漏斗中,静止至分层去除交界处的变性蛋白质和下层有机相,保留上层水相以4 000 r/min离心5 min,把脱蛋白处理液转移至50 mL容量瓶中,用蒸馏水定容,摇匀,得供试品溶液。
1.3.3 澳洲坚果壳多糖成分的鉴定
取1 mL供试品溶液3 份,分别加0.5 mL质量分数5%的苯酚溶液和2 mL浓硫酸溶液,1 mL质量分数0.5%的α-萘酚溶液和2 mL浓硫酸溶液,1 mL质量分数2%的蒽酮溶液和2 mL浓硫酸溶液,进行显色反应,观察实验现象,检识多糖化合物的有无[13]。
1.3.4 多糖含量测定
1.3.4.1 标准曲线制备
[14-15]的方法,略作改动。准确移取质量浓度1.00 mg/mL的葡萄糖标准溶液各0.0、0.5、1.0、1.5、2.0、2.5、3.0 mL于7 个50 mL的容量瓶中,用蒸馏水定容至刻度,摇匀,备用。再分别精密移取这7 种溶液2.0 mL置于7支25 mL的比色管中,依次精密加入1.0 mL新配制的5%苯酚溶液,摇匀,再缓慢加入5 mL浓硫酸,摇匀后置70 ℃水浴中加热15 min,取出冷却至室温,用2 mL蒸馏水按同样的操作作空白对照,用紫外分光光度计于波长490 nm处测定其吸光度,以吸光度(A)为纵坐标,葡萄糖标准溶液质量浓度(C,mg/mL)为横坐标绘制标准曲线。得回归方程A=15.424C+0.001 0,相关系数R=0.999 4。结果表明葡萄糖质量浓度在0.00~0.06 mg/mL范围内与吸光度呈良好的线性关系。
1.3.4.2 多糖提取率的测定
准确移取2.0 mL提取液于25 mL的比色管中,依次精密加入1.0 mL新配制的质量分数5%苯酚溶液,摇匀,再缓慢加入5 mL浓硫酸,摇匀后置70 ℃水浴中加热15 min,取出冷却至室温,用2 mL蒸馏水按同样的操作作空白对照,用紫外分光光度计于波长490 nm处测定其吸光度,平行测定3 次,取平均值。多糖提取率按式(1)计算:
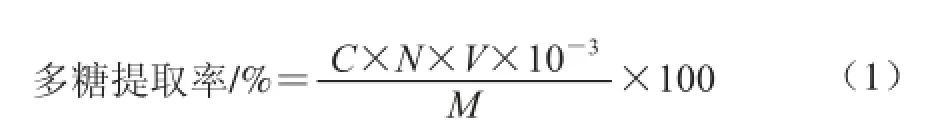
式中:C为多糖的质量浓度/(mg/mL);N为稀释倍数;V为提取液的定容体积/mL;M为澳洲坚果壳粉末的质量/g。
1.3.5 提取工艺单因素试验
在预试验的基础上,选水作为提取溶剂,微波法作为提取方法。分别考察以下单因素影响:1)选择微波功率分别为100、200、300、400、500 W的条件下进行比较,料液比1∶50(g/mL),微波时间2.5 min;2)确定了微波功率300 W提取效果较好后,分别在微波时间2.0、2.5、3.0、3.5、4.0 min的条件下进行提取,料液比1∶50(g/mL);3)确定了微波时间3.0 min提取效果较好后,分别在料液比1∶10、1∶20、1∶30、1∶40、1∶50 (g/mL)的条件下进行提取,微波功率300 W,从而确定各因素的影响作用。
1.3.6 正交试验设计
在单因素试验的基础上,以微波功率、微波时间、料液比为试验考察因素,以澳洲坚果壳多糖的提取率为评价指标,设计L9(33)正交试验优化提取条件,因素与水平设计见表1。

表1 正交试验因素与水平Table 1 Factors and levels used for orthogonal array experiments
1.3.7 澳洲坚果壳多糖抗氧化活性的测定
1.3.7.1 澳洲坚果壳多糖对•OH的清除作用
参考文献[16-17]的方法,稍作改动。分别配制0.005 5、0.011 0、0.016 5、0.022 0、0.027 5 mg/mL质量浓度的澳洲坚果壳多糖溶液,取1.0 mL于试管中,分别加9 mmol/L的硫酸亚铁溶液和9 mmol/L的水杨酸-乙醇溶液各2.0 mL,再加8.8 mmol/L的过氧化氢溶液2.0 mL,最后用蒸馏水定容至10 mL,在37 ℃水浴中恒温反应30 min后,在波长510 nm处测定吸光度,以蒸馏水作空白。同时,以VC作阳性对照,多糖提取液对•OH的清除率按式(2)计算:

式中:A0为空白对照液的吸光度;Ax为加H2O2提取液的吸光度;Ax0为不加H2O2提取液的本底吸光度。
1.3.7.2 澳洲坚果壳多糖对DPPH自由基清除作用
参考文献[18-19]的方法,稍作改动。向2.5 mL 2×10-4mol/L的DPPH-乙醇溶液中分别加入不同质量浓度(0.005 5、0.011 0、0.016 5、0.022 0、0.027 5 mg/mL)的澳洲坚果壳多糖提取液1.0 mL,混匀,在室温条件下反应30 min后在波长517 nm处测定吸光度Ai,同时测定2.5 mL 2×10-4mol/L的DPPH-乙醇溶液与1.0 mL乙醇溶液混合液的吸光度Ac,及2.5 mL无水乙醇与不同质量浓度(0.005 5、0.011 0、0.016 5、0.022 0、0.027 5 mg/mL)的澳洲坚果壳多糖提取液1.0 mL,混合液的吸光度Ab。同时,以VC作阳性对照,多糖提取液对DPPH自由基清除率按式(3)计算:
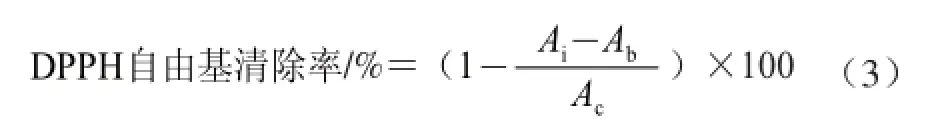
参考文献[20]的方法,稍作改动。在25 mL比色管中依次加入50 mmol/L Tris-HCl溶液(pH 8.2)4.5 mL,超纯水4.2 mL,混匀,在25 ℃水浴中恒温20 min后,加入25 ℃水浴中预热好的3 mmol/L邻苯三酚0.3 mL(以0.3 mL10 mmol/L的HCl溶液代替邻苯三酚作为空白对照),混匀后在325 nm波长处每隔30 s测1 次吸光度,直到5 min时停止。计算空白液的吸光度随时间的变化率F0。
依照上述方法,在5 支25 mL比色管中分别加入质量浓度0.005 5、0.011 0、0.016 5、0.022 0、0.027 5 mg/mL的澳洲坚果壳多糖提取液1.0 mL,再依次加入4.5 mL Tris-HCl溶液(pH 8.2),3.2 mL的超纯水,混匀,在25 ℃水浴锅中恒温20 min后,加入25 ℃水浴中预热好的3 mmol/L邻苯三酚溶液0.3 mL,混匀后在325 nm波长处每隔30 s测1 次吸光度,直到5 min时停止。计算对照液的吸光度随时间的变化率FX。同时,以VC作阳性对照,多糖提取液对•的清除率按式(4)计算:
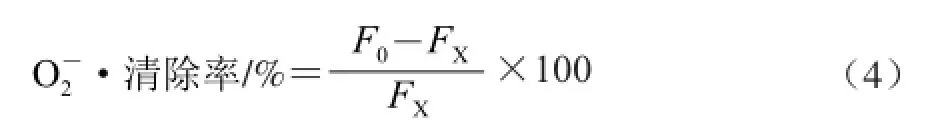
2 结果与分析
2.1 澳洲坚果壳多糖类化合物颜色反应检识
加质量分数5%的苯酚溶液和硫酸溶液,样品提取液呈橙黄色环;加质量分数0.5%的α-萘酚溶液和浓硫酸溶液,样品提取液呈紫色环;加质量分数2%的蒽酮溶液和浓硫酸溶液,样品提取液呈蓝绿色环。显色反应结果表明澳洲坚果壳的提取溶液中含有多糖类化合物。
2.2 澳洲坚果壳多糖提取单因素试验结果
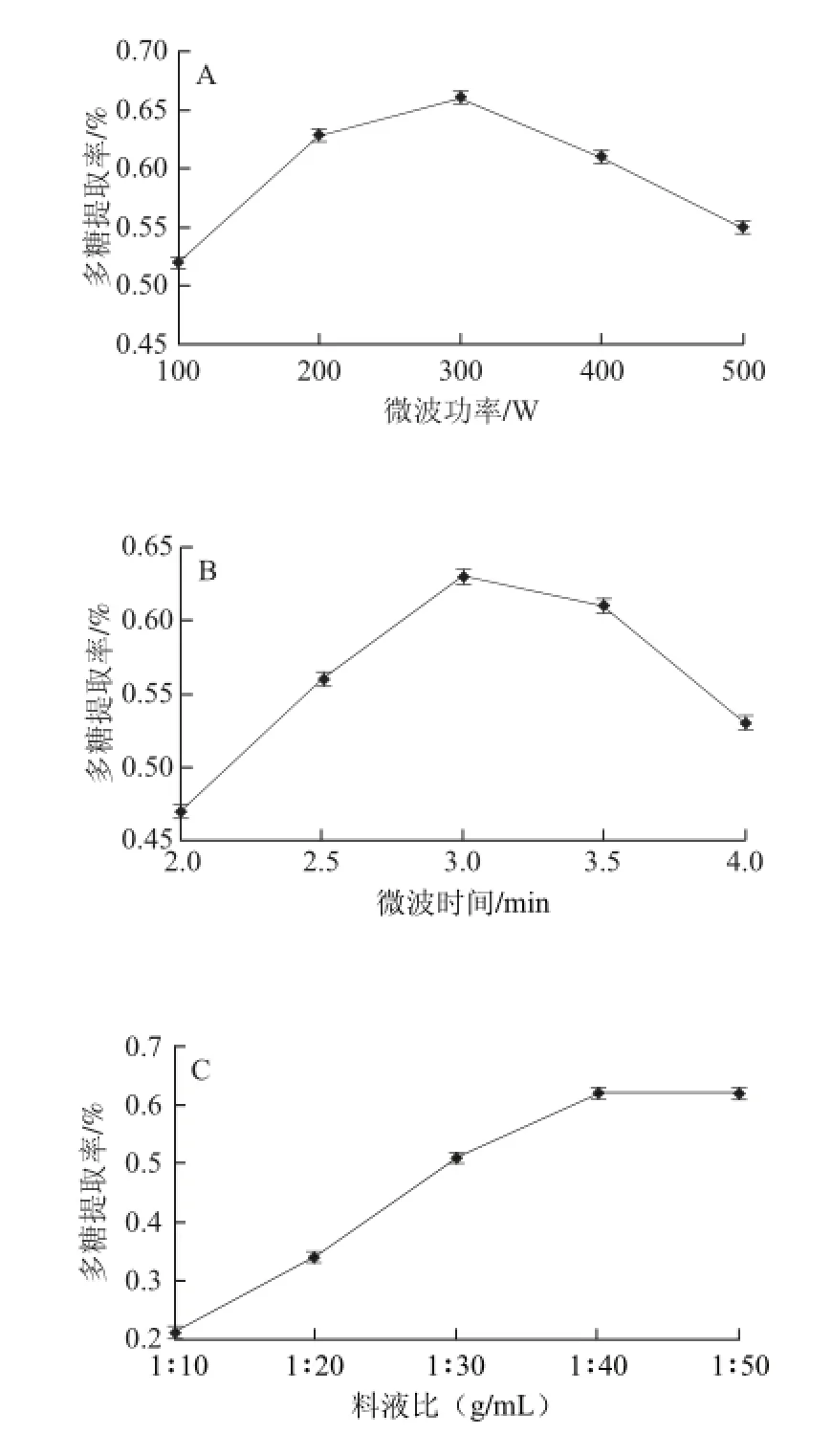
图1 微波功率(A)、微波时间(B)和料液比(CC)对多糖提取效果的影响Fig. 1 Effects of microwave power (A), microwave irradiation time (B) and solid/solvent ratio (C) on the extraction yield of polysaccharide
2.2.1 微波功率对澳洲坚果壳多糖提取效果的影响
在料液比1∶50(g/mL)、微波提取时间2.5 min的条件下,考察微波功率对澳洲坚果壳多糖提取效果的影响,结果见图1A。由图1A可知,开始随微波功率的增大,澳洲坚果壳多糖的提取率增大,当微波功率为300 W时,提取率最大,之后随微波功率的继续增大,提取率呈下降趋势。出现这种趋势的原因可能是当微波时间一定时,微波功率升高,物料吸收的微波热能随之增加,有效促进植物细胞的破碎,溶出物质增加;当微波功率增加达到一定水平后,会引起多糖降解,多糖提取率反而减小[21]。故选择微波功率200、300、400 W 3个水平进行正交试验。
2.2.2 微波时间对澳洲坚果壳多糖提取效果的影响
在料液比1∶50(g/mL)、微波功率300 W的条件下,考察微波时间对澳洲坚果壳多糖提取效果的影响,结果见图1B。由图1B可知,开始随微波时间的延长,多糖提取率逐渐增大,当微波提取时间为3.0 min时,提取率最大,之后再继续延长微波时间,提取率呈下降趋势。出现这种趋势的原因可能是较短时间内,微波对植物细胞壁及细胞膜的破坏作用大,导致细胞内物质大量溶出,多糖提取率显著提高;另一方面,随着细胞破碎程度越来越大,细胞中其他杂质的溶出也增加,多糖提取率反而下降[22]。故选择微波提取时间2.5、3.0、3.5 min 3个水平进行正交试验。
2.2.3 料液比对澳洲坚果壳多糖提取效果的影响
在微波功率300 W、微波时间3.0 min的条件下,考察料液比对澳洲坚果壳多糖提取效果的影响,结果见图1C。由图1C可知,开始随提取液用量的增大,多糖提取率逐渐增大,当料液比在1∶10~1∶40(g/mL)时,提取率上升很快,当料液比在1∶40~1∶50(g/mL)时,多糖提取率增长趋于缓慢。出现这种趋势的原因可能是对于一定量的澳洲坚果壳粉末,溶剂用量的增加可以增加固液接触面积和质量浓度差,有利于扩散速度的提高。当提取液用量继续增大,固液质量浓度差的增幅逐渐降低,多糖提取率的增加也趋于平缓,过多使用提取溶液会造成后续处理的难度和提高成本[23-24]。故选择料液比为1∶30、1∶40、1∶50(g/mL)3 个水平进行正交试验。
2.3 提取工艺参数优化正交试验结果
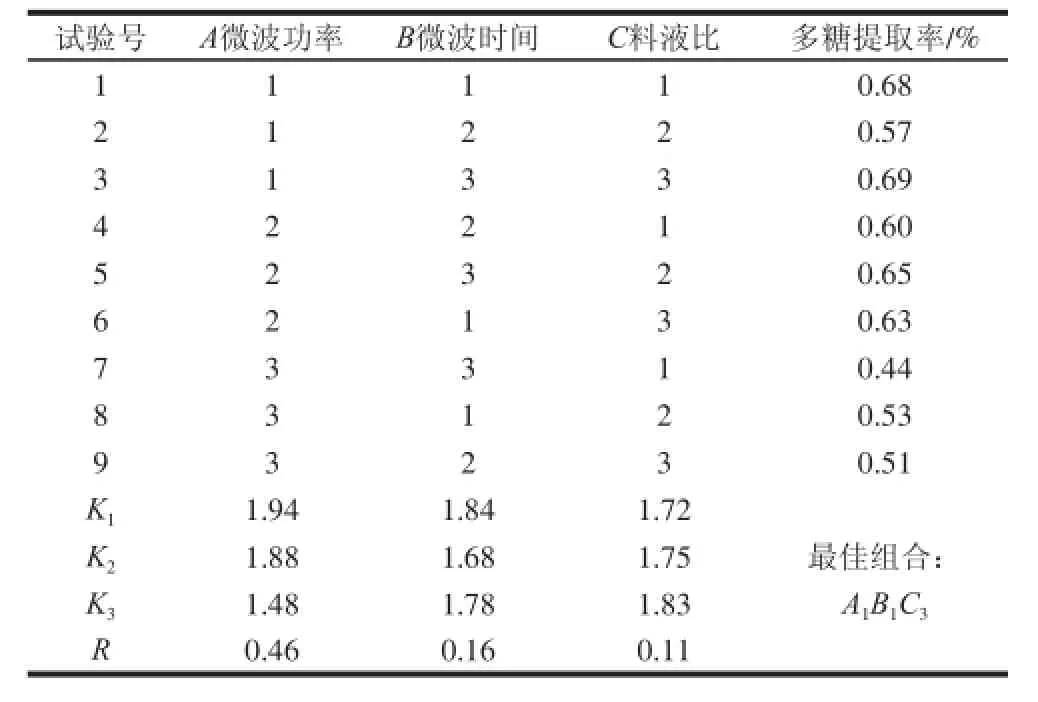
表2 正交试验设计及结果Table 2 Orthogonal array design with experimental results
从表2可知,不同因素对澳洲坚果壳多糖提取效果的影响程度不同,其影响的主次顺序为A(微波功率)>B(微波时间)>C(料液比)。由表2还可以得出,微波功率为显著影响因素,极差分析最佳组合为A1B1C3,即最佳提取工艺参数为微波功率200 W、微波时间2.5 min、料液比1∶50(g/mL)。在该工艺条件下进行验证性实验,测得澳洲坚果壳多糖平均提取率为0.70%,相对标准偏差为1.17%,表明该方法重复性良好,适合于澳洲坚果壳多糖的提取。
2.4 澳洲坚果壳多糖抗氧化性分析
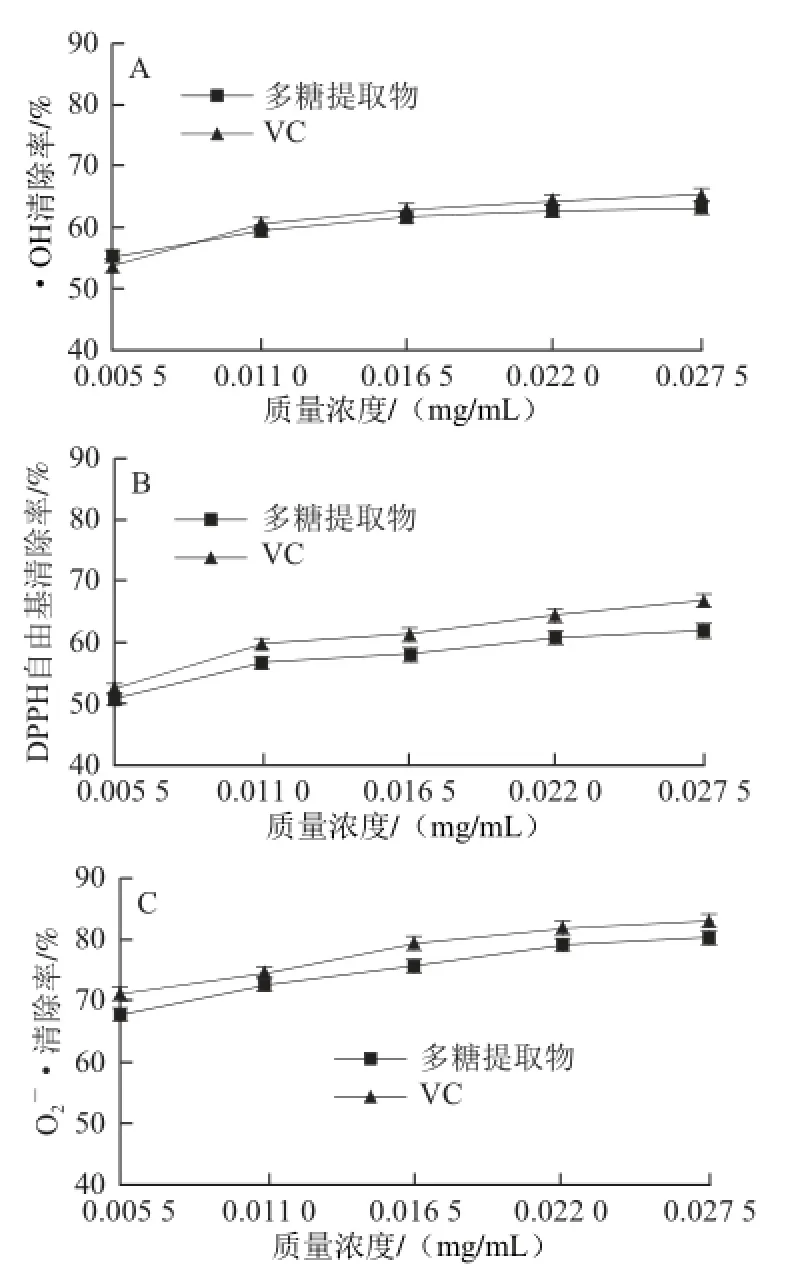
图2 澳洲坚果壳多糖对·OH(A)、DPPH自由基(BB)和OO-2•(CC)的清除作用Fig. 2 Scavenging effects of polysaccharides from Macadamia integrifolia shell on hydroxyl (A), DPPH (B) and superoxide anion (C) radicals
2.4.1 清除·OH的能力评价
·OH是目前已知活性氧中对生物体毒性最强、危害最大的一种自由基,可与细胞中的任何分子发生反应对机体造成损伤,清除·OH的能力是评价抗氧化物的重要指标[25-26]。从图2A可以看出,澳洲坚果壳多糖对由H2O2/ Fe2+体系通过Fenton反应产生的·OH具有清除作用,且随澳洲坚果壳多糖质量浓度的增加,其清除·OH的能力逐步增强,即清除率与多糖的质量浓度间存在一定的量效关系。在0.005 5~0.027 5 mg/mL范围内,当多糖质量浓度为0.0275 mg/mL时,·OH清除率最大为63.11%;质量浓度为0.005 5 mg/mL时,清除·OH的效果大于VC,表明澳洲坚果壳多糖具有较强的清除·OH的能力。
2.4.2 清除DPPH自由基的能力评价
DPPH是一种以氮为中心的稳定自由基,当待测物中含有抗氧化物时,抗氧化物能提供一个孤对电子与其配对结合,使DPPH的特征紫色逐渐变成黄色或消失,根据褪色程度的大小可间接评价其抗氧化剂的抗氧化性[27]。从图2B可以看出,随着澳洲坚果壳多糖质量浓度的增加,其清除DPPH自由基的能力逐步增强,即清除率与多糖的质量浓度间存在一定的量效关系。在0.005 5~0.027 5 mg/mL范围内,当多糖质量浓度为0.027 5 mg/mL时,DPPH自由基清除率最大为61.90%,虽然澳洲坚果壳多糖清除DPPH自由基的效果稍差于VC,但是澳洲坚果壳多糖依然表现出较强的清除DPPH自由基的能力,表明澳洲坚果壳多糖具有较好的抗氧化能力。
2.4.3 清除O2-•的能力评价
O2-•可通过邻苯三酚在碱性条件下发生自氧化产生,并生成有色中间产物,多糖能够抑制O2-•的形成,通过检测有色中间物的生成量,可测定多糖的清除能力。多糖能够与O2-•结合形成稳态自由基,终止自由基链反应,而发挥抗氧化作用[28-29]。从图2C可知,澳洲坚果壳多糖对由邻苯三酚自氧化体系所产生的O2-•有清除率作用,且随澳洲坚果壳多糖质量浓度的增加,其清除O2-•的能力逐步增强,即清除率与多糖的质量浓度间也存在一定的量效关系。在0.005 5~0.027 5 mg/mL范围内,当多糖质量浓度为0.027 5 mg/mL时,O2-•清除率最大为80.09%,而且清除O2-•的效果与VC很接近,表明澳洲坚果壳多糖具有很强的清除O2-•的能力。
3 结论与讨论
一般来说,单糖羟基多、极性大、易溶于水、难溶于低极性的有机溶剂,多糖则随着聚合度的增加,性质与单糖的差别越来越大,难溶于冷水,易溶于热水成胶体溶液。目前提取植物多糖的常用方法有:热水浸提法、酸浸提法、碱浸提法、酶法、超声提取、微波提取和超临界CO2等[30],本实验采用微波提取,微波法具有选择性强、省时快速、提取率高等特点。从植物中提取得到的多糖常含有较多的蛋白质,常用除蛋白质的方法有三氯乙酸沉淀法、Sevag法、蛋白酶水解法和鞣酸法等,本实验采用Sevag法除澳洲坚果壳多糖中的蛋白,Sevag法具有操作简便、速度快、损失小等特点。
正交试验结果表明,微波功率、微波时间、料液比对澳洲坚果壳多糖提取率的影响很大,影响程度由大到小依次为微波功率、微波时间、料液比,本实验优化的最佳提取工艺参数为微波功率200 W、微波时间2.5 min、料液比1∶50(g/mL)。在此工艺条件下进行验证实验,测得澳洲坚果壳多糖平均提取率为0.70%。该方法准确度高、重复性好,可用于澳洲坚果壳多糖提取和含量测定。
本研究结果表明,澳洲坚果壳中含有多糖类化合物,澳洲坚果壳多糖具有较强的体外抗氧化活性,相关研究结果对澳洲坚果壳多糖的提取及抗氧化活性成分的开发利用提供了理论依据,而其抗氧化活性成分及抗氧化作用机理还有待进一步的研究。
参考文献:
[1] 陆超忠, 肖邦森, 孙光明, 等. 澳洲坚果优质高效栽培技术[M]. 北京:中国农业出版社, 2000.
[2] DUXBURY D. Lipid scientists shake healthy macadamia nuttree[J]. Food Processing, 1995, 54(6): 83.
[3] 王文林, 陆超忠, 杜丽清, 等. 我国澳洲坚果的研究及发展[J]. 中国热带农业, 2008(3): 24-25. DOI:10.3969/ j.issn.1673-0658.2008.03.009.
[4] 匡湘鸾. 澳洲坚果在云南发展前景广阔[J]. 中国热带农业, 2007(4): 12. DOI:10.3969/j.issn.1673-0658.2007.04.006.
[5] 赵丽娟, 张捷利, 李铁纯. 攀枝花地区澳洲坚果中脂肪酸的气相色谱-质谱联用分析[J]. 时珍国医国药, 2008, 19(10): 2445-2446. DOI:10.3969/j.issn.1008-0805.2008.10.067.
[6] 刘建福, 黄莉. 澳洲坚果的营养价值及其开发利用[J]. 中国食物与营养, 2005(2): 25-26. DOI:10.3969/j.issn.1006-9577.2005.02.008.
[7] 杜丽清, 邹明宏, 曾辉, 等. 澳洲坚果果仁营养成分分析[J]. 营养学报, 2010, 32(1): 95-96.
[8] 芦燕玲, 李亮星, 魏杰, 等. 气质联用法分析澳洲坚果壳的挥发性成分[J]. 化学研究与应用, 2012, 24(3): 433-436. DOI:10.3969/ j.issn.1004-1656.2012.03.018.
[9] 刘晓芳, 王如阳, 叶艳青. 澳洲坚果壳制备活性炭的工艺研究[J].安徽农业科学, 2008, 36(26): 11186-11187. DOI:10.3969/ j.issn.0517-6611.2008.26.012.
[10] 刘晓芳, 刘满红, 张晓梅, 等. 澳洲坚果壳活性炭对Cr(Ⅵ)的吸附性能[J]. 云南民族大学学报(自然科学版), 2012, 21(3): 178-181. DOI:10.3969/j.issn.1672-8513.2012.03.006.
[11] 宁平, 杨月红, 彭金辉, 等. 澳洲坚果壳活性炭制备的热解特性研究[J]. 林产化学与工业, 2006, 26(4): 61-64. DOI:10.3321/ j.issn:0253-2417.2006.04.016.
[12] 石柳, 王金华, 熊智, 等. 澳洲坚果壳中纤维素和木质素成分分析[J]. 湖北农业科学, 2009, 48(11): 2846-2848. DOI:10.3969/ j.issn.0439-8114.2009.11.071.
[13] 何兰, 姜志宏. 天然产物资源化学[M]. 北京: 科学出版社, 2008: 124-125.
[14] 涂宗财, 李敏, 刘光宪, 等. 苯酚-硫酸法测定油菜花粉多糖含量的研究[J]. 食品工业科技, 2007, 28(4): 219-221. DOI:10.3969/ j.issn.1002-0306.2007.04.065.
[15] 刘敏, 郭丽梅, 张丽. 苯酚-硫酸法测定油松花粉多糖含量研究[J]. 时珍国医国药, 2010, 21(6): 1526-1528. DOI:10.3969/ j.issn.1008-0805.2010.06.110.
[16] 刘玉芬, 夏海涛. 响应面法优化碱蒿黄酮提取工艺及其体外抗氧化作用[J]. 食品科学, 2012, 33(12): 63-68.
[17] 鲁晓翔, 唐津忠. 紫背天葵中总黄酮的提取及其抗氧化性研究[J]. 食品科学, 2007, 28(4): 145-147. DOI:10.3321/ j.issn:1002-6630.2007.04.031.
[18] 王敏, 魏益民, 高锦明. 苦荞黄酮的抗脂质过氧化和红细胞保护作用研究[J]. 中国食品学报, 2006, 6(1): 278-283. DOI:10.3969/ j.issn.1009-7848.2006.01.059.
[19] SHE G M, XU C, LIU B, et al. Polyphenolic acids from mint (the aerial of Mentha haplocalyx Briq.) with DPPH radical scavenging activity[J]. Journal of Food Science, 2010, 75(4): 359-362. DOI:10.1111/j.1750-3841.2010.01603.x.
[20] 曹炜, 陈卫军, 索志荣, 等. 啤酒及其酚类提取物的抗氧化作用[J].西北大学学报, 2005, 35(1): 53-56. DOI:10.3321/j.issn:1000-274X.2005.01.014.
[21] 陈小梅, 甘纯玑, 陈彩玲, 等. 响应面法优化微波辅助提取浒苔多糖工艺[J]. 食品研究与开发, 2011, 32(4): 44-48. DOI:10.3969/ j.issn.1005-6521.2011.04.012.
[22] 杨颖, 孙文武, 周晨, 等. 响应曲面法优化玉竹水溶性多糖提取及体外抗氧化研究[J]. 食品与生物技术学报, 2013, 32(3): 298-306. DOI:10.3969/j.issn.1673-1689.2013.03.011.
[23] BENDAHOU A, DUFRESNE A, KADDAMI H, et a1. Isolation and structural characterization of hemicelluloses from palm of Phoenix dactylifera L.[J]. Carbohydrate Polymers, 2007, 68(3): 601-608.
[24] 王磊, 刘秀凤, 邱芳萍, 等. 微波辅助提取玉米须多糖及其组成的研究[J]. 食品与生物技术学报, 2009, 28(1): 72-75. DOI:10.3321/ j.issn:1673-1689.2009.01.015.
[25] 谢云涛, 马国平, 何玉凤, 等. BPR硫脲催化光度法对羟基自由基的检测及清除作用[J]. 化学通报, 2006(6): 458-461. DOI:10.3969/ j.issn.0441-3776.2006.06.021.
[26] 殷军, 葛青, 毛建卫, 等. 竹叶多糖的组成及抗氧化活性分析[J]. 食品工业科技, 2013, 34(2): 100-103.
[27] 张汇, 鄢嫣, 聂少平, 等. 黑灵芝不同部位多糖成分分析及抗氧化活性[J]. 食品科学, 2011, 32(1): 56-61.
[28] PAN Daodong, MEI Xiuming. Antioxidant activity of an exopolysaccharide purifi ed from Lactococcus lactis subsp. lactis 12[J]. Carbohydrate Polymers, 2010, 80(3): 908-914.
[29] 张兰杰, 王洪宽, 李铁纯, 等. 盘锦河蟹卵和蟹肉中脂肪酸成分分析及其对超氧阴离子自由基的抑制作用[J]. 食品科学, 2010, 31(5): 108-110.
[30] 李娜, 杨晓杰, 李旭业, 等. 植物多糖提取技术研究[J]. 高师理科学刊, 2012, 32(2): 86-89. DOI:10.3969/j.issn.1007-9831.2012.02.027.
Optimization of Microwave-Assisted Extraction of Polysaccharides from Macadamia integrifolia Shell and Evaluation of Their Antioxidant Activities
YANG Shenming, FAN Shuguo, WEN Meiqiong, WANG Zhenji*, XIE Jing
(School of Chemistry and Life Sciences, Chuxiong Normal University, Chuxiong 675000, China)
In this study, the microwave-assisted extraction of polysaccharides from Macadamia integrifolia shell was optimized, and the antioxidant properties of the extracted polysaccharides were determined. Optimization of extraction parameters for improved extraction effi ciency of polysaccharides was done using single factor experiment and an orthogonal array design L9(33). Meanwhile, the antioxidant activities were evaluated by hydroxyl, 1,1-diphenyl-2-picrylhydrazyl (DPPH) and superoxide anion free radical scavenging assays. The optimum extraction parameters were determined as follows: microwave power, 200 W; microwave irradiation time, 2.5 min; and solid-to-solvent ratio, 1:50 (g/mL). Under these conditions, the average extraction yield of polysaccharides was 0.70%. At a polysaccharide concentration of 0.027 5 mg/mL, the percentage scavenging of ·OH, DPPH free radical and O2-· were 63.11%, 61.90% and 80.09%, respectively, implying that these polysaccharides have good ability to scavenge ·OH, DPPH free radical and O2-·.
Macadamia integrifolia shell; microwave-assisted extraction; polysaccharide; antioxidant properties
10.7506/spkx1002-6630-201610004
TQ35
A
1002-6630(2016)10-0017-06
杨申明, 范树国, 文美琼, 等. 微波辅助提取澳洲坚果壳多糖的工艺优化及抗氧化性评价[J]. 食品科学, 2016, 37(10): 17-22. DOI:10.7506/spkx1002-6630-201610004. http://www.spkx.net.cn
YANG Shenming, FAN Shuguo, WEN Meiqiong, et al. Optimization of microwave-assisted extraction of polysaccharides from Macadamia integrifolia shell and evaluation of their antioxidant activities[J]. Food Science, 2016, 37(10): 17-22. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610004. http://www.spkx.net.cn
2015-08-12
国家自然科学基金青年科学基金项目(31300370);云南省重点建设学科基金项目(05YJJSXK03);云南省高校科技创新团队支持计划项目(IRTSTYN);楚雄师范学院教改项目(1510)
杨申明(1976—),男,实验师,学士,研究方向为天然有机产物化学。E-mail:ysm@cxtc.edu.cn
*通信作者:王振吉(1983—),男,副教授,博士,研究方向为天然产物化学。E-mail:wangzj@cxtc.edu.cn

