氨基酸的内源性合成限制了动物的生长、泌乳和繁殖(Ⅱ)
侯永清,姚康,印遇龙,,伍国耀,3
(1.动物营养与饲料科学湖北省重点实验室,动物营养与饲料安全湖北省协同创新中心,武汉轻工大学,湖北武汉430000;2中国科学院亚热带农业生态研究所,湖南长沙410000;3.德克萨斯农工大学动物科学系,美国德克萨斯州001210)
氨基酸的内源性合成限制了动物的生长、泌乳和繁殖(Ⅱ)
侯永清1,姚康2,印遇龙1,2,伍国耀1,3
(1.动物营养与饲料科学湖北省重点实验室,动物营养与饲料安全湖北省协同创新中心,武汉轻工大学,湖北武汉430000;2中国科学院亚热带农业生态研究所,湖南长沙410000;3.德克萨斯农工大学动物科学系,美国德克萨斯州001210)
中国猪营养国际论坛是由美国动物科学学会、上海亘泰实业集团和上海优久生物科技有限公司联合主办,以“凝聚全球科研力量,驱动猪业创新思维”为宗旨,力邀全球一流的机构、专家和学者,倾力打造一个动物营养领域具有国际性、前沿性和权威性的论坛。该论坛每两年举办一届,聚焦行业发展中的热点、难点,通过专家学者和企业领导者之间进行开放建设性的学术探讨、理论研究和实践经验交流,整合全球动物营养领域最新的技术和研究成果,推动行业发展,创造和提升产业价值。
www.asaschina.org
1 断奶动物的氨基酸代谢
断奶与肠功能紊乱、氨基酸代谢改变、哺乳动物生长减缓有关。植物性日粮和母乳在氨基酸组成上的主要区别在于(以干物质基础表示),前者具有更高含量的丙氨酸、精氨酸、组氨酸和甘氨酸,以及更低含量的支链氨基酸、谷氨酸、谷氨酰胺、赖氨酸、蛋氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸和酪氨酸。对于饲喂玉米-豆粕型饲料的断奶仔猪,日粮必需氨基酸,以及天冬酰胺、丝氨酸、丙氨酸均超出了蛋白质合成的需要,但日粮天冬氨酸、谷氨酸、甘氨酸、脯氨酸、精氨酸、谷氨酰胺并不能满足需要(表1)。
定量分析的结果表明,在断奶仔猪中,通过非蛋白质合成途径可供肠外利用的必需氨基酸的氮、碳总量,大大超过了用于合成氨基酸的量(表1)。根据血浆中精氨酸、天冬氨酸、谷氨酸、谷氨酰胺、亮氨酸、赖氨酸和脯氨酸的半衰期,14~35日龄仔猪每千克体重降解的速率是相同的。假定30日龄断奶仔猪和14日龄母乳喂养的仔猪每千克体重肠外氨基酸合成的速率不同,可用于肠外代谢的必需氨基酸和肠外组织合成的氨基酸之间碳、氮含量的巨大差异表明断奶仔猪氨基酸的内源性合成也被关键酶的活性所限制。因为蛋白质的高摄入量会导致肠功能紊乱和腹泻,这是由于肠道中过多的组氨酸产生的组胺导致的,故需要向断奶仔猪的日粮中直接补充可合成氨基酸。
一些证据表明,非必需氨基酸合成的量不足以使断奶仔猪达到最大生长(Mateo等,2007)。第一,低出生体重的仔猪口服(1 g/kg体重/d)谷氨酰胺可促进它们的存活和生长,特别是在应对内毒素的治疗上(Li等,2014)。第二,在早期断奶仔猪日粮中添加1%的谷氨酰胺可防止断奶后第一周的空肠绒毛萎缩,并且在断奶后第二周提高25%的饲料转化率(Gao等,2012)。第三,向断奶仔猪日粮中添加0%~4%的谷氨酸单钠剂量依赖性地促进空肠的生长、肠道的抗氧化能力增强、体重增加和饲料利用率提高,同时降低了腹泻率。第四,在无脯氨酸日粮中补充0%~2.1%的脯氨酸可增加仔猪69 g/d的体重和20%的饲料利用率,同时降低了血浆中50%的尿素浓度(Lassala等,2010)。在断奶仔猪的玉米-豆粕型饲料中补充1%的脯氨酸也得到了相同的结果(Lassala等,2011)。第五,在7~21日龄牛奶喂养的仔猪日粮中添加0.4%的精氨酸降低了血浆中35%的氨浓度,并增加66%的体重。第六,在断奶仔猪日粮中补充精氨酸可促进肠血管以及肠黏膜的生长并增强免疫能力(Jamin等,2009;Yao等,2008)。第七,在生长猪的日粮中补充1%的精氨酸可在增加5.5%的骨骼肌的同时降低11%胴体脂肪含量(Rezaei等,2013)。因此,断奶仔猪不能合成足够的精氨酸、谷氨酸、谷氨酰胺和脯氨酸以维持其最大生长或理想肠道健康。在大鼠中也报道有类似的研究结果(Sevastiadou等,2011)。
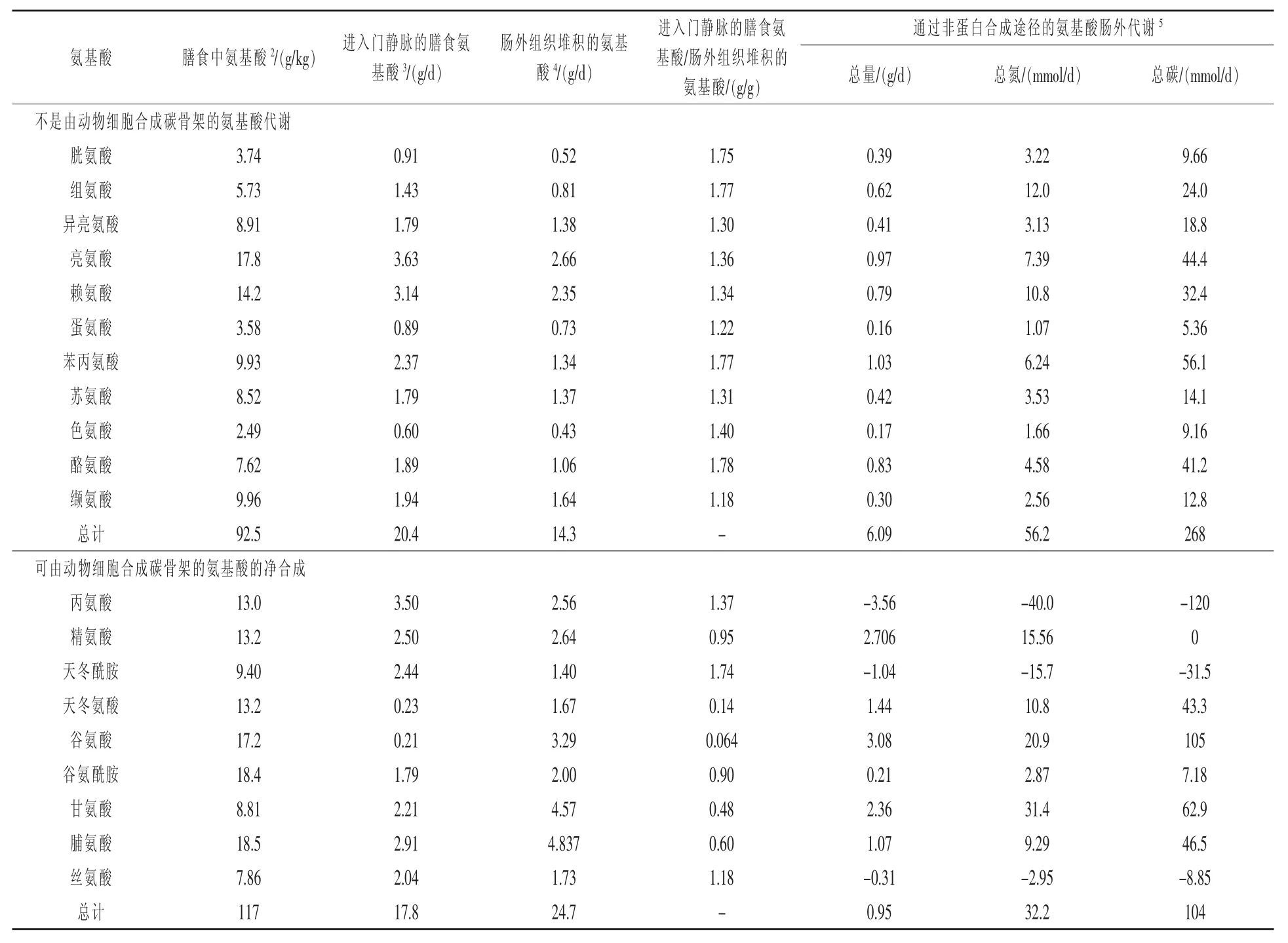
表1 断奶第21天的30日龄仔猪的氨基酸代谢1
2 妊娠期的哺乳动物的氨基酸代谢
胎盘和胎儿在妊娠期的快速生长,需要大量来自妊娠期日粮的氨基酸的供应。为了防止妊娠期间超重或肥胖的出现,必须控制母体的摄食量(Haynes等,2009)。进入门静脉的日粮氨基酸和子宫摄取的氨基酸之间的差异可以为妊娠动物的氨基酸代谢提供有益信息(Wu等,1996)。例如,每天2 kg饲喂母猪的玉米-豆粕型饲料中含有的12.2%的粗蛋白质、日粮赖氨酸和色氨酸不能满足妊娠晚期子宫摄取的需要,日粮蛋氨酸的量恰好满足子宫摄取的量,其他所有必需氨基酸的量均超过了子宫摄取的量(表2)。丙氨酸、天冬酰胺、丝氨酸是仅有的、在膳食中的供给量超过了子宫摄取量的可合成氨基酸。其他非必需氨基酸(包括精氨酸、谷氨酸、谷氨酰胺、甘氨酸)必须由妊娠母畜合成来维持胎儿的生长发育。
由于氨具毒性并且可能对其他代谢(如组胺、硫化氢和同型半胱氨酸)有不利影响,因此过量摄入的蛋白质和氨基酸会降低胚胎和胎儿的存活率并减缓其生长。当给处于妊娠晚期的妊娠母猪每天饲喂2~2.2 kg日粮时,一些氨基酸内源性合成的量不足以达到最佳妊娠效果(Wu等,1996)。支持这一观点的是,妊娠第30天和第114天,在母猪日粮中添加0.83%的精氨酸可使每窝活产仔数增加2头,初生重增加24%(Xiao,2005)。同样,在妊娠第14~28天,在母猪日粮中添加0.4%或0.8%的精氨酸增加了胎盘重量,促进了胚胎存活以及生长发育(Shen和Ifua,2010)。精氨酸对改善妊娠母羊的繁殖性能也在实际生产中得到证实(Sawant等,2015)。此外,在妊娠期间或妊娠第一周内向日粮中添加1.3%的精氨酸盐酸盐增加了大鼠每窝3只的活产仔数(Manjarin等,2014)。最后,为处于妊娠晚期(33周)、宫内发育迟缓的妇女静脉注射精氨酸7 d(20 g/d),到期(39周)出生体重增加了6.4%,而为宫内胎儿生长受限的妇女注射精氨酸则促进了胎儿的生长发育(Manjarin等,2012;Mateo等,2008)。
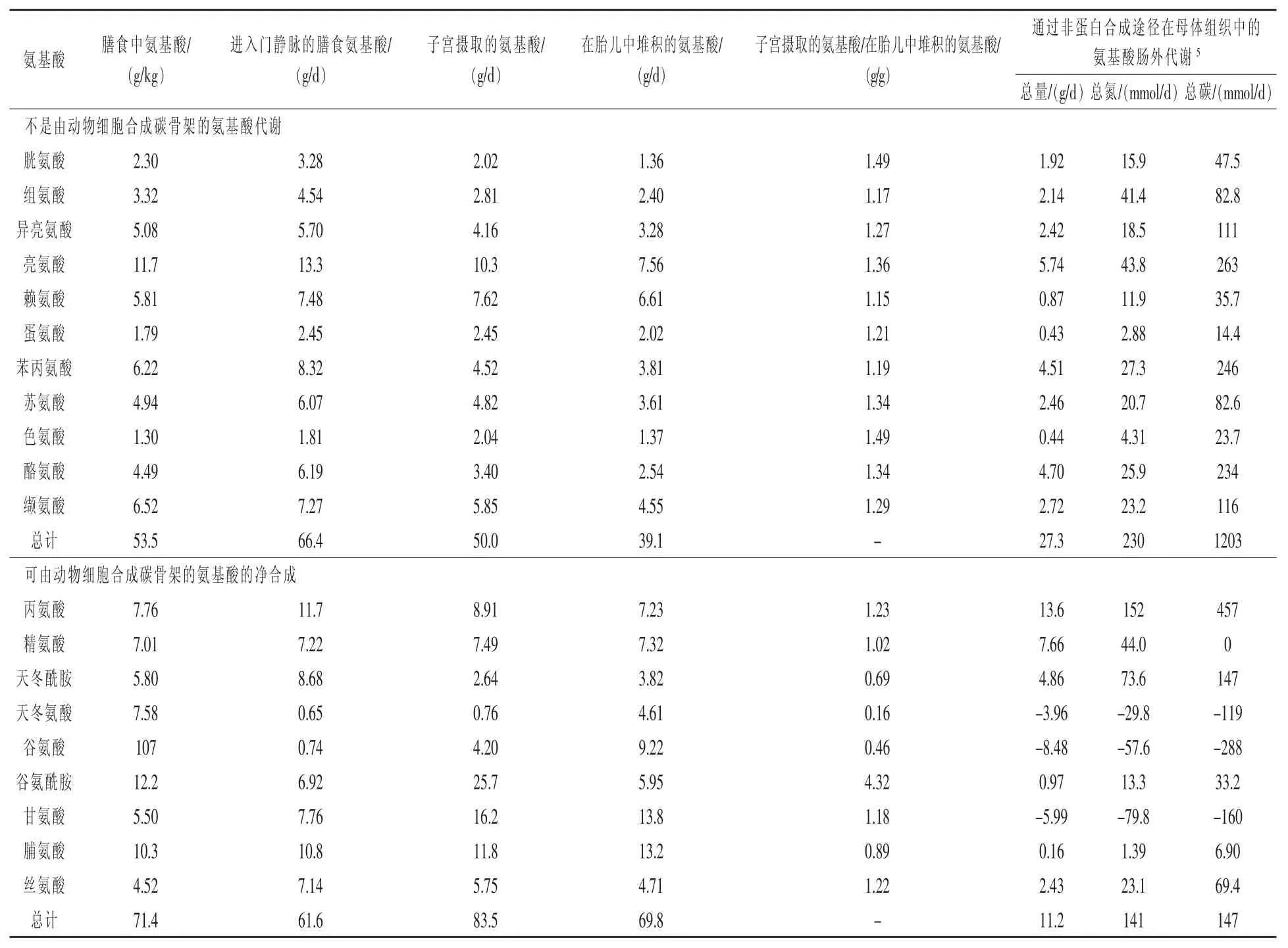
表2 妊娠母猪的氨基酸代谢
试验数据表明,妊娠母畜由于蛋白摄入不足,甘氨酸和谷氨酰胺合成不足,也会影响胚胎生长和后代健康(Li等,2009;O'Quinn等,2002)。第一,为母鼠的膳食补充甘氨酸可防止食用低蛋白日粮的幼鼠的高血压和血管功能障碍。第二,对于食用12%粗蛋白质日粮的母鼠以及接受静脉注射乙醇的母羊,为母体补充谷氨酰胺可促进胎儿生长,同样可使胎儿存活于被注射猪圆环病毒II型的母鼠中。其潜在的机制可能涉及抗氧化功能、免疫反应、酸碱平衡和蛋白质合成的改善(Foyer和Paul,2012;Li等,2009)。
3 泌乳期的哺乳动物的氨基酸代谢
目前关于泌乳母猪产奶的氨基酸代谢研究较少。对母猪、奶牛和大鼠的研究表明,当日粮蛋白摄取量增加时,可增加泌乳期产奶量(Rezaei等,2013)。饲喂包含18%粗蛋白质的玉米-豆粕型饲料的泌乳母猪在哺乳期第1~21天每天损失约0.5 kg体重,甚至在泌乳期第1~18天平均每天损失1.4 kg体重(表3)(Bruckental等,1991)。表明在当前饲喂系统下,日粮蛋白质摄入不能满足多产母猪的乳蛋白合成。目前仍然不能确定是日粮中的必需氨基酸还是可合成氨基酸亦或是两者共同限制通乳。
除了赖氨酸,进入门静脉的日粮必需氨基酸均超过它们在母乳中的产量(表3)。日粮赖氨酸的量刚好与其在奶中的产量相称,而日粮中的丙氨酸、精氨酸、天冬酰胺、甘氨酸和丝氨酸,均超过了其在母乳中的产量。如前所述,这些氨基酸在母体分解代谢以维持某些细胞的需求,并且它们也可通过器官间的互作来合成从而被乳腺利用,这反映了在泌乳期氨基酸的动态代谢。日粮天冬氨酸、谷氨酸、谷氨酰胺和脯氨酸不能满足其在母乳中的产量(表3),而且这些氨基酸必需由日粮氨基酸从头合成。因此,当向哺乳母猪的低蛋白质日粮中添加必需氨基酸时,可减少它们损失的体重并且促进仔猪的生长(Ospinarojas等,2013)。
目前,关于由泌乳期乳腺摄取的所有氨基酸的研究报道很少。由母猪乳腺摄取的支链氨基酸和精氨酸大大超过了它们在母乳中的产量(Ospinarojas等,2013)。在乳腺上皮细胞中,支链氨基酸被分解代谢以形成谷氨酸、天冬氨酸、谷氨酰胺,而精氨酸则被精氨酸酶分解为脯氨酸和多胺(Corzo等,2005)。因为多胺对DNA和蛋白质的合成十分重要,由乳腺上皮细胞分解精氨酸从而产生多胺对新生儿小肠的发育有着重要生理作用。由于肠道可利用谷氨酸和天冬氨酸将脯氨酸转化为母乳中含量丰富的精氨酸,因此并没有出现精氨酸的碳或氮在母方与新生儿间所谓的精氨酸-脯氨酸循环中的净损失(Wu和Jr,1998)。我们研究的另一个突出方面是,日粮甘氨酸的量比甘氨酸在奶中的产量多很多(表3)。哺乳母畜中甘氨酸是如何超出蛋白质合成被利用的仍然未知,但甘氨酸的代谢在调节产奶上可能起着重要的作用。这个假设需要试验数据来支持。
如前所述,泌乳母猪调动它们储存的蛋白质提供氨基酸,用于产奶。然而,因为体蛋白的过度损失不利于存活,这一过程必须要有一个限制。因此,泌乳母畜可能无法合成足够的氨基酸来维持最大产奶。这个观点被以下结论证实:(1)向玉米-豆粕型日粮中添加1%的精氨酸盐酸盐可刺激泌乳母猪产奶并提高仔猪体重(Bruckental等,1991);(2)向日粮中添加1%的谷氨酰胺促进了母猪的产奶以及仔猪的生长和存活(Bartell和Batal,2007);(3)向哺乳母猪的玉米-豆粕型日粮中添加1%和2%的谷氨酰胺提高了产奶量、仔猪的生长性能和存活率,以及用于泌乳的饲料利用率(Olubodun等,2015)。在奶牛中有类似的结果报道。例如,向泌乳奶牛的皱胃中注射谷氨酸增加了乳蛋白的产量(Salmanzadeh和Shahryar,2013)。此外,在泌乳奶牛的十二指肠中每天注射80 g脯氨酸促进了乳蛋白的合成(Awad等,2014)。因此,哺乳母畜日粮中需要足量的可合成氨基酸来最大化其产奶量。
4 家禽的氨基酸代谢
鸡的生长非常迅速,对日粮中摄入的氨基酸反应敏感。甘氨酸和脯氨酸从头合成的量不足以使家禽达到最大生长。因此,在21~35日龄肉鸡的17%粗蛋白质日粮中补充0.3%的甘氨酸提高了对脂肪的吸收、粗蛋白质的合成、体重的增加以及饲料利用率(Zhang等,2006)。Andersen等(2016)向5~21日龄肉鸡的18%粗蛋白质日粮中补充0.2%的甘氨酸也得到了类似的结果。此外,有证据表明,雏鸡的最大生长需要膳食中的谷氨酸和谷氨酰胺,这表明雏鸡不能合成足够的谷氨酸或谷氨酰胺(Caballero-Solares等,2015;Lavsson等,2014)。支持这一观点的是,向日粮中添加0.5%~1%的谷氨酸提高了小肠绒毛高度、体重以及饲料转化率,同时降低1~42日龄肉鸡孵化后的死亡率(Olubodun等,2015)。有研究报道,日粮中添加1%或0.7%的谷氨酰胺分别提高了1~21日龄肉鸡或21~42日龄火鸡的体增重和饲料转化率(Salmanzaden和Shahryar,2013;Bartell和Batal,2007)。此外,在16.2%粗蛋白质日粮中添加可合成氨基酸(0.8%甘氨酸、0.43%脯氨酸、0.33%丙氨酸、1.21%谷氨酸、0.99%天冬氨酸)的混合物也提高了1~42日龄肉鸡的体重和饲料转化率(Awad等,2014)。总的来说,这些结果表明,当食用标准蛋白质日粮时鸡不能合成充足的甘氨酸、谷氨酸和谷氨酰胺;当食用低粗蛋白质日粮时鸡不能合成充足的甘氨酸、脯氨酸、丙氨酸、谷氨酸和天冬氨酸。
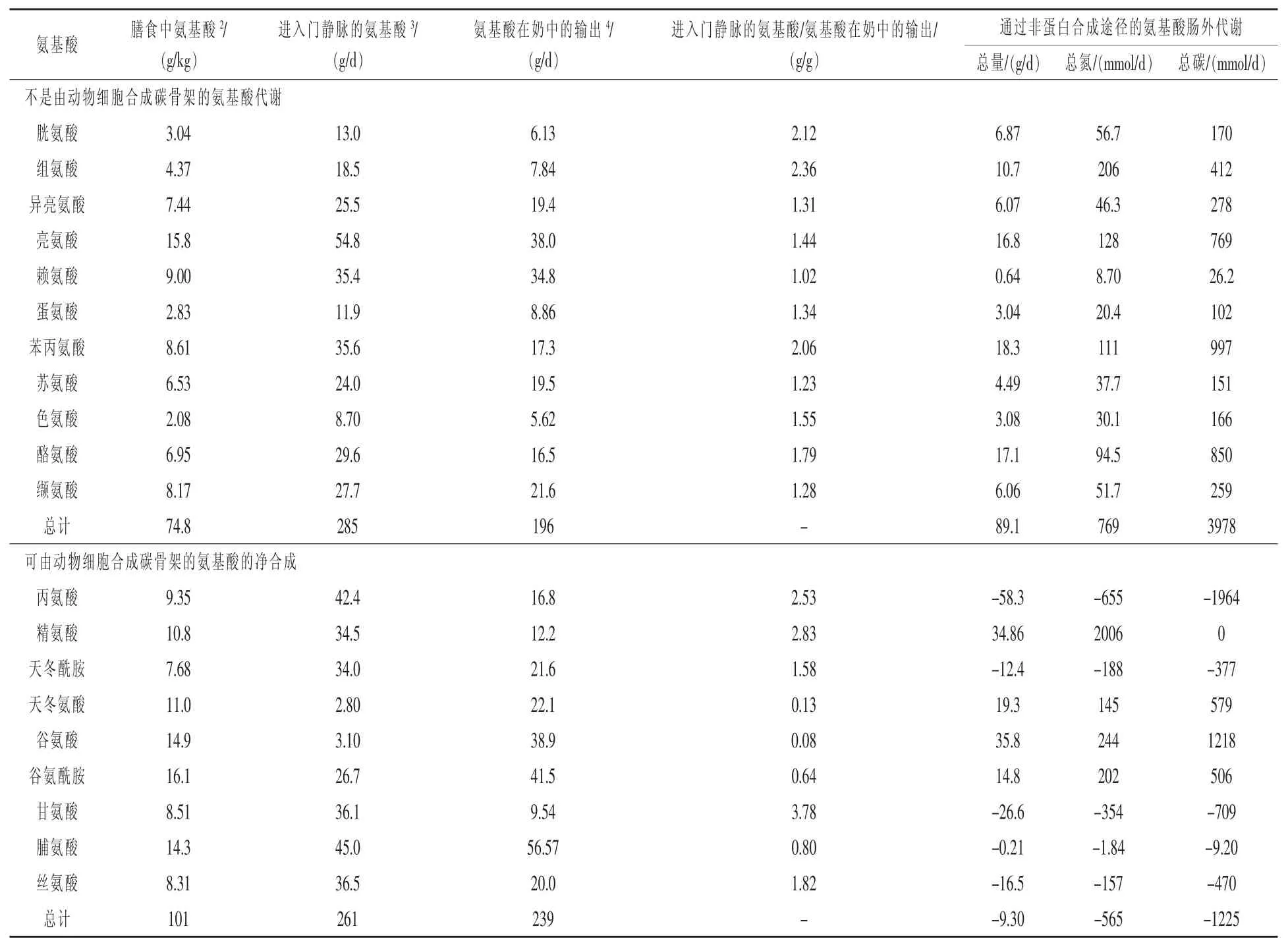
表3 泌乳母猪的氨基酸代谢1
5 鱼类的氨基酸代谢
与家畜和家禽相比,对水产动物氨基酸代谢的研究是比较少的。然而,有证据表明,鱼不能充分地合成多种非必需氨基酸。例如,脯氨酸的内源性合成不能满足虹鳟鱼对脯氨酸的需要(Zhang等,2006)。此外,在日粮中添加谷氨酰胺增加了红鼓(眼斑拟石首鱼)、建鲤和杂种鲈鱼的肠绒毛高度和体重,同时促进T淋巴细胞和B淋巴细胞的增殖并且提高鱼的免疫能力(Andersen等,2016)。同样,在日粮中添加谷氨酸提高了大西洋鲑鱼片的品质并减少脂肪在肝脏和全身中的积累,同时促进了生长,提高了抗氧化能力并且促进抗氧化基因在肠道中的表达(Larsson等,2014)。同样,在日粮中添加4%的谷氨酸或谷氨酰胺提高了金头鲷幼鱼的蛋白质存留量和饲料利用率(Caballero-Solares等,2015)。此外,日粮谷氨酰胺补充物通过提高消化酶的活性、抗氧化能力、缺氧的耐受性促进了后期幼体舌鳎鱼和半滑舌鳎的存活和生长(Liu等,2015)。最后,鱼类最佳的摄食、脂肪消化、营养吸收、对环境改变(如从海水到淡水)的适应以及生长都需要日粮甘氨酸的补充。
6 结论与展望
必需氨基酸不能在动物细胞中合成,因此其在家畜、家禽、鱼类和人类营养研究中备受关注。相比之下,由于可合成的氨基酸被认为可以在动物体内充足地从头合成,可合成氨基酸的膳食需求被忽略了很久。然而,最近对健康大鼠、猪、家禽和鱼的研究并不支持这个假设。在动物中,氨基酸部分由必需氨基酸合成,并且大多数可合成氨基酸是可以相互转化的(Wu等,2016)。重要的是,通过日粮或内源性合成提供的可合成氨基酸均可以匀出用于蛋白质合成的必需氨基酸。应该牢记的是,对动物来说,日粮氨基酸几乎是氮的唯一来源,并且氮原子不能在体内产生。因此,进入门静脉的和可用于肠道代谢之间的、子宫摄取的和胎儿生长需要之间的或乳腺摄取的和产奶输出之间的氮平衡能够提供关于哺乳动物氨基酸合成的影响因子的有用信息。这些数据中的一部分目前适用于猪,但不适用于其他物种。
对猪氮代谢的定量分析表明,在现有加料程序条件下,动物体内氨基酸的合成被前体的可用性和酶活性所限制。大量的证据表明最大生长、繁殖和泌乳需要日粮可合成氨基酸的补充(Dai等,2015;SanGabriel和Vneyama,2013)。可以推测分别用于合成丙氨酸、天冬氨酸、谷氨酸或谷氨酰胺的丙酮酸盐、草酰乙酸盐和α-酮戊二酸可能导致动物葡萄糖的蛋白质保留效应。这些氨基酸对在应激条件(如妊娠、哺乳、断奶、高温环境、长途运输、受伤、感染和疾病)下维持全身的动态平衡特别重要。因为动物的遗传品系可能影响它们对日粮氨基酸的需求,所以在对慢生长猪与快生长猪的比较中确定全身氨基酸的合成速率和其对肌肉生长的促进作用是十分重要的。
生长是幼小动物在数量和质量上对膳食氨基酸需求的敏感的确定标准,如同雄性精子的数量与活力、孕育的胚胎存活和泌乳母系的乳蛋白产量。另一方面,氮平衡并不是成年动物对日粮必需氨基酸的需要的高度敏感指标。例如,9 d几乎不含精氨酸的膳食并没有影响男性的氮平衡,但降低了他们90%的精子数量和活力(Holt和Albanese,1944)。同样,幼小雄鼠2个月的日粮中缺乏精氨酸并没有影响氮平衡,但会导致睾丸的连续损伤,没有精子产生,肾小管的管腔异常充满细胞碎屑、粒细胞和巨噬细胞(Holt和Albanese,1944)。
研究实验室动物和农场动物对可合成氨基酸的日粮需求能够指导对人类的研究。到目前为止,除了牛磺酸,关于人类对可合成氨基酸的膳食需求的研究报道很少。膳食牛磺酸对婴儿和猫的视觉功能、心血管和肌肉系统的正常发育十分重要(Marromichalis等,2001)。婴儿在以下情况下不能足量合成某氨基酸:(1)在烧伤和创伤的情况下不能合成足量的脯氨酸和精氨酸(Kalhan和Bier,2008);(2)在食用低蛋白质日粮时不能合成足量的甘氨酸(Tan等,2009);(3)在患肠道炎症时不能合成足量的谷氨酰胺和精氨酸(Becker等,2008)。现在还不能确定日均摄食0.8 g蛋白质/kg体重的老年人能否合成足够的非必需氨基酸来维持骨骼肌量,防止氧化应激。
除了蛋白质的合成,血管、生殖、免疫、抗氧化和胃肠道功能以及全身的内环境稳定,健康和神经发育对氨基酸(包括体内可合成的氨基酸)的功能性需要应该参考动物和人类氨基酸的膳食需求(Wu等,2014a)。例如,某些氨基酸的代谢产物和一些氨基酸(如谷氨酸、天冬氨酸和甘氨酸)本身都是神经递质。据我们所知,在各物种中,尚无评估促进脑神经元发育的氨基酸最佳摄入量的研究报道。近年来人类对氨基酸在生化、生理和营养上更深的了解正在世界范围内改变家畜、家禽和鱼类饲养的方法。饲料级精氨酸、天冬氨酸、谷氨酸、谷氨酰胺、甘氨酸和脯氨酸预计可以提升全球化动物生产的效率和经济回报。从实验室中以及对重要农业动物的研究中获得的知识对促进人类的生长和健康有着重要的意义。
[1]Andersen S M,Waagbo R,Espe M.Functional amino acids in fish nutrition,health and welfare[J].Front Biosci,2016,8:143~169.
[2]Awad E A,Zulkifli I,Farjam A S,et al.Amino acids fortification of Low-Protein diet for broilers under tropical climate.2.Nonessential amino acids and increasing essential amino acids[J].Italian Journal of Animal Science,2014,13(3):631~636.
[3]Bartell S M,Batal A B.The effect of supplemental glutamine on growth performance,development of the gastrointestinal tract,and humoral immune response of broilers[J].Poultry Science,2007,86(9):1940~1947.
[4]Bruckental I,Ascarelli I,Yosif B,et al.Effect of duodenal proline infusion on milk production and composition in dairy cows[J].Animal Production,1991,53(3):299~303.
[5]Caballero-Solares A,Viegas I,Salgado M C,et al.Diets supplemented with glutamate or glutamine improve protein retention and modulate gene expression of key enzymes of hepatic metabolism in gilthead seabream(Sparus aurata)juveniles[J].Aquaculture,2015,444:79~87.
[6]Corzo A,Fritts C A,Kidd M T,et al.Response of broiler chicks to essential and non-essential amino acid supplementation of low crude protein diets [J].Animal Feed Science&Technology,2005,118(3):319~327.
[7]Dai Z,Wu Z L,Hang S Q,et al.Amino acid metabolism in intestinal bacteria and its potential implications for mammalian reproduction[S].Mol Hum Reprod,2015,21:389~409.
[8]Foyer C H,Paul M J.Glutamine and glutamate supplementation raise milk glutamine concentrations in lactating gilts[J].Journal of Animal Science& Biotechnology,2012,3(1):25~31.
[9]Gao K,Jiang Z,Lin Y,et al.Dietary L-arginine supplementation enhances placental growth and reproductive performance in sows[J].Amino Acids,2012,42(6):2207~2214.
[10]Haynes T E,Li P,Li X,et al.L-Glutamine or L-alanyl-L-glutamine prevents oxidant-or endotoxin-induced death of neonatal enterocytes[J]. Amino Acids,2009,37(1):131~142.
[11]Holt L E Jr.,Albanese A A.Observations on amino acid deficiencies in man[J].Trans Assoc Am Physicians,1944,58:143~56.
[12]Jamin A,D′Inca R,Le F H N,et al.Fatal effects of a neonatal high-protein diet in low-birth-weight piglets used as a model of intrauterine growth restriction[J].Neonatology,2009,97(4):321~328.
[13]Larsson T,Koppang E O,Espe M,et al.Fillet quality and health of Atlantic salmon(Salmo salar L.)fed a diet supplemented with glutamate[J].Aquaculture,2014,s 426~427(1):288~295.
[14]Lassala A,Bazer F W,Cudd T A,et al.Parenteral Administration of LArginine Prevents Fetal Growth Restriction in Undernourished Ewes[J].Journal of Nutrition,2010,140(7):1242~1248.
[15]Lassala A,Bazer F W,Cudd T A,et all.Parenteral Administration of l-Arginine Enhances Fetal Survival and Growth in Sheep Carrying Multiple Fetuses[J].Journal of Nutrition,2011,141(5):849~855.
[16]Li P,Knabe D A,Kim S W.Lactating porcine mammary tissue catabolizes branched-chain amino acids for glutamine and aspartate synthesis[J].Journal of Nutrition,2009,139(8):1502~1509.
[17]Li X,Bazer F W,Johnson G A,et al.Dietary supplementation with larginine between days 14 and 25 of gestation enhances embryonic development and survival in gilts[J].Amino Acids,2014,46(2):375~384.
[18]Liu J W,Mai K S,Xu W,et al.Effects of dietary glutamine on survival,growth performance,activities of digestive enzyme,antioxidant status and hypoxia stress resistance of half-smooth tongue sole(Cynoglossus semilaevis Gunther)post larvae[J].Aquaculture,2015,446:48~56.
[19]Manjarin R,Bequette B J,Wu G,et al.Linking our understanding of mammary gland metabolism to amino acid nutrition[J].Amino Acids,2014,46(11):2447~2462.
[20]Manjarin R,Zamora V,Wu G,et al.Effect of amino acids supply in reduced crude protein diets on performance,efficiency of mammary uptake,and transporter gene expression in lactating sows[J].Journal of Animal Science,2012,90(9):3088~3100.
[21]Mateo R D,Wu G,Bazer F W,et al.Dietary L-arginine supplementation enhances the reproductive performance of gilts[J].Journal of Nutrition,2007,137(3):652~656.
[22]Mateo R D,Wu G,Moon H K,et al.Effects of dietary arginine supplementation during gestation and lactation on the performance of lactating primiparous sows and nursing piglets[J].Journal of Animal Science,2008,86(4):827~835.
[23]Olubodun J O,Zulkifli I,Farjam A S,et al.Glutamine and glutamic acid supplementation enhances performance of broiler chickens under the hot and humid tropical condition[J].Ital J Anim Sci,2015,14:3263.
[24]Ospinarojas I C,Murakami A E,Oliveira C A,et al.Supplemental glycine and threonine effects on performance,intestinal mucosa development,and nutrient utilization of growing broiler chickens[J].Poultry Science,2013,92(10):2724~2731.
[25]Rezaei R,Jia S,Assaad H,et al.Monosodium glutamate supplementation to the diet for lactating sows enhances growth performance and survival of suckling piglets[J].Amino Acids,2013,45(3):596~597.
[26]Rezaei R,Knabe D A,Tekwe C D,et al.Dietary supplementation with monosodium glutamate is safe and improves growth performance in postweaning pigs[J].Amino Acids,2013,44(3):911~923.
[27]Salmanzadeh M,Shahryar H A.Effects of dietary supplementation with glutamine on growth performance,small intestinal morphology and carcass traits in turkey poults under heat stress[J].Revue De Médecine Vétérinaire,2013,164(10):476~480.
[28]San Gabriel A,Uneyama H.Amino acid sensing in the gastrointestinal tract[M].Amino Acids,2013,45:451~461.
[29]Sawant O B,Wu G,Washburn S E.Maternal L-glutamine supplementation prevents prenatal alcohol exposure-induced fetal growth restriction in an ovine model[J].Amino Acids,2015,47(6):1183~1192.
[30]Shen S F,Hua C H.Effect of L-arginine on the expression of Bcl-2 and Bax in the placenta of fetal growth restriction[J].The journal of maternal-fetal &neonatal medicine:the official journal of the European Association of Perinatal Medicine,the Federation of Asia and Oceania Perinatal Societies,the International Society of Perinatal Obstetricians,2010,24(6):822~826.
[31]Tan B,Li XG,Kong X,et al.Dietary L-arginine supplementation enhances the immune status in early-weaned piglets[J].Amino Acids,2009,37(2):323~331.
[32]Wu G,Meier S A,Knabe D A.Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs[J].Journal of Nutrition,1996,126(10):2578~2584.
[33]Wu G,Wu Z L,Dai Z L,et al.Dietary requirements of“nutritionally nonessential amino acids”by animals and humans[M].Amino Acids,2013,44:1107~1113.
[34]Xiao X L.L-Arginine treatment for asymmetric fetal growth restriction [J].International Journal of Gynaecology&Obstetrics the Official Organ of the International Federation of Gynaecology&Obstetrics,2005,88(1):15~18.
[35]Yao K,Yin Y L,Chu W,et al.Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J].Molecular Crystals&Liquid Crystals,2008,138(5):867~872.
[36]Zhang Y,Dabrowski K,Hliwa P,et al.Indispensable amino acid concentrations decrease in tissues of stomachless fish,common carp in response to free amino acid-or peptide-based diets[J].Amino Acids,2006,31(2):165~17.
(全文完)
10.15906/j.cnki.cn11-2975/s.20161011
S816.7
A
1004-3314(2016)10-0036-07

