阿萨希毛孢子菌抗氧化酶活性研究
张杨梅,李海涛,王聪敏,祝 贺,敖俊红,杨蓉娅
阿萨希毛孢子菌抗氧化酶活性研究
张杨梅,李海涛,王聪敏,祝贺,敖俊红,杨蓉娅

张杨梅
目的观察和测定44株不同来源阿萨希毛孢子菌(Trichosporon asahii,T.asahii)抗氧化酶活性。方法收集44株不同来源T.asahii,将其分为环境组(3株)、临床组(9株)、体内传代组(20株)和体外耐药组(12株),分别用羟胺法和可见光法测定其抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性,并进行比较和分析。结果环境组:SOD酶活性均值为(4.01±0.66)U/mgprot,CAT酶活性均值为(48.51±7.60)U/mgprot;临床组:SOD酶活性均值为(10.45±3.87)U/mgprot,CAT酶活性均值为(110.56±35.77)U/mgprot;体内传代组:至传代第5代,菌株SOD酶活性均值为(8.65±4.15)U/mgprot,CAT酶活性均值为(71.36±12.19)U/mgprot;耐药组:至诱导末期第10代菌株SOD酶活性均值为(8.02±1.56)U/mgprot,CAT酶活性均值为(80.43±8.92)U/mgprot。结论T.asahii具有较强的抗氧化能力。不同来源T.asahii抗氧化能力不同,主要体现在抗氧化酶活性的不同。其中,临床组菌株抗氧化能力最强,体内传代组菌株和体外耐药组菌株次之,环境组菌株最低。
阿萨希毛孢子菌;超氧化物歧化酶;过氧化氢酶
超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)是保护真菌免受活性氧递质(reactive oxygen species,ROS)氧化杀伤的两种最主要的抗氧化酶,近年来主要作为致病真菌的毒力因子而备受关注,这在白念珠菌[1,2]、烟曲霉[3,4]、新型隐球菌[5,6]等常见致病真菌的研究中均有报道。然而,阿萨希毛孢子菌(Trichosporon asahii,T.asahii)抗氧化酶的研究尚未见报道,因此,本课题收集笔者所在实验室现有的44株不同来源的T.asahii,测定其SOD和CAT酶活性并进行比较和分析,初步探索T.asahii抗氧化酶在其感染宿主以及致病过程中的作用。
1 材料与方法
1.1材料
1.1.1实验菌株共44株T.asahii,根据其不同来源分为环境组、临床组、体内传代组、体外耐药组。
环境组: 3株环境分离株。CBS8904、CBS7137、CBS8520均购自荷兰真菌生物多样性中心(CBS)。
临床组: 9株临床分离株。其中1株标准株(CBS2479)购自CBS;6株(BZP07001、BZP 07002、BZP 07003、BZP 07004、BZP 09001、BZP 09002)分别由华中科技大学、河北医科大学、解放军307医院、北京大学第一医院惠赠;2株(BZP07005、BZP07005R)为我科临床分离株。
体内传代组:20株小鼠体内传代菌株。将1株临床标准株CBS2479和3株环境分离株CBS8904、CBS7137、CBS8520分别于小鼠体内依次传代1~5代,由小鼠肾脏组织分离培养[7],分别对应编号:CBS2479 P1-5、CBS8904 P1-5、CBS7137 P1-5、CBS8520 P1-5。
体外耐药组:12株菌。其中,氟康唑高耐药诱导及回复菌株各6株(分别将1株临床标准株CBS2479和1株环境分离株CBS8904在氟康唑浓度逐渐梯级倍增的PDA培养基中分别转种传代,获得耐药菌株;将耐药菌株在不含氟康唑的PDA培养基上连续传代,获得回复菌株[8])。前期研究[8]表明T.asahii氟康唑耐诱导第6代后,其耐药性逐渐升高,因此,分别选择诱导及回复中期、末期菌株各6株,对应编号:CBS2479 F6、F9、F10、R7、R8、R9,CBS8904 F6、F9、F10、R7、R8、R9(其中,F6为诱导中期菌株,F9、F10为诱导末期菌株;R7为回复中期菌株,R8、R9为回复末期菌株)。
上述菌株经API 20C AUX生物鉴定及ITS序列分析验证(AS2.2174)。
质控株1株:标准菌株近平滑念珠菌ATCC 22019,由北京大学第一医院真菌研究中心惠赠。
1.1.2主要试剂 总SOD测试盒、CAT测定试剂盒及总蛋白定量测定试剂盒,均购自南京建成生物工程研究所。直径425~600 µm玻璃微珠,购自美国Sigma公司。
1.2方法
1.2.1将-80℃保存的T.asahii菌种复苏,取新鲜单菌落接种于PDA培养基上,35℃生长48 h。用0.9%无菌生理盐水配置浓度为1.5×108cfu/ml的T.asahii菌悬液。取1 ml菌悬液添加到50 ml含有4%葡萄糖和1%真菌蛋白胨的SDB液体培养基中,在摇床上震荡培养(37℃,150 r/min,48 h)。离心机分离(20℃,3 500 r/min)后,弃上清液,取下层细胞沉淀,无菌水冲洗3次,用于细胞裂解。
1.2.2细胞裂解用玻璃珠溶解法溶解上述细胞。将细胞在含有0.5 g直径425~600 µm玻璃微珠的裂解缓冲液(磷酸钾50 mmol/L,pH7.0)中重悬。混悬液在Fastprep 核酸提取仪中以4.0 m/s 的速度强振荡6次,每次40 s,冰上冷却。离心机分离(4℃,16 000 r/min,10 min),弃去细胞碎片和玻璃微珠。上清液用于酶活性的分析。
1.2.3酶活性测定用总SOD测试盒和CAT测定试剂盒分别测定SOD和CAT酶活性,具体操作方法按照说明书执行。重复3遍。 BCA法测定蛋白质浓度:用标准血清蛋白作对照。
1.3统计学方法
SPSS 13. 0统计软件分析。采用单样本K-S方法对各组数据进行正态性分析,用两独立样本t检验、配对两样本t检验进行两个样本均数的比较。
2 结果
2.1环境组与临床组抗氧化酶活性结果
质控株近平滑念珠菌ATCC22019 SOD酶活性为41.289 U/mgprot,CAT酶活性为4.208 U/mgprot。T.asahii环境组:环境分离株CBS8904、CBS7137、CBS8520的SOD酶活性分别为3.828、3.46、4.75 U/mgprot,均值为(4.01±0.66)U/mgprot,CAT酶活性分别为45.833、42.61、57.082 U/mgprot,均值为(48.51±7.60)U/mgprot。T.asahii临床组:不同临床分离来源菌株抗氧化酶活性不同,SOD酶活性变化范围为6.221~16.826 U/mgprot,均值为(10.45±3.87)U/mgprot;CAT酶活性变化范围为61.956~164.552 U/mgprot,均值为(110.56±35.77)U/mgprot,详见表1。

表1 T.asahii 环境株与临床株抗氧化酶活性
2.2体内传代组抗氧化酶活性结果
小鼠体内传代第1~5代后,4株菌株抗氧化酶活性逐渐升高(P<0.05)(图1a-1d)。临床标准株CBS2479 SOD酶活性依次是传代前的0.98、1.16、1.63、1.70、2.35倍,CAT酶活性依次是传代前的1.18、1.24、1.25、1.23、1.44倍;其余3株环境分离株CBS8904、CBS7137、CBS8520至传代第5代,SOD酶活性分别是传代前的2.05、1.45、1.5倍,CAT酶活性分别是传代前的1.34、1.55、1.21倍,其中,CBS8904 SOD酶活性升高幅度最大,约105%,而CBS7137 CAT酶活性升高幅度最大,约55%。 详见表2。
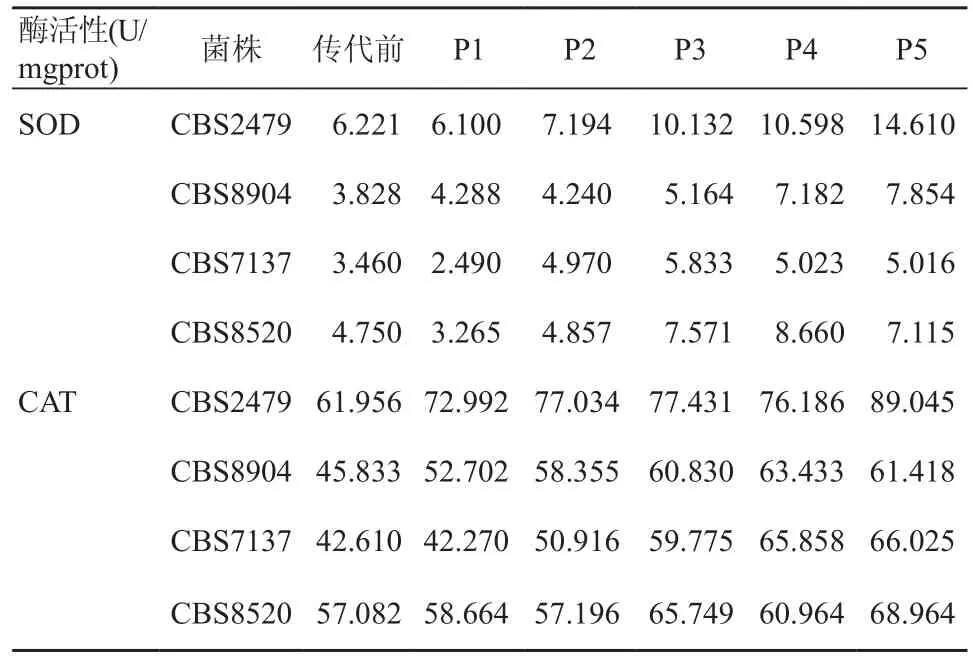
表2 T.asahii小鼠体内传代株抗氧化酶活性
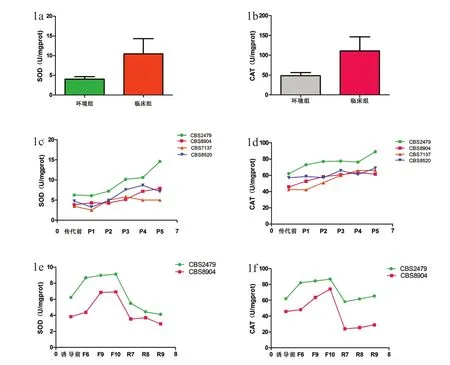
图1 不同菌株SOD与CAT酶活性的变化趋势比较
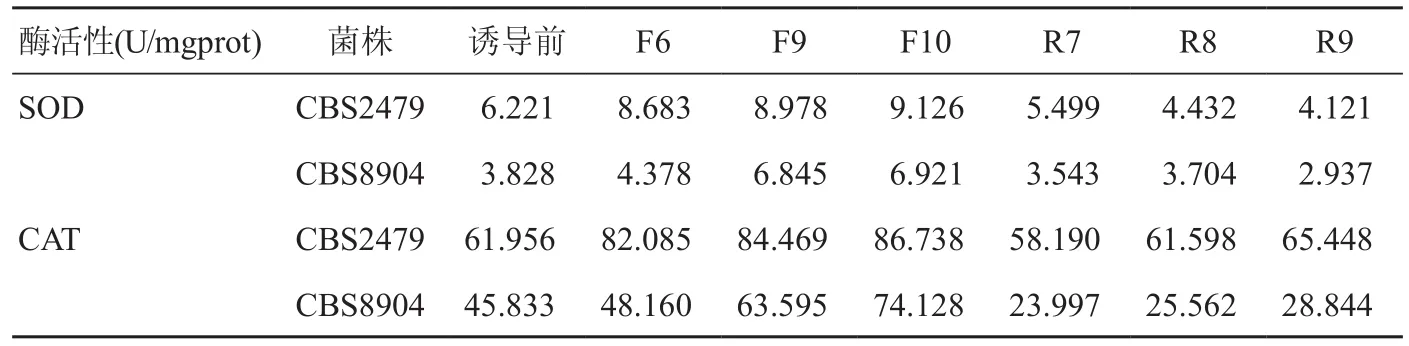
表3 T.asahii氟康唑耐药株诱导及回复菌株SOD和CAT活性
2.3耐药组抗氧化酶活性结果
体外氟康唑耐药诱导后,T.asahii 菌株抗氧化酶活性随诱导代数的递增而逐渐升高(P<0.05)(图1e,1f)。临床标准株CBS2479诱导第6、9、10代SOD酶活性分别是诱导前的1.40、1.44、1.47倍,CAT酶活性分别是诱导前的1.32、1.36、1.40倍,至诱导末期第10代SOD、CAT酶活性分别比诱导前升高了47%、40%;与临床标准株类似,至诱导末期第10代环境分离株CBS8904 SOD和CAT酶活性也分别较前升高了81%和62%。而在回复末期,菌株CBS2479和CBS8904 抗氧化酶SOD和CAT酶活性逐渐恢复至正常水平,详见表3。
3 讨论
病原微生物侵入机体后,面临的第一道防线是机体吞噬细胞的氧化杀伤。吞噬细胞吞噬病原微生物后可产生ROS起到杀伤作用,主要通过破坏核酸、氧化蛋白质以及脂质过氧化进而破坏多种细胞功能[9,10]。为了生存,病原微生物也进化了一系列抗氧化防御和修复系统来应对机体的氧化杀伤。其中,抗氧化防御酶系统主要包括SOD、CAT、谷胱甘肽系统等[11],这些物质在中和或消除氧化损伤中起重要作用。在白念珠菌、烟曲霉、新型隐球菌等常见致病真菌的研究中,证实抗氧化酶SOD和CAT在保护真菌免受ROS氧化杀伤中起重要保护作用,此外,SOD或CAT酶抑制或缺失的菌株可表现出毒力的迅速减弱[1-6]。近年来,由于T.asahii引起的播散性毛孢子菌病的发病率呈明显上升趋势,占深部真菌感染患者的5%~10%[12],且T.asahii对绝大多数抗真菌药均耐药,一旦该菌在机体造成播散性、系统性感染,病死率可高达80%以上[13],使得该菌的感染机制与致病机制越来越受到人们的关注。在前期的研究中,宗丽娜等[14]发现了T.asahii可对3种不同的氧化剂(甲萘醌、H2O2、二酰胺)产生不同程度的抵抗作用,其中,对H2O2的抵抗作用最强,二酰胺次之,甲萘醌最小。基于上述研究,笔者推测:与其他真菌病原体一样[1,6],T.asahii也拥有相应的抗氧化防御系统;并且T.asahii能够入侵宿主体内,并造成严重感染与其抵抗或逃避宿主免疫系统攻击的能力(尤其是抗氧化防御能力)存在一定联系。为了验证这一假设,笔者收集不同来源T.asahii菌株,测定其SOD和CAT抗氧化酶活性,初步探索其抗氧化防御机制,为进一步研究该菌的感染机制奠定基础。
本研究通过测定环境组和临床组T.asahii的抗氧化酶活性发现:临床组菌株抗氧化酶活性均显著高于环境组(P<0.01)(图1a,1b)。其中,临床组SOD酶活性为(10.45±3.87)U/mgprot,CAT酶活性为(110.56±35.77)U/mgprot,环境组SOD酶活性为(4.01±0.66)U/mgprot,CAT酶活性为(48.51 ±7.60)U/mgprot,前者SOD酶活性是后者的2~5倍;前者CAT酶活性约是后者的1.5~4倍,且不同临床分离来源菌株抗氧化酶活性也存在一定差异。由于菌株抗氧化能力的不同,主要体现在抗氧化酶活性的不同,笔者认为T.asahii临床组抗氧化能力高于环境组。结合已往研究,笔者发现:T.asahii 临床组菌株抗氧化酶SOD酶活性[(10.45±3.87)U/mgprot与隐球菌(12±0.5)U/mgprot][15]相当,低于杜氏念珠菌(27.87 ±20.82)U/mgprot(从巴西某大学附属医院口腔念珠菌病人体上分离出杜氏念珠菌Cd1、Cd2、Cd3、Cd4、Cd5、Cd7、Cd9、Cd11和Cd13 SOD酶活性的均值)[16],明显低于白念珠菌(151.83±73.27)U/mgprot(从巴西某大学附属医院口腔念珠菌病人体上分离出的白念珠菌Ca10、Ca81、Ca119、Ca170和CaATCC44373 SOD酶活性的均值)[16];T.asahii 临床组菌株抗氧化酶CAT酶活性[(48.51±7.60)U/mgprot]显著高于烟曲霉[(1.75±0.75)U/mgprot、土曲霉(3.5±0.8)U/mgprot][17],因此,推测不同种属真菌的抗氧化能力不同。
本研究结果显示,小鼠体内传代后,T.asahii菌株CBS2479、CBS8904、CBS7137和CBS8520抗氧化酶活性逐渐升高。传代前T.asahii菌株SOD酶活性为(4.56±1.23)U/mgprot,CAT酶活性为(51.87 ±9.15)U/mgprot;至传代第5代,菌株SOD酶活性增至(8.65±4.15)U/mgprot,CAT酶活性增至(71.36±12.19)U/mgprot,分别比传代前升高了90%、34%,且其CAT酶活性高于环境组(P<0.05)。提示T.asahii侵入机体后,通过与机体免疫系统相互作用,激发或诱导了其抗氧化机制,最终使得抗氧化酶活性有不同程度的升高,其抗氧化能力也随之升高。既往研究发现,SOD、CAT酶在中和或阻断巨噬细胞、中性粒细胞释放ROS引起的氧化杀伤中起重要作用[1,3,6];此外,在烟曲霉的研究中,Diamond等[18]证实CAT酶还可抑制中性粒细胞髓过氧化物酶系统对菌丝的损伤。因此,推测T.asahii抗氧化酶在保护菌株免受宿主免疫系统氧化杀伤中起一定作用,甚至可以协助菌株逃避宿主免疫系统的攻击,进一步促进感染的形成。此外,本组研究数据还显示临床株SOD酶活性随传代数增加而增加,而CAT酶活性并未随传代数增加有明显变化。由于病原微生物侵入机体后面临吞噬细胞的氧化杀伤,主要表现在吞噬细胞质膜上的NADPH氧化酶(Nox)被迅速激活,首先与O2相互作用产生大量O2-,进而产生其他ROS如H2O2、羟自由基等,在吞噬小体中共同杀伤微生物[9]。因此,笔者推测传代菌株SOD酶活性升高较CAT酶活性明显与上述氧化应激反应过程密切相关,然而这方面还有待进一步研究。
本研究结果也显示,T.asahii经氟康唑耐药诱导后,临床标准株CBS2479和环境株CBS8904抗氧化酶活性均升高(P<0.05)。诱导前菌株SOD酶活性为(5.02±1.69)U/mgprot,CAT酶活性为(53.89 ±11.40)U/mgprot;至诱导末期第10代菌株SOD酶活性升高至(8.02±1.56)U/mgprot,CAT酶活性为(80.43±8.92 )U/mgprot,分别比诱导前升高了60%、49%,且其SOD和CAT酶活性均高于环境组(P<0.05);回复期,两组菌株抗氧化酶活性逐渐恢复至正常水平,至回复末期菌株SOD酶活性为(3.53 ±0.84)U/mgprot,CAT酶活性为(47.15±25.88)U/mgprot。提示氟康唑也可激活或诱导抗氧化酶活性,使得菌株抗氧化能力进一步升高;由于氟康唑暴露去除后,菌株SOD、CAT 酶活性可降至正常水平,说明T.asahii SOD和CAT 酶活性的诱导具有可调节性,这与Linares等[16]的研究结果相一致。Christopher等[19]还通过对白念珠菌暴露于唑类、多烯类、棘白霉素类抗真菌药时蛋白质组学的研究进一步证明,在酮康唑、两性霉素B、卡泊芬净3种药物作用下均可见参与抗氧化机制的蛋白质表达增高。Blum 等[17]认为与烟曲霉相比,土曲霉对两性霉素B固有耐药与其较高的过氧化氢酶活性密切相关,而与麦角固醇含量、细胞壁成分、脂质过氧化水平无明显相关性。因此,我们推测氟康唑药物在杀伤T.asahii过程中,伴随一定程度的氧化杀伤作用,同时T.asahii抗氧化酶活性的激活或诱导使得其抗氧化能力提高可能是抗真菌药物氟康唑耐药机制之一,这方面还有待深入研究。
T.asahii SOD与CAT两种酶活性在宿主因素和氟康唑作用下呈协同性增高,即SOD酶活性升高的同时,CAT酶活性也表现出相同的升高趋势。由于SOD催化O2-生成H2O2和O2,CAT可催化H2O2生成H2O和O2,笔者认为上述协同作用与SOD的产物是CAT的底物有关,这与Linares等[16]的研究结果相一致。
总之,本研究通过测定44株不同来源T.asahii的抗氧化酶活性发现,与其他大多数真菌病原微生物一样[1-6],T.asahii也拥有较强的抗氧化机制;不同来源T.asahii抗氧化能力不同,主要体现在抗氧化酶活性的不同。其中,临床株SOD和CAT酶活性显著高于环境株;体内传代第5代菌株SOD和CAT酶活性显著高于传代前,且其CAT酶活性明显高于环境株;耐药诱导末期第10代耐药株SOD和CAT酶活性均高于诱导前,且其SOD和CAT酶活性显著高于环境株。此外,宿主因素与氟康唑药物暴露均可激活或诱导T.asahii 两种抗氧化酶活性的升高,说明T.asahii抗氧化机制与其感染机制以及耐药机制之间存在一定的联系,这将是今后的研究方向。
[1]Wysong DR, Christin L, Sugar AM, et al. Cloning and sequencing of a Candida albicans catalase gene and effects of disruption of this gene [J]. Infect Immun, 1998, 66(5):1953-1961.
[2] Martchenko M, Alarco AM, Harcus D, et al. Superoxide dismutases in Candida albicans: transcriptional regulation and functional characterization of the hyphal-induced SOD5 gene [J]. Mol Biol Cell, 2004, 15(2):456-467.
[3] Paris S, Wysong D, Debeaupuis JP, et al. Catalases of Aspergillus fumigatus [J]. Infect Immun, 2003, 71(6):3551-3562.
[4] Holdom MD, Hay RJ, Hamilton AJ, et al. Purification, N-terminal amino acid sequence and partial characterization of a Cu, Zn superoxide dismutase from the pathogenic fungus Aspergillus fumigatus [J]. Free Radic Res, 1995, 22(6):519-531.
[5] Giles SS, Stajich JE, Nichols C, et al. The Cryptococcus neoformans catalase gene family and its role in antioxidant defense [J]. Eukaryot Cell, 2006, 5(9):1447-1459.
[6] Cox GM, Harrison TS, McDade HC, et al. Superoxide dismutase influences the virulence of Cryptococcus neoformans by affecting growth within macrophages [J]. Infect Immun, 2003, 71(1):173-180.
[7] 韩秀峰, 李海涛, 杨蓉娅, 等. 体内外诱导对阿萨希毛孢子菌形态及药物敏感性的影响研究 [J]. 实用皮肤病学杂志, 2015, 8(1):6-10.
[8] 郭朝霞, 李海涛, 杨蓉娅, 等. 阿萨希毛孢子菌对氟康唑耐药性的体外诱导及其稳定性研究 [J]. 中华皮肤科杂志, 2013, 46(5):41-44.
[9] Smith PD, Lamerson CL, Banks SM, et al. Granulocytemacrophage colony-stimulating factor augments human monocyte fungicidal activity for Candida albicans [J]. J Infect Dis, 1990, 161(5):999-1005.
[10] Brummer E, Stevens DA. Candidacidal mechanisms of peritoneal macrophages activated with lymphokines or gamma-interferon [J]. J Med Microbiol, 1989, 28(3):173-181.
[11] Temple MD, Perrone GG, Dawes IW. Complex cellular responses to reactive oxygen species [J]. Trends Cell Biol, 2005, 15(6):319-326.
[12] Kushima H, Tokimatsu I, Ishii H, et al. Cloning of the lanosterol14-aα-demethylase ( ERG11) gene in Trichosporon asahii: a possible association between G453R amino acid substitution and azole resistance in T. asahii [J]. FEMS Yeast Res, 2012, 12(6):662-667.
[13] Gross JW, Kan VL. Trichosporon asahii infection in an advanced AIDS patient and literature review [J]. AIDS, 2008, 22(6):793-795.
[14] 宗丽娜, 李海涛, 杨蓉娅, 等. 阿萨希毛孢子菌对氧化剂敏感性的实验研究 [J]. 实用皮肤病学杂志, 2012, 5(2):65-70.
[15] Dias AL, Brigagão MR, Colepicolo P, et al. Superoxide dismutase in Cryptococcus neoformans varieties gattii, grubi, and neoformans [J]. Mem Inst Oswaldo Cruz, 2006, 101(1):107-109.
[16] Linares CE, Giacomelli SR, Altenhofen D, et al. Fluconazole and amphotericin-B resistance are associated with increased catalase and superoxide dismutase activity in Candida albicans and Candida dubliniensis [J]. Rev Soc Bras Med Trop, 2013, 46(6):752-758.
[17] Blum G, Perkhofer S, Haas H, et al. Potential basis for amphotericin B resistance in Aspergillus terreus [J]. Antimicrob Agents Chemother, 2008, 52(4):1553-1555.
[18] Diamond RD, Clark RA. Damage to Aspergillus fumigatus and Rhizopus oryzae hyphae by oxidative and nonoxidative microbicidal products of human neutrophils in vitro [J]. Infect Immun, 1982, 38(2):487-495.
[19] Hoehamer CF, Cummings ED, Hilliard GM, et al. Changes in the proteome of Candida albicans in response to azole,polyene, and echinocandin antifungal agents [J]. Antimicrob Agents Chemother, 2010, 54(5):1655-1664.
(本文编辑祝贺)
Study on antioxidant enzymatic activities of Trichosporon asahii
ZHANG Yang-mei,LI Hai-tao,WANG Cong-min,et al
Shanxi Medical University, Taiyuan 030001, China
ObjectiveTo observe and determinate the antioxidant enzymatic activity of 44 Trichosporon asahii (T.asahii) strains from different sources. MethodsTotal 44 T.asahii strains collected from different sources were divided into four groups: environment group (3 strains), clinical group (9 strains), internal passage group (20 strains), fluconazole-resistant group (12 strains), the superoxide dismutase (SOD) and catalase (CAT) activities were compared and analyzed by hydroxylamine method and visible light method, respectively. Results Environment group: SOD activity mean value was (4.01±0.66)U/mgprot, CAT activity mean value was (48.51±7.60)U/mgprot. Clinical group: SOD activity mean value was (10.45±3.87)U/mgprot, CAT activity mean value was (110.56±35.77)U/mgprot. Internal passage group: after the fifth passage, SOD activity mean value was (8.65±4.15) U/mgprot, CAT activity mean value was (71.36±12.19)U/mgprot. Fluconazole-resistant group: after the tenth resistant induce, SOD activity mean value was (8.02±1.56)U/mgprot, CAT activity mean value was (80.43±8.92)U/mgprot. ConclusionT.asahii has strong antioxidant ability. T.asahii strains from different sources have different antioxidant abilities, which mainly manifested in the difference of antioxidant enzymatic activity. Clinical group strains has the strongest antioxidant capacity, internal passage group strains and fluconazole-resistant group are the second, and the environmental group strains is the lowest.
Trichosporon asahii;Superoxide dismutase;Catalase [J Pract Dermatol, 2016, 9(2):84-88]
R379
A
1674-1293(2016)02-0084-05
10.11786/sypfbxzz.1674-1293.20160202
国家自然科学基金(81472892);国家自然科学基金•青年科学基金(81202136);全军医学科技青年培育基金(14QNP010)
030001 太原,山西医科大学第二临床医学院(张杨梅);北京军区总医院全军皮肤损伤修复研究所(张杨梅,李海涛,王聪敏,祝贺,敖俊红,杨蓉娅)
张杨梅,在读硕士研究生,住院医师,研究方向:真菌感染性皮肤病,E-mail: zhangyangmei1990@sina.com
杨蓉娅,E-mail: yangrya@sina.cn
(2015-11-30
2016-01-28)

