毛细管电泳基因扫描和凝胶电泳异源双链分析在免疫球蛋白/T细胞受体基因重排检测中的应用研究*
陈杰 郑可 张文燕 孙林雍 唐源 严嘉琦 赵莎 刘卫平
(四川大学华西医院病理科, 四川 成都 610041)
·论著·
毛细管电泳基因扫描和凝胶电泳异源双链分析在免疫球蛋白/T细胞受体基因重排检测中的应用研究*
陈杰 郑可 张文燕 孙林雍 唐源 严嘉琦 赵莎 刘卫平
(四川大学华西医院病理科, 四川 成都 610041)
目的 探讨免疫球蛋白轻链IgK及T细胞抗原受体(TCRγ)基因重排更有效的检测方法。 方法 收集四川大学华西医院病理科2013~2014年淋巴组织增生性病变石蜡样本共139例,采用BIOMED-2系统扩增,分别使用毛细管电泳基因扫描和凝胶电泳异源双链分析两种方法进行IgK和TCRγ基因重排检测,比较不同方法之间的检出率。 结果 81例行IgK基因重排检测,其中59例病理诊断为B细胞淋巴瘤,毛细管电泳基因扫描检出阳性47例(79.66%),凝胶电泳异源双链分析检出阳性34例(57.63%),二者差异有统计学意义(P=0.01)。58例行TCRγ基因重排检测,其中26例病理诊断为T细胞淋巴瘤,毛细管电泳基因扫描检出阳性21例(80.77%),凝胶电泳异源双链检出阳性17例(65.38%),差异无统计学意义(P=0.211)。 结论 毛细管电泳基因扫描在抗原受体基因重排检测中比凝胶电泳异源双链分析有更好的检测灵敏度。
毛细管电泳; 凝胶电泳; 基因重排; BIOMED-2系统
免疫球蛋白(Immunoglobin, Ig)和T细胞受体(T cell receptor, TCR)基因重排检测是淋巴组织增生性疾病的重要辅助诊断手段,其基本原理是淋巴组织肿瘤起源于单个恶性转化的淋巴细胞,相同的克隆具有相同的基因重排方式。因此,淋巴组织增生克隆性分析的常用检测方法,常规用于石蜡包埋组织。四川大学华西医院病理科分子病理室采用BIOMED-2标准化的Ig和TCR基因重排克隆性分析系统合成引物并行扩增反应,其结果分析采用聚丙烯酰胺凝胶跑电泳结合异源双链分析检测目标条带[1-2];在2014年逐步替换为毛细管电泳基因扫描,使用InVivoScribe Technologies公司商品化试剂进行Biomed-2扩增,扩增后使用ABI3500基因分析仪行毛细管电泳,检测其目标扩增峰[3]。本文将对比毛细管电泳基因扫描和凝胶电泳异源双链分析两种方法在抗原受体基因重排检测中的差异。
1 材料与方法
1.1 材料 收集四川大学华西医院病理科2013~2014年淋巴组织增生性病变139例,均为10%中性缓冲福尔马林固定石蜡包埋组织样本。
1.2 方法
1.2.1 DNA提取 使用QIAGEN FFPE DNA提取试剂盒提取DNA;并检查浓度备测。扩增管家基因β-globin检测其质量。
1.2.2 引物 室内合成引物和商品化试剂盒的引物相同:IgK: Vk1f/6, Vk2f,Vk3f,Vk4,Vk5,Vk7,Jk1-4,Jk5,Kde,InTR;TCRγ:Vr1f,Vr10,Vr9,Vr11,Jr1.1/2.1,Jr1.3/2.3。
1.2.3 凝胶电泳异源双链分析 所有样本均使用天根公司商品化BufferMix加Taq酶及室内合成的引物配制反应体系,进行Biomed-2扩增,反应结束后行异源双链分析,最后使用聚丙烯酰氨凝胶电泳检测目标条带。
1.2.4 毛细管电泳基因扫描法 所有样本均使用InVivoScribe Technologies公司的IdentiCloneTMIGK Gene Clonality Assay、IdentiCloneTMTCRγ Gene Clonality Assay试剂盒及ABI公司的AmpliTaq Gold Taq酶配制反应体系,进行Biomed-2扩增,随后配制检测体系行异源双链分析,使用ABI3500基因分析仪跑毛细管电泳,结果使用GeneMapper软件进行分析。两种方法均使用相同的IgK及TCRγ阳性和阴性对照品,空白对照使用灭菌去离子水。
1.3 结果判读标准 两种方法的扩增片段范围一致。IgK TubeA扩增条带/扩增峰范围:120~160 bp、190~210 bp、260~300 bp,TubeB为:210~250 bp、270~300 bp、350~390 bp;TCRγ TubeA扩增条带/扩增峰范围:145~255 bp,TubeB为80~220 bp。凝胶电泳异源双链分析的结果在目标片段范围内可见清晰条带,边缘整齐,宽<1 mm,视为有克隆性重排;若条带显色较弱视为弱阳性;呈现涂片状(smear)则为阴性[4]。毛细管电泳基因扫描的结果在目标片段范围内查见明显的尖锐扩增峰,且峰高超过10 000可视为有克隆性重排;若扩增峰高度在10 000以下视为弱阳性;若呈现连续的波浪小峰或者数个低矮杂乱峰、甚至无峰出现则为阴性[3]。IgK检测中其TubeA反应结果会在146 bp处出现一高度在10 000以内的非特异性扩增峰,应不纳入判读范围。
1.4 统计学方法 用SPSS软件进行统计分析,两组结果比较采用2检验,P<0.05为差异有统计学意义。
2 结果
2.1 病理诊断 139例样本的病理诊断为B细胞淋巴瘤62例,T细胞淋巴瘤31例,霍奇金淋巴瘤9例,不典型淋巴组织增生9例,炎性病变(包括Kikuchi病)9例,淋巴组织反应性增生12例,EB病毒相关淋巴增生性病变3例,Langerhans细胞组织细胞增生症1例,脾脏淤血伴髓外造血1例,骨髓造血细胞增生活跃2例。
2.2 DNA质量检测 提取的DNA经质控引物扩增均获得100~400 bp目标条带,符合检测要求。
2.3 IgK和TCR基因重排检测结果 139例样本中81例进行了IgK基因重排检测,48例(59.26%)毛细管电泳基因扫描检出克隆性重排,35例(43.21%)凝胶电泳异源双链分析法检出克隆性。58例进行了TCR基因重排检测,32例(55.17%)毛细管电泳基因扫描检出克隆性重排(表1)。
2.4 B细胞淋巴瘤的IgK和TCR基因重排检测结果 62例B细胞淋巴瘤,其中59例用两种方法同时进行了IgK检测,毛细管电泳基因扫描法检出克隆性重排47例(79.66%),凝胶电泳异源双链分析法检出克隆性重排34例(57.63%)(图1)。两组结果比较,差异有统计学意义(P<0.05)。另外3例同时进行了TCRγ基因检测,均未检出克隆性重排。
2.5 T细胞淋巴瘤的IgK和TCR基因重排检测结果 31例T细胞淋巴瘤,其中26例用两种方法同时进行了TCRγ基因重排检测,毛细管电泳基因扫描检出克隆性重排21例(80.77%),凝胶电泳异源双链检出克隆性重排17例(65.38%)(图2)。2检验比较显示二者差异无统计学意义(P=0.211)。余5例行IgK基因重排检测,均未检出克隆性重排。

表1 139例淋巴组织增生性病变IgK/TCR基因重排检测结果[n(×10-2)]
注:ND:未检测;MALToma:黏膜相关淋巴组织结外边缘区淋巴瘤。
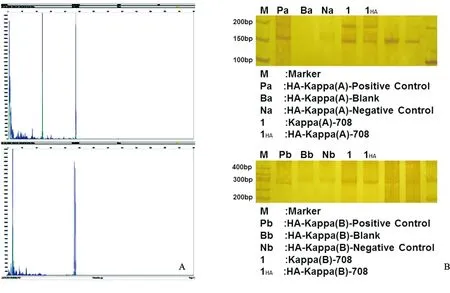
图1 弥漫大B细胞淋巴瘤基因重排检测结果
Figure 1 Positive results of Igk in diffuse large B cell lymphoma by capillary electrophoresis and gel electrophoresis
注:A.毛细管电泳TubeA在120~160 bp及260~300 bp范围内见克隆性扩增峰,TubeB在270~300 bp范围内见克隆性扩增峰;B.凝胶电泳TubeA在120~160 bp及260~300 bp范围内见克隆性扩增条带,TubeB在270~300 bp范围内见克隆性扩增条带。

图2 淋巴组织反应性增生基因重排检测结果
Figure 2 Negative results of Igk in reactive hyperplasia by capillary electrophoresis and gel electrophoresis
注:A.毛细管电泳;B.凝胶电泳;两种方法TubeA、TubeB在目标范围内均未查见克隆性扩增峰/扩增条带。

图3 外周T细胞淋巴瘤基因重排检测结果(非特指)
Figure 3 Positive results of TCRγ in peripheral T cell lymphoma by capillary electrophoresis and gel electrophoresis
注:A.毛细管电泳TubeA在145~255 bp范围内见克隆性扩增峰,TubeB在80~220 bp范围内见克隆性扩增峰;B.凝胶电泳TubeA在145~255 bp范围内见克隆性扩增条带,TubeB在80~220 bp范围内见克隆性扩增条带.
2.6 其他淋巴组织增生性疾病的IgK和TCR基因重排检测结果 12例反应性增生,7例行IgK检测,其中毛细管电泳基恩扫描阳性1例(14.29%),凝胶电泳异源双链结果为阴性(图3);5例进行了TCRr检测,其中毛细管电泳基因扫描检出阳性2例(40%),凝胶电泳异源双链检出阳性1例(20%),余为阴性(图4)。
3 讨论
B或T淋巴细胞在分化成熟过程中免疫球蛋白或T细胞受体基因发生重排,形成数目庞大的不同克隆。与反应增生淋巴组织中的多克隆淋巴细胞不同,淋巴瘤的发生被认为是B或T淋巴细胞被阻断在其分化过程中某一阶段而造成淋巴细胞的克隆性增生所致,淋巴瘤肿瘤细胞来自于同一克隆(少数为寡克隆),具有一致的基因重排。多数淋巴增生性疾病通过组织形态学观察及免疫表型分析能够明确诊断,但仍有5%~10%的病例需要通过分子水平的克隆性分析来协助确定病变性质。早在1990年就已经将PCR技术应用于检测淋巴细胞基因重排以助判断其增生的克隆性,但由于引物覆盖率低,致使很多假阴性出现。为解决引物设计所致的假阴性,并标准化该项PCR检测技术,欧洲7个国家47家研究所组织了“欧洲BIOMED-2协同研究”,成功设计出了BIOMED-2系统,该系统设计了107种引物,被组合在18个多重引物扩增管中且具有互补性,可以检测出几乎全部的B细胞、T细胞基因重排片段。后续的大量研究证实BIOMED-2系统被适用于各种亚型淋巴瘤的基因重排检测[5-19]。

图4 淋巴组织反应性增生基因重排检测结果
Figure 4 Negative results of TCRγ in reactive hyperplasia by capillary electrophoresis and gel electrophoresis
注:A.毛细管电泳,B.凝胶电泳;两种方法TubeA、TubeB在目标范围内均未查见克隆性扩增峰/扩增条带。
本研究采用BIOMED-2系统中IgK及TCRγ引物组合进行基因重排检测,所有139例样本内参质控引物扩增均得到300 bp以上的产物,均符合BIOMED-2系统片段范围。在进行IgK基因重排检测的81样本中,59例最终诊断为B细胞淋巴瘤,包括弥漫大B细胞淋巴瘤、套细胞淋巴瘤、胃黏膜相关淋巴组织淋巴瘤等七种亚型,毛细管电泳基因扫描检出阳性47例(79.66%),而凝胶电泳异源双链分析检出阳性34例(57.63%),在统计学上两种方法差异有统计学意义(P=0.01)。在进行TCRγ基因重排检测的59样本中,26例最终诊断为T细胞淋巴瘤,包括NK/T细胞淋巴瘤、外周T细胞淋巴瘤(非特指)、间变性大细胞淋巴瘤等六种亚型,毛细管电泳基因扫描检出阳性21例(80.77%),凝胶电泳异源双链检出阳性17例(65.38%),在统计学上两种方法差异无统计学意义(P=0.211)。上述结果提示B细胞淋巴瘤的IgH基因重排检测,毛细管电泳基因扫描更加敏感、检出率更高。就其可能的原因,包括:凝胶电泳使用的是室内合成引物,由于引物在合成、配制中存在诸多影响因素,反复冻融亦会导致引物降解、扩增效率变低,以至于在BIOMED-2扩增后观察不到明确的克隆性条带;而毛细管电泳使用的商品化试剂盒,其引物、Buffer等均为标准化生产的,其试剂稳定性更好,扩增效率更好。凝胶电泳结果采用聚丙烯酰胺凝胶经过电泳后,使用银染法显色观察,聚丙烯酰胺凝胶配制的好坏,染色、显色的质量均直接影响到结果判断,且聚丙烯酰胺凝胶需肉眼观察,受限于分辨率,其结果存在不确定性。而使用毛细管电泳检测进行的是片段的分析,PCR产物在毛细管中电泳,经激光照射后由信号收集器收集荧光信号,最后由软件自动计算并以扩增峰的形式显示结果,其结果可以明确知道每个扩增片段的条带位置及扩增峰高度,即使少量的扩增片段亦可以收集到激光信号,敏感性和准确性均高于聚丙烯凝胶电泳。
12例淋巴组织反应性增生样本中7例进行IgK检测,毛细管电泳检出阳性1例;5例进行TCRγ检测,毛细管电泳检出阳性2例,凝胶电泳检出阳性1例。尽管例数不多,但是没有呈现毛细管电泳基因扫描检测基因重排的过度敏感或假阳性增加的趋势。
4 结论
本研究通过同一组病例的两种实验方法比较结果表明:毛细管电泳基因扫描因采用并经过相关卫生管理机构认证的商品化试剂盒,具有很强的规范性和稳定性,较传统的凝胶电泳异源双链分析有更高的检测灵敏度,更好的阳性检出率;可以减少重复率提高工作效率;能够提高淋巴瘤基因重排的检测准确率,是实验室标准化的最佳选择。
[1]van Dongen JJ, Langerak AW, Brüggemann M,etal. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936[J]. Leukemia, 2003,17(12):2257-2317.
[2]Liu H, Bench AJ, Bacon CM,etal. A practical strategy for the routine use of BIOMED-2 PCR assays for detection of B- and T-cell clonality in diagnostic haematopathology[J]. Br J Haematol, 2007,138:31-43.
[3]Fan H, Robetorye RS.Detection of clonal T-cell receptor beta and gamma chain gene rearrangement by polymerase chain reaction and capillary gel electrophoresis[J].Methods Mol Biol, 2013,999:169-188.
[4]唐源, 江炜,李雷,等.BIOMED-2系统引物用于检测T细胞淋巴瘤石蜡样本T细胞受体γ基因重排的研究[J].中华病理学杂志,2009,38(4):253-257.
[5]Swerdlow SH, Campo E, Harris NL,etal. WHO Classification of Tumors of Haematopoietic and Lymphoid Tissues[M]. Lyon: IARC, 2008.
[6]黄娟, 刘浩,曾凡才,等. BIOMED-2系统应用于B细胞非霍奇金淋巴瘤抗原受体基因重排检测的研究[J].泸州医学院学报,2015,38(5):437-440.
[7]秦海明, 匡丽,程琳,等. BIOMED-2基因重排检测在疑难淋巴组织增生性疾病诊断中的应用[J].诊断病理学杂志,2014,21(6):388-390.
[8]张建中, 晏良遂. PCR技术检测IgH和TCRγ基因重排机器在淋巴瘤诊断中的初步应用[J].中华病理学杂志,1993,22(6):337-340.
[9]钟梅, 吕亚莉,赵坡,等.异源双链鉴定法检测淋巴瘤lgH、TCRB基因重排[J].诊断病理学杂志,2004,11(4):255-256.
[10] Evans PA, Pott C, Groenen PJ,etal. Significantly improved PCR-based clonality testing in B-cell malignancies by use of multiple immunoglobulin gene targets. Report of the BIOMED-2 Concerted Action BHM4-CT98-3936[J]. Leukemia,2007, 21(2):207-214.
[11] Kokovic I, Jezersek Novakovic B, Novakovic S.Diagnostic value of immunoglobulin κ light chain gene rearrangement analysis in B-cell lymphomas[J].Int J Oncol, 2015,46(3):953-962.
[12] 潘鑫艳, 冯强,黎贵芸,等. BIOMED-2引物系统检测T 淋巴母细胞性淋巴瘤/急性淋巴细胞白血病中Ig /TCR 基因重排[J]. 临床与实验病理学杂志, 2015,31(10):1131-1139.
[13] 闫庆国, 黄高, 王哲,等. BIOMED-2 标准化的IG/TCR 基因重排克隆性分析系统及其应用研究[J]. 诊断病理学杂志, 2008,5(4):307-309.
[14] 潘云, 李甘地,刘卫平. 淋巴母细胞淋巴瘤及其分子遗传学研究进展[J].中华病理学杂志,2005,34(4): 236-239.
[15] 闫庆国, 郭英,黄高. T 、B 细胞受体基因重排克隆性分析的应用要略[J].诊断病理学杂志, 2004, 11(2):113 -115.
[16] 田晓峰, 许良中,何开玲,等.PCR检测恶性淋巴瘤基因重排的方法学探讨[J].实用肿瘤杂志,1999,14(3):180-181.
[17] 陆俐丽, 林贤东,郑天荣,等. B 细胞淋巴瘤IgH 基因重排的检测及临床应用[J]. 福建医药杂志, 2007,9(6):77-79.
[18] 张振中, 吴逸明,徐玉宝,等. 短链线性聚丙烯酰胺-毛细管电泳分析DNA片段[J]. 中国药科大学学报,2000,31(3):196-198.
[19] 王萍, 王瑞年,卢健,等. 非霍奇金淋巴瘤的IgH 和TCRδ基因重排[J]. 临床与实验病理学杂志,2002,18:21-23.
Comparative study of capillary electrophoresis-genescan and polyacrylamide gel electrophoresis-heteroduplex polymorphism in detecting IG/TCR gene rearrangement
CHEN Jie,ZHENG Ke,ZHANG Wenyan,et al
(DepartmentofPathology,WestChinaHospital,Sichuanuniversity,Chengdu610041,China)
Objective To compare the sensitivity of immunoglobulin heavy chain (IGH) gene rearrangement, immunoglobulin light chain(IgK) rearrangement and TCRγ gene clonal rearrangment by capillary electrophoresis (CE)-genescan and polyacrylamide gel electrophoresis(PAGE)-heteroduplex polymorphism, then establish a more effective method in detecting gene rearrangement. Methods DNA was extracted from paraffin embedded tissues in 139 patients of lymphoproliferative disease which collected from Department of Pathology, West China Hospital of Sichuan University in the period of 2013 to 2014. Clonal gene rearrangement was detected by PAGE-heteroduplex polymorphism and CE-genescan and compare the sensitivity of the two methods. Results 81 patients were positive for IgK rearrangement. 59 cases were diagnosed as B-cell lymphomas. 47 cases (79.66%) were positive for IgK rearragement by CE-genescan, whereas the positive rate was 57.63% by PAGE-heteroduplex polymorphism. 58 cases were positive for T-cell receptor (TCRγ) gene rearrangement. 26 of these were diagnosed as T-cell lymphomas. 80.77% (21/26) and 65.38%(17/26) TCRγ clonality were detected by CE-genescan and by PAGE-heteroduplex polymorphism, respectively. In composition, The positive rate of the former was higher than that of the latter, and there was a significant difference in the IgH rearrangement (P=0.01 ), while there was no significant difference in TCRγ rearrangement (P=0.211 ). Conclusion CE-genescan has a higher detecting sensitivity to antigen receptor gene rearrangement than PAGE-heteroduplex polymorphism. It’s an efficient detection of gene rearrangement.
Capillary electrophoresis; Gel electrophoresis; Gene rearrangement; BIOMED-2 system
国家自然科学基金(81272626)
张文燕,教授,本刊审稿专家,E-mail:zhangwenyanpath@163.com
R-331; R 733
A
10.3969/j.issn.1672-3511.2016.11.003
2016-07-26; 编辑: 张文秀)

