ERCC1、TUBB3、RRM1、TOP2A基因联合检测在中晚期食管癌个体化治疗中的应用
李伟民,赵建亭,杨晓光,程鑫,闫冀豫,邝文明
(鹤壁市人民医院,河南鹤壁458030)
ERCC1、TUBB3、RRM1、TOP2A基因联合检测在中晚期食管癌个体化治疗中的应用
李伟民,赵建亭,杨晓光,程鑫,闫冀豫,邝文明
(鹤壁市人民医院,河南鹤壁458030)
目的 观察癌组织中切除修复交叉互补基因1(ERCC1)、β微管蛋白3(TUBB3)、核苷酸还原酶亚基1(RRM1)、拓扑异构酶ⅡA(TOP2A)基因联合检测指导中晚期食管癌患者个体化治疗的效果。方法 将108例中晚期食管癌患者随机分为观察组72例和对照组36例,对照组采用顺铂联合5-氟尿嘧啶化疗,观察组先用分支DNA液相芯片技术检测食管癌组织中的ERCC1、TUBB3、RRM1、TOP2A基因,根据检测结果制定个体化治疗策略。评价两组临床总有效率(RR),记录疾病进展时间(TTP)、中位生存时间(OS),观察不良反应。结果 观察组和对照组RR分别为52.78%、30.56%,P<0.05;观察组、对照组中位TTP分别为10.8、5.6个月,OS分别为10.0、12.7个,P均<0.05。观察组严重恶心呕吐、血红蛋白减少发生率低于对照组 (P均<0.05)。结论 ERCC1、TUBB3、RRM1、TOP2A基因联合检测指导中晚期食管癌个体化治疗,可显著提高患者近期疗效,改善预后,减轻不良反应。
食管癌;切除修复交叉互补基因1;β微管蛋白3;核苷酸还原酶亚基1;拓扑异构酶ⅡA;个体化治疗
食管癌是我国常见恶性肿瘤之一,病死率居各类恶性肿瘤第4位。由于早期食管癌无特异性临床症状,大多患者确诊时已为中晚期,错失最佳手术治疗时机,预后较差,化疗是其主要的姑息疗法[1]。近年来研究[2]表明,肿瘤细胞DNA修复及其相关基因的表达是导致药物反应个体化差异的主要因素。提示前瞻性地检测肿瘤基因,并根据检测结果制定个体化治疗方案,可提高化疗疗效。2012年2月~2015年8月,我们在检测中晚期食管癌患者癌组织切除修复交叉互补基因1(ERCC1)、β微管蛋白3(TUBB3)、核苷酸还原酶亚基1(RRM1)、拓扑异构酶ⅡA(TOP2A)基因表达水平的基础上制定个体化治疗策略,并评估其在提高疗效和改善预后等方面的价值。现报告如下。
1 资料与方法
1.1 临床资料 纳入标准:①经病理确诊为中晚期食管癌,均已错失手术治疗时机或术后复发;②美国东部协作肿瘤组(ECOG)评分评价患者体力≤2分,预计生存期﹥3个月;③有临床可测量的病灶;④辅助化疗停止6个月或既往未行化疗;⑤血常规、基础骨髓功能及肝、肾功能均达到化疗标准。排除标准:①合并精神疾病、溃疡性结肠炎及严重心、肝、肺、肾等重要脏器疾病者;②妊娠期或哺乳期患者;③临床、随访资料不完整者。选取同期鹤壁市人民医院肿瘤科收治的中晚期食管癌患者108例,男65例、女43例,年龄(46.94±5.58)岁;肿瘤位于食管上段8例,中段53例,下段47例;TNM分期Ⅱ期18例,Ⅲ期53例,Ⅳ期27例;曾行放疗72例。将患者随机分为观察组72例和对照组36例,两组临床资料具有可比性(P均>0.05)。本研究经院医学伦理委员会审批,患者均知情同意。
1.2 化疗方法 对照组采用顺铂(DDP)联合5-氟尿嘧啶(5-FU)化疗,DDP 20 mg/m2,5-FU 500 mg/m2,静脉滴注,第1~5天,28 d为1个周期,至少化疗4个周期。观察组则先采用分支DNA液相芯片技术检测食管癌组织中的ERCC1、TUBB3、RRM1、TOP2A基因,根据检测结果制定个体化治疗策略。ERCC1基因低表达选择DDP,TUBB3基因低表达或中表达选择多西他赛(DOC),RRM1基因低表达或中表达选择吉西他滨(GEM),TOP2A基因低表达选择依托泊苷(ETO)。用药剂量:DDP 25 mg/m2,静脉滴注,第1~3天,28 d为1个周期;DOC 75 mg/m2,静脉滴注,21 d为1个周期;GEM 1 000 mg/m2,静脉滴注,第1、8、15天,28 d为1个周期;ETO 100 mg/m2,静脉滴注,第1天,21 d为1个周期,至少化疗4个周期。一旦患者出现病情进展,则按照对照组治疗方案进行后续化疗,最多进行6个周期化疗。
1.3 疗效、预后及不良反应评价方法 参照实体瘤疗效评价标准1.0版进行疗效评价[3]。完全缓解(CR):肿瘤病灶全部消失,且至少维持4周;部分缓解(PR):肿瘤病灶总直径缩小≥30%;进展(PD):肿瘤病灶总直径增加≥20%或出现新发病灶;稳定(SD):介于PR、PD之间。总有效率(RR)=(CR+PR)/(CR+PR+SD+PD)×100%。患者均获得随访,随访终点为死亡或2016年2月29日,疾病进展时间(TTP)定义为从治疗开始到确定肿瘤病灶客观进展的时间,中位生存时间(OS)定义为从治疗开始到患者死亡或者末次随访的时间。根据NCI常见毒性分级标准(CTC3.0版)对治疗期间化疗不良反应程度进行评价[4],分为0~Ⅳ度。

2 结果
2.1 两组治疗效果比较 观察组CR 4例、PR 34例、SD 29例、PD 7例、RR 52.78%,对照组CR 1例、PR 10例、SD 18例、PD 7例、RR 30.56%;两组RR比较,P<0.05。
2.2 两组TTP、OS比较 观察组、对照组中位TTP分别为10.8、5.6个月,OS分别为10.0、12.7个月;两组TTP、OS比较,P均<0.05。
2.3 两组化疗不良反应发生率比较 观察组严重恶心呕吐、血红蛋白减少发生率低于对照组 (P均<0.05)。见表1。
3 讨论
化疗是中晚期食管癌患者主要的姑息疗法,以控制病情、提高生存质量、延长生存时间为主要治疗目的[5]。含DDP的化疗方案是目前治疗中晚期食管癌的主要方案,化疗有效率高,且价格低廉,但并非所有患者都可获益[6]。
个体化选择敏感药物,是中晚期食管癌患者化疗的关键所在。已有研究[7~10]报道,肿瘤对化疗药物的敏感性是由一系列相关基因共同调控的复杂过程,其中包括与铂类药物敏感性有关的ERCC1、与紫杉醇类药物敏感性有关的TUBB3、与ETO敏感性有关的TOP2A、与GEM敏感性有关的RRM1等。既往对上述肿瘤基因与患者化疗有效率和预后关系的回顾性研究较多,但临床根据上述肿瘤基因制定中晚期食管癌患者个体化治疗策略是否可行的研究尚不多见[11,12]。本研究采用分支DNA液相芯片技术对观察组食管癌组织中的ERCC1、TUBB3、RRM1、TOP2A基因表达水平进行检测,并根据检测结果制定个体化治疗策略,ERCC1基因低表达选择DDP、TUBB3基因低表达或中表达选择DOC、RRM1基因低表达或中表达选择GEM、TOP2A基因低表达选择ETO,对照组则接受DDP联合5-FU化疗。结果显示,观察组治疗有效率为52.78%,明显高于对照组(30.56%),差异具有统计学意义。此外,随访结果显示,观察组中位TTP、OS均较对照组有所延长,组间差异具有统计学意义。观察组严重恶心呕吐、血红蛋白减少发生率低于对照组。表明ERCC1、TUBB3、RRM1、TOP2A基因联合检测指导制定中晚期食管癌患者个体化治疗策略,可提高化疗有效率,延长中位TTP、OS,并且患者部分化疗不良反应严重程度明显减轻。根据肿瘤基因检测结果选择敏感化疗药物进行治疗可避免盲目的无效用药,减少化疗药物累加的毒性,进而显著减轻化疗不良反应;另外,选择敏感化疗药物治疗的有效率明显提高,患者的生存质量和化疗耐受性均有所提高,使患者完成化疗的积极性提高,并可能使患者一线治疗失败后可及时进行二线化疗或后续其他治疗,最终达到延长患者总生存时间的目的。
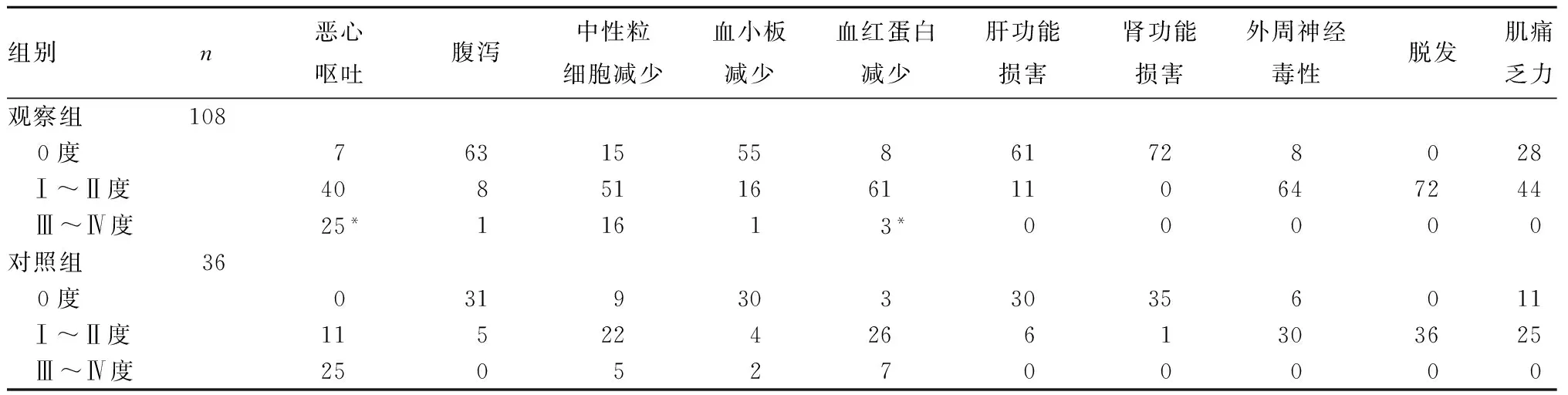
表1 两组化疗不良反应情况比较(例)
注:与对照组比较,*P<0.05。
综上所述,基因检测指导制定中晚期食管癌个体化治疗策略,可显著提高患者的近期治疗效果,改善预后,且可显著减轻化疗不良反应,提高化疗的耐受性,具有较高的临床应用价值。
[1] 赫捷.中国食管癌流行病学现状、诊疗现状及未来对策[J].中国癌症杂志,2011,21(7):501-504.
[2] Wang S, Pan H, Liu D, et al. Excision repair cross complementation group 1 is a chemotherapy-tolerating gene in cisplatin-based treatment for non-small cell lung cancer[J]. Int J Oncol, 2015,46(2):809-817.
[3] 任伟,闫婧.食管癌放化疗后近期疗效评价标准的研究进展[J].中华肿瘤杂志,2014,36(9):641-644.
[4] 李舰波,黄益波,郑志范.替吉奥和顺铂方案同步调强放疗治疗胸中上段及胸上段食管癌的临床研究[J].中国临床药理学杂志,2015,31(3):175-177.
[5] 林德荣,叶尚月,朱胜裕.调强放疗同步化疗治疗中晚期食管癌的疗效观察[J].中国癌症杂志,2014,24(2):157-160.
[6] Song T, Zhang X, Fang M, et al. Concurrent chemoradiotherapy using paclitaxel plus cisplatin in the treatment of elderly patients with esophageal cancer[J]. Onco Targets Ther, 2015,8:3087-3094.
[7] 刘萍.非小细胞肺癌组织中RRM1的表达与含吉西他滨方案耐药的关系[J].郑州大学学报:医学版,2011,46(6):876-878.
[8] Ozcan MF, Dizdar O, Dincer N, et al. Low ERCC1 expression is associated with prolonged survival in patients with bladder cancer receiving platinum-based neoadjuvant chemotherapy[J]. Urol Oncol, 2013,31(8):1709-1715.
[9] 郭智兴,林佳锐,陈智远,等.TUBB3在体外化疗药物敏感试验肝细胞癌标本中的表达及意义[J].广东医学,2012,33(18):2750-2753.
[10] Kaplan E, Gündüz U. Expression analysis of TOP2A, MSH2 and MLH1 genes in MCF7 cells at different levels of etoposide resistance[J]. Biomed Pharmacother, 2012,66(1):29-35.
[11] 丁龙龙.TOP2A基因预测蒽环类药物治疗乳腺癌疗效研究进展[J].中国实用外科杂志,2014,34(5):456-458.
[12] Huang ZL, Cao X, Luo RZ, et al. Analysis of ERCC1, BRCA1, RRM1 and TUBB3 as predictors of prognosis in patients with non-small cell lung cancer who received cisplatin-based adjuvant chemotherapy: A prospective study[J]. Oncol Lett, 2016,11(1):299-305.
赵建亭(E-mail: zjt2052@163.com )
10.3969/j.issn.1002-266X.2016.42.026
R458.3
B
1002-266X(2016)42-0074-03
2016-07-23)

