甲苯二异氰酸酯(TDI)致癌性的综合评估
Robyn L. Prueitt,Lorenz R. Rhomberg,管娜,Julie E. Goodman,金小伟
1. Gradient公司,马萨诸塞州剑桥市 02138,美国 2. 科思创聚合物(中国)有限公司,上海 200120 3. 中国环境监测总站,北京 100012
甲苯二异氰酸酯(TDI)致癌性的综合评估
Robyn L. Prueitt1,Lorenz R. Rhomberg1,管娜2,*,Julie E. Goodman1,金小伟3
1. Gradient公司,马萨诸塞州剑桥市 02138,美国 2. 科思创聚合物(中国)有限公司,上海 200120 3. 中国环境监测总站,北京 100012
甲苯二异氰酸酯(TDI)被数家机构分类为可能的人类致癌物,其主要依据为动物实验发现对啮齿动物经灌胃暴露TDI后肿瘤发生率升高。基于研究结果的可靠性以及一致性,综合评估了现有研究数据是否支持这一分类。结果显示现有的流行病学数据不足以有力证明TDI为人类致癌物。动物实验研究表明,吸入接触TDI并不导致肿瘤发生。经灌胃暴露后观察到的肿瘤很可能是由于TDI转化为已知的啮齿动物致癌物甲苯二胺(TDA)所致。在TDI吸入暴露的体内实验中,当由TDI转化生成的TDA不能达到具有显著生物学效应的浓度时,TDI对啮齿动物或人类都没有遗传毒性。由于哺乳动物在生理性接触条件下TDI不能转变成TDA,所以对人类而言,TDI接触与致癌效应之间无直接的显著因果关系。因此虽然在如灌胃等非生理暴露的条件下,TDI可能的人类致癌物的分类是正确的,但本文对其致癌研究数据的合理评估和正确理解有助于将产品监管力度集中于与职业暴露更相关的有害健康效应上。
异氰酸酯;证据权重;致癌性;风险评估;遗传毒性
异氰酸酯是具有广泛工业用途的高反应性化合物。甲苯二异氰酸酯(TDI)的最主要用途是生产聚氨酯泡沫塑料,该种塑料一般用于生产家具、寝具和汽车座椅等产品[1]。同时, TDI也用于生产弹性体、粘合剂和涂料[1-3]。人类接触TDI的主要途径是在生产和使用该工业原料的工作场所内经呼吸道吸入TDI蒸气、气溶胶,或者经皮肤接触。2种广泛使用的TDI异构体是2,4-TDI及2,6-TDI。80%的2,4-TDI和20%的2,6-TDI混合物(称为80/20TDI)是工业用途TDI的主要商业产品[3]。
国际癌症研究机构(IARC)认定TDI为可能的人类致癌物[2]。欧盟(EU)也把TDI归类为可疑的人类致癌物[4]。美国(US)国家毒理学规划处(NTP)也把TDI归类为可以合理预期的人类致癌物[1]。所有这些分类主要基于对啮齿动物经灌胃方式给予TDI后肿瘤发生率升高的实验结果[5]。Prueitt等[6]曾使用证据权重的假设为基础(HBWoE)的方法来评估现有的流行病学、实验动物学以及相关机理的研究结果是否支持TDI为人类致癌物,考察这些所谓支持TDI致癌性的研究结果是否可归因于其他解释。本文中,我们通过PubMed和Toxline收集了TDI致癌和遗传毒性相关的现有流行病学、实验动物学以及有关机理的研究,采用了类似的评估方法,着重评价现有研究结果的可靠性以及一致性,进而为TDI环境管理和分类提供一定的理论依据。
1 材料与方法(Materials and methods)
1.1 数据的收集与整理
数据收集是通过PubMed和Toxline数据库对所有有关TDI的潜在致癌性和遗传毒性的流行病学,实验动物和机制评估的研究进行了检索。检索词包括“甲苯二异氰酸”,“癌症”,“致癌物”,“赘生物”,“流行病学”,“基因毒性”,“致突变”和“染色体”。数据收集过程也参考了收集到的文献综述中引用的参考文献。最后从相关的研究中提取了所有的肿瘤和遗传毒性数据并制作成表,以方便定性评价TDI的潜在的、包括遗传毒性和非遗传的致癌性。
1.2 数据的统计分析与评价
质量评估是评价相关研究的科学完整性和有效性,包括具体的研究测试方法、统计方法等。一致性则是评价不同的种属(流行病学、动物毒理学研究、体外试验)或各种试验条件下重复实验结果是否都能得出相同或类似的结论,同时考虑剂量-效应关系和人的相关性等。本文通过评估相关研究的各个方面来系统、定性地评价每一个研究的质量。对于流行病学研究,评价暴露评估方法、统计方法和可能的混杂和偏倚;对于动物实验研究,评价染毒途径、统计方法和历史对照数据;遗传毒性研究则评价溶剂、暴露途径、样本大小和可能的混杂因子。此外,本文还定性地评估研究终点在研究中的一致性和重复性,如增加的肿瘤发病率是否是某种特定癌症,在不同层级的研究中(流行病学、动物毒理学研究、体外试验)的重复性,以及遗传毒性研究是否观察到类似的试验结果(阳性或阴性)。
2 结果与分析(Results and analysis)
2.1 流行病学研究
瑞典、英国(UK)和美国(US)共3项队列研究评价了TDI在职业暴露人群中的致癌风险。这些队列研究及研究结果说明如下,并总结于表1。
瑞典队列[7-9]自1965年起在每个工厂平均测量9次异氰酸酯的空气暴露值,并对每年的暴露估计值进行分类。英国队列[10-11]根据员工在每个工厂的工种履历估计暴露值,并采用英格兰和威尔士的相关值作为外部标准计算癌症发病率和死亡率。同时,也采用队列内部标准计算死亡率,包括使用6个分组变量:性别、年龄、工作年代、队列种类(包括首次进入队列并具备完整工种档案的员工,或在具备完整人员工种档案前被雇佣并在当日仍被雇佣的员工)、随访期以及暴露水平。在UK队列女性受试者中开展的一项巢式病例-对照研究测量了工人工作期间可能暴露其中的九大类物质。美国队列[12]获取了空气 TDI的浓度数据。这些数据来源于现存的公司和州政府空气TDI浓度数据资料,或者1984—1985年年间在3个工厂收集的暴露资料。该队列也收集了超过4 h的个体呼吸区域空气样本来测量TDI的浓度,同时,也固定采集了其他可能的空气污染物(见表1)。
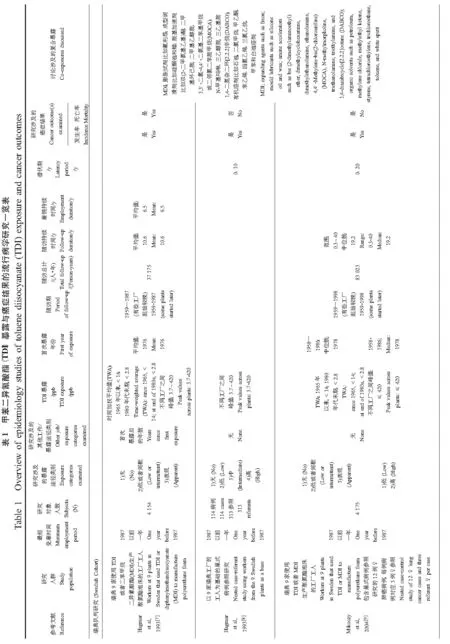
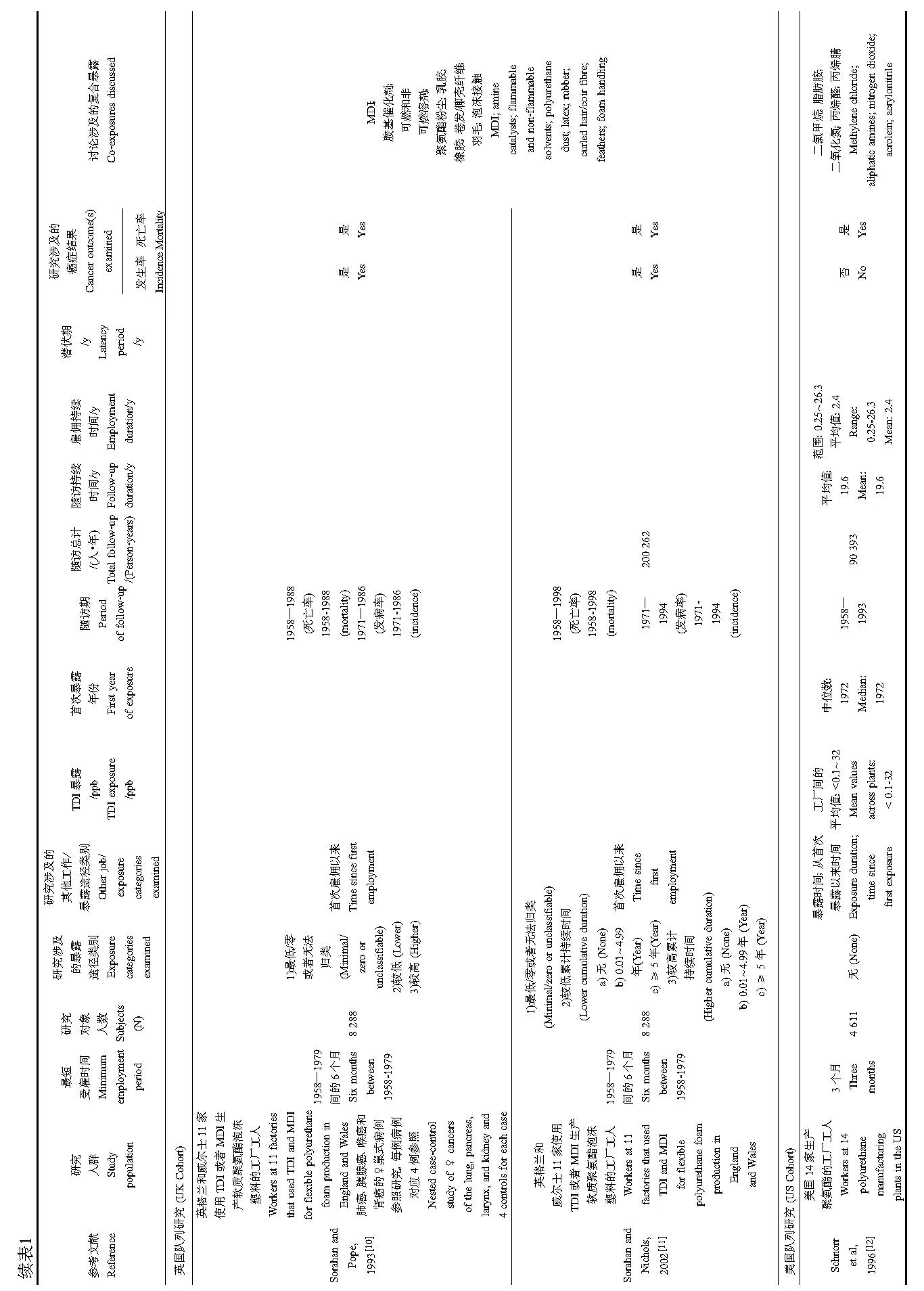
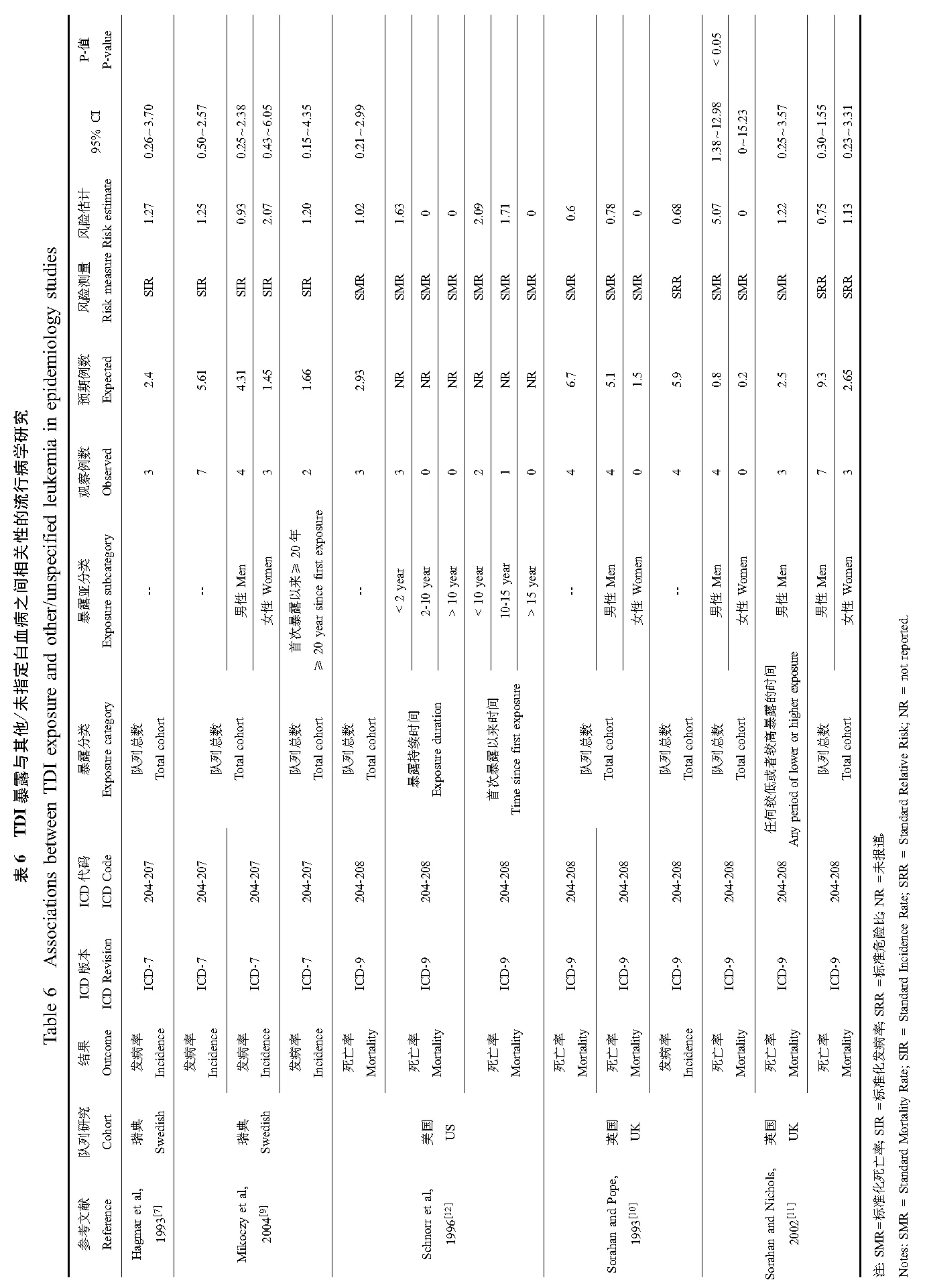
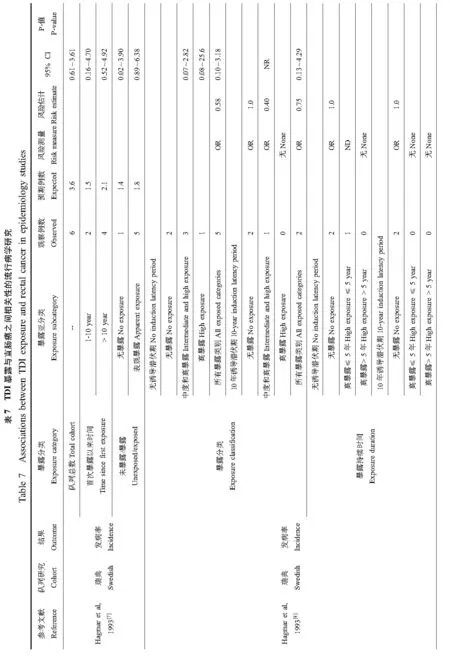
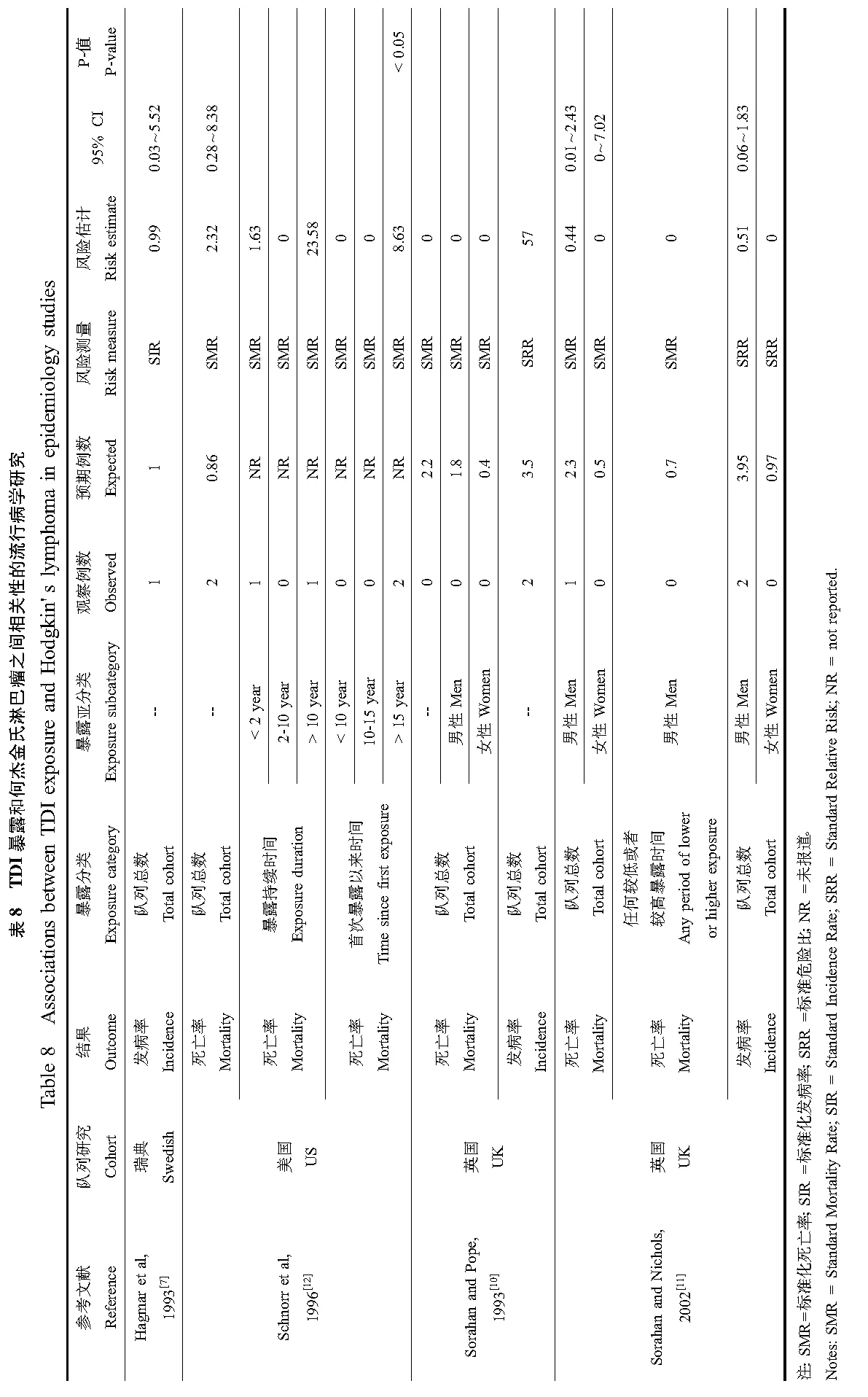
3项队列研究详细评估了多种癌症发病率和死亡率,但大多数研究并未发现异氰酸酯暴露与癌症发病或死亡之间的必然关联。但是,异氰酸酯与7种癌症发病或死亡的关联至少在一项研究中报道了。表2至表8呈现了相关研究结果包括肺癌、胰腺癌、喉癌、肾癌、白血病、直肠癌以及霍奇金氏病。
2.1.1 流行病学研究结果的一致性评估
为了评估异氰酸酯暴露与癌症之间的关系,我们评估了研究结果的一致性、特异性(只针对某种癌症)以及报道之间的可重复性。尽管每项研究都或多或少存在研究设计和统计学强度的差异,但如果甲苯二异氰酸酯确是某种癌症的致病因素,则可以预期在不同的研究中观测到特定的肿瘤类型。
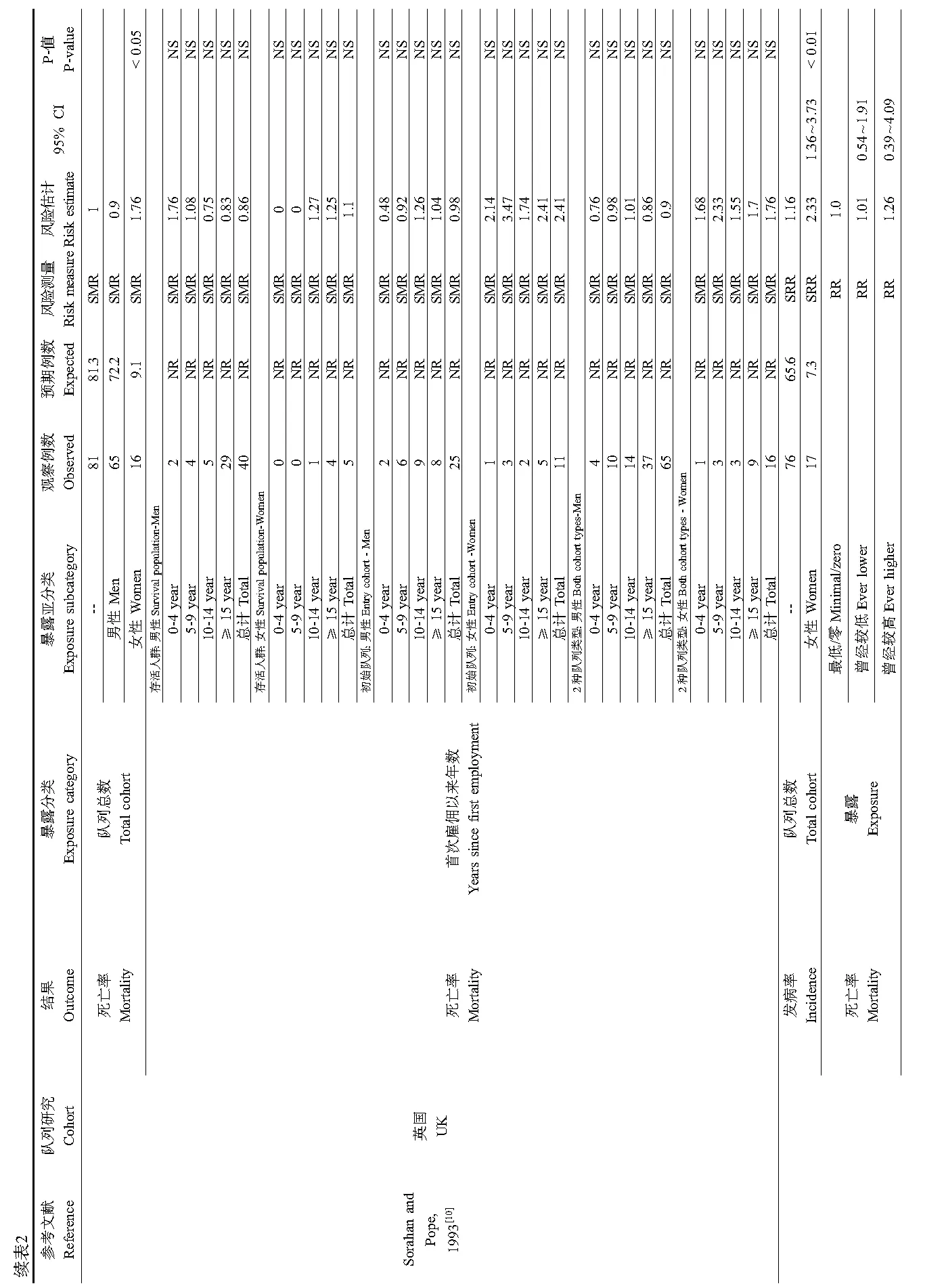
在5项关于肺癌的队列研究中,有3项研究报道了瑞典[9]和英国队列[10-11]中暴露于TDI的女性工人中肺癌发病率和死亡率升高,而男性工人中无此现象。一项较为早期的瑞典队列[7]和美国队列[12]并未观测到TDI与肺癌的关联。所有研究也未发现TDI暴露-效应关系。例如,Mikoczy等[9]在没有暴露/低暴露和长期显著暴露于TDI的女性工人中观测到了相似数量的肺癌发病。此外,英国队列研究也不支持TDI致肺癌的结论,因为该队列的肺癌仅发生于未暴露于异氰酸酯的女性[10-11]。
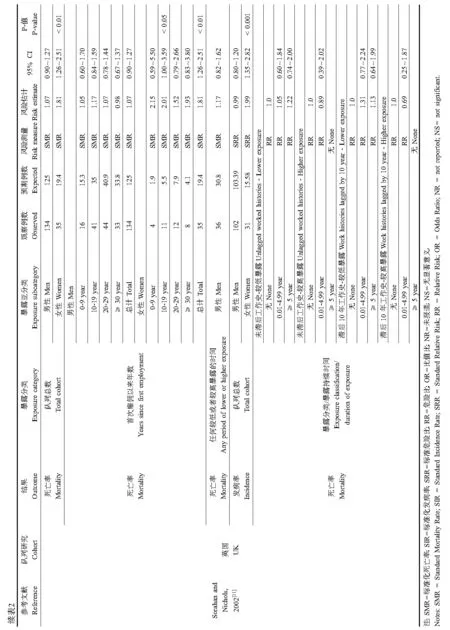
仅有英国队列的2项研究评估了TDI对喉癌的影响。这2项研究都观察到喉癌的发病率上升[10-11]。然而,Sorahan与Nichols[11]在新随访期间(1989—1994年)并未发现喉癌的新案例,似乎提示之前Sorahan与Pope[10]观测到的喉癌高发病率并未随研究时间的增加而持续上升,因此不完全支持TDI对喉癌的致癌效应。
尽管多项队列评价了TDI对其他癌症的可能致癌效应,仅一项研究报道了TDI可能增加这些癌症的风险。在4项评估TDI暴露对胰腺癌发病率和死亡率影响的研究中,只有Sorahan与Pope[10]在英国队列中报道了TDI可能只增加女性胰腺癌的发病风险。该队列在较长随访期后,以及在瑞典[9]和美国队列中[12],胰腺癌的发病风险都没有上升[11]。在3项关于TDI与肾癌的研究中,只有Sorahan与Pope[10]报道肾癌发病率上升,但未随随访期的延长而上升[11],另3项研究都未观察到肾癌死亡率上升[10-12]。所有6项关于直肠癌的研究中,只有Schnorr等[12]报道了其发病风险上升。美国队列中观测到的高直肠癌死亡率仅限于暴露于TDI少于2年的工人中,而作业时间大于2年或更长时间的工人中并未观测到类似的高死亡率。4项关于霍奇金氏病的研究中,Schnorr等[12]报道了美国工人中暴露于TDI至少15年后霍奇金氏病的死亡率增加,但瑞典[7]或英国队列[10-11]中未观测到此结果。
现有的5项关于综合白血病的研究中[7,9-12],TDI暴露与其发病率和死亡率没有关联。只有Sorahan与Nichols[11]评估了TDI对除淋巴、骨髓、或单核类以及未指定细胞类型的白血病外的综合白血病的影响,并发现男性工人的此种综合白血病死亡率上升。
对已报道的TDI可能致癌的研究中,我们还评估了其剂量-效应关系。因为没有实际测量的TDI浓度数据,本文使用估计的暴露水平、首次暴露时间以及总暴露长度来评估TDI可能的致癌风险。研究发现TDI与被评估的癌症都没有明显的剂量-效应关系。不仅如此,有些癌症发病风险随估计的暴露值增加而降低。例如,在英国队列中,所有女性肺癌和胰腺癌死亡病例都发生在未暴露于TDI的女性工人中,而在短期或长期暴露于TDI的女性中并未观测到肺癌和胰腺癌的死亡病例[10,11]。
总之,同队列或不同队列之间关于TDI暴露和癌症发病或死亡之间的关联性并不一致,仅有个别队列中的某项研究观察到TDI暴露与某些特定癌症存在一定的相关。
2.1.2 流行病学研究质量的评估
在现有队列研究中,很少存在TDI的暴露浓度测量值,绝大多数情况下,TDI暴露水平是根据工人的工作任务和工作场所或从履历表提示的工种来估计的。因为工厂中不同工作场所之间和同一场所内部的暴露程度存在很大差异[7],美国队列研究中从公司记录中得到的TDI的暴露信息并不一定反映其真实的暴露水平。Hagmar等[8]观测到暴露程度分类与空气中的TDI浓度之间缺乏线性关系,且就不同工厂的空气浓度而言该分类并不统一。此外,该暴露分类没有考虑到某具体工种的暴露强度可能随时间发生改变[11]。在现有流行病学研究中,缺乏准确的TDI暴露数据可能导致了暴露水平误差和/或暴露分类错误,从而降低研究结果的可信度[13-15]。
当采用不同统计方法分析数据或在一项研究中评估多种疾病与某种暴露因素的关联时,所得到的统计学结果在很大程度上受到多重比较的影响,产生的随机误差所导致的假阳性结果,除非对多重比较进行校正[16]。在以上所讨论的研究中评估与多种癌症的发病率和死亡率的关系,绝大多数队列采用了多种TDI的暴露条件,但是没有任何研究校正了多重比较。因此,所观测到的为数不多的阳性结果很可能是由于随机误差等偶然因素导致。并且如下文详细讨论所示,尽管在多项研究采用多种统计分析方法评估了TDI致癌的可能性,仅有一项研究,甚至是单项研究中的一个或几个分析中观测到了TDI与某特定癌症之间的关联。研究结果的不一致性进一步说明目前研究所采用的不恰当的统计方法很可能导致假阳性结果的出现,也进一步说明目前流行病学研究尚缺乏足够的TDI致癌性证据。




在所有的聚氨酯泡沫塑料制造厂中,工人还暴露于除TDI以外的大量的其他化学物质,但目前流行病学研究未关注这些协同暴露物或混合暴露情况。瑞典和英国队列未区分TDI与MDI(二苯甲烷二异氰酸酯)的致癌影响,而只评估了2种混合异氰酸酯的暴露而非仅针对TDI。此外只有Sorahan与Pope[10]的研究试图评估除异氰酸酯之外的其他协同暴露化学物质对人类致癌的影响。一项英国女性工人巢式病例-对照研究了9种暴露物质对肺癌、胰腺癌、喉癌和肾癌发病率和死亡率的影响。这9种暴露物包括胺类催化剂、非易燃溶剂、易燃溶剂、聚氨酯尘埃、乳胶、橡胶、卷毛/椰壳纤维、羽毛和泡沫塑料。统计结果显示无论现阶段暴露于这些物质或5年甚至10年前的暴露都与致癌无关,这从某种角度上提示这些物质并不是TDI和癌症研究中可能的混杂因素。
吸烟被认为可能是英国和瑞典队列中观测到的女性工人肺癌发病风险上升的混杂因素。Sorahan与Pope[10]在英国队列中比较了所有可能与吸烟有关的癌症(肺、舌、口、咽、食道、胰腺、喉、膀胱、泌尿)与其他所有癌症的标准化死亡率(SMR)。对女性来说,死亡率仅在与吸烟相关的癌症患者中升高,说明女性工人的吸烟习惯可能导致了死亡率的上升。相反,Mikoczy等[9]认为吸烟不是英国和瑞典队列中女性肺癌发病风险上升的原因,因为同期男性肺癌并未上升。并且虽然吸烟是心血管疾病的危险因素,但女性心血管疾病标准化死亡率(SMR)也未见上升。由于现有队列研究缺乏具体的吸烟信息,目前流行病学研究尚不能充分评估吸烟对TDI可能致癌性的潜在影响。
目前流行病学研究并未考虑其他混杂因素的影响例如肥胖或饮食。这些因素可能增加某些癌症的发病风险,例如在英国队列的初始研究中观察到的女性肾癌和胰腺癌的高发病率等[10]。此外,某些报道的TDI致癌风险即使可信也可能是其他因素如吸烟或其他暴露物所导致。
2.2 动物实验研究
TDI的长期致癌性的研究有对大鼠和小鼠吸入[17]或灌胃[5,18]2种方式染毒(表9),表10至16归纳总结了接触TDI后发病率上升的7种癌症类型的研究结果。Loeser[17]对不同组的Sprague-Dawley(SD)大鼠和CD-1小鼠通过全身暴露方式接触浓度分别为0、0.05 ppm或0.15 ppm(0、0.36或1.07 mg·m-3)的80/20TDI蒸气长达2年,发现从小鼠实验获得的肿瘤发生率和恶性发生率无法推导出与暴露相关的致癌作用。相较于对照组,在暴露组中仅有的看起来发病率升高的肿瘤类型是在低剂量和高剂量的雄性小鼠中的多发性肺腺瘤及在低剂量的雄性小鼠中的造血和淋巴网状内皮系统的淋巴瘤。
NTP[5]通过灌胃将F344/N大鼠和B6C3F1小鼠暴露于与标准湿度(0.05%)玉米油混合的80/20TDI。管饲溶液在室温下储存于干燥箱外不超过1周。给药组的存活率随剂量的增加而减低。
2.2.1 动物实验研究结果一致性评估
为了评估在生物测定中TDI暴露和癌症之间的因果关系,需考虑每一个癌症研究终点的结果一致性,癌症类型的特异性,不同研究结果的可重复性,量效关系和所观察到效应的生物学意义。对于TDI来说,由于缺乏相似设计的重复研究,无法评估相似剂量的多个研究中肿瘤发病率的升高和某一特定物种、性别和肿瘤类型的剂量-反应关系这两方面结果的一致性。由于仅有2项各涉及2个物种的研究,则只能评估是否特定的肿瘤终点在不同性别、物种和给药途径的研究中受到影响的一致性。如果影响是一致的,则说明肿瘤的特异性。
多发性肺腺瘤的发生只在吸入研究的小鼠中,并且仅在雄性小鼠中发现该类肿瘤发病率上升,且没有剂量-反应关系。吸入后的低剂量组雄性小鼠中和灌胃后高剂量组的雌性小鼠中淋巴瘤发病率上升。该研究中的同一研究终点都没有剂量-反应关系。如果TDI是小鼠淋巴瘤的特定致病因素,则不能解释TDI只在吸入暴露后的雄性小鼠中和灌胃暴露后的雌性小鼠中导致淋巴瘤。纤维瘤和纤维肉瘤的发病率,无论是作为单一肿瘤类型或两者合并,在灌胃暴露后的雄性大鼠中上升,而在吸入暴露后则未发现。雌性大鼠在灌胃暴露后,纤维瘤及纤维肉瘤的合并发病率也有上升,但在吸入研究中的雌性大鼠或在灌胃研究中的小鼠的发病率则都没有上升。良性乳腺肿瘤合并良性皮下肿瘤(而不是良性乳腺肿瘤的单一类型)的发病率仅在灌胃后的雌性大鼠中上升,且没有剂量-反应关系。

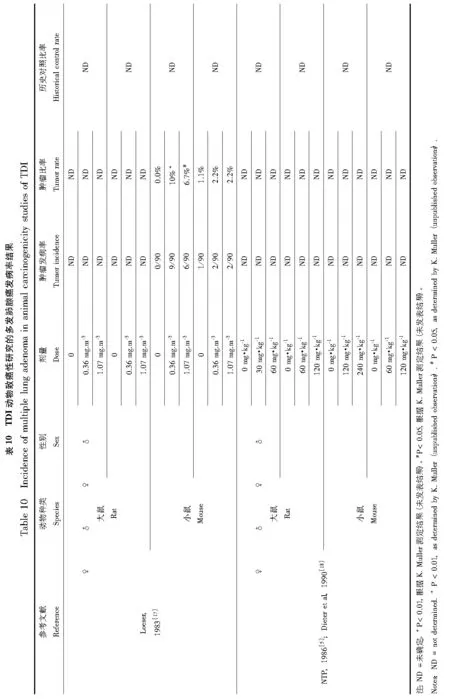
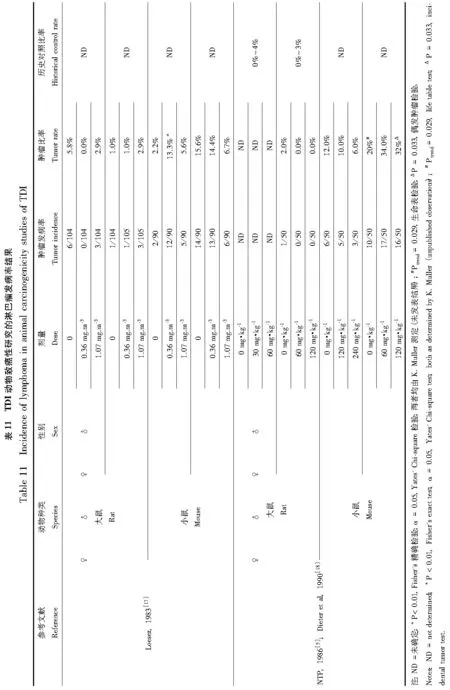
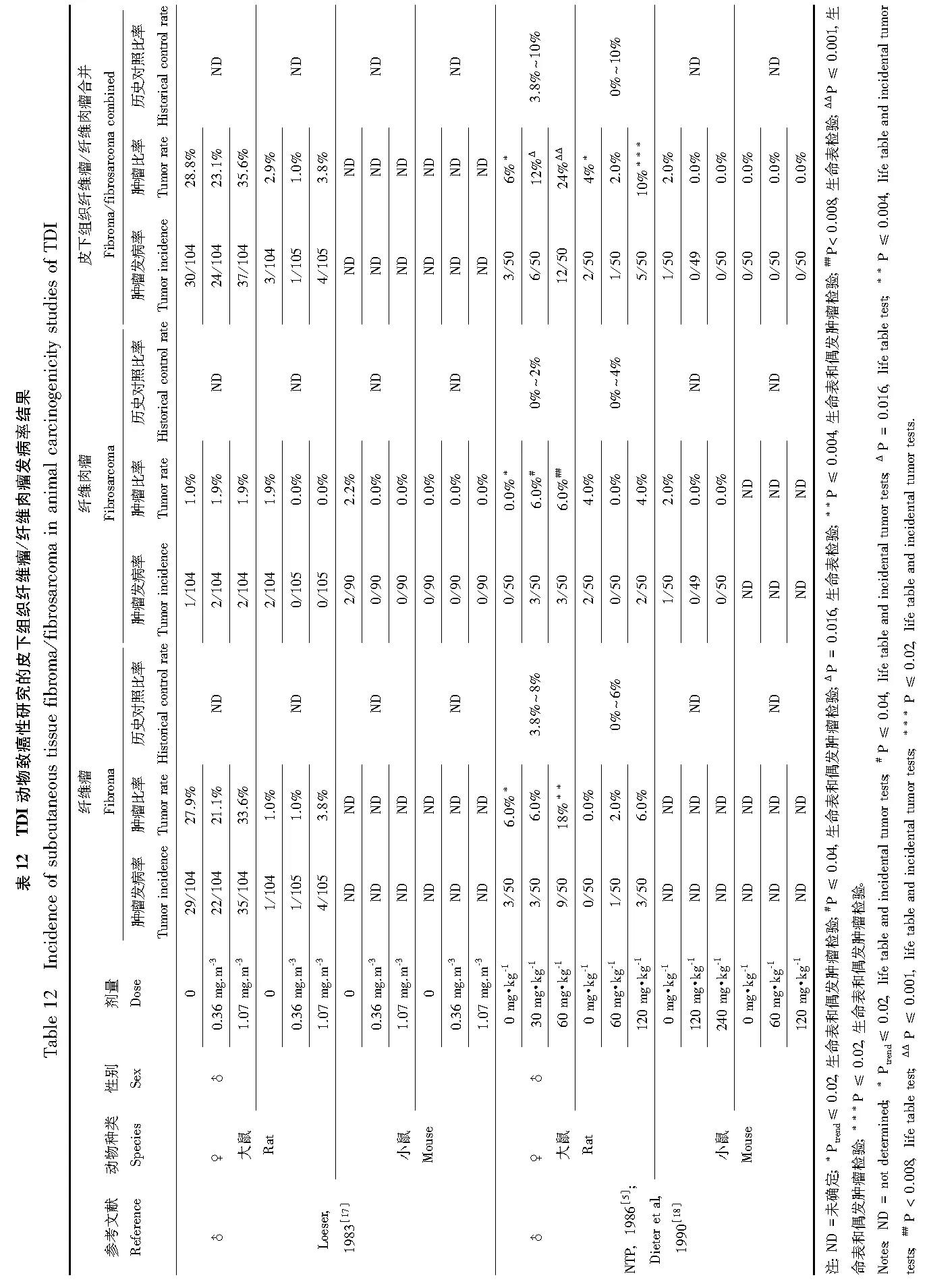




在胰腺中,腺泡细胞腺瘤发病率在灌胃暴露后的雄性大鼠中以剂量依赖的方式上升,而胰岛细胞腺瘤发病率仅在灌胃暴露后的雌性大鼠中上升,且不存在剂量-反应关系。胰岛细胞腺瘤和癌的合并发病率在灌胃暴露后的雄性大鼠中上升,但在雌性大鼠中没有上升。肝细胞腺瘤发病率仅在灌胃暴露后的雌性小鼠中发现有上升。肝细胞腺瘤及癌的合并发病率在灌胃的雌性小鼠中上升,但没有剂量-反应关系。雄性小鼠肝脏肿瘤的发病率没有上升,大鼠也没有上升(大鼠在吸入和灌胃研究中仅有肝细胞癌发病率的报道)。在吸入和灌胃研究的小鼠中以及灌胃研究的雄性大鼠中有循环系统的血管瘤和血管肉瘤发病率的报道。循环系统血管肉瘤发病率以及合并血管瘤及血管肉瘤发病率只有在灌胃给药后的雌性小鼠中有上升的报道,但是在灌胃后的大鼠或吸入后的小鼠中则没有上升。
有学者在TDI长期致癌研究中报道了不同物种、性别和暴露途径诱导肿瘤的不一致结果。多发性肺腺瘤发病率上升,而单肺腺瘤或肺癌发病率不上升,这一结果的生物相关性是令人不解的。在小鼠中,肺肿瘤发展首先为区域过度增生,然后发展为腺瘤并最终进展为腺癌[19]。但是这种过度增生—腺瘤—腺癌的连续在人体中则没有,人体很少出现肺上皮细胞的过度增生。在人体中,腺瘤被归类为极少或从来不会发展成癌症的肿瘤[20-21]。此外,许多小鼠品系,包括用于TDI吸入研究的CD-1系,有肺肿瘤的高背景发病率。因此,在TDI研究中发现的多发性肺腺瘤发病率升高很可能与人类无关。
许多小鼠品系也有淋巴瘤的高背景发病率,这通常是由于存在于这些小鼠中的内源性病毒,与给药和人类不相关[22]。造血系统恶性肿瘤的命名标准化在TDI吸入研究后有所改进,这说明TDI吸入暴露研究中报道的淋巴瘤诊断可能不准确,此外,TDI的高反应性使其作用不可能发生在远离暴露部位之处。对此目前还没有TDI吸入暴露引起淋巴瘤机理方面的清楚解释。
2.2.2 动物实验研究质量的评估
Loeser[17]的研究中的全身吸入暴露途径是评估人类接触TDI最相关的暴露场景,灌胃不是人类常见的暴露途径。研究表明,酸性环境(比如胃)有利于TDI的2个异氰酸酯基团水解形成甲苯二胺(TDA),而TDA是一种公认的啮齿动物遗传毒性致癌物[23]。在相对中性pH值的生物系统中(如呼吸道),TDI主要与生物分子(如蛋白质或糖类)形成加合物,而不是形成TDA[24-28]。在吸入暴露后,几乎没有任何自由TDA形成[29-31]。此外,TDI在蒸汽或气溶胶状态下并不水解为TDA[32-34];因此在Loeser[17]的研究中不太可能有任何TDA被吸入。
有证据表明TDI在NTP灌胃研究中使用的玉米油给药溶液中不稳定[5]。在研究的14个月期间使用的TDI形成了一种不透明的外观,并且含有0.3%不可溶聚脲和0.5%的已溶解、非挥发性的不明物质。作为给药溶液的溶剂所使用的“正常”玉米油含有0.05%左右的残留水分,而TDI在正常玉米油中会发生降解,室温下存放24 h后损失12%~26%的TDI,7 d后损失27%~80%。灌胃研究使用的给药溶液却是每周制备1次。因此,在该研究中使用的给药溶液除TDI以外还含有相当比例不明成分的反应产物。给药溶液中的TDI不仅在灌胃前降解,以及给药后在胃中进一步水解产生一定但无法确切量化的TDA,从而导致观察到的肿瘤发病率。与此相一致,使用80/20TDI灌胃诱导肿瘤的模式(即有哪些器官产生肿瘤)与NTP研究者们报道的2,4-TDA膳食暴露的肿瘤诱导模式[35,18]类似(表17)。此外,Sielken等[36]的一项近期研究比较了TDI和TDA癌症生物测定,并确定灌胃暴露于TDI后观察到的肿瘤与小部分(约5%)的给药剂量转变为TDA一致。由于极有可能小部分的TDI转变为TDA,所以可以合理推论TDA可能是灌胃暴露于TDI后观察到的致癌活性的原因。
Loeser[17]声称在他们的统计评估中没有发现在吸入生物测定中暴露和肿瘤发生率之间的关联,但是没有报道统计分析使用的方法或结果。Muller使用2种不同的统计方法对该研究得到的数据又进行了评估(K. Muller,未发表的数据)。第1种方法是使用单侧Fisher精确检验法对各剂量组与对照组进行成对比较。因为在各个分组中死亡模式十分相似,所以不需要进行存活校正。此种评估表明,相较于对照组,在2个TDI剂量组的雄性小鼠中的多发性肺腺瘤,以及在低剂量组的雄性小鼠中的造血/淋巴网状内皮系统淋巴瘤发生率差别达到了5%水平的统计学意义。第2种方法是符合美国食品药品监督管理局(FDA)的指导原则的统计学方法。该方法使用偏离线性的初始检验。如果线性不能被排除,则添加一个线性趋势检验。如果线性趋势检验结果在α = 0.02具有统计学意义,或发现数据明显偏离线性,则进行配对卡方检验以及叶氏连续性修正(α = 0.05,双侧)。这种方法显示,雄性小鼠中造血或淋巴网状内皮系统的淋巴瘤发病率明显地偏离线性,进一步采用叶氏的卡方检验分析发现低剂量TDI组的雄性小鼠中该肿瘤类型的发病率相对于对照组上升,且具有统计学意义。

因为在灌胃生物测定中出现过高死亡率[5](特别是在给药组中),所以有必要在肿瘤发病率的统计分析中使用存活校正处理。NTP使用2种不同方法来校正间发死亡率,并分别使用传统方法来合并列联表[5]。统计显著性由总体剂量-反应趋势的检验以及高、低剂量组与溶剂对照组两两比较来确定。其中,第1种生命表方法假设在研究结束前垂死动物中观察到的所有肿瘤都是致命的,在每一个带有所研究肿瘤的动物死亡的时间点,对照组和剂量组中荷瘤动物的比例与各组中接受暴露动物总数都进行了比较。第2种方法是偶发性肿瘤检验,该方法假设所有在研究结束前在垂死动物中观察到的所有肿瘤是“偶发性的”,因为它们是在对死于不相关原因的动物进行尸体剖检中被发现的。在5个时间间隔中的每一个时间间隔的对照组和剂量组中荷瘤动物的比例与在该时间间隔中尸体剖检的动物数量进行了比较。把每一个单独时间间隔的对比合并,从而得出一个单一总体结果。
除存活校正检验外,NTP对所有荷瘤动物使用了Fisher精确检验作两两比较,并用线性趋势检验分析剂量-反应趋势[5]。他们指出如果这些方法分析结果不同,数据的最终解释取决于该具体肿瘤被视为是死因的可信程度。因为给药的大鼠存活率降低,所以NTP还指出对试验中间发生的死亡率校正的统计步骤比未经过校对的分析更具有意义,但是对任何具体肿瘤类型是否为给药小鼠的死因则没有给出结论[5]。
最后,吸入和灌胃2种动物染毒方式通过几种不同方法测量了许多不同的研究终点,这产生了多重统计比较,但是这2种研究皆使用不同方法来修正多重比较。
在Loeser[17]的吸入研究中,增高的肿瘤发病率与同一检测机构的历史对照数据比较接近。在历史对照中雄性小鼠的多发性肺腺瘤发病率在0%~8%范围内,而造血/淋巴网状内皮系统淋巴瘤发病率在0%~14%范围内(K. Muller,未发表的数据)。在TDI吸入研究中的淋巴瘤发病率,无论是低TDI剂量(13%)或者高TDI剂量(6%)组,都在历史对照的发病率范围内。吸入研究的低剂量组的多发性肺腺瘤发病率(10%)则略高于历史对照范围,但高剂量组(7%)却在历史对照范围之内,表明该肿瘤与暴露无关。与此相反,对于在灌胃研究中有历史对照数据的各肿瘤类型,不仅相对于溶剂对照具有统计学意义升高的发病率,而且几乎总是高于历史对照。
2.3 遗传毒性研究
目前关于TDI的遗传毒性和诱变效应已经开展了许多体外和体内研究,表18至21总结了这些研究的结果。因为体外研究是在液态介质中进行,TDI在用于体外测定之前,通常溶解于有机溶剂(如二甲基亚砜DMSO)中。体内研究在大多数情况下使用吸入作为暴露途径,少数研究使用了腹腔注射或气管内慢慢灌输TDI。另外,有几项研究使用了因职业接触TDI的工人的血细胞来检验遗传毒性效应。
2.3.1 遗传毒性研究结果一致性评估
在细菌诱变性测定中报道的TDI数据在不同研究中相对一致:在任何研究的任何测试菌株中,在没有代谢活化的情况下,都没有TDI的阳性反应。阳性反应仅在有代谢活化的情况下观察到,并且只有在某些测试菌株中(TA 98、TA 100、TA 1537和TA 1538)发现而在其他测试菌株中(TA 97、TA 1535、WP2uvrA)则未发现。这种反应模式与TDA细菌诱变性测定中观察到的反应模式相同[37](表22),与在研究条件下TDI水解生成少量TDA的推断一致(详见下文)。
哺乳动物细胞的体外遗传毒性测定结果显示不同的研究存在一定的一致性:大部分研究的阳性反应是仅在没有代谢活化的情况下观察到的(表19),与TDA的反应模式一致[37]。有一个例外是日本化学工业生态-毒理和信息中心(Japan Chemical Industry Ecology-Toxicology and Information Center, JETOC)[38]和Maki-Paakkanen及Norppa[39]研究发现在有和没有代谢活化2种条件下TDI都引起染色体畸变,不过在Maki-Paakkanen及Norppa的研究中该作用没有剂量-反应关系。此外,在有和没有代谢活化2种条件下的正向突变测定中还观察到了阳性反应[40],不过此阳性反应只有达到导致显著细胞毒性的剂量时才出现。




表22 TDI和TDA细菌致突变研究对比

化合物Compound代谢激活MetabolicactivationS.typhimurium菌株s.typhimuriumstrainE.coli菌株E.colistrainTA97TA98TA100TA1535TA1537TA1538WP2uvrATDI否No-------是Yes-++-++-TDA否No-------是Yes-++-++-
TDI遗传毒性的动物体内研究中,无论哪种暴露途径,都一致报道了在大鼠和小鼠中微核诱导、染色体畸变和姐妹染色单体交换(SCE)的阴性结果(表20)。其中,有2项关于TDI遗传毒性的哺乳动物体内试验使用了吸入作为暴露途径[17,31],另有2项研究将TDI溶解于玉米油,并使用腹腔注射TDI[45-46]。在4个关于人类TDI遗传毒性研究中,有3个报道了阴性反应,只有Bilban[41]的研究发现了相对于未暴露的对照组,职业接触TDI工人中的染色体畸变、姐妹染色单体交换和微核诱导增加(表21),但该研究没有考虑到接触TDI的工人有较高的吸烟指数并且可能同时接触多种化学物。
2.3.2 遗传毒性研究质量的评估
TDI遗传毒性体外研究的最主要问题是使用有机溶液(比如DMSO或丙酮)溶解TDI。这些有机溶剂是水溶性的,因此TDI可以与溶解于这些有机溶液中的水分反应后快速水解形成TDA及其他反应产物[23,42-43]。此外,细菌诱变性测定的水性环境进一步减少TDI和增加了TDA[23]。几乎所有的TDI体外遗传毒性研究在加入水性测定环境前都使用有机溶液如DMSO、乙二醇二甲醚(EGDE)或丙酮来溶解TDI,这些研究都有可能检测到少量TDI、一定浓度的TDA以及其他反应产物。另外一些研究报道TDI与溶剂或测试培养基混合后有可见沉淀物[39,44],体外测定中TDI的总体反应模式与TDA的反应模式相似[37]。
在职业接触TDI工人的遗传毒性研究中,受试人数很少,限制了结果的解释。同时这些研究没有对工作环境接触其他化合物或者吸烟等因素进行校正。以往职业暴露于异氰酸酯的工人的受控TDI暴露研究也只使用了少数的受试者,并且没有控制潜在的混杂因素,如吸烟以及治疗所用的哮喘和气短的药物。此外,有以往职业暴露的受试者已经对TDI敏感,在受控暴露时表现出阳性哮喘反应,可能促成DNA断裂。尽管缺乏对这些潜在混杂因素的考虑,这些研究中暴露于TDI的几个受试者的DNA损害并没有增加。
3 讨论(Discussion)
笔者从流行病学、动物实验和遗传毒性3个方面综合评估了TDI致癌的证据,重点关注了研究质量和结果一致性。笔者发现目前绝大多数流行病学研究结果是零相关。仅在少数几个研究中,TDI暴露与某些特定癌症研究终点有相关性,但是结果并不一致,并且可能不是因果关系。报道的阳性结果存在其他的合理科学解释(比如是由于偶然或混杂因素)。
就动物实验数据而言,TDI吸入给药实验中的雄性小鼠的多发性肺腺瘤和造血/淋巴网状内皮系统淋巴瘤的发病率相对于对照组小鼠升高,但是这2类肿瘤都没有统计学显著的剂量-反应关系,发病率的数值是在历史对照发病率的波动范围之内,这说明肿瘤与暴露无关。此外,这2类肿瘤的生物学意义也存在疑问。在灌胃暴露的研究中[5],几种肿瘤类型相较于溶剂对照和历史对照的发病率上升,其中多数具有统计学显著的剂量-反应关系,但是仅发生于某一物种的单一性别。肿瘤诱导模式与膳食接触TDA后观察到的肿瘤模式十分相似[35]。生物学合理性的解释为TDA是灌胃给予TDI后观察到的致癌活性的原因[36]。
不同学者报道的细菌和哺乳动物体外致突变性实验结果相对一致,阳性反应模式类似于TDA的反应模式。几乎所有的研究在检验前均使用有机溶剂溶解TDI,因此有可能这些研究中的染毒物质除了少量TDI外,还有TDA及其他反应产物。与此相反,无论是哪种暴露途径,大鼠和小鼠中TDI遗传毒性的体内研究都一致地报道了阴性结果。因为上述任何遗传毒性研究都没有使用灌胃方法,TDI不会直接进入胃里的酸性环境。另有一项研究发现,人类吸入暴露后也没有发现遗传毒性,但是该研究没有考虑吸烟和接触其他化学物的潜在混杂因素。在啮齿动物和人类的体内遗传毒性研究中产生阴性结果的原因,与具有生理学参考意义的吸入暴露途径研究中的阴性结果的原因很可能是一致的,即均未产生TDA[29]。
在2项动物实验研究之间,动物研究与流行病学研究之间,所谓TDI暴露诱导的肿瘤类型没有一致性,这说明导致癌症的根本原因不是TDI暴露。啮齿动物通过2种不同途径暴露于TDI后肿瘤反应并不相似,这说明潜在的致癌原因与暴露途径相关。比较TDI灌胃研究与膳食暴露TDA研究结果,发现肿瘤模式具有相似性,这可能因为灌胃研究中摄取的TDI有一部分转变为TDA。在TDI吸入暴露后没有观察到这种TDI向TDA的转化,这吸入暴露后无TDI暴露相关的肿瘤诱导的原因。因此,TDI转变为TDA是在动物实验中所观察到的不同部位肿瘤诱导最可能的原因。动物中的肿瘤效应仅发生于灌胃研究中,吸入暴露则没有类似效应,并且在人体也没有出现与动物实验中诱导机理相同的肿瘤。动物实验和流行病学数据之间的唯一共同点是,没有与TDI吸入暴露有关的肿瘤产生。
以上这些数据表明TDI在生理性接触条件下不是致癌物。TDI只有在溶于有机溶剂的体外条件下有遗传毒性,TDI降解(部分转变为TDA)在体外致突变性实验的液态条件下进一步加强。吸入暴露后未发现体内TDI的遗传毒性与该暴露途径不能生成具有生物学意义水平的TDA相关;同时证据表明TDA仅在灌胃暴露条件下形成。在致癌性生物测定和流行病学研究中发现肿瘤发生率在吸入暴露于TDI后未上升,这说明TDI在没有可检测到的自由TDA形成的条件下没有致癌效应。同时没有证据表明TDI蒸气在空气中可以水解成TDA,所以吸入生物测定中的动物和暴露于TDI的工人并没有吸入TDA。由此可见TDA形成是TDI致癌性的必要条件。
综上可知,如果想证明TDI致癌性是跨越各个哺乳动物物种的,那么必须有数据证明TDI不仅是实验动物的遗传毒性致癌物并且人群通过吸入接触TDI也可以导致癌症,但是已有的体内研究结果不支持这一观点。因为人类是经由吸入途径暴露于TDI中的,此种途径不会产生具有生物学意义程度的TDA,因此在灌胃暴露的小鼠和大鼠中观察到的肿瘤不应成为支持TDI的潜在人类致癌性的证据。现有证据分析证明,在生理性接触条件下TDI在体内转化成TDA所导致的致癌过程不是存在于各种哺乳动物物种的共同潜在机制,而在流行病学研究中观察到的少数正关联可归因于其他解释。因此综上所述,目前尚无科学证据证明人类TDI接触和致癌效应之间具有直接的显著因果关系。因此虽然在如灌胃等非生理暴露的条件下,TDI可能的人类致癌物的分类是正确的,但本文对其致癌研究数据的合理评估和正确理解仍有助于将产品监管力度集中于与职业暴露更相关的有害健康效应(致敏性)。
[1] National Toxicology Program (NTP). Report on Carcinogens [M]. 13th ed. Research Triangle Park: National Institutes of Health, 2014. http://ntp.niehs.nih.gov/go/roc13
[2] International Agency for Research on Cancer(IARC). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans: Volume 71. Re-evaluation of Some Organic Chemicals, Hydrogen, and Hydrogen Peroxide (in 3 parts) [M]. Lyon: World Health Organization (WHO), 1999: 865-879
[3] Collins M A. Toxicology of toluene diisocyanate [J]. Applied Occupational and Environmental Hygiene, 2002, 17(12): 846-855
[4] Commission of the European Communities(CEC). Commission Directive 98/98/EC of 15 December 1998 adapting to technical progress for the 25 time Council Directive 67/548/EEC on the approximation of laws, regulations, and administrative provisions relating to the classification, packaging and labeling of dangerous substances [R]. Official Journal of the European Communities, 1998, 41(L355): 386-389
[5] National Toxicology Program (NTP). Toxicology and carcinogenesis studies of commercial grade 2,4 (80%)- and 2,6 (20%)-toluene diisocyanate (CAS No. 26471-62-5) in F344/N rats and B6C3F1mice (gavage studies) [R]. US Department of Health and Human Services, 1986. http://ntp.niehs.nih.gov/ntp/htdocs/LT_rpts/tr251.pdf
[6] Prueitt R L, Rhomberg L R, Goodman J E. Hypothesis-based weight-of-evidence evaluation of the human carcinogenicity of toluene diisocyanate [J]. Critical Reviews in Toxicology, 2013, 43(5): 391-435
[7] Hagmar L, Welinder H, Mikoczy Z. Cancer incidence and mortality in the Swedish polyurethane foam manufacturing industry [J]. British Journal of Industrial Medicine, 1993, 50(6): 537-543
[8] Hagmar L, Stromberg U, Welinder H, et al. Incidence of cancer and exposure to toluene diisocyanate and methylene diphenyldiisocyanate: A cohort based case-referent study in the polyurethane foam manufacturing industry [J]. British Journal of Industrial Medicine, 1993, 50(11): 1003-1007
[9] Mikoczy Z, Welinder H, Tinnerberg H, et al. Cancer incidence and mortality of isocyanate exposed workers from the Swedish polyurethane foam industry: Updated findings 1959-98 [J]. Occupational and Environmental Medicine, 2004, 61(5): 432-437
[10] Sorahan T, Pope D. Mortality and cancer morbidity of production workers in the United Kingdom flexible polyurethane foam industry [J]. British Journal of Industrial Medicine, 1993, 50(6): 528-536
[11] Sorahan T, Nichols L. Mortality and cancer morbidity of production workers in the UK flexible polyurethane foam industry:Updated findings, 1958-98 [J]. Occupational and Environmental Medicine, 2002, 59(11): 751-758
[12] Schnorr T M, Steenland K, Egeland G M, et al. Mortality of workers exposed to toluene diisocyanate in the polyurethane foam industry [J]. Occupational and Environmental Medicine, 1996, 53(10): 703-707
[13] Jurek A M, Greenland S, Maldonado G, et al. Proper interpretation of non-differential misclassification effects: Expectations vs. observations [J]. International Journal of Epidemiology, 2005, 34(3): 680-687
[14] Jurek A M, Greenland S, Maldonado G. How far from non-differential does exposure or disease misclassification have to be to bias measures of association away from the null? [J]. International Journal of Epidemiology, 2008, 37(2): 382-385
[15] Wacholder S, Hartge P, Lubin J H, et al. Non-differential misclassification and bias towards the null: A clarification [Letter to the editor] [J]. Occupational and Environmental Medicine, 1995, 52(8): 557-558
[16] Curran-Everett D. Multiple comparisons: Philosophies and illustrations [J]. American Journal of Physiology - Regulatory, Integrative and Comparative Physiology, 2000, 279: R1-R8
[17] Loeser E. Long-term toxicity and carcinogenicity studies with 2,4/2,6-toluene-diisocyanate(80/20) in rats and mice [J]. Toxicology Letters, 1983, 15(1): 71-81
[18] Dieter M P, Boorman G A, Jameson C W, et al. The carcinogenic activity of commercial grade toluene diisocyanate in rats and mice in relation to the metabolism of the 2,4- and 2,6-TDI isomers [J]. Toxicology and Industrial Health, 1990, 6(6): 599-621
[19] Witschi H, Espiritu I, Dance S T, et al. A mouse lung tumor model of tobacco smoke carcinogenesis [J]. Toxicological Sciences, 2002, 68(2): 322-330
[20] Hahn F F, Gigliotti A, Hutt J A. Comparative oncology of lung tumors [J]. Toxicologic Pathology, 2007, 35: 130-135
[21] Nikitin A Y, Alcaraz A, Anver M R, et al. Classification of proliferative pulmonary lesions of the mouse: Recommendations of the mouse models of human cancers consortium [J]. Cancer Research, 2004, 64: 2307-2316
[22] Risser R, Horowitz J M, McCubrey J. Endogenous mouse leukemia viruses [J]. Annual Review of Genetics, 1983, 17: 85-121
[23] Seel K, Walber U, Herbold B, et al. Chemical behaviour of seven aromatic diisocyanates (toluenediisocyanates and diphenylmethanediisocyanates) under in vitro conditions in relationship to their results in the Salmonella/microsome test [J]. Mutation Research, 1999, 438(2): 109-123
[24] Baillie T A, Slatter J G. Glutathione: A vehicle for the transport of chemically reactive metabolites in vivo [J]. Accounts of Chemical Research, 1991, 24(9): 264-270
[25] Lange R W, Day B W, Lemus R, et al. Intracellular S-glutathionyl adducts in murine lung and human bronchoepithelial cells after exposure to diisocyanatotoluene [J]. Chemical Research in Toxicology, 1999, 12(10): 931-936
[26] Day B W, Jin R, Basalyga D M, et al. Formation, solvolysis, and transcarbamoylation reactions of bis(S-glutathionyl) adducts of 2,4- and 2,6-diisocyanatotoluene [J]. Chemical Research in Toxicology, 1997, 10(4): 424-431
[27] Mormann W, Frank P, Schupp T,et al. Reactions of N-acetylcysteine adducts of aromatic (di)isocyanates with functional groups of organic molecules: Transcarbamoylation reactions in aqueous buffer and in an organic solvent [J]. EXCLI Journal, 2008, 7: 19-43
[28] Wisnewski A V, Hettick J M, Siegel P D. Toluene diisocyanate reactivity with glutathione across a vapor/liquid interface and subsequent transcarbamoylation of human albumin [J]. Chemical Research in Toxicology, 2011, 24(10): 1686-1693
[29] Timchalk C, Smith F A, Bartels M J. Route-dependent comparative metabolism of [14C]toluene 2,4-diisocyanate and [14C]toluene 2,4-diamine in Fischer 344 rats [J]. Toxicology and Applied Pharmacology, 1994, 124(2): 181-190
[30] Sakkinen K, Tornaeus J, Hesso A, et al. Protein adducts as biomarkers of exposure to aromatic diisocyanates in workers manufacturing polyurethane (PUR) foam [J]. Journal of Environmental Monitoring, 2011, 13(4): 957-965
[31] Lindberg H K, Korpi A, Santonen T, et al. Micronuclei, hemoglobin adducts and respiratory tract irritation in mice after inhalation of toluene diisocyanate (TDI) and 4,4'-methylenediphenyl diisocyanate (MDI) [J]. Mutation Research, 2011, 723(1): 1-10
[32] Holdren M W, Spicer C W, Riggin R M. Gas phase reaction of toluene diisocyanate with water vapor [J]. American Industrial Hygiene Association Journal, 1984, 45(9): 626-633
[33] Brorson T, Skarping G, Renman L, et al. Test atmospheres of diisocyanates with special reference to controlled exposure of humans [J]. International Archives of Occupational & Environmental Health, 1989, 61(8): 495-501
[34] Skarping G, Brorson T, Sango C. Biological monitoring of isocyanates and related amines. III. Test chamber exposure of humans to toluene diisocyanate [J]. International Archives of Occupational & Environmental Health, 1991, 63(2): 83-88
[35] National Toxicology Program (NTP). Bioassay of 2,4-diaminotoluene for possible carcinogenicity (CAS No. 95-80-7) [R]. US Department of Health, Education, and Welfare, 1979. http://ntp.niehs.nih.gov/ntp/htdocs/LT_rpts/tr162.pdf
[36] Sielken R L, Bretzlaff R S, Valdez-Flores C, et al. Statistical comparison of carcinogenic effects and dose-response relationships in rats and mice for 2,4-toluene diamine to those ascribed to toluene diisocyanate [J]. Ecological Risk Assessment, 2012, 18: 1315-1337
[37] European Commission. European Union Risk Assessment Report. 4-Methyl-m-phenylenediamine (toluene-2,4-diamine) risk assessment. CAS-No.: 95-80-7. EINECS-No.: 202-453-1. Final approved version [R]. Italy: European Commission, 2008. http://echa.europa.eu/documents/10162/c666021a-4985-488e-a066-071cf9513129.
[38] Japan Chemical Industry Ecology-Toxicology and Information Center (JETOC). Mutagenicity test data of existing chemical substances based on the toxicity investigation system of the industrial safety and health law [R]. Japan: Chemical Substance Investigation Division, Industrial Safety and Health Department, Labour Standards Bureau, Ministry of Labour, 1996
[39] Maki-Paakkanen J, Norppa H. Chromosome aberrations and sister-chromatid exchanges induced by technical grade toluene diisocyanate and methylenediphenyl diisocyanate in cultured human lymphocytes [J]. Toxicological Letters, 1987, 36(1): 37-43
[40] McGregor D B, Brown A G, Howgate S, et al. Responses of the L5178Y mouse lymphoma cell forward mutation assay. V: 27 coded chemicals [J]. Environmental and Molecular Mutagenesis, 1991, 17(3): 196-219
[41] Bilban M. Mutagenic testing of workers exposed to toluene-diisocyanates during plastics production process [J].American Journal of Industrial Medicine, 2004, 45(5): 468-474
[42] Gahlmann R, Herbold B, Ruckes A, et al. Untersuchungen zur stabilitat aromatischer diisocyanate in dimethylsulfoxid (DMSO): Toluylen diisocyanat (TDI) und diphenylmethandiisocyanate (MDI) im Ames-test [J]. Zentralbl Arbeitsmed Arbeitsschutz Prophyl Ergonomie, 1993, 43(2): 34-38
[43] Herbold B, Haas P, Seel K, et al. Studies on the effect of the solvents dimethylsulfoxide and ethyleneglycoldimethylether on the mutagenicity of four types of diisocyanates in the Salmonella/microsome test [J]. Mutation Research, 1998, 412(2): 167-175
[44] Gulati D K, Witt K, Anderson B, et al. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. III. Results with 27 chemicals [J]. Environmental and Molecular Mutagenesis, 1989, 13: 133-193
[45] National Toxicology Program (NTP). Rodent bone marrow cytogenetics-chromosome aberrations. Study ID: 544551 [R]. Research Triangle Park: National Institute of Environmental Health Sciences, 1989. http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm?fuseaction=invivoca.casummary&study_no=544551&cas_no=26471%2D62%2D5&endpointlist=CA
[46] National Toxicology Program (NTP). Rodent bone marrow cytogenetics-sister chromatid exchange. Study ID: 544551 [R]. Research Triangle Park: National Institute of Environmental Health Sciences, 1989. http://ntp-apps.niehs.nih.gov/ntp_tox/index.cfm?fuseaction=invivosc.scsummary&study_no=544551&cas_no=26471%2D62%2D5&endpointlist=SC
[47] Anderson D, Styles J A. The bacterial mutation test. Six tests for carcinogenicity [J]. British Journal of Cancer, 1978, 37(6): 924-930
[48] Andersen M, Binderup M L, Kiel P, et al. Mutagenic action of isocyanates used in the production of polyurethanes [J]. Scandinavian Journal of Work, Environment & Health, 1980, 6(3): 221-226
[49] Japanese Ministry of Health, Labour, and Welfare (JMHLW). Toxicity Testing Reports of Environmental Chemicals [R]. Office of Chemical Safety, Evaluation and Licensing Division, Pharmaceutical and Medical Safety Bureau, 2001
[50] Zeiger E, Anderson B, Haworth S, et al. Salmonella mutagenicity tests: III. Results from the testing of 255 chemicals [J]. Environmental Mutagen, 1987, 9(S9): 1-109
[51] Marczynski B, Czuppon A B, Marek W, et al. Indication of DNA strand breaks in human white blood cells after in vitro exposure to toluene diisocyanate (TDI) [J]. Toxicology and Industrial Health, 1992, 8(3): 157-169
[52] Marczynski B, Czuppon A B, Schreiber G H, et al. DNA double-strand breaks and apoptosis after in vitro exposure to toluene diisocyanate [J]. Toxicology in Vitro, 1993, 7(4): 531-535
[53] Shaddock J G, Robinson B Y, Casciano D A. Effect of pretreatment with hepatic mixed-function oxidase inducers on the genotoxicity of four rat carcinogens in the hepatocyte/DNA repair assay [J]. Mutagenesis, 1990, 5(4): 387-391
[54] Holmen A, Akesson B, Hansen L,et al. Comparison among five mutagenicity assays in workers producing polyurethane foams [J]. International Archives of Occupational & Environmental Health, 1988, 60(3): 175-179
[55] Marczynski B, Merget R, Teschner B,et al. Changes in low molecular weight DNA fragmentation in white blood cells after diisocyanate exposure of workers [J]. Archives of Toxicology, 2003, 77(8): 470-476
[56] Marczynski B, Merget R, Mensing T, et al. DNA strand breaks in the lymphocytes of workers exposed to diisocyanates: Indications of individual differences in susceptibility after low-dose and short-term exposure [J]. Archives of Toxicology, 2005, 79(6): 355-362
Evaluation of the Carcinogenicity of Toluene Diisocyanate
Robyn L. Prueitt1, Lorenz R. Rhomberg1, Guan Na2,*, Julie E. Goodman1, Jin Xiaowei3
1. Gradient, Cambridge, Massachusetts 02138, USA 2. Covestro Polymers (China) Co. Ltd., Shanghai 200120, China 3. China National Environmental Monitoring Center, Beijing 100012, China
Received 12 January 2016 accepted 4 May 2016
Toluene diisocyanate (TDI) is classified by several agencies as a possible human carcinogen, based on increased tumor incidences in rodents treated with TDI by oral gavage. We evaluated whether the available data support this classification, focusing on the quality of available studies and the consistency of results. The epidemiology data are not sufficiently robust to support TDI as a human carcinogen. The experimental animal studies indicate that TDI does not induce tumors in rats or mice after inhalation exposure. Tumors observed after oral gavage exposure are most likely due to the conversion of TDI to toluene diamine (TDA), a known rodent tumorigen. TDI is not genotoxic in rodents or humans after inhalation exposure, when TDA is not formed to a biologically significant degree. We conclude that a causal relationship between TDI exposure and carcinogenic effects is not plausible in humans, because the conversion of TDI to TDA does not occur in mammalian species under physiological exposure conditions. Thus, although the classification of TDI as a possible human carcinogen may be accurate for non-physiological exposures, a better understanding of the derivation of the data will allow for the proper focus to be placed on product stewardship efforts, which is more relevant to occupational exposure.
isocyanates; weight of evidence; carcinogenicity; risk assessment; genotoxicity
Robyn L. Prueitt (1972-),女,美国注册毒理师,研究方向为遗传学、流行病学、致癌和毒理学,E-mail: rprueitt@gradientcorp.com;
*通讯作者(Corresponding author), E-mail: na.guan@covestro.com
10.7524/AJE.1673-5897.20160112001
2016-01-12 录用日期:2016-05-04
1673-5897(2016)4-026-35
X171.5
A
简介:管娜(1975—),女,毒理学博士,欧洲注册毒理师,主要研究方向为风险评估和健康毒理,发表学术论文10余篇。
Prueitt R L, Rhomberg L R, 管娜, 等. 甲苯二异氰酸酯(TDI)致癌性的综合评估[J]. 生态毒理学报,2016, 11(4): 26-60
Prueitt R L, Rhomberg L R, Guan N, et al. Evaluation of the carcinogenicity of toluene diisocyanate [J]. Asian Journal of Ecotoxicology, 2016, 11(4): 26-60 (in Chinese)

