羊肚菌多糖抑制人乳腺癌细胞MDA-MB-231增殖和诱导细胞凋亡研究
李 谣,陈金龙,王丽颖,张月巧,吴素蕊,明 建,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
羊肚菌多糖抑制人乳腺癌细胞MDA-MB-231增殖和诱导细胞凋亡研究
李 谣1,陈金龙1,王丽颖1,张月巧1,吴素蕊2,明 建1,3,*
(1.西南大学食品科学学院,重庆 400715;2.中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223;3.西南大学 国家食品科学与工程实验教学中心,重庆 400715)
以黑脉羊肚菌多糖为原料,研究羊肚菌多糖对人乳腺癌细胞MDA-MB-231(以下简称MDA)增殖和凋亡的影响。结果表明:在无细胞毒性范围内,羊肚菌多糖能显著抑制人乳腺癌细胞MDA的增殖,半数有效浓度(median effective concentration,EC50)值为0.096 mg/mL,同时人乳腺癌细胞MDA表现出多种细胞凋亡的形态学变化。免疫印迹检测实验结果显示,羊肚菌多糖能抑制B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白表达,促进Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)表达,同时增加Bax/Bcl-2蛋白表达比值,并呈现出剂量依赖效应。说明羊肚菌多糖能抑制人乳腺癌细胞MDA增殖,促进细胞凋亡。
羊肚菌;多糖;人乳腺癌细胞MDA-MB-231;细胞增殖;细胞凋亡
羊肚菌(Morchella esculenta (L.) Pers.,MEP)是一种药食两用的真菌,因其菌盖表面凹凸不平、状如羊肚而得名,常见的羊肚菌有尖顶羊肚菌、黑脉羊肚菌、褐赭色羊肚菌、粗腿羊肚菌、宽圆羊肚菌。羊肚菌不仅味道鲜美,而且营养丰富,含有多种生物活性物质,如多糖、蛋白质、矿物质、膳食纤维、维生素等,具有调节机体免疫力、抗菌、抗疲劳、保肝、抗肿瘤等多种功效[1-4]。羊肚菌多糖是羊肚菌的主要活性物质,Fu Lihong等[5]研究发现羊肚菌胞外多糖具有较强的清除羟自由基和1,1-二苯基-2-三硝基苯肼自由基的活性,还能显著抑制D-氨基半乳糖小鼠模型肝脏和血清中丙二醛的形成,提高抗氧化酶的活性。马利等[6]研究发现尖顶羊肚菌胞外多糖提取物具有促进皮肤成纤维细胞细胞增殖、胶原蛋白合成,具有延缓细胞衰老的作用。明建等[7]研究发现羊肚菌多糖对于大鼠肠道内乙酸、丙酸、异丁酸、丁酸、戊酸、己酸的产生代谢有较大影响。Hu Meili等[8]研究发现羊肚菌发酵液多糖能诱导HepG2细胞凋亡。
本课题组前期研究制备得到黑脉羊肚菌多糖(polysaccharides from Morchella angusticeps Peck,PMEP)并进行了结构鉴定,PMEP是一种由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,以α-1,4-葡萄糖、α-1,2-甘露糖、α-1,6-半乳糖和α-1,5-阿拉伯糖残基连接,并有α-1,2,6-甘露糖、α-1,4,6-葡萄糖和β-1,2,6半乳糖的高度分支结构的一种杂多糖[9]。本研究以人乳腺癌细胞MDA-MB-231(以下简称为MDA)为模型,研究了PMEP对MDA细胞增殖和凋亡的影响,旨在为PMEP功能食品或药品的开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
PMEP由西南大学食品科学学院食品营养实验室制备[9]。
青霉素、链霉素、庆大霉素、蛋白酶抑制剂、非离子型表面活性剂(Igepal) 美国Sigma公司;Hank平衡盐溶液(Hank balanced salt solution,HBSS)、William’s Medium E(WME)培养基、表皮生长因子、肝素、胰岛素、氢化可的松 美国Gibco生物科技公司;胎牛血清(fetal bovine serum,FBS) 美国Atlanta生物科技公司;TUNEL细胞凋亡检测试剂盒 美国Serologicals公司;蛋白含量检测试剂盒、二抗(鼠抗单克隆抗体) 美国Sigma-Aldrich公司;一抗(抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)抗体、抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体) 美国Santa Cruz公司;鲁米诺化学发光试剂盒、脱脂奶粉美国Cell Signaling Technology公司;乳腺癌细胞MDAMB-231 美国模式培养物集存库;二甲苯(分析纯,下同)、磷酸盐缓冲液(phosphate buffer saline,PBS)美国Fisher公司。
1.2 仪器与设备
5180 R型冷冻离心机 德国Eppendorf公司;DM IRB型倒置显微镜 德国Leica仪器有限公司;HERA cell 240型CO2培养箱 美国Thermo公司;T75细胞培养瓶、96 孔黑色底部透明微孔板、96孔白色底部透明微孔板美国Corning公司;Falcon 8孔细胞培养板 美国BD公司;F5Multi模式酶标仪 美国Molecular Devices公司。
1.3 方法
1.3.1 MDA细胞培养[10-11]
MDA细胞在含10% FBS的生长培养基CM(WME、2 mmol/L谷氨酸盐、10 mmol/L 4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)-1-piperazinyl] ethanesulfonic acid,HEPES)、5 µg/mL胰岛素、0.05 µg/mL氢化可的松、50 Units/mL青霉素、50 µg/mL链霉素、100 µg/mL庆大霉素)上,37 ℃、体积分数5% CO2条件下培养,用于实验的细胞为第12~35代。
1.3.2 MDA细胞毒性测定[10-11]
取对数生长期的MDA细胞接于96 孔白板,使每孔细胞数约为4×104个,于37℃、5% CO2条件下培养24 h后,移去残余培养基,PBS清洗1 次。其中,样品组孔中加入不同质量浓度(0.04、0.08、0.12、0.16、0.20、0.24、0.28、0.32、0.36、0.40 mg/mL)的100 μL含PMEP的培养基(每个质量浓度梯度做3 个平行孔),对照组孔中加入100 μL的培养基,于37℃、5% CO2条件下培养24 h后开始测板。移去96 孔板内残余培养基,用PBS清洗1 次,加50 μL/孔亚甲基蓝溶液(98% HBSS、0.67%戊二醛、0.6%亚甲基蓝)染色,于37 ℃条件下培养1 h,然后移去染色液,并用去离子水清洗该96 孔板至清洗液无色,吸去板中多余水分并风干2~3 min,加100 μL/孔洗脱液(49% PBS、50%乙醇、1%醋酸),然后漩涡振荡20 min,使孔内已染色的细胞形成均匀的细胞悬浮液。最后,于570 nm波长处读取各孔中染色细胞悬浮液的吸光度。减少的吸光度按公式(1)计算,当减少的吸光度≥10%时,即认为样品具有细胞毒性。
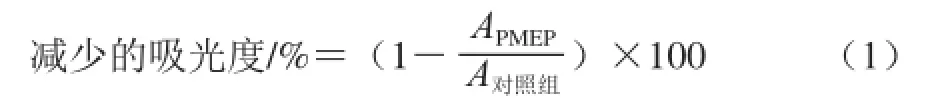
1.3.3 MDA细胞抗增殖活性的测定[10-11]
取对数生长期的MDA细胞接于96 孔板,使每孔细胞数约为2.5×104个,于37 ℃、5% CO2条件下培养8 h后,移去残余培养基,PBS清洗1 次。其中,样品组孔中加入不同质量浓度(0.04、0.08、0.12、0.16、0.20、0.24、0.28、0.32、0.36、0.40 mg/mL)的100 μL含PMEP的培养基(每个质量浓度梯度做3 个平行孔),对照组孔中加入100 μL的培养基,于37 ℃、5% CO2条件下培养72 h后开始测板,测板操作同上述细胞毒性实验。细胞增殖抑制率按公式(2)计算,同时细胞增殖抑制效果也用半数有效浓度(median effective concentration,EC50)表示,EC50表示50%最大效应时的浓度。

1.3.4 TUNEL细胞凋亡检测[12]
将MDA细胞接于Falcon 8孔细胞培养载玻片上,使每孔细胞数约为3×105个,37 ℃条件下培养,待细胞长至60%~70%融合时,更换无血清培养,37 ℃条件下培养2 h,再用含PMEP的无血清培养基37 ℃条件下培养4 h,PBS漂洗后,用1%多聚甲醛-PBS溶液固定细胞20 min,再用预冷乙醇-乙酸混合液(2∶1,V/V)于-20 ℃条件下固定5 min,3% H2O2-PBS溶液室温条件下灭活15 min,抑制内源性过氧化物酶。然后加入脱氧核苷酸末端转移酶(terminal deoxynucleotidyl transferase,TdT)工作液(对照组不加TdT酶)使细胞DNA片段与过氧化物酶标记的抗地高辛抗体结合,加入二氨基联苯胺(diaminobenzidine,DAB)工作液室温条件下染色,再用甲基绿复染剂室温下衬染,以进一步区分凋亡细胞与正常细胞,最后用二甲苯脱水,封片,干燥后,在倒置显微镜下观察并记录实验结果。每个样品随机计数4 个视野,按式(4)计算细胞凋亡率。计算时,将显微镜视野中细胞总数控制在100 个左右。

1.3.5 免疫印迹检测Bax、Bcl-2蛋白表达[13-14]
将MDA细胞接于6 孔培养板中,使每孔细胞数约为5×105个,加入不同质量浓度(0、0.08、0.16、0.32 mg/mL)PMEP溶液培养24 h,结束后除去生长培养基,用预冷PBS清洗2 次后将细胞从培养板中刮下。加入细胞裂解液(50 mmol/L pH 7.4三羟甲基氨基甲烷(Tris)、1% Igepal、150 mmol/L氯化钠、1 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA))和蛋白酶抑制剂(1 g/mL抑肽酶、1 g/mL亮胎酶肽、1 g/mL胃蛋白酶抑制剂、1 mmol/L原钒酸钠)4 ℃条件下孵育30 min,每5 min振荡一次,使其充分裂解,促进蛋白质的提取。然后4 ℃、12 000×g离心5 min,每组细胞取等量蛋白裂解液经过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离后转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,PVDF膜在5%脱脂奶粉-TBST封闭液中室温封闭2 h后,与一抗(抗Bcl-2抗体、抗Bax抗体)4 ℃恒温摇床振荡孵育过夜,洗涤后加入二抗室温条件下振荡孵育2 h,采用Lumin GLO发光试剂盒荧光显色。用ImageJ2x软件对蛋白条带进行扫描和定量分析。
1.4 数据分析
数据采用Sigmaplot 12.5软件进行统计分析,实验结果用表示,采用方差分析(analysis of variance,ANOVA)进行Duncan’s多重比较分析。
2 结果与分析
2.1 PMEP对MDA细胞增殖和细胞毒性的影响
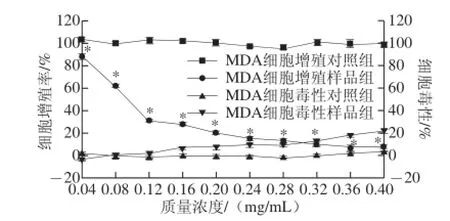
图1 PMEP对MDA细胞增殖和细胞毒性的影响Fig. 1 Effect of PMEP on the proliferation and cytotoxicity of MDA-MB-231 human breast cancer cells
由图1可知,当PMEP质量浓度>0.382 mg/mL时显示细胞毒性,此时对MDA细胞增殖的抑制率几乎达到100%。且不同质量浓度的PMEP(0.04、0.08、0.12、0.16、0.20、0.24、0.28、0.32、0.36、0.40 mg/mL)对MDA细胞增殖有明显的抑制作用,呈现出剂量依赖效应。与对照组相比,当PMEP质量浓度为0.04 mg/mL时,对MDA细胞增殖抑制率约为10%;当PMEP质量浓度为0.12 mg/mL时,对MDA细胞增殖抑制率约为70%,PMEP抑制MDA细胞增殖的EC50为0.096 mg/mL,其抗增殖活性高于许多食用菌提取物,如金针菇(EC50值为0.15 mg/mL)、鸡腿菇(EC50值为0.45 mg/mL)、鬼伞菌(EC50值为0.12 mg/mL)[15]、灵芝(EC50值>0.125 mg/mL)[16]、云芝(EC50值>1.0 mg/mL)[17]、鼎湖鳞伞多糖菌丝多糖提取物(EC50值为0.116 mg/mL)[18],低于黄枝瑚菌(EC50值为0.067 mg/mL)[19]。
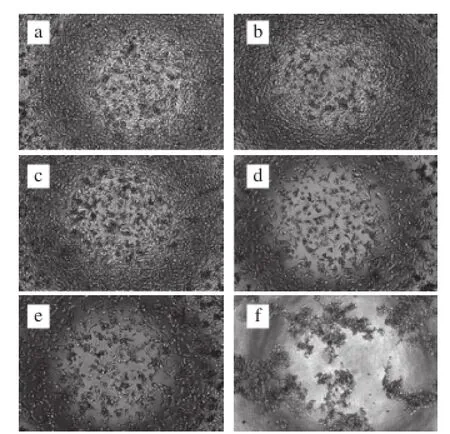
图2 PMEP对MDA细胞形态的影响Fig. 2 Effect of PMEP on the morphology of MDA-MB-231 human breast cancer cells
由图2可知,对照组中MDA细胞生长良好,相邻细胞连接紧密。随着PMEP质量浓度的增加,MDA细胞数量明显减少,细胞密度降低,培养基上层有明显的死细胞漂浮,且呈现出剂量依赖效应,充分说明PMEP能显著抑制MDA细胞生长,表现出良好的抗增殖活性。
2.2 PMEP诱导MDA细胞凋亡的影响

图3 PMEP对MDA细胞凋亡的影响Fig. 3 Effect of PMEP on the apoptosis of MDA-MB-231 human breast cancer cells
由图3A可知,对照组中,MDA细胞染色均一、细胞结构清晰且细胞排列紧密。经过不同质量浓度PMEP处理后,MDA细胞形态变得不规则,且细胞轮廓模糊、细胞体萎缩、细胞间隙增大、染色质凝聚、细胞核破裂、细胞膜出现空泡,表现出多种细胞凋亡的形态学变化。由图3B可知,在对照组中,凋亡细胞占MDA细胞总数2%,随着PMEP质量浓度增加,凋亡细胞数量呈显著上升趋势,当多糖质量浓度为0.32 mg/mL时,细胞凋亡率达到18%,是MDA细胞对照组的9 倍。所以,PMEP能诱导乳腺癌细胞MDA发生凋亡。
2.3 PMEP对MDA细胞蛋白Bcl-2、Bax表达的影响

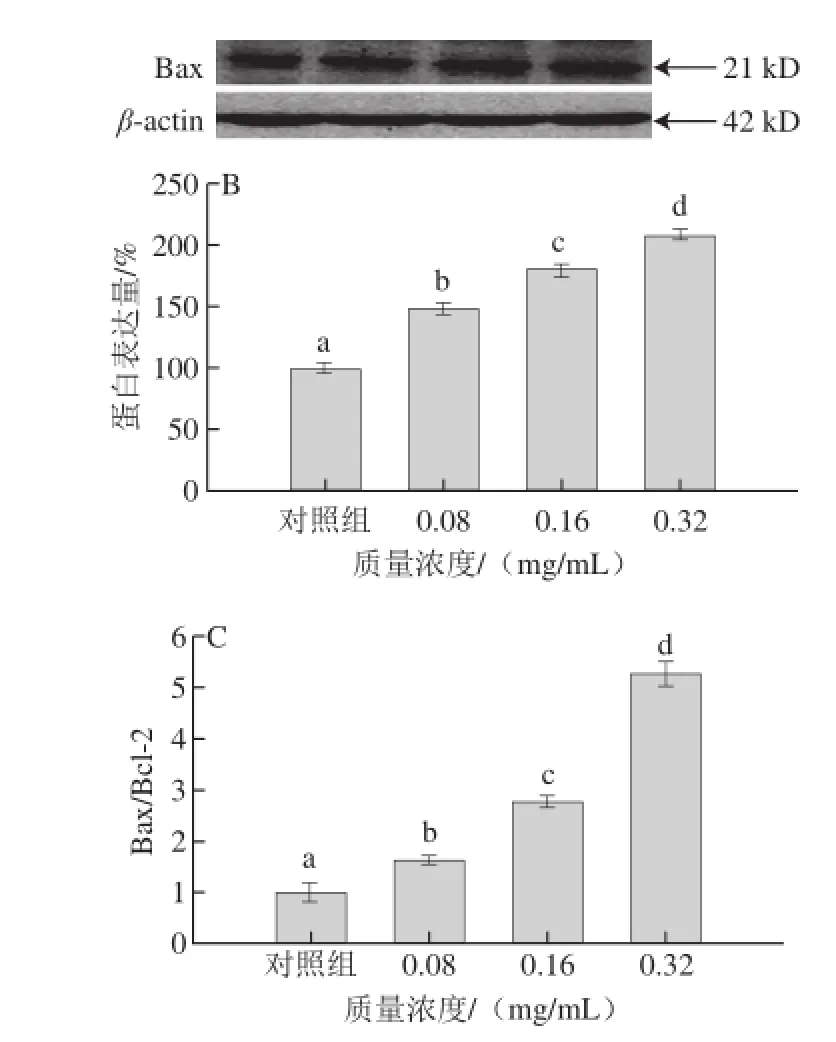
图4 PMEP对MDA细胞的Bcl-2(A)和Bax(B)蛋白表达的影响Fig. 4 Effects of PMEP on the expression of Bcl-2 (A) and Bax (B) in MDA-MB-231 human breast cancer cells
细胞凋亡的发生受到细胞内凋亡调节蛋白的调控,Bcl-2家族蛋白是一类典型的凋亡调节蛋白,其中包括抑制细胞凋亡蛋白Bcl-2和促进细胞凋亡蛋白Bax。由图4A可知,当PMEP质量浓度高于0.08 mg/mL时,P M E P处理能显著降低B c l-2蛋白表达(P<0.05),当PMEP质量浓度为0.08、0.16、0.32 mg/mL时,Bcl-2蛋白表达分别下降7.75%、35.07%、60.38%。由图4B可知,PMEP能显著增加Bax蛋白表达(P<0.05),当PMEP质量浓度为0.08、0.16、0.32 mg/mL时,Bax蛋白表达分别增加49.20%、79.86%、108.28%。由图4C可知,PMEP处理后,Bax/Bcl-2蛋白表达比值显著增加(P<0.05),当PMEP质量浓度为0.08、0.16、0.32 mg/mL时,Bax/Bcl-2蛋白表达比值分别增加0.61、1.77、4.25 倍。所以,PMEP能抑制Bcl-2蛋白表达、促进Bax蛋白表达,同时增加Bax/Bcl-2蛋白表达比值,且呈现出明显剂量依赖效应,对MDA细胞的凋亡有一定促进作用。Chow等[20]研究发现云芝糖肽能诱导MDA细胞凋亡,抑制细胞增殖,其作用机制可能与p21蛋白表达上调和细胞周期蛋白D1(Cyclin D1)表达下调有关。Jiang Xue等[14]研究了2α-羟基熊果酸抑制MDA细胞增殖的作用机制,其对Bcl-2、Bax蛋白表达的影响与本研究一致,除此之外,还观察到肿瘤坏死因子受体相关因子2、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、Cyclin D1蛋白表达下调,p-ASK1、p-p38、p-p53、p-21蛋白表达上调,并显著上调Bax/Bcl-2比例和活化型半胱天冬酶-3(cleaved caspase-3)蛋白表达,结果表明,2α-羟基熊果酸通过调节p38/分裂原激活蛋白激(mitogen-activated protein kinase,MAPK)信号转导通路抑制MDA细胞增殖,诱导细胞凋亡。现有研究表明,Bax蛋白和Bcl-2蛋白除了通过形成同源或异源二聚体来调节细胞凋亡外,还能与其他蛋白作用参与细胞凋亡[21-23]。PMEP抑制MDA细胞增殖的作用机制尚不明确,后期应对p38/MAPK信号传导通路上相关蛋白(如PCNA、Cyclin D1、CDK4、p-ASK1、p-p38、p-p53、p21、TRAF2等)进行研究。
3 结 论
本实验以MDA细胞为模型,研究了PMEP的抗增殖活性和促细胞凋亡作用,初步探讨了其作用机制。结果表明:1)PMEP对MDA细胞增殖有显著的抑制作用,并呈现出剂量依赖效应,其EC50值为0.096 mg/mL,且经过PMEP处理后,MDA细胞数量明显减少,细胞密度降低,说明PMEP能显著抑制MDA细胞的生长;2)经过PMEP处理后,MDA细胞体萎缩、细胞间隙增大、染色质凝聚、细胞核破裂、细胞膜出现空泡,表现出多种细胞凋亡的形态学变化,同时随着PMEP质量浓度增加,凋亡细胞数量呈显著上升趋势,说明PMEP能诱导MDA细胞发生凋亡;3)PMEP能抑制Bcl-2蛋白表达、促进Bax蛋白表达,同时增加Bax/Bcl-2蛋白表达比值,且呈现出明显剂量依赖效应,说明PMEP对MDA细胞的凋亡有一定促进作用。
[1] HELENO S A, STOJKOVIC D, BARROS L, et al. A comparative study of chemical composition, antioxidant and antimicrobial properties of Morchella esculenta (L.) Pers. from Portugal and Serbia[J]. Food Research International, 2013, 51(1): 236-243. DOI:10.1016/j.foodres.2012.12.020.
[2] NITHA B, DE S, ADHIKARI S K, et al. Evaluation of free radical scavenging activity of morel mushroom, Morchella esculenta mycelia: a potential source of therapeutically useful antioxidants[J]. Pharmaceutical Biology, 2010, 48(4): 453-460. DOI:10.3109/13880200903170789.
[3] BADSHAH H, QURESHI R A, KHAN J, et al. Pharmacological screening of Morchella esculenta (L.) Pers., Calvatia gigantea (Batsch ex Pers.) Lloyd and Astraeus hygrometricus Pers., mushroom collected from South Waziristan (FATA.)[J]. Chemistry, 2012, 6(10): 1853-1859. DOI:10.5897/JMPR11.1138.
[4] YANG H, YIN T, ZHANG S. Isolation, purification, and characterization of polysaccharides from wide Morchella esculenta (L.) Pers[J]. International Journal of Food Properties, 2015, 18(7): 1385-1390. DOI:10.1080/10942912.2014.915849.
[5] FU L H, WANG Y P, WANG J J, et al. Evaluation of the antioxidant activity of extracellular polysaccharides from Morchella esculenta[J]. Food and Function, 2013, 4(6): 871-879. DOI:10.1039/C3FO60033E.
[6] 马利, 李霞, 张松. 尖顶羊肚菌胞外多糖提取物对皮肤成纤维细胞增殖和衰老的影响[J]. 菌物学报, 2014, 33(2): 385-393. DOI:10.13346/j.mycosystema.130281.
[7] 明建, 吴素蕊, 曾凯芳, 等. 羊肚菌多糖PMEP-1对大鼠肠道内短链脂肪酸的影响[J]. 食品科学, 2010, 31(19): 367-371.
[8] HU M, CHEN Y, WANG C, et al. Induction of apoptosis in HepG2 cells by polysaccharide MEP-II from the fermentation broth of Morchella esculenta[J]. Biotechnology Letters, 2013, 35(1): 1-10. DOI:10.1007/s10529-012-0917-4.
[9] 明建, 曾凯芳, 赵国华, 等. 羊肚菌水溶性多糖PMEP-1的分离纯化与结构特征分析[J]. 食品科学, 2009, 30(15): 104-108. DOI:10.3321/ j.issn:1002-6630.2009.15.023.
[10] BOAVENTURA B C B, AMBONI R D M C, da SILVA E L, et al. Effect of in vitro digestion of yerba mate (Ilex paraguariensis A. St. Hil.) extract on the cellular antioxidant activity, antiproliferative activity and cytotoxicity toward HepG2 cells[J]. Food Research International, 2015, 77: 257-263. DOI:10.1016/j.foodres.2015.05.004. [11] ZHANG L, LIU R, NIU W. Phytochemical and antiproliferative activity of proso millet[J]. PLoS ONE, 2014, 9(8): 1-10. DOI:10.1371/ journal.pone.0104058.
[12] SUN J, LIU R H. Cranberry phytochemical extracts induce cell cycle arrest and apoptosis in human MCF-7 breast cancer cells[J]. Cancer Letters, 2006, 241(1): 124-134. DOI:10.1016/j.canlet.2005.10.027.
[13] YOON H, LIU R H. Effect of selected phytochemicals and apple extracts on NF-κB activation in human breast cancer MCF-7 cells[J]. Journal of Agricultural and Food Chemistry, 2007, 55(8): 3167-3173. DOI:10.1021/jf0632379.
[14] JIANG X, LI T, LIU R H. 2α-Hydroxyursolic acid inhibited cell proliferation and induced apoptosis in MDA-MB-231 human breast cancer cells through the p38/MAPK signal transduction pathway[J]. Journal of Agricultural and Food Chemistry, 2016, 64(8): 1806-1816. DOI:10.1021/acs.jafc.5b04852.
[15] GU Y H, LEONARD J. In vitro effects on proliferation, apoptosis and colony inhibition in ER-dependent and ER-independent human breast cancer cells by selected mushroom species[J]. Oncology Reports, 2006, 15(2): 417-423. DOI:10.3892/or.15.2.417.
[16] WENG C J, YEN G C. The in vitro and in vivo experimental evidences disclose the chemopreventive effects of Ganoderma lucidum on cancer invasion and metastasis[J]. Clinical and Experimental Metastasis, 2010, 27(5): 361-369. DOI:10.1007/s10585-010-9334-z.
[17] SLIVA D, JEDINAK A, KAWASAKI J, et al. Phellinus linteus suppresses growth, angiogenesis and invasive behaviour of breast cancer cells through the inhibition of AKT signalling[J]. British Journal of Cancer, 2008, 98(8): 1348-1356. DOI:10.1038/sj.bjc.6604319.
[18] GAN D, ZENG X, LIU R H, et al. Potential mechanism of mycelium polysaccharide from Pholiota dinghuensis Bi in regulating the proliferation and apoptosis of human breast cancer MCF-7 cells through p38/MAPK pathway[J]. Journal of Functional Foods, 2015, 12: 375-388. DOI:10.1016/j.jff.2014.12.008.
[19] LIU K, WANG J, ZHAO L, et al. Anticancer, antioxidant and antibiotic activities of mushroom Ramaria flava[J]. Food and Chemical Toxicology, 2013, 58: 375-380. DOI:10.1016/j.fct.2013.05.001.
[20] CHOW L W C, LO C S Y, LOO W T Y, et al. Polysaccharide peptide mediates apoptosis by up-regulating p21 gene and down-regulating cyclin D1gene[J]. The American Journal of Chinese Medicine, 2003, 31(1): 1-9. DOI:10.1142/S0192415X03000758.
[21] EDLICH F, MARTINOU J C. Mitochondria and cell death[M]. New York: Springer, 2016: 69-83. DOI:10.1007/978-1-4939-3612-0_4.
[22] UM H D. Bcl-2 family proteins as regulators of cancer cell invasion and metastasis: a review focusing on mitochondrial respiration and reactive oxygen species[J]. Oncotarget, 2015, 7(5): 5193-5203. DOI:10.18632/oncotarget.6405.
[23] SONG S, JACOBSON K N, MCDERMOTT K M, et al. ATP promotes cell survival via regulation of cytosolic [Ca2+] and Bcl-2/Bax ratio in lung cancer cells[J]. American Journal of Physiology, 2016, 310(2): 99-114. DOI:10.1152/ajpcell.00092.2015.
Polysaccharides from Morchella angusticeps Peck Inhibit Cell Proliferation and Induce Apoptosis in MDA-MB-231 Human Breast Cancer Cells
LI Yao1, CHEN Jinlong1, WANG Liying1, ZHANG Yueqiao1, WU Surui2, MING Jian1,3,*
(1. College of Food Science, Southwest University, Chongqing 400715, China; 2. Kunming Edible Fungi Institute, All China Federation of Supply and Marketing Cooporatives, Kunming 650223, China; 3. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
The effects of polysaccharides from Morchella angusticeps Peck (PMEP) on the proliferation and apoptosis of MDA-MB-231 human breast cancer cells were investigated in this study. The results showed that PMEP could significantly inhibit the proliferation of MDA-MB-231 in the non-cytotoxic concentration range with a median effective concentration (EC50) of 0.096 mg/mL. MDA-MB-231 cells also showed a series of morphological changes associated with apoptosis. Western blotting assay showed that PMEP could inhibit the expression of B-cell lymphoma-2 (Bcl-2) protein, increase the expression of Bcl-2 associated X protein (Bax) and Bax/Bcl-2 ratio in a dose-dependent manner. In conclusion, PMEP could inhibit the proliferation and induce the apoptosis of MDA-MB-231 cells.
Morchella esculenta; polysaccharide; MDA-MB-231 human breast cancer cell; cell proliferation; cell apoptosis
10.7506/spkx1002-6630-201621036
S567.3
A
1002-6630(2016)21-0214-05
李谣, 陈金龙, 王丽颖, 等. 羊肚菌多糖抑制人乳腺癌细胞MDA-MB-231增殖和诱导细胞凋亡研究[J]. 食品科学, 2016, 37(21): 214-218. DOI:10.7506/spkx1002-6630-201621036. http://www.spkx.net.cn
LI Yao, CHEN Jinlong, WANG Liying, et al. Polysaccharides from Morchella angusticeps Peck inhibit cell proliferation and induce apoptosis in MDA-MB-231 human breast cancer cells[J]. Food Science, 2016, 37(21): 214-218. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621036. http://www.spkx.net.cn
2016-05-11
国家自然科学基金面上项目(31271825);“十二五”国家科技支撑计划项目(2013BAD16B01)
李谣(1992—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:liyao427@163.com
*通信作者:明建(1972—),男,教授,博士,研究方向为食品化学与营养学。E-mail:mingjian1972@163.com

