紫薯花色苷-蛋白复合物的制备及结构表征
郭 莹,江 甜,李书艺,祝振洲,何静仁
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
紫薯花色苷-蛋白复合物的制备及结构表征
郭 莹,江 甜,李书艺,祝振洲,何静仁*
(武汉轻工大学食品科学与工程学院,湖北 武汉 430023)
采用硫酸铵沉淀法制备紫薯花色苷-蛋白复合物,经二乙氨基乙基纤维素52和Sephadex G-75葡聚糖凝胶纯化得紫薯纯蛋白,利用聚丙烯酰胺凝胶电泳测定紫薯蛋白及紫薯花色苷-蛋白复合物的分子质量,运用紫外、荧光、红外和圆二色谱多种光谱方法对紫薯蛋白及紫薯花色苷-蛋白复合物进行结构表征。结果表明:紫薯蛋白及花色苷-蛋白复合物的分子质量无明显差异,均存在4 种不同的分子质量分布:58、24、18 kD和14 kD。紫薯蛋白紫外最大吸收峰位于200 nm波长处,复合物的紫外光谱略有红移且吸收增强。紫薯蛋白荧光光谱的最大发射波长是340 nm,而复合物的荧光强度几乎完全猝灭。紫薯蛋白的红外光谱图具有酰胺带特征吸收,复合物的红外光谱峰形和吸收强度发生明显变化。圆二色谱图显示紫薯蛋白二级结构以β-折叠(43.6%)和无规卷曲(45.7%)为主,β-转角(10.6%)次之,而复合物以β-折叠(72.2%)为主,无规卷曲(27.8%)含量降低,β-转角消失。
紫薯;花色苷-蛋白复合物;紫薯蛋白;结构表征
紫薯(Ipomoea batatas L.)又名黑薯,是我国常见甘薯品种资源中一种特殊的品种,近年来因其富含花色苷类物质而吸引着国内外诸多学者研究探讨。此外,紫薯块根中约含有2%~10%的蛋白质,其中约80%为可溶性蛋白[1]。紫薯蛋白氨基酸种类齐全,氨基酸组成能较好的满足人体的需求。因赖氨酸是禾谷类粮食的第一限制氨基酸,而紫薯蛋白中赖氨酸含量相对较高[2],对其赖氨酸不足进行补充,具有较高的营养价值。
农产品在加工、贮藏、食用等过程中,其活性成分与蛋白质的相互作用不可避免[3],以共价键[4]或非共价键[5-6]的形式结合形成新的复合物[7]。烟草中蛋白质含量丰富,可与多种多酚类化合物结合形成多酚蛋白复合物,具有卓越的抗紫外能力[8]。紫薯富含花色苷与蛋白质,而关于紫薯蛋白及其花色苷复合物的研究鲜见报道。本实验采用硫酸铵沉淀法制备紫薯花色苷-蛋白复合物,运用紫外、荧光、红外和圆二色谱等光谱方法对紫薯纯蛋白及其花色苷复合物的结构进行表征,为紫薯营养的物质基础研究及其功效评价提供依据和参考。
1 材料与方法
1.1 材料与试剂
紫薯品种为美国黑薯,由湖北郧府薯业有限公司提供。
硫酸铵、氯化钠、碳酸钠、盐酸、氯化钾、乙酸、乙酸钠、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、甘氨酸、过硫氨酸 国药集团化学试剂有限公司;三羟甲基氨基甲烷(Tris(hydroxymethyl) aminomethane,Tris) 上海如吉生物科技发展有限公司;交联聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP) 上海阿拉丁试剂有限公司;透析袋(压平宽度10 mm,截留分子质量3 500 D)美国Viskase公司;没食子酸 美国Sigma公司;福林-酚试剂 上海荔达生物科技有限公司;蛋白质分子质量标准Marker(15~250 kD) 美国Bio-Rad公司;二乙氨基乙基纤维素(diethyl-aminoethanol,DEAE)-52 上海源叶变换生物科技有限公司;Sephadex G-75葡聚糖凝胶 武汉市盖云天生物技术有限公司;所有试剂均为分析纯。
1.2 仪器与设备
PCL-2紫外检测器 上海金达生化仪器有限公司;Mini-Protean-3电泳仪配电泳槽 美国Bio-Rad公司;Evolution 220紫外-可见分光光度计 美国Thermo Fisher公司;F-4600荧光光谱仪 日本日立公司;NEXUS670傅里叶变换红外光谱仪 美国尼高力仪器公司;J-1500圆二色谱仪 日本JASCO公司。
1.3 方法
1.3.1 紫薯花色苷-蛋白复合物的制备[8]
紫薯洗净后切块,加入3 倍体积蒸馏水,打浆,40 ℃水浴提取3 h,4 000 r/min离心30 min,取上清液。重复1 次,合并上清液。上清液中添加硫酸铵至饱和度60%,在4 ℃条件下缓慢搅拌1 h,4 000 r/min、4 ℃离心30 min取沉淀,用适量蒸馏水溶解沉淀后透析,冷冻干燥后即得到紫薯花色苷-蛋白复合物。
1.3.2 紫薯花色苷-蛋白复合物中蛋白质的分离纯化
取紫薯花色苷-蛋白复合物0.1 g溶于20 mL蒸馏水中,加入1g PVPP[9]涡旋后放置1 h,6 000 r/min离心30 min,上清液经0.22 μm的微孔滤膜过滤后,上DEAE-52阴离子交换层析柱(2.6 cm×23 cm)。用含0.3 mol/L NaCl的50 mmol/L Tris的HCl 缓冲液(pH 7.5)进行洗脱,流速为1 mL/min,在280 nm波长处用紫外检测器在线检测,收集峰组分,透析后冻干,得到粗蛋白粉末。
取10 mg粗蛋白粉溶于1 mL蒸馏水中,配制成10 mg/mL的蛋白液,上样于Sephadex G-75葡聚糖凝胶柱(2.6 cm×20 cm)进一步纯化,用蒸馏水进行洗脱,流速为1 mL/min,在280 nm波长用处紫外检测器在线检测,收集蛋白质峰的洗脱液,冻干,得到较纯的蛋白粉末样品。
1.3.3 紫薯蛋白与紫薯花色苷-蛋白复合物成分的测定
1.3.3.1 蛋白质含量的测定
参照GB 5009.5—2010《食品中蛋白质的测定》[10],采用凯氏定氮法测定。
1.3.3.2 总酚含量测定
采用福林-酚法测定紫薯花色苷-蛋白复合物的总酚含量[11]。准确吸取1 mL样品于10 mL刻度试管中,加5 mL蒸馏水与0.5 mL福林-酚试剂,摇匀1 min后加入1.5 mL 20% Na2CO3溶液,用蒸馏水稀释至刻度,室温避光反应2 h后在760 nm波长处测定吸光度。以没食子酸(gallic acid,GA)为标准品绘制标准曲线,总酚含量以没食子酸当量记,单位为mg GA/g。
1.3.3.3 总花色苷含量测定
采用pH示差法测定紫薯花色苷-蛋白复合物的总花色苷含量[12]。1 mL样品分别用pH 1.0、4.5缓冲液稀释,在最大吸收波长λmax和700 nm波长处测定吸光度。总花色苷含量按矢车菊素-3-葡萄糖苷含量记,计算公式如下:
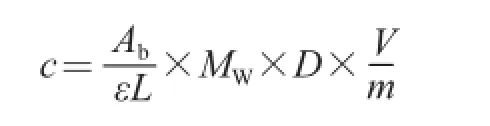
式中:c为总花色苷含量/(mg/g);Ab=(Aλmax-A700nm)pH1.0-(Aλmax-A700nm)pH4.5;ε为矢车菊素-3-葡萄糖苷的摩尔消光系数(26 900 L/(mol·cm));L为比色皿宽度(1 c m);MW为矢车菊素-3-葡萄糖苷的摩尔质量(4 4 9.2 g/m o l);D为稀释倍数;V为样品体积/mL;m为样品质量/g。
1.3.4 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)实验
根据Laemmli[13]的方法进行SDS-PAGE,分离胶的体积分数为12%,浓缩胶的体积分数为5%,紫薯蛋白与紫薯花色苷-蛋白复合物样品用去离子水溶解,按照每4 μL蛋白样品加入1 μL蛋白上样缓冲液的比例,混合蛋白样品和蛋白上样缓冲液,沸水浴10 min以充分变性蛋白,冷却至室温后,直接上样到SDS-PAGE胶点样孔中,上样量为10 μL。60 V电泳40 min,然后120 V电泳约2 h。采用0.25%的考马斯亮蓝R-250对分离胶进行染色,然后在7.5%乙酸中脱色。利用凝胶成像系统对凝胶拍照。
1.3.5 紫外吸收光谱分析
利用10 mmol/L的磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.0)调整紫薯蛋白和紫薯花色苷-蛋白复合物样品质量浓度到0.1 mg/mL,在190~700 nm进行光谱扫描,波长间隔为1 nm。
1.3.6 荧光光谱分析
紫薯蛋白和紫薯花色苷-蛋白复合物样品溶解在10 mmol/L的PBS(pH 7.0)中,调节质量浓度到0.1 mg/mL,固定激发波长为280 nm,测定290~450 nm的荧光发射光谱,激发和发射狭缝宽均为2.5 nm。
1.3.7 傅里叶变换红外光谱分析
取紫薯蛋白和紫薯花色苷-蛋白复合物冻干样品各1 mg与100 mg溴化钾粉末混合,在玛瑙研钵中磨细后压成透明薄片,在4 000~400 cm-1波数范围内扫描,每个样品扫描16 次,采用Omnic 8.2软件对数据进行处理分析。
1.3.8 圆二色谱分析
在室温条件下对紫薯蛋白和紫薯花色苷-蛋白复合物样品进行远紫外区圆二色谱分析,配制样品质量浓度为0.1 mg/mL,扫描范围为190~240 nm,样品池光程为2 mm。扫描速率为100 nm/mim,光谱带宽为1 nm,扫描3 次。
2 结果与分析
2.1 紫薯蛋白与紫薯花色苷-蛋白复合物成分含量
紫薯花色苷-蛋白复合物冻干后为深紫色粉末,蛋白质含量为(5 4.3 5±0.6 2)%,总酚含量为(128.62±4.54) mg/g,总花色苷含量为(47.41±0.73) mg/g。纯化后的紫薯蛋白为白色粉末,蛋白质含量为(94.43±1.16)%。
2.2 SDS-PAGE图谱
紫薯花色苷-蛋白复合物与紫薯蛋白的SDS-PAGE图谱如图1所示。与紫薯花色苷-蛋白复合物相比,经纯化处理后的蛋白条带更为清晰。紫薯花色苷-蛋白复合物与紫薯蛋白的分子质量并无明显差异,均在10 kD以上,有4 个明显的区域:58、24、18 kD和14 kD,其中分子质量为24 kD的染色带最粗,推断为紫薯中可溶性蛋白质的主要亚基。有相关报道表明SDS可破坏蛋白质与其他分子之间的非共价作用,而蛋白质与多酚反应形成的共价复合物的电泳条带会向上迁移[14],因而初步推断该紫薯花色苷-蛋白复合物是紫薯花色苷与紫薯蛋白反应形成的非共价复合物。
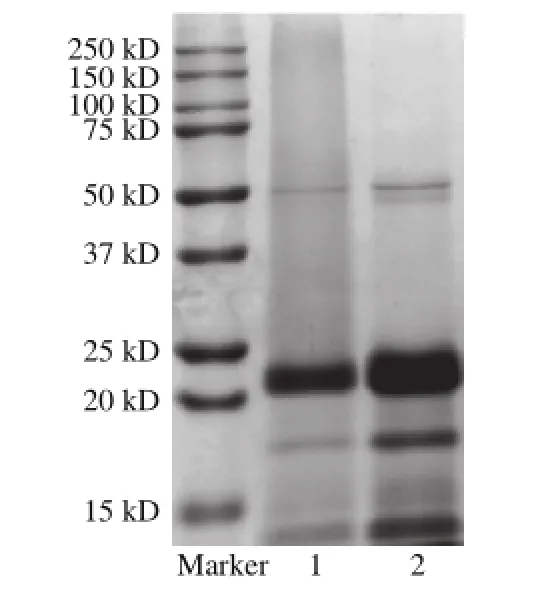
图1 紫薯蛋白与紫薯花色苷-蛋白复合物的SDS-PAGE图谱Fig. 1 SDS-PAGE of PSPP and complexes
2.3 紫外光谱分析
紫薯花色苷-蛋白复合物与紫薯蛋白的紫外吸收曲线如图2所示。紫薯蛋白主要有两个特征吸收峰,约200 nm波长处的强吸收峰是肽键的特征吸收峰,在280 nm波长附近出现的较弱的峰,一般为蛋白中色氨酸残基和酪氨酸残基的吸收峰。紫薯花色苷-蛋白复合物除具有此两峰外,还存在另两个吸收峰,330 nm波长处为花色苷中酰化结构的吸收峰,540 nm为花色苷在可见区的最大吸收波长。与紫薯蛋白相比,紫薯花色苷-蛋白复合物的紫外吸收增强,并发生了轻微的红移,说明花色苷与蛋白质发生了相互作用,芳香族氨基酸微环境疏水性增强。Zuo Huijun等[15]发现飞燕草素-3-葡萄糖苷与牛血清白蛋白结合后其紫外光谱会发生红移。
2.4 荧光光谱分析
图3为紫薯花色苷-蛋白复合物与紫薯蛋白的荧光光谱。蛋白质具有内源性荧光,主要来自色氨酸、酪氨酸和苯丙氨酸,其中色氨酸的荧光强度最强,最大发射波长为340 nm左右。固定激发波长为280 nm时,紫薯蛋白的最大发射波长是340 nm,表现了色氨酸的荧光特性。与紫薯蛋白的荧光光谱相比,紫薯花色苷-蛋白复合物的荧光强度显著降低,几乎完全猝灭,且出现了明显的蓝移,说明色氨酸残基空间位置发生了变化,周围微环境的疏水性增强。Wiese等[16]得到类似的研究结果:矢车菊素-3-葡萄糖苷与人血清蛋白的相互作用会导致蛋白荧光强度的猝灭。
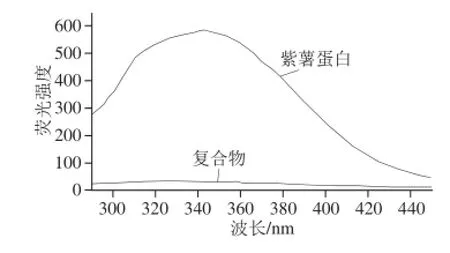
图3 紫薯蛋白与紫薯花色苷-蛋白复合物的荧光光谱Fig. 3 Fluorescence emission spectra of PSPP and complexes
2.5 傅里叶变换红外光谱分析
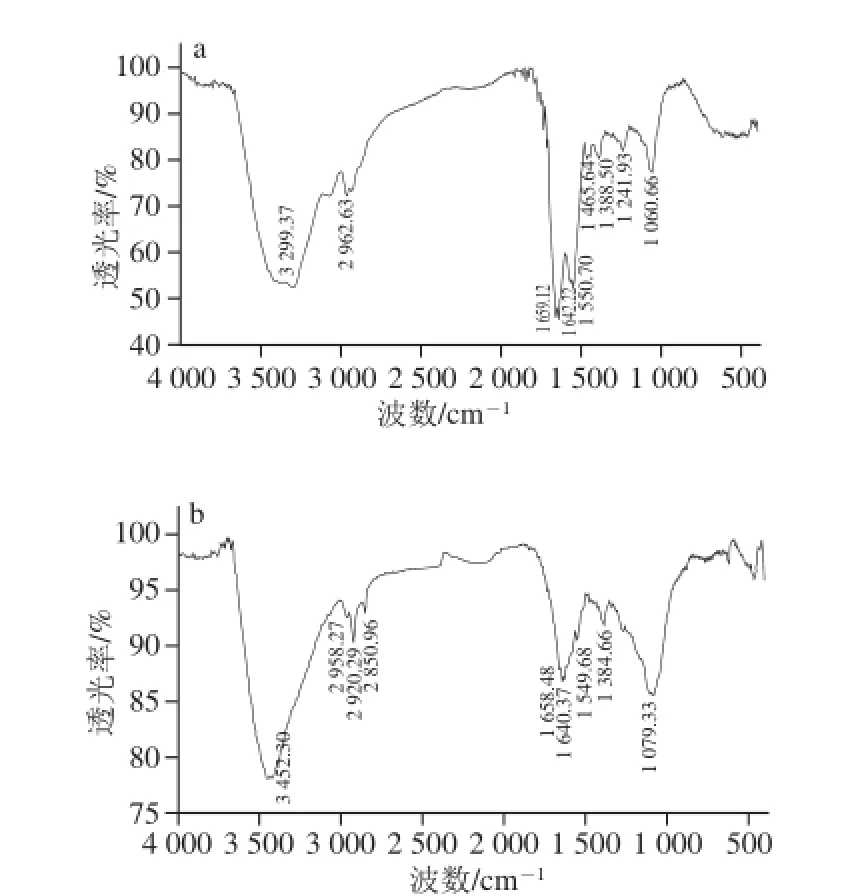
图4 紫薯蛋白(a)与紫薯花色苷-蛋白复合物(b)的FTIRFig. 4 FTIR spectra of PSPP and complexes
图4 为紫薯花色苷-蛋白复合物与紫薯蛋白的红外光谱图。酰胺A在3 400~3 440 cm-1处有吸收峰,与N—H伸缩振动有关。紫薯蛋白的酰胺A在3 299.37 cm-1处出现,发生红移现象,来源于酰胺A的N—H伸缩振动与氢键形成的缔合体,其对应波数会向低波数方向移动,一般在3 300 cm-1左右[17]。紫薯花色苷-蛋白复合物中此峰消失,说明分子内与分子间的氢键缔合消失[18]。紫薯蛋白在2 962.63 cm-1处有弱吸收,是由酰胺B的—CH2不对称伸缩引起的,而紫薯花色苷-蛋白复合物中此峰在2 958.27 cm-1处,较之略有红移。此外,紫薯花色苷-蛋白复合物中有2 个新峰出现,3 452.30 cm-1处可能是羟基伸缩振动吸收峰,2 920.29 cm-1处可能是甲氧基中C—H伸缩振动吸收峰,2 850.96 cm-1处可能是亚甲峰[19]。
紫薯蛋白在1 659.12 cm-1和1 642.22 cm-1处的强吸收峰,来自酰胺Ⅰ带的C=O伸缩振动。紫薯花色苷-蛋白复合物中酰胺Ⅰ带吸收峰强度明显减弱,且分别红移至1 658.48、1 640.37 cm-1处。紫薯蛋白和紫薯花色苷-蛋白复合物在1 550.70、1 549.68 cm-1处的吸收是酰胺Ⅱ带的特征吸收峰,反映了蛋白质的C—N伸缩振动和N—H弯曲振动。紫薯蛋白在1 465.64 cm-1和1 388.50 cm-1处的弱吸收是由C—H弯曲振动引起的,1 241.93 cm-1处为酰胺Ⅲ带(由C—N伸缩振动和N—H弯曲振动引起)的特征吸收,1 060.66 cm-1处为C—O伸缩振动。紫薯花色苷-蛋白复合物中这几处的特征吸收消失,并出现两个新峰,1 384.66 cm-1处可能是甲氧基中C—H面内弯曲振动吸收峰,1 079.33 cm-1处可能是C—O—C伸缩振动吸收峰[20],综合见表1。
由图4b可知,复合物中有羟基、甲氧基和含氧杂环等特征基团,这些基团也是花色苷类物质的特征基团。紫薯花色苷-蛋白复合物中酰胺带的峰形发生明显变化,可能是花色苷类物质与蛋白结合,导致蛋白结构发生变化[21]。
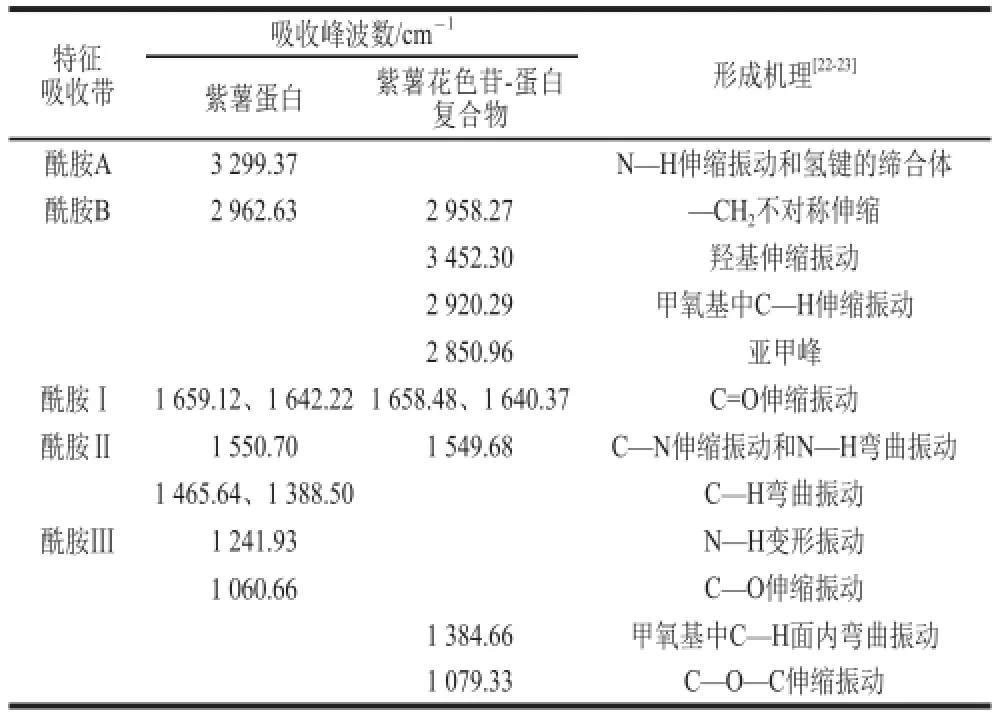
表1 紫薯蛋白与紫薯花色苷-蛋白复合物的红外光谱吸收峰位置Table 1 FTIR spectral peak locations of PSPP and complexes
2.6 圆二色光谱分析
远紫外圆二色谱常用来分析蛋白质的二级结构,它对蛋白质的构象变化极其灵敏,从圆二色光谱的变化可推导出构象的变化。由图5可知,紫薯蛋白在193 nm波长处的正峰和218 nm波长处的负峰为β-折叠[24]的特征峰,而紫薯花色苷-蛋白复合物中β-折叠的特征峰有所偏移,分别移动至195 nm和214 nm波长处,并且峰强度明显增强。无规卷曲构象在紫薯蛋白中表现为200 nm波长处的强负峰和212 nm波长处的正峰[24],而紫薯花色苷-蛋白复合物在203 nm和210 nm波长处的特征峰强度显著减小。利用Yang氏算法计算得到蛋白的二级结构百分含量,结果如表2所示。紫薯蛋白的二级结构主要为β-折叠和无规卷曲,此结果与Sun Minjie等[25]制备的甘薯蛋白的圆二色光谱结果类似。紫薯花色苷-蛋白复合物中β-折叠含量增加,β-转角和无规卷曲含量降低,α-螺旋含量没有变化。
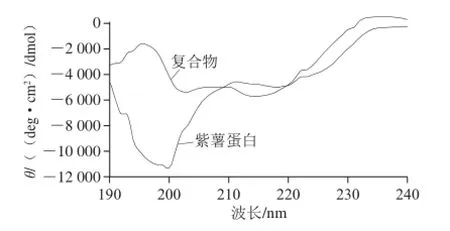
图5 紫薯蛋白与紫薯花色苷-蛋白复合物的圆二色光谱Fig. 5 CD spectra of PSPP and complexes
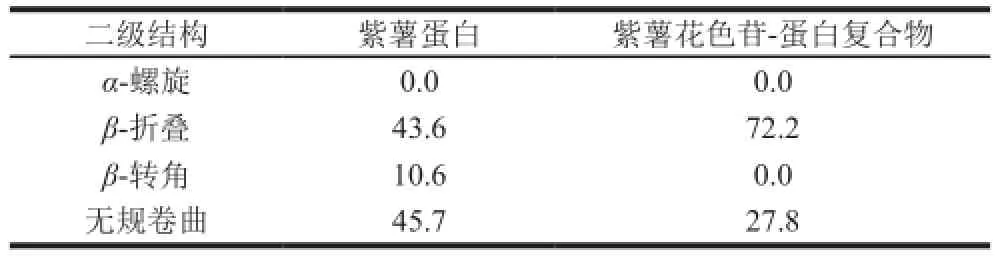
表2 紫薯蛋白与紫薯花色苷-蛋白复合物的二级结构含量Table 2 Secondary structure contents of PSPP and complexes %
3 结 论
采用硫酸铵沉淀法提取紫薯花色苷-蛋白复合物,柱层析系统分离纯化得紫薯纯蛋白。凝胶电泳图谱显示两者分子质量无明显差异,亚基分布在14~58 kD。但二者在结构上有一定的差异,可能是花色苷与蛋白质结合对蛋白的结构和构象产生了一定影响。
紫薯蛋白紫外最大吸收峰位于200 nm波长处,紫薯花色苷-蛋白复合物的紫外吸收增强,并略有红移。紫薯蛋白的最大发射波长是340 nm,紫薯花色苷-蛋白复合物复合物荧光强度显著降低,几乎完全猝灭。紫薯蛋白的红外光谱具有明显的酰胺带吸收,紫薯花色苷-蛋白复合物的峰形和吸收强度发生变化。圆二色光谱图谱显示紫薯蛋白二级结构以β-折叠和无规卷曲为主,紫薯花色苷-蛋白复合物中β-折叠含量较高,空间构象更为有序。
[1] 李郁, 木泰华, 孙艳丽, 等. 不同溶剂和超滤浓缩倍率对甘薯蛋白提取及纯度的影响[J]. 食品研究与开发, 2007, 28(6): 1-5. DOI:0.3969/ j.issn.1005-6521.2007.06.001.
[2] PĘKSA A, KITA A, KUŁAKOWSKA K, et al. The quality of protein of coloured fleshed potatoes[J]. Food Chemistry, 2013, 141(3): 2960-2966. DOI:10.1016/j.foodchem.2014.12.013.
[3] ALU’DATT M H, RABABAH T, EREIFEJ K, et al. Phenolic-protein interactions in oilseed protein isolates[J]. Food Research International, 2013, 52(1): 178-184. DOI:10.1016/j.foodres.2013.03.010.
[4] ROHN S. Possibilities and limitations in the analysis of covalent interactions between phenolic compounds and proteins[J]. Food Research International, 2014, 65(Part A): 13-19. DOI:10.1016/ j.foodres.2014.05.042.
[5] JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids and proteins[J]. Food Chemistry, 2015, 175: 556-567. DOI:10.1016/ j.foodchem.2014.12.013.
[6] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International, 2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009.
[7] ALU’DATT M H, RABABAH T, ALHAMAD M N, et al. Antioxidant and antihypertensive properties of phenolic-protein complexes in extracted protein fractions from Nigella damascena and Nigella arvensis[J]. Food Hydrocolloids, 2016, 56: 84-92. DOI:10.1016/ j.foodhyd.2015.12.008.
[8] 林晓婕, 傅红, 杨琳, 等. 烟草色素蛋白复合物中多酚类物质对其抗紫外性能的影响[J]. 中国烟草科学, 2011, 32(2): 57-61. DOI:10.3969/ j.issn.1007-5119.2011.02.013.
[9] LIU M X, WANG Y W, HAN J G, et al. The content and distribution of condensed tannins in different species of the genus sorghum (Sorghum Moench) and their effect on seed protein electrophoresis[J]. Journal of the Science of Food and Agriculture, 2009, 89(9): 1446-1452. DOI:10.1002/jsfa.3593.
[10] 卫生部. 食品中蛋白质的测定: GB 5009.5—2010[S]. 北京: 中国标准出版社, 2010: 1-7.
[11] DENG G F, LIN X, XU X R, et al. Antioxidant capacities and total phenolic contents of 56 vegetables[J]. Journal of Functional Foods, 2013, 5(1): 260-266. DOI:10.1016/j.jff.2012.10.015.
[12] WANG H Y. Rapid quantitative analysis of individual anthocyanin content based on high-performance liquid chromatography with diode array detection with the pH differential method[J]. Journal of Separation Science, 2014, 37(8): 2535-2544. DOI:10.1002/jssc.201400364.
[13] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[14] 魏子淏. 乳蛋白-EGCG和壳聚糖-绿原酸复合物的制备、结构表征及功能评价[D]. 北京: 中国农业大学, 2015: 20-21.
[15] ZUO H J, TANG L, LI S, et al. Combined multispectroscopic and molecular docking investigation on the interaction between delphinidin-3-O-glucoside and bovine serum albumin[J]. Luminescence, 2015, 30(1): 110-117. DOI:10.1002/bio.2704.
[16] WIESE S, GÄRTNER S, RAWEL H M, et al. Protein interactions with cyanidin-3-glucoside and its influence on [alpha]-amylase activity[J]. Journal of the Science of Food and Agriculture, 2009, 89(1): 33. DOI:10.1002/jsfa.3407.
[17] MAZZARACCHIO P, TOZZI S, BOGA C, et al. Interaction between gliadins and anthocyan derivatives[J]. Food Chemistry, 2011, 129(3): 1100-1107. DOI:10.1016/j.foodchem.2011.05.084.
[18] 杨伟, 袁芳, 高彦祥. 鱼胶原蛋白肽与表没食子儿茶素酸酯相互作用的研究[J]. 光谱学与光谱分析, 2015, 35(1): 184-188. DOI:10.3964/j.issn.1000-0593(2015)01-0184-05.
[19] 张海悦, 张守媛, 韩升廷. 黑葵花籽壳中主要花色苷类物质的结构分析[J]. 食品科学, 2012, 33(17): 118-121. DOI:1002-6630(2012)17-0118-04.
[20] 郭庆启, 张娜, 刘洪博, 等. 大孔树脂法纯化黑加仑果渣花色苷及初步鉴定[J]. 中国调味品, 2010, 35(9): 100-103; 113. DOI:10.3969/ j.issn.1000-9973.2010.09.021.
[21] WANG L, XU Y, ZHOU S M, et al. Interaction between Vaccinium bracteatum Thunb. leaf pigment and rice proteins[J]. Food Chemistry, 2016, 194: 272-278. DOI:10.1016/j.foodchem.2015.08.006.
[22] 孟令芝, 何永炳. 有机波谱分析[M]. 武汉: 武汉大学出版社. 1997: 1-47.
[23] ZHANG H, YU D D, SUN J, et al. Interaction of milk whey protein with common phenolic acids[J]. Journal of Molecular Structure, 2014, 1058: 228-233. DOI:10.1016/j.molstruc.2013.11.009.
[24] 沈星灿, 梁宏, 何锡文, 等. 圆二色光谱分析蛋白质构象的方法及研究进展[J]. 分析化学, 2004, 32(3): 388-394. DOI:10.3321/ j.issn:0253-3820.2004.03.028.
[25] SUN M J, MU T H, SUN H N, et al. Digestibility and structural properties of thermal and high hydrostatic pressure treated sweet potato (Ipomoea batatas L.) protein[J]. Plant Foods for Human Nutrition, 2014, 69(3): 270-275. DOI:10.1007/s11130-014-0426-9.
Preparation and Structure Identification of Anthocyanins-Protein Complexes from Purple Sweet Potato
GUO Ying, JIANG Tian, LI Shuyi, ZHU Zhenzhou, HE Jingren*
(College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Purple sweet potato anthocyanins-protein complexes were extracted with hot water and precipitated by adding ammonium sulfate to 60% saturation. Purple sweet potato protein (PSPP) was further purified from the complexes by DEAE-52 ion exchange chromatography and Sephadex G-75 gel filtration chromatography. The molecular weights of PSPP and the complexes were determined by SDS-PAGE. A series of spectroscopic methods were used to characterize their structures. Results showed that there was no difference between PSPP and its complexes with anthocyanins in molecular weight. SDS-PAGE analysis exhibited four bands with molecular weights of 58, 24, 18 and 14 kD, respectively. The UV absorption spectra of both PSPP and the complexes showed a peak at 200 nm, but additional peaks and red-shift phenomenon of the complexes were observed when compared to PSPP. The maximum fluorescence emission wavelength of PSPP was 340 nm, and the intensity for the complexes was almost entirely quenched. FTIR spectra of PSPP had characteristic amide bands, and the shape and intensity of the complexes revealed a significant change. Circular dichroism (CD) revealed that PSPP had a secondary structure characterized by β-sheets (43.6%) and random coils (45.7%), β-turns (10.6%), while the complexes had higher content of β-sheets (72.2%) and decreased content of random coils (27.8%), and showed the disappearance of β-turns.
purple sweet potato; anthocyanins-protein complexes; purple sweet potato protein; structure characterization
10.7506/spkx1002-6630-201621019
Q946.1
A
1002-6630(2016)21-0109-05
郭莹, 江甜, 李书艺, 等. 紫薯花色苷-蛋白复合物的制备及结构表征[J]. 食品科学, 2016, 37(21): 109-113. DOI:10.7506/ spkx1002-6630-201621019. http://www.spkx.net.cn
GUO Ying, JIANG Tian, LI Shuyi, et al. Preparation and structure identification of anthocyanins-protein complexes from purple sweet potato[J]. Food Science, 2016, 37(21): 109-113. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201621019. http://www.spkx.net.cn
2015-11-13
湖北省自然科学基金计划项目(2014CFB891);湖北省科技支撑计划项目(2015BHE015);国家自然科学基金面上项目(31371727);国际科技合作与交流专项(2014DFG32310)
郭莹(1991—),女,硕士研究生,研究方向为农产品加工化学与食品营养。E-mail:guoying1254@126.com
*通信作者:何静仁(1974—),男,教授,博士,研究方向为膳食功效物质基础与分子营养。E-mail:jingren.he@whpu.edu.cn

