甲状旁腺激素-人血清白蛋白融合蛋白在CHO细胞中的表达
张焕,徐栋生,蔡燕飞,陈蕴,金坚
(江南大学药学院,江苏无锡214122)
甲状旁腺激素-人血清白蛋白融合蛋白在CHO细胞中的表达
张焕,徐栋生,蔡燕飞,陈蕴,金坚
(江南大学药学院,江苏无锡214122)
人甲状旁腺激素是由人甲状腺旁腺主细胞分泌合成的一种单链多肽激素,成熟的甲状旁腺激素含84个氨基酸残基,其活性区域为N-末端1-34氨基酸片段,目前已上市的PTH药物也以34个氨基酸残基的多肽为主,主要用于治疗老年骨质疏松以及绝经后妇女骨质疏松。但是PTH的稳定性较差,导致体内半衰期短,难以形成有治疗作用的稳态血药浓度,从而限制了其临床应用。因此,设计稳定并能保持原有生物活性的PTH药物分子至关重要。构建含有融合蛋白基因PTH-HSA的pM H3质粒,并通过电转染的方法转入中国仓鼠卵巢细胞(Chinese ham ster ovary cell,CHO细胞)中,利用pM H3质粒所携带的N EO基因进行筛选,最终得到能稳定表达目的蛋白的重组细胞,并在5L发酵罐中进行表达,融合蛋白PTH-HSA表达量达到155m g/L。W estern blot检测显示,该融合蛋白同时具有HSA和PTH双重免疫原性。
甲状旁腺激素-人血清白蛋白;融合蛋白;中国仓鼠卵巢细胞
人甲状旁腺激素(Human parathyroid hormone,hPTH)是由人甲状腺旁腺主细胞分泌合成的一种单链多肽激素,成熟的PTH含84个氨基酸残基,其活性区域为N-末端1-34氨基酸片段,目前已上市的PTH药物也以34个氨基酸残基的多肽为主,主要用于治疗老年骨质疏松以及绝经后妇女骨质疏松[1]。但是PTH发挥的稳定性较差,导致体内半衰期短,难以形成有治疗作用的稳态血药浓度,从而限制了其临床应用[2]。因此,设计稳定并能保持原有生物活性的PTH药物分子至关重要。
人甲状旁腺激素是人体内调节钙磷代谢和骨转换的最为重要的激素之一。甲状旁腺激素的分子量仅为9.5KD,作为一种分子药物使用时,在代谢的过程中容易被肾小球滤过,导致体内半衰期较短,为了达到治疗效果需要频繁给药或大剂量用药,从而给患者带来了极大的不便。因此,增大分子量是长效蛋白药物开发的主要方法。人血清白蛋白HSA是一个稳定的“惰性”蛋白,同时也是许多内源因子和外源药物的载体。药物与其融合后可以减缓自身的生物利用速度,延长在体内的半衰期,最长可达19d。陈静等在毕赤酵母中表达HSA-hPTH(1-34)融合蛋白,检测到该融合蛋白具有生物活性,表达量可达400mg/L,分子量约为70KD。此项研究虽然成功地表达了具有生物活性的HSA-hPTH(1-34),但是融合蛋白在毕赤酵母中表达后,其N端的PTH肽中氨基酸会被随机偶然修饰,影响融合蛋白的质量从而影响融合蛋白的实际应用[3]。目前中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO细胞)已经成为表达重组蛋白药物最为理想的宿主之一,CHO细胞表达的糖基化药物最接近天然蛋白,且很少分泌自身内源蛋白,产物胞外分泌,利于纯化[4]。本研究利用CHO表达系统的优势,在CHO表达系统中对hPTH(1-34)和HSA融合蛋白进行表达,期望获得高效表达融合蛋白hPTH(1-34)-HSA的CHO细胞系,为HSA融合蛋白药物提供新的表达思路。
1 材料和方法
1.1材料
质粒pPIC9K/hPTH(1-34)-HSA由江南大学药学院实验室保存;CHO-S细胞和pMH3质粒由AmProtein公司馈赠;大肠杆菌DH5α,T4连接酶,限制性内切酶EcoRI、NotI,DNA聚合酶等购自TaKaRa公司;质粒提取试剂盒、胶回收试剂盒、PCR产物回收试剂盒等购自上海生工生物公司;DMEM-F12培养基和胎牛血清(FBS)购自Gibco公司;无血清基础培养基B001和无血清流加培养基F001购自杭州安瑞普生物制品研究有限公司;G418购自Sigma公司;PTH抗体、HSA(HRP)抗体、HSA抗体均购自Abcam公司;山羊抗兔二抗和山羊抗小鼠二抗购自碧云天公司;尿微量白蛋白试剂盒购自上海名典生物,其余均为国产或进口分析纯试剂。
1.2PCR扩增引物
PTH(1-34)-HSA融合蛋白PCR引物见表1。
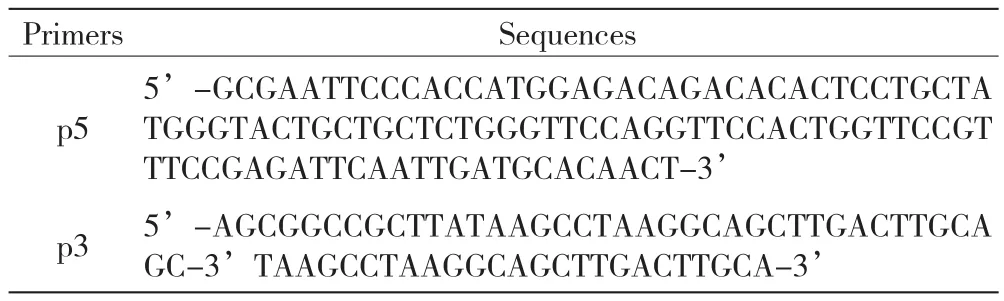
表1 PTH(1-34)-HSA融合蛋白PCR引物
其中,p5和p3的波浪线部分为EcoRⅠ和NotⅠ的酶切位点;p5中EcoRⅠ后CCACC为Kozac序列,下划线部分为Igk信号肽序列,以上引物均由上海生工生物工程有限公司合成。
1.3CHO-S细胞的转染
CHO-S细胞在含10%胎牛血清的DMEM-F12培养基中培养,当细胞长至汇合度80%左右时,用胰酶消化,离心收集细胞,PBS重悬并调整浓度为1.5×107cells/mL。取200μL细胞悬液,10μg质粒进行电转染。电转条件为:500V,500μs电击4次,每两次电击间隔冰浴1min。电击后将电极杯中的细胞悬液均分至2个10cm培养皿(DMEM/F12,含10%胎牛血清)中培养24h后,加入终浓度为1.5mg/L G418进行筛选,期间观察细胞状态,待细胞出现大量死亡时(一般2~3d)更换到含10%胎牛血清的DMEM-F12培养基中培养,待细胞克隆长出。
1.4稳定表达PTH(1-34)-HSA细胞株的筛选
1.4.1孔板筛选
待细胞克隆长至合适大小后将所有单克隆挑至96孔板中。在含10%胎牛血清的DMEM-F12培养基中培养7~8d后PBS清洗细胞,每孔加入100μL无血清培养基,48h后取上清液用HSA(HRP)抗体进行Dot-blot检测,进行快速筛选。得到的PTH-HSA高表达克隆转入24孔板中,培养2~3d后用PBS清洗,每孔加入200μL无血清培养基,48h后取上清液进行Dot-blot检测,挑选表达量最高的克隆作为一次克隆。用同样的方法进行二次克隆筛选,以纯化克隆并提高产量。
1.4.2摇瓶终筛
通过梯度将血清的方法将96孔板中筛选的克隆进行悬浮驯化,驯化好的细胞能在无血清培养基B001中正常生长,表现为细胞大小均一,无成团现象,密度每天翻倍,活率在98%以上。弃去无法悬浮驯化的细胞克隆。从摇瓶中取对数生长期的细胞,调整细胞密度为1.0×106cells/mL。分装至150mL摇瓶中,每株细胞3瓶,每瓶30mL,并添加每瓶600μL(200g/L)葡萄糖,110rpm,37℃恒温振荡培养7d。待培养结束后,取样收集上清,将上清液样品进行SDS-PAGE和Western blot检测,此步骤所用抗体为PTH抗体。挑选表达量最高的克隆作为最终筛选成功的细胞克隆。
1.4.3Dot-blot检测
培养上清按照顺序点到NC膜上,5%脱脂奶粉37℃封闭2h,HSA(HRP)抗体37℃孵育1h,TBST(TBS含0.5% Twen-20)漂洗3次,ECL显色成像。
1.4.4Western blot检测
取表达上清样品进行SDS-PAGE分离,转至NC膜上,5%脱脂奶粉37℃封闭2h,一抗37℃孵育2h,TBST(TBS含0.5%Tween-20)漂洗3次,二抗37℃孵育1h,TBST(TBS含0.5%Tween-20)漂洗3次,ECL显色成像。
1.5PTH(1-34)-HSA细胞株上罐发酵
将筛选获得的高表达细胞株进行上罐发酵(发酵罐AP20-5L,购自杭州安普杭州安普生物工程有限公司)。一次性反应袋的最大装液量为为3L。种子液1L,密度约为4×106cells/mL。培养条件为:温度37℃,pH6.8~7.0,溶氧40%~80%,转速55rpm,种子扩培至密度为8×106cells/mL时,降低培养温度至34℃,用以推迟细胞进入衰亡期,尽可能提高蛋白产量。每天取样,通过检测细胞活率、糖浓度、乳酸浓度等指标来确定流加方案,流加培养基为F001。待细胞活率降至80%时停止发酵。
2 结果与讨论
2.1表达载体pMH3/PTH(1-34)-HSA的构建
图1为重组质粒pMH3/PTH(1-34)-HSA的示意图,pMH3载体拥有GC-rich高效表达核心技术(WO2008/091276)、天然高表达元件(Chick beta actin gene intron-1)等,主要用于哺乳动物宿主细胞的高表达稳定细胞株构建。将目的基因hPTH(1-34)-HAS插在其多克隆位点区域。
图2中,PCR结果显示目的基因PTH(1-34)-HAS约为2000bp,与其理论值相符。酶切结果显示目的基因的分子量大小同样与理论值相符。测序结果与设计的基因序列比对结果一致,证实重组质粒构建成功。
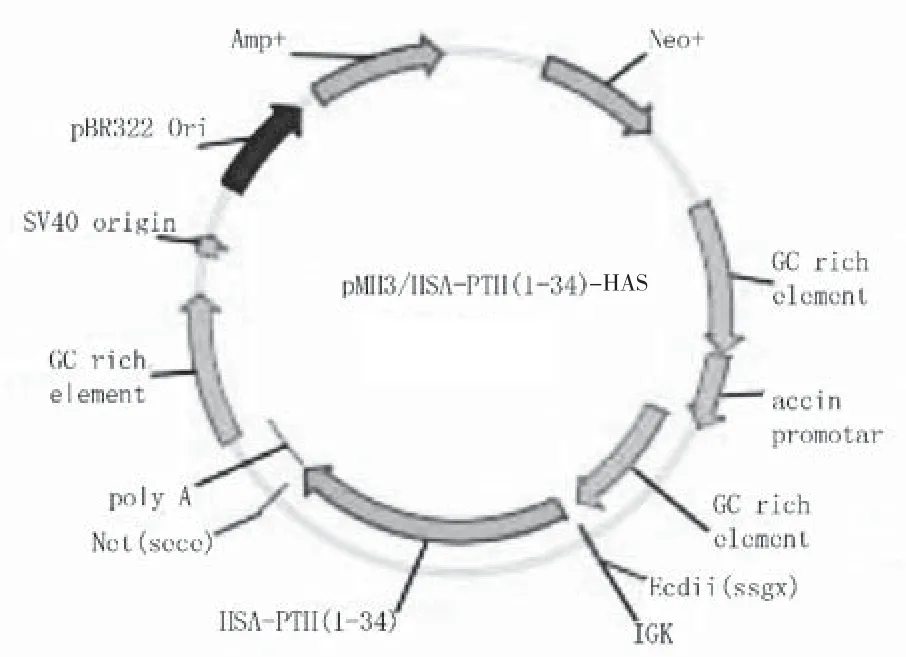
图1 pMH3/PTH(1-34)-HSA重组质粒示意图
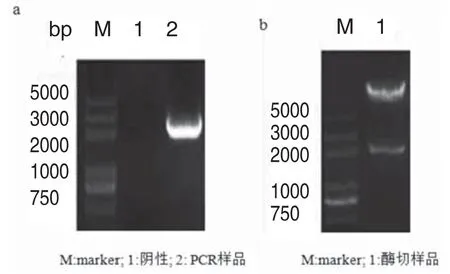
图2 pMH3/PTH(1-34)-HSA重组质粒的构建
2.296孔板筛选
将挑取的克隆在96孔板中分别进行培养,表达并取上清液进行Dot-blot检测,图3显示了部分结果。结果显示,一次克隆中有40%左右的克隆具有HSA免疫原性,二次克隆的阳性率明显提高,基本高于90%,说明通过二次克隆筛选既提高了蛋白产量,同时克隆的纯度和稳定性也有了大幅度提高。将挑选出的高表达量菌株扩培,并冻存一份在液氮中。
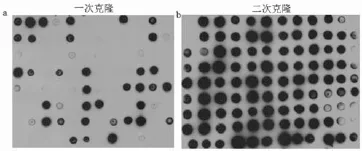
图3 孔板筛选结果
2.3摇瓶终筛
将驯化好的细胞克隆在摇瓶中悬浮培养7d,通过SDS-PAGE和Western blot检测进一步筛选高表达克隆。结果如图4所示,图中阳性为酵母表达的融合蛋白,由本研究室自行提供。结果表明,挑选的6个克隆均具有PTH免疫原性,能较好得表达目的蛋白,目的蛋白分子量约为70KD,与实际相符。其中泳道8的克隆表达量最高,是一般克隆的两三倍。因此,最终选择该克隆为最终被筛选成功的克隆。
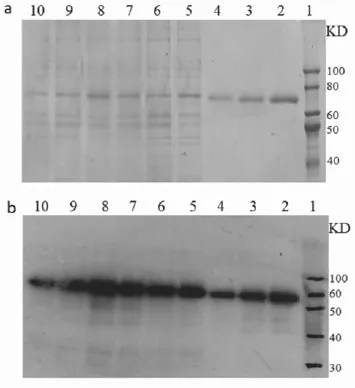
图4 摇瓶终筛结果
2.4PTH(1-34)-HSA细胞株上罐发酵
将摇瓶终筛获得的克隆进行上罐发酵,上罐第4天种子扩培至密度为8×106cells/mL,此时将培养温度降低至34℃,同时进行流加F001,每天取样,待上罐至12d时,细胞活率降至80%停止发酵。将样品进行SDS-PAGE和Western blot检测,结果如图5所示。结果表明,筛选的克隆适用于罐上表达,随着发酵时间的延长其产量逐渐增高,与PTH单抗杂交后条带单一。通过尿微量白蛋白试剂盒检测融合蛋白表达量达为155mg/L。
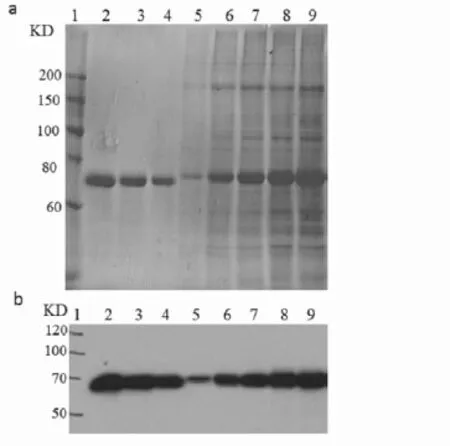
图5 重组细胞株的罐上表达情况
3 结论
本研究成功构建了含有融合蛋白基因PTH(1-34)-HSA的pMH3质粒,并通过电转染的方法转入CHO-S细胞中,通过二次克隆筛选及摇瓶终筛,最终获得了能稳定表达目的蛋白的重组细胞,并在5L发酵罐中进行发酵表达,筛选的克隆适用于罐上表达,表达产物相对分子量为70KD与目的融合蛋白理论分子量相符,且具有HSA和PTH双重免疫原性,融合蛋白表达量达到155mg/L。
本研究室已经在毕赤酵母中成功表达了多种白蛋白融合药物,以延长小分子蛋白药物的半衰期。PTH(1-34)-HSA融合蛋白也已在酵母中获得成功表达,然而外源性重组蛋白在酵母中进行糖基化的方式与哺乳动物细胞有所不同,表达蛋白虽然有一定活性,但由于糖基化方式不同,作为药物在人体内易出现糖蛋白免疫原性增强、活性降低、半衰期缩短等问题。CHO表达系统与其他表达系统相比更适于重组蛋白表达[6]:具有准确的转录后修饰功能,表达的糖基化药物蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子;适应悬浮培养;重组基因高效扩增表达;产物胞外分泌。目前已筛选出可高效表达hPTH(1-34)-HSA融合蛋白的单克隆细胞株,经过悬浮驯化后,可以达到高密度培养,提高融合蛋白表达量,实现融合蛋白的高效表达,为重组蛋白的规模化生产奠定基础。
[1] Silva BC,CostaAG,Cusano NE,et al. Catabolic and anabolic actions of parathyroid hormone on the skeleton[J]. Journal of Endocrinological Investigation,2011,34(10):801-810.
[2]李俊毅,彭林,唐存多,等.全长PTH(1-34)-HSA融合蛋白在毕赤酵母中的表达及其活性[J].中国生物制品学杂志,2013,26(4):515-520.
[3]诸葛斌,刘青霞,方慧英,等.利用酿酒酵母稳定表达重组人血清白蛋白-人甲状旁腺激素(1-34)ab二联体融合蛋白,中国:201210479073.4[P].2013.
[4] Kim JY,Kim YG,Lee GM. CHO cells i n biotechnology for production of recombinant proteins: current state and further potential[J]. Applied Microbiology and Biotechnology,2012,93(3):917-930.
[5]关波,金坚,李华钟.改良毕赤酵母分泌表达外源蛋白能力的研究进展[J].微生物学报,2011,51(7):851-857.
[6]王登,刘煜.用于重组蛋白表达的哺乳动物细胞系的研究进展[J].药物生物技术,2014,11(5):478-482.
Expression of Parathyroid Hormone - Human Serum Albumin Fusion Protein in CHO Cells
Zhang Huan,Xu Dong-sheng,Cai Yan-fei,Chen Yun,Jin Jian
Human parathyroid hormone is synthesized as a single polypeptide hormone secreted by the thyroid parathyroid chief cells,the mature PTH containing 84 amino acid residues,the active region for N-terminal 1-34 amino acid fragment,the PTH drugs already on the market also to 34 amino acid residues of the polypeptide based,mainly for treatment of the old osteoporosis and postmenopausal women with osteoporosis. But the stability of PTH is poor,which leads to a short half-life in vivo,and it is difficult to form a stable blood drug concentration with therapeutic action,thus limiting its clinical application. Therefore,it is very important to design a PTH drug molecule which is stable and can maintain the original biological activity. PMH3 plasmid containing fusion protein gene PTH-HSA was constructed in this paper. And by electroporation method into Chinese hamster ovary (CHO cell,Chinese hamster ovary cell) cell in,use pMH3 plasmids carrying the neo gene was screened and eventually get stable expression of aim protein of recombinant cells,and its expression in 5L fermentor,the fusion protein PTH-HSA expression reached 155mg/L. Western Blot assay showed that the fusion protein had both HSA and PTH double immunogenicity.
Parathyroid hormone - human serum albumin; Fusion protein; Chinese hamster ovary cell
Q786
A
2096-0387(2016)05-0036-05
国家重大新药创制项目(2013zx09102033);国家高技术863计划(2014aa021003,2015aa020802);国家自然科学基金(81273437)。
张焕(1990-),男,安徽安庆人,硕士,研究方向:生物制药。

