4-(3-羟基丁氧基)-2-丁醇光学异构体的合成
孙宝厚, 赵 毅, 海 俐, 郭 丽, 吴 勇
(四川大学华西药学院, 靶向药物及释药系统教育部重点实验室, 成都 610041)
4-(3-羟基丁氧基)-2-丁醇光学异构体的合成
孙宝厚, 赵 毅, 海 俐, 郭 丽, 吴 勇
(四川大学华西药学院, 靶向药物及释药系统教育部重点实验室, 成都 610041)
以廉价易得的(R/S)-3-羟基丁酸甲酯(4a/4b)为起始原料, 经过5步反应, 以44%~50%的总收率合成了4-(3-羟基丁氧基)-2-丁醇光学异构体1a~1c, 为相应的手性新药的开发提供了新途径.
保丹健素; 二羟基二丁醚; 光学异构体
胆结石病是胆道系统的一种常见疾病. 近年来, 胆结石的发病率呈现逐年升高的趋势, 对人们的日常生活造成了严重的影响. 目前, 治疗胆结石的药物主要有保丹健素、 茴三硫和托尼萘酸等, 其中保丹健素具有利胆、 护肝、 解痉、 降脂、 排石和消炎的作用[1~6]. 其通用名为二羟基二丁醚, 由4-(3-羟基丁氧基)-2-丁醇(1)、 3-(3-羟基丁氧基)-1-丁醇(2)和3-(3-羟基-1-甲基丙氧基)-1-丁醇(3) 3种成分组成(见图1)[7], 能调节胆汁中水相和固相双相分泌, 具有高效率、 低毒性及质量可控的特点.
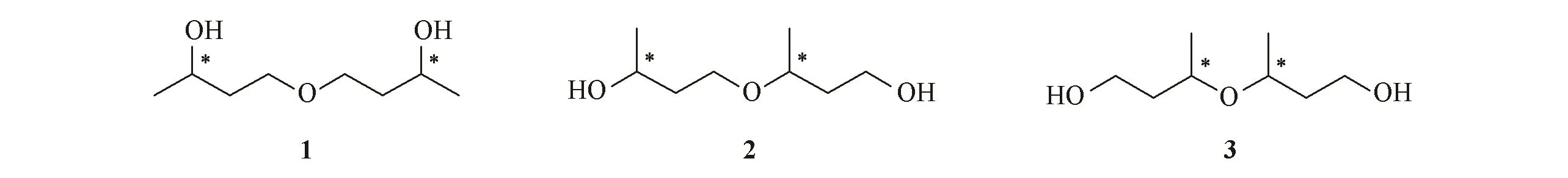
Fig.1 Regioisomers of dihydroxyldibutylether
从消旋的药物中分离手性异构体是发现新药的重要途径, 例如: 从奥美拉唑中分离得到的左旋埃索美拉唑, 在临床上用作质子泵抑制剂[8]; 西替利嗪和左旋西替利嗪均表现出良好的抗组胺活性[9]. 保丹健素给药后, 化合物1在体内可以快速发挥药效[10], 其包含3个光学异构体(R)-4-[(R)-3-羟基丁氧基]-2-丁醇(1a), (S)-4-[(S)-3-羟基丁氧基]-2-丁醇(1b)和(R)-4-[(S)-3-羟基丁氧基]-2-丁醇(1c)(图2). 迄今, 关于保丹健素的研究主要集中在其生产工艺方面, 有关其光学异构体的分离或者制备方法的报道较少[11]. 制备手性药物的方法主要有化学方法和生物方法[12,13], 本文采用化学方法中的手性源合成法定向合成3种光学异构体(1a~1c), 以实现相关新药的研发.
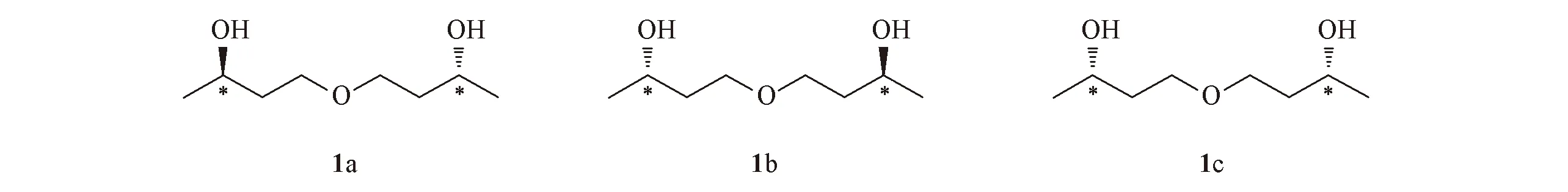
Fig.2 Stereoisomers of compound 1
1 实验部分
1.1 试剂与仪器
三氟甲磺酸(TFA)、 四氢呋喃(THF)、 甲磺酰氯(MsCl)、 叔丁基二甲基氯硅烷(TBSCl)、 吡啶(Py)、 4-二甲氨基吡啶(DMAP)、 N,N-二甲基甲酰胺(DMF)、 溴化苄(BnBr)、 乙酸乙酯(EA)和四丁基氟化铵(TBAF)均为市售分析纯, 除特殊注明外未经进一步处理.
Bruker Avance 400 MHz型核磁共振仪(以四甲基硅烷为内标)和Bruker APEX Ⅱ型傅里叶变换离子回旋共振质谱仪(ESI源), 瑞士布鲁克公司; MCP 200型旋光仪(奥地利安东帕公司); CLJBQ-3型恒温磁力搅拌器(郑州长城科工贸有限公司); EYELA 型旋转蒸发仪(东京理化器械独资工厂); FA2104型电子天平(上海恒平科学仪器有限公司).
1.2 实验过程
目标化合物1a~1c的合成路线如Scheme 1所示.

Scheme 1 Synthetic route of compounds 1a—1cReagents and conditions: a. benzyl trichloroacetimidate, TFA, CH2Cl2, r. t., 24 h; b. LiAlH4, THF, 0 ℃, 2 h; c. MsCl, Py, CH2Cl2, 0 ℃, 2 h; d. NaH, THF, 70 ℃, 5 h; e. H2, Pd/C, MeOH, 50 ℃, 2 h.

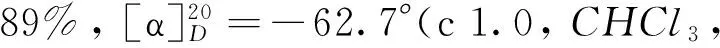
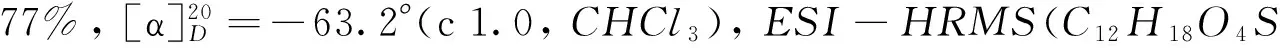
化合物8a~8c参照文献[11]方法合成. 目标化合物1a~1c参照文献[11]方法合成. 化合物8a~8c和1a~1c的理化性质和核磁共振数据分别列于表1和表2.
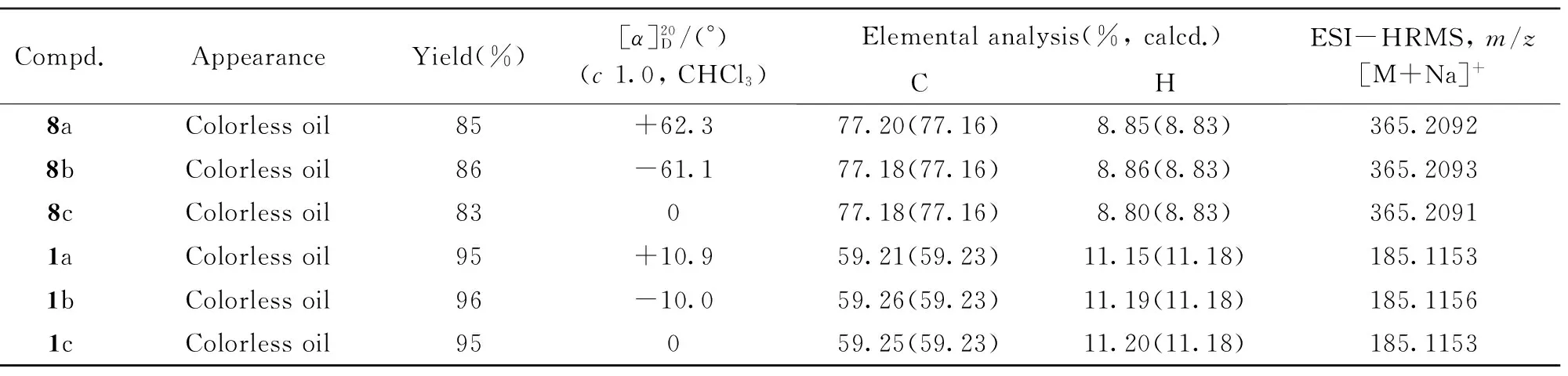
Table 1 Appearance, yields, optical rotation, elemental analysis and MS data of compounds 8a—8c and 1a—1c

Table 2 1H NMR and 13C NMR data of compounds 8a—8c and 1a—1c
2 结果与讨论
从结构式分析, 化合物1可以分为2个对称的结构片段(3-羟基丁氧基), 每个片段均含有1个二级羟基的手性中心. 该分子的合成重点在于如何保持光学纯度. 本文最初设计的合成路线如Scheme 2所示.
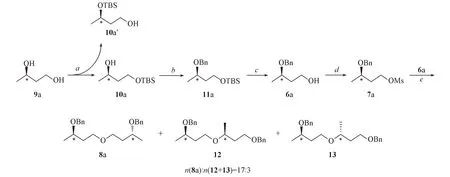
Scheme 2 Synthetic route of compound 8aReagents and conditions: a. imidazole, TBSCl, DMAP, DMF, r. t., 24 h; b. NaH, BnBr, THF, r. t., 10 h; c. TBAF, THF, 60 ℃, 4 h; d. MsCl, Py, CH2Cl2, 0 ℃, 2 h; e. NaH, THF, 70 ℃, 5 h.
起初尝试以(R)-1,3-丁二醇(9a)为起始原料, 在碱性条件下, TBSCl与伯位羟基反应, 得到化合物10a[17]; 继而在NaH作用下, 与溴化苄反应, 之后再经TBAF/加热脱除叔丁基二甲基硅基保护基得到化合物6a. 在碱性条件下, 化合物6a磺酸酯化后得到化合物7a. 在NaH作用下, 化合物6a与7a通过Williamson反应[18]得到化合物8a. 该路线在合成上是可行的, 并且最终也得到了化合物8a. 但是, 核磁共振谱图显示, 8a约含有15%的异构体, 推测其结构可能主要是化合物12和13. 这可能是由于TBSCl的选择性不佳, 在合成化合物10a时, 少量的TBSCl与化合物9a的仲羟基发生反应生成10a′, 因其极性与10a一致, 薄层色谱未能检测出, 核磁共振谱图显示确实含有少量的异构体(10a含量约为90%), 继而参与了后续反应. 随后尝试降低反应温度, 以及采用位阻更大的保护基(叔丁基二苯基硅基)来保护羟基, 反应收率有所改善, 但依然含有其异构体. 鉴于化合物8a与其同分异构体的分离纯化困难, 因此放弃了该条路线, 又设计了如Scheme 3所示的合成路线.
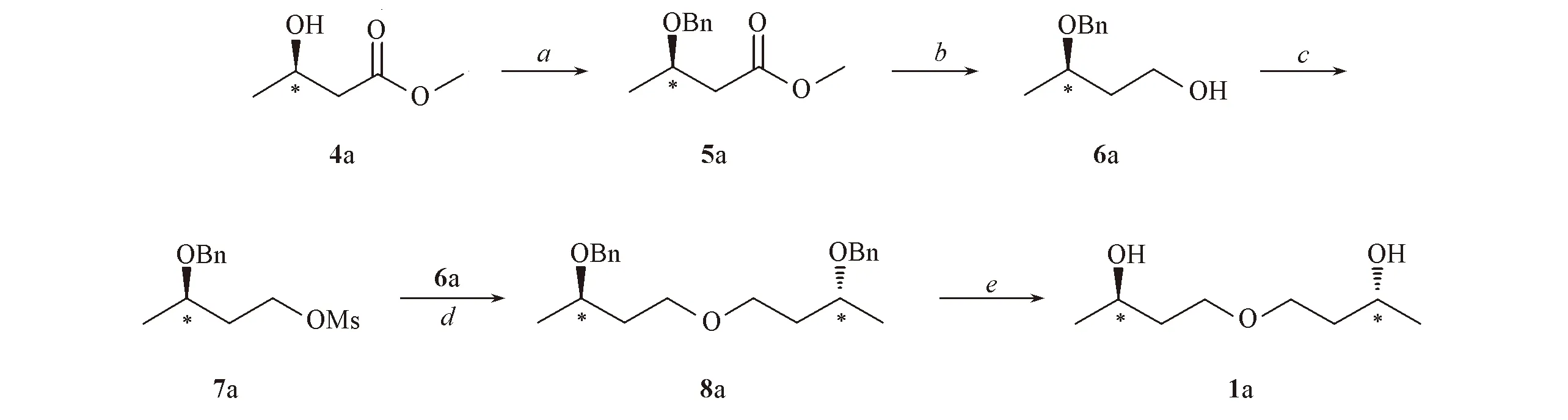
Scheme 3 Synthetic route of compound 1aReagents and conditions: a. benzyl trichloroacetimidate, TFA, CH2Cl2, r. t., 24 h; b. LiAlH4, THF, 0 ℃, 2 h; c. MsCl, Py, CH2Cl2, 0 ℃, 2 h; d. NaH, THF, 70 ℃, 5 h; e. H2, Pd/C, MeOH, 50 ℃, 2 h.
该路线以廉价易得的(R)-3-羟基丁酸甲酯(4a)为起始原料, 用苄基保护羟基得到化合物5a. 起初尝试用溴化苄对化合物4a的羟基进行保护, 但化合物4a在各种碱的催化下(见表3), 室温下与溴化苄发生反应, 效果均不理想. 随后尝试将化合物4a在Ag2O作用下, 与溴化苄反应, 最终得到了化合物5a[19], 但是考虑到成本[n(Ag2O)∶n(4a)=8∶1]、 反应时间(72 h)及收率(70%)等原因, 放弃了该路线. 最终选取在三氟甲磺酸催化下, 化合物4a与2,2,2-三氯乙酰亚胺苄酯反应, 顺利得到了化合物5a[20], 且收率较高(85%). 将化合物5a用LiAlH4还原酯键生成醇(6a), 磺酸酯化后得到化合物7a. 在NaH作用下, 化合物6a与7a经Williamson反应缩合得到化合物8a, 氢化脱除苄基即可得到目标化合物1a.
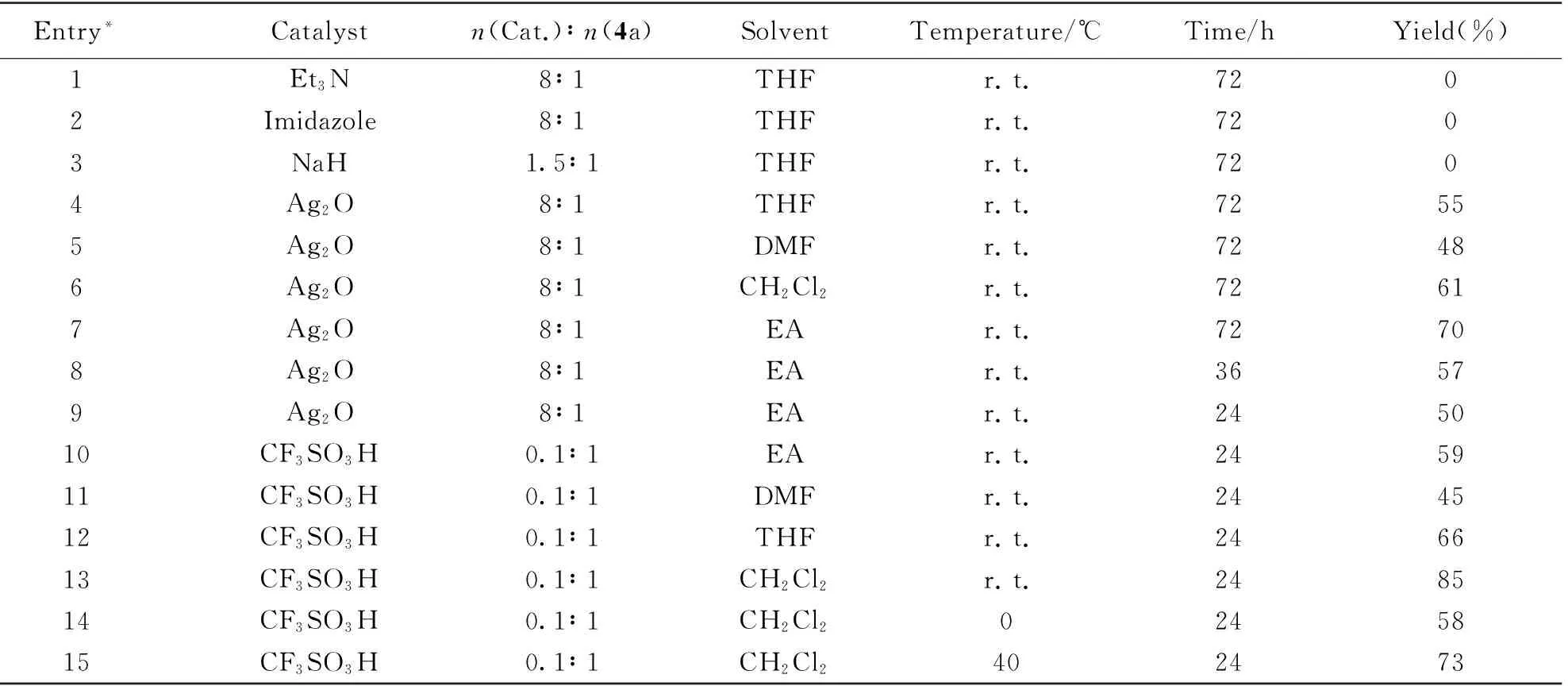
Table 3 Synthetic reaction conditions of compound 5a
* Reactant of Entries 1—9: benzyl bromide; reactant of Entries 10—15: benzyl trichloroacetimidate.
基于Scheme 3所示的路线合成了化合物1a~1c, 合成路线如Scheme 1所示. 对于合成过程中的中间体5a/5b和6a/6b, 通过与文献[14,16]报道的核磁数据和旋光度对比, 保持其光学纯度; 同时, 在化合物8a和8b的核磁共振氢谱上并未发现其非对映异构体8c.
3 结 论
以廉价易得的(R/S)-3-羟基丁酸甲酯(4a/4b)为起始原料, 经过5步反应, 以44%~50%的总收率合成了3个4-(3-羟基丁氧基)-2-丁醇异构体1a~1c. 该路线通过改良的Williamson合成法制备醚, 选择甲磺酰氯与化合物6a/6b反应生成甲磺酸酯基作为易离去基团; 以苄基作为保护基在H2/Pd/C的温和条件下经过滤后处理即可得高纯度的产品; 反应路线不涉及手性变化, 避免了降低中间化合物的光学纯度. 该方法简单易行, 产率较高, 对相应的手性新药的开发具有一定的借鉴意义.
[1] Farooq M. O., Main A., Saeed B., Ikram A., Qasmi S. A., J. Ayub Med. Coll. Abbottabad, 2014, 26(4), 543—547
[2] Chen L. L., Du R. M., Chen S. Y., Hebei Med., 2003, 9(8), 711—712(陈丽丽, 杜瑞明, 陈少逸. 河北医学, 2003, 9(8), 711—712)
[3] Corbic M., Dumont M., de Cou⊇t G., Erlinger S., J. Pharmacol. Exp. Ther., 1982, 221(3), 769—774
[4] Zhu T. Y., Yuan J. Y., Xie B. G., Li Y. W., Chem. Reagents, 2015, 37(2), 168—170(朱太勇, 袁建勇, 谢宝刚, 李雁武. 化学试剂, 2015, 37(2), 168—170)
[5] Liu C., Guan X., Chin. Med. J. Metallurgical Industry, 2008, 25(5), 624(刘畅, 官鑫. 中国冶金工业医学杂志, 2008, 25(5), 624)
[6] Missale G., Camarri E., Fici F., Agosti A., Di Murro R., Int. J. Clin. Pharmacol. Ther., 1981, 19(6), 273—274
[7] Staccioli S., Altamura M., Giorgi G., J. Mass Spectrom., 2009, 44(7), 1081—1086
[8] Marom H., Pogodin S., Agranat I., Chirality, 2014, 26(4), 214—227
[9] Bulca S., Bayramgurler D., Demirsoy E. O., Yavuz M., Akturk A. S., Bilen N., Kiran R., J. Dermatol. Treat., 2013, 24(6), 473—476
[10] Yuan B., Li L., Fu Y., Jin Y., Guo L. X., Xu H. Y., J. Chromatogr. B, 2012, 911, 27—33
[11] Yue Q. M., Zhao Y., Sun B. H., Hai L., Guo L., Wu Y., Chin. J. Chem., 2015, 33, 1145—1152
[12] Zhao Y., Ma H. P., Fu Z. J., Zhang G. Y., Chem. Res. Chinese Universities, 2014, 30(6), 915—918
[13] Nie G. Z., Li L. S., Cheng B. P., Zhou R. D., Zhang H. F., Chem. J. Chinese Universities, 2014, 35(7), 1414—1422(聂桂珍, 李来生, 程彪平, 周仁丹, 张宏福. 高等学校化学学报, 2014, 35(7), 1414—1422)
[14] Tanasova M., Anyika M., Borhan B., Angew. Chem. Int. Ed., 2015, 54(14), 4274—4278
[15] Dong X., Li Y., Gou X. F., Zhao J. L., Hua C. W., Chem. Res. Chinese Universities, 2014, 30(3), 383—386
[16] Takahashi S., Souma K., Hashimoto R., Koshino H., Nakata T., J. Org. Chem., 2004, 69(13), 4509—4515
[17] Huang P. Q., Lan H. Q., Zheng X., Roan Y. P., J. Org. Chem., 2004, 69(11), 3964—3967
[18] Shen X., Neumann C. N., Kleinlein C., Angew. Chem. Int. Ed., 2015, 127(19), 5754—5757
[19] Evans P. A., Andrews W. J., Angew. Chem. Int. Ed., 2008, 47(29), 5426—5429
[20] Ren H., Wulff W. D., Org. Lett., 2013, 15(2), 242—245
(Ed.: P, H, D, K)
† Supported by the National Natural Science Foundation of China(Nos.21472130, 81573286).
Synthesis of Three Stereoisomers of 4-(3-Hydroxylbutoxy)-2-butanol†
SUN Baohou, ZHAO Yi, HAI Li, GUO Li*, WU Yong*
(Key Laboratory of Drug Targeting and Drug Delivery System, Ministry of Education, West China School of Pharmacy, Sichuan University, Chengdu 610041, China)
Dihydroxydibutylether(DHBE) is a choleretic drug used for the treatment of gallstone and hepatic disorders due to its choleretic activity and hepatoprotective action. 4-(3-Hydroxylbutoxy)-2-butanol(1) is one of the three stereoisomers of DHBE. The compound has rapid efficacy in the body. It contains three stereoisomers, (R)-4-[(R)-3-hydroxybutoxy]-2-butanol(1a), (S)-4-[(S)-3-hydroxybutoxy]-2-butanol(1b) and (R)-4-[(S)-3-hydroxybutoxy]-2-butanol(1c). In this paper, the synthesis of the three stereoisomers of compound 1 from readily available starting materials, methyl (R/S)-3-hydroxybutanoate, in 5 steps with overall yields of 44%—50% was reported. The ether was synthesized by Williamson reaction first, followed by the removal of the benzyl. Then the target compounds 1a—1c were obtained. The synthetic approach has the advantages of easy manipulation, high yield and purity.
Dyskinebyl; Dihydroxydibutylether; Stereoisomer
10.7503/cjcu20150702
2015-09-08.
日期: 2015-12-26.
国家自然科学基金(批准号: 21472130, 81573286)资助.
O623
A
联系人简介:郭 丽, 女, 博士, 教授, 博士生导师, 主要从事靶向药物研究. E-mail: guoli@scu.edu.cn
吴 勇, 男, 博士, 教授, 博士生导师, 主要从事主动靶向药和手性药物研究. E-mail: wyong@scu.edu.cn

