夹心ELISA检测牛γ-干扰素方法的建立及应用
钱 琨,赵 巍,黄大卢,邵红霞,4,秦爱建
(1.扬州大学兽医学院,扬州 225009;2.江苏省动物预防医学重点实验室,扬州 225009;3.教育部禽类预防医学重点实验室,扬州 225009;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
·研究论文·
夹心ELISA检测牛γ-干扰素方法的建立及应用
钱 琨1,2,3,4,赵 巍2,3,黄大卢2,3,邵红霞2,3,4,秦爱建1,2,3,4
(1.扬州大学兽医学院,扬州 225009;2.江苏省动物预防医学重点实验室,扬州 225009;3.教育部禽类预防医学重点实验室,扬州 225009;4.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
为建立检测牛γ-干扰素(BoIFN-γ)的双夹心ELISA方法,将前期获得的针对BoIFN-γ的单克隆抗体作为捕捉抗体进行夹心ELISA检测天然BoIFN-γ,结果表明单克隆抗体BoIFN-γ-6E5、BoIFN-γ-3E1、BoIFN-γ-3C2三株能捕捉到天然的牛γ干扰素。经过条件摸索和优化,最终建立了以3E1/HRP-6E5为最佳组合的检测BoIFN-γ的夹心ELISA方法。用建立的双夹心ELISA检测方法和进口试剂盒同时对66份血样进行检测,结果表明双夹心ELISA方法和进口试剂盒检测结果的符合率达95.45%,说明该方法能有效地对牛结核病γ-干扰素进行检测。
牛γ-干扰素;双夹心ELISA;应用
牛结核病(bovine tuberculosis)是一种由结核分支杆菌引起的一种人畜共患病。人结核病中有10%左右是由牛结核分枝杆菌引起的。牛结核病的诊断及防治对控制人结核病具有十分重要的公共卫生意义[1]。尽管动物的结核病在许多发达国家已经被控制,但是在发展中国家,结核病在人类和家畜中仍是一个非常严重的问题。
牛结核的根除主要依靠诊断和净化,国内外用于诊断牛结核病的检测主要有3种方法[2]:细菌学检测法、分子生物学检测法[3]、免疫学检测法[4]。结合分枝杆菌培养法检测时间长,不利于快速尽早地诊断结核病,不易达到早期阻断结核病传播的目的。分子生物学诊断法中的PCR法容易出现样品间的交叉污染,同时还易出现假阳性和假阴性的结果。结核菌素(purified protein derivative,PPD)变态反应试验结果主要是通过人肉眼判断,所以会存在人为判断误差,同时它检测的特异性差,时间长,同样达不到快速诊断的目的,在临床应用中灵敏度也不高,影响因素多[5]。1990年,Rothel等[6]建立了一种通过检测γ-干扰素(interferon γ,IFN-γ)来检测牛结核病的方法,由于其特异性好,灵敏度高的特点而被推广。IFN-γ检测法的田间试验已在许多国家完成[7],在爱尔兰、澳大利亚和新西兰等国家,IFN-γ正式试验已被批准[8]。IFN-γ试验的发展已成为牛结核病诊断的一个主要发展趋势[9],相关试剂盒在国外已商品化,但由于进口试剂盒价格昂贵,限制了其在我国的推广应用。因此,本研究在前期制备得到针对牛γ-干扰素单克隆抗体的基础上,建立了检测牛γ-干扰素的双夹心ELISA方法,为我国牛结核病的防控与根除提供技术支持。
1 材料与方法
1.1 抗体、待检血样与生物试剂 单克隆抗体BoIFN-γ-6E5、BovIFN-γ-3E1、BoIFN-γ-3C2、His-BoIFN-γ融合蛋白由本实验室自行研制保存[10,11];66份待检牛血清样品分别来自江苏省、山东省和北京市;TMB购自AMRESCO公司;30%过氧化氢购自国药集团化学试剂有限公司;辣根过氧化物酶(HRP)标记兔抗鼠IgG 、OPD(邻苯二胺)购自上海生工生物公司;澳大利亚的进口试剂盒Mycobacterium bovis Gamma interferon Test Kit for Cattle;辣根过氧化物酶标记试剂盒购于Thermo公司;抗体纯化Protein G柱购于GE公司;其他有关试剂均为国产分析纯。
1.2 天然牛γ-干扰素的刺激 参照文献[12],用肝素抗凝管无菌采集江苏省某牛场可疑的结核病牛全血,总共9份血样,无菌环境下分装到24孔板中,每孔1.5 mL,每个血样设3个孔。分别加100μLBPPD、100μL APPD、100μL 1640,轻轻混匀,放置37℃、含5%的CO2培养箱中培养24 h,收集全血上清检测。
1.3 单克隆抗体与天然BoIFN-γ的反应性 按照文献[12]进行,最终得到的阳性单抗利用过氧化物酶标记试剂盒标记进行后期的夹心ELISA实验。
1.4 双夹心ELISA检测牛γ-干扰素方法的建立
14.1 最适包被抗体和最适酶标抗体的筛选及反应条件优化 将能结合天然BoIFN-γ反应的抗体BoIFN-γ-6E5、BoIFN-γ-3E1、BoIFN-γ-3C2分别包被,同时酶标抗体HRP-BoIFN-γ-6E5、HRP-BoIFN-γ-3E1分别做双夹心ELISA检测天然BoIFN-γ,以最终确定夹心ELISA方法中的最佳包被单抗和最佳酶标抗体。参考文献[11],通过常规方法确定最佳包被抗体和酶标抗体的使用条件。
1.4.2 双夹心ELISA灵敏度和特异性确定 将原核表达的His-BoIFN-γ按照10、5、2.5、1.25、0.7、0.3、0.1、0.01 μg/mL依次稀释以每孔100 μL的量加入相应的孔中计算夹心ELISA方法的灵敏度;将建立的夹心ELISA方法检测已知的阴性和阳性牛全血上清,同时用原核表达的His-BoIFN-γ作为阳性对照,确定夹心ELISA方法的特异性。
1.5 夹心ELISA方法的临界值判定 选择优化好的ELISA条件,对已知的阳性以及阴性样品与进口试剂盒进行比对检测的基础上,制定本ELISA的判定标准。
1.6 夹心ELISA方法的临床应用 用建立好的夹心ELISA方法检测临床收集的66份样品,同时与进口试剂盒检测结果进行比较。
2 结果
2.1 单克隆抗体结合天然BoIFN-γ的反应结果 包被前期实验筛选到的9株单抗,用HRP酶标抗BoIFN-γ抗体作为检测抗体,检测9株单抗是否能捕获到已知阳性血清中天然的BoIFN-γ,结果显示BoIFN-γ-6E5、BoIFN-γ-3E1、BoIFN-γ-3C2三株单抗能够捕获到天然BoIFN-γ,结果见表1。

表1 夹心ELISA检测单抗与天然BoIFN-γ反应性结果Table 1 The results of McAb to natural BoIFN-γdetected by sandwish ELISA
2.2 3 株单抗识别的抗原表位分析结果 为了了解BoIFN-γ-6E5、BoIFN-γ-3E1、BoIFN-γ-3C2三株单抗是否针对不同的抗原表位,进行了单克隆抗体相加ELISA试验,在抗体相加ELISA试验中,当两两抗体叠加的AI值>10%时,表明这两种抗体所识别不同的抗原表位。从表2可知,3E1、3C2和6E5I识别不同的抗原表位。

表2 单抗相加ELISA试验结果Table 2 Result of additive ELISA of monoclonalantibodies to BoIFN-γ
注:数值为AI值
Note: The data was the AI value
2.3 最适捕捉抗体和最适检测抗体的配对实验 将BoIFN-γ-6E5、BoIFN-γ-3E1、BoIFN-γ-3C2三株单抗作为捕捉抗体包被,酶标抗体HRP-BoIFN-γ-6E5和HRP-BoIFN-γ-3E1作为检测抗体进行夹心ELISA,检测已知的阳性和阴性牛全血上清。结果显示,BoIFN-γ-3E1包被,用HRP-BoIFN-γ-6E5检测时特异性和反应性都较好,结果见表3。
2.4 最佳捕捉抗体溶度和酶标检测抗体浓度的确定 以直接ELISA方法检测酶标抗体HRP- BoIFN-γ-6E5的最低稀释度和工作浓度,以表达的His-BoIFN-γ融合蛋白为包被抗原,酶标抗体作系列稀释,计算OD450平均值。直接ELISA结果表明,酶标结合物HRP-BoIFN-γ-6E5最佳工作浓度确定为0.09 μg/mL。
将捕捉抗体BoIFN-γ-3E1按照4、2、1、0.5、0.25、0.125、0.07、0.03 μg/孔包被反应板,每孔加样的体积为100 μL,HRP- BoIFN-γ-6E5工作浓度为0.09 μg/mL,结果显示BoIFN-γ-3 E1抗体最适包被量为0.5 μg/孔。
2.5 双夹心ELISA检测方法的灵敏度与特异性 将BoIFN-γ-3E1按照0.5 μg/孔包被;将原核表达的His-BoIFN-γ融合蛋白作为检测抗原按照10 μg/mL、5 μg/mL、0.5 μg/mL、0.05 μg/mL、0.005 μg/mL、0.0005 μg/mL浓度梯度稀释,每孔加样100 μL;HRP- BoIFN-γ-6 E5按照1:4 000工作浓度稀释。夹心ELISA结果显示,检测原核表达rBoIFN-γ的灵敏度为0.5 ng,结果见表4。同样的方法检测抗原为His-BoIFN-γ融合蛋白、His蛋白、试剂盒检测出的含天然BoIFN-γ牛全血上清和不含天然BoIFN-γ阴性牛全血上清,结果显示双夹心ELISA方法既不与His蛋白反应也不与阴性牛全血上清反应,说明该方法特异性较好,结果见表5。
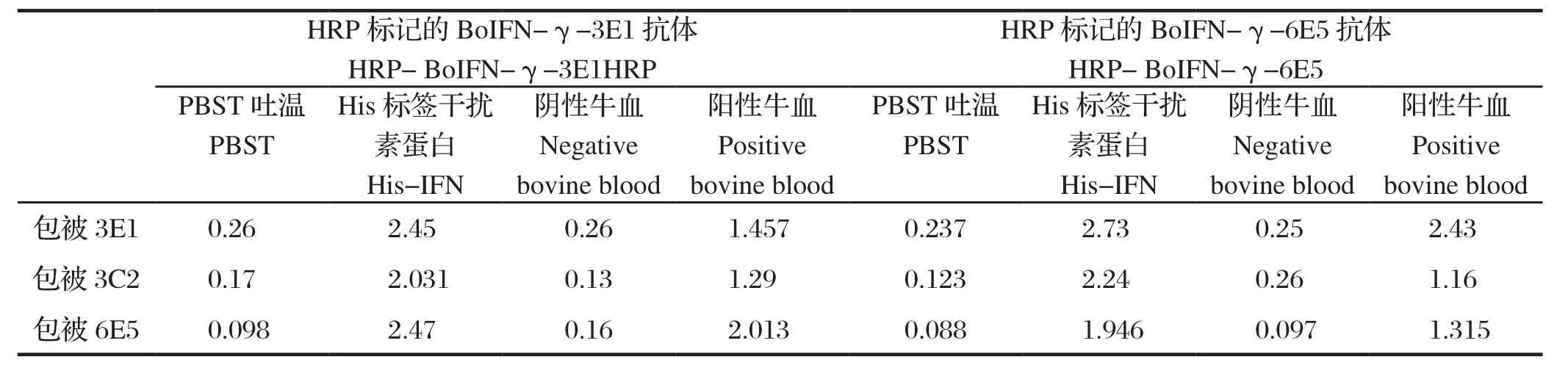
表3 包被抗体和检测抗体的筛选Table 3 The selection of detecting antibody

表4 夹心ELISA检测rBoIFN-γ的灵敏性结果Table 4 The sensitivity results of sandwich ELISA to detect rBoIFN-γ
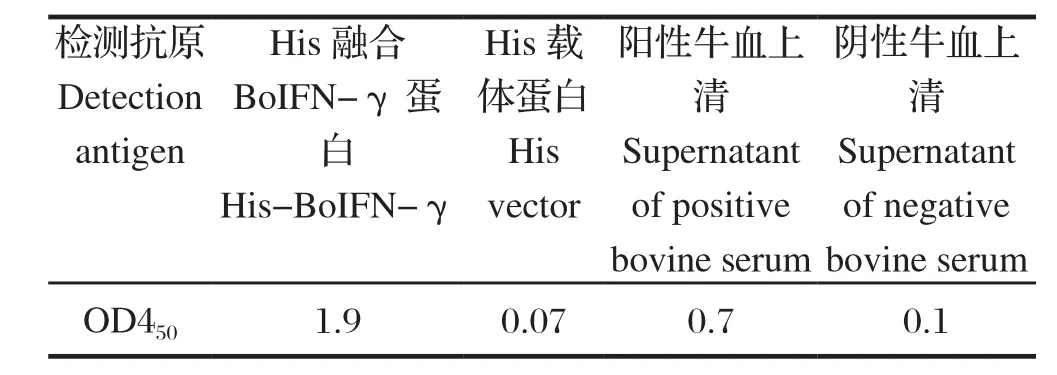
表5 夹心ELISA检测BoIFN-γ结果Table 5 The results of sandwich ELISA to detect BoIFN-γ
2.6 双夹心ELISA检测方法临界值的确定 对已知的阳性以及阴性样品与进口试剂盒进行比对检测的基础上,制定了本ELISA的判定标准:当BPPD的OD450-1640的OD450≥0.15,且BPPD的OD450-APPD的OD450≥0.1,判断为阳性;BPPD的OD450-1640的OD450<0.15,或者BPPD的OD450-APPD的OD450<0.15判断为阴性。
2.7 双夹心ELISA检测方法的临床检测 利用本研究建立的双夹心ELISA方法检测分别来自北京市、江苏省和山东省的共66份牛血样,双夹心ELISA方法检测到阳性样品36份,阴性样品30份,所检测结果与进口试剂盒结果相比较,符合率达95.45%。具体检测结果见表6。

表6 双夹心ELISA与进口试剂盒对比实验Table 6 Comparison of the results between the sandwichELISA and commercial ELISA kit
3 讨论
结核病是威胁人类健康的重大疫病之一,世界卫生组织对结核病的防控一直保持高度重视,每年投入的结核病的防控治疗基金也在逐年上升[13]。牛结核病是由牛分枝杆菌引起的慢性消耗性传染病,是一种能够传染人的人畜共患病。近年来人结核病虽然已经有所控制,但是仍然呈现一种缓慢上升趋势[14],并且人结核病中有一部分病例是牛结核分枝杆菌引起的。同时牛结核病也严重影响全球奶牛养殖业的发展,并严重阻碍着国际贸易的正常进行[15]。所以对牛结核病的防治具有十分重大的公共卫生意义,我国长期发展规划中也将牛结核病列为动物重要疫病之一。
目前,国内外检测牛结核的方法主要有细菌学方法、PCR方法和免疫学方法等[2]。在免疫学检测方法中,结核菌素皮内变态反应被广泛使用,但其灵敏性和特异性不高,检测时间较长。1990年,Wood等[6]建立了通过检测经牛PPD刺激的牛全血释放出来的γ干扰素,从而诊断牛结核病的ELISA方法。牛结核分枝杆菌侵染机体后会刺激机体淋巴细胞形成记忆淋巴细胞,即会使淋巴细胞致敏。因此将无菌采集到的牛血用牛结核分枝杆菌的特异性抗原(BPPD)再次刺激,就会导致全血中的致敏淋巴细胞被活化,短时间释放出大量的γ-干扰素,因此就可以通过检查牛全血上清中的γ-干扰素来达到检查牛结核病的目的。这种方法虽然需要一定的实验技术和实验条件,但是作为结核菌素皮内变态反应的有益补充,已经帮助许多国家控制或根除了牛结核病。牛结核病在我国部分地区仍然存在,目前生产一线的检测方法还停留在结核菌素皮内变态反应方法的应用。由于进口检测试剂盒价格昂贵,无法大范围推广应用,因此我国急需自主研发具有完全独立知识产权的检测牛γ-干扰素的检测方法。
本研究利用2株针对不同抗原表位,并能结合天然牛γ-干扰素的单克隆抗体建立了双夹心ELISA检测方法,能检测到0.5 ng原核表达的rBoIFN-γ。在66份临床样品的对比检测中,自制的双夹心ELISA检测方法检测到36份阳性样品,而进口试剂盒仅检测到其中的33份,阴性样品检测结果一致,这其中差异的3份牛血清样品,还有待利用其他的方法来确定,同时还需要更多的检测样品来补充和完善应用结果数据。此外,自制双夹心ELISA检测方法检测灵敏度还可以进一步提高,从而提高检测方法的灵敏性。
本研究成功建立了单抗双夹心ELISA检测牛γ-干扰素方法,可以应用于临床样本的检测,并且该方法与进口试剂盒检测结果符合率高,为今后牛γ-干扰素检测试剂盒的研发打下基础,为我国牛结核病的检疫和根除提供了一种实用、有效的检测方法,具有很好的应用价值。
[1] Humblet M F, Boschiroli M L, Saegerman C. Classification of worldwide bovine tuberculosis risk factors in cattle: a stratified approach[J]. Vet Res, 2009, 40(5): 50.
[2] Sarnaik R M, Sharma M, Kate S K, et al. Serodiagnosis of tuberculosis: assessment of kaolin agglutination test[J].Tuber Lung Dis, 1993, 74(6): 405-406.
[3] Dalovisio J R, Montenegro-James S, Kemmerly S A, et al. Comparison of the amplified Mycobacterium tuberculosis (MTB) direct test, Amplicor MTB PCR, and IS6110-PCR for detection of MTB in respiratory specimens[J]. Clin Infect Dis, 1996. 23(5): 1099-1106.
[4] Sugden E A, Stilwell K, Rohonczy E B, et al. Competitive and indirect enzyme-linked immunosorbent assays for Mycobacterium bovis infections based on MPB70 and lipoarabinomannan antigens[J]. Can J Vet Res, 1997, 61(1): 8-14.
[5] Corrin K C, Carter C E, Kissling R C, et al. An evaluation of the comparative tuberculin skin test for detecting tuberculosis in farmed deer[J]. N Z Vet J, 1993, 41(1): 12-20.
[6] Rothel J S, Jones S L, Corner L A, et al. A sandwich enzyme immunoassay for bovine interferon-gamma and its use for the detection of tuberculosis in cattle[J]. Aust Vet J, 1990, 67(4): 134-137.
[7] Ameni G, Miörner H, Roger F, et al. Comparison between comparative tuberculin and gamma-interferon tests for the diagnosis of bovine tuberculosis in Ethiopia[J]. Trop Anim Health Prod, 2000, 32(5): 267-276.
[8] González Llamazares O R, Gutiérrez Martín C B, Alvarez Nistal D, et al. Field evaluation of the single intradermal cervical tuberculin test and the interferongamma assay for detection and eradication of bovine tuberculosis in Spain[J]. Vet Microbiol, 1999, 70(1-2): 55-66.
[9] Pollock J M, Neill S D. Mycobacterium bovis infection and tuberculosis in cattle[J]. Vet J, 2002, 163(2): 115-127.
[10] 许金俊. 奶牛干扰素-γ基因的表达及其在乳房炎防治中的初步应用[D]. 扬州: 扬州大学, 2005.
[11] 尹天燕. γ-干扰素介导牛结核快速检测方法的研究及初步应用[D]. 扬州: 扬州大学, 2010.
[12] 黄大卢. BoIFN-γ基因的原核表达及其单克隆抗体的研制[D]. 扬州: 扬州大学, 2012.
[13] Sattah M V, Aye S S, Azen C, et al. Interferon-gamma release assay T-SPOT.TB and HIV-related tuberculosis[J]. Int J Tuberc Lung Dis, 2012, 16(2): 281-282.
[14] Humblet M F, Boschiroli M L, Saegerman C.Classification of worldwide bovine tuberculosis risk factors in cattle: a stratified approach[J]. Vet Res, 2009, 40(5): 50.
[15] Sabio y García J V, Bigi F, Rossetti O, et al. Expression of MPB83 from Mycobacterium bovis in Brucella abortus S19 induces specific cellular immune response against the recombinant antigen in BALB/c mice[J]. Microbes Infect, 2010, 12(14-15): 1236-1243.
DEVELOPMENT AND APPLICATION OF SANDWICH ELISA FOR DETECTING BOVINE INTERFERON GAMMA
QIAN Kun1,2,3,4, ZHAO Wei2,3, HUNAG Da-lu2,3, SHAO Hong-xia2,3,4, QIN Ai-jian1,2,3,4
(1. Colledge of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China; 2. Key Laboratory of Jiangsu Preventive Veterinary Medicine, Yangzhou University, Yangzhou 225009, China; 3. Ministry of Education Key Lab for Avian Preventive Medicine, Yangzhou 225009, China; 4. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China)
To develop a sandwich ELISA for detection of bovine interferon γ (BoIFN-γ), 3 monoclonal antibodies against BoIFN-γ were tested as capture antibodies. All of 3 monoclonal antibodies recognized BoIFN-γ. The sandwich ELISA method was optimized and monoclonal antibody 3E1 was determined as the capture antibody. Total 66 serum samples from different regions were tested using the sandwich ELISA developed here and a commercial ELISA kit. The agreement between these two methods was 95.45%, suggesting the promising possibility of the sandwich ELISA for effective detection of BoIFN-γ in bovine tuberculosis disease.
Bovine interferon γ; sandwich ELISA; application
S852.4
A
1674-6422(2016)05-0057-06
2016-01-18
江苏省科技支撑计划(BE2013391);江苏省优势学科项目
钱 琨,男,博士,主要从事动物传染病研究
秦爱建,E-mail:aijian@yzu.edu.cn

