植物角质降解菌的种属鉴定、发酵条件优化及酶学性质研究
梁争文 张铁鹰* 李 爽 刘俊丽
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.甘肃农业大学动物科学技术学院,兰州730070)
植物角质降解菌的种属鉴定、发酵条件优化及酶学性质研究
梁争文1张铁鹰1*李 爽1刘俊丽2
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.甘肃农业大学动物科学技术学院,兰州730070)
本试验旨在通过角质降解菌株X8P的种属鉴定、发酵条件优化和酶学性质研究,探讨降解植物表面角质层,进一步改善动物对植物纤维利用的可能新方案。试验通过形态观察和16S rDNA测序鉴定菌株X8P种属,并对其产酶所需碳源、氮源、发酵温度与时间进行优化,其发酵液经硫酸铵盐析沉淀获得其胞外蛋白粗酶,并对其粗酶催化的适宜pH和pH稳定性、温度和温度稳定性,以及有机溶剂、表面活性剂和金属离子对其活性的影响进行研究。结果表明:1)菌株X8P经形态观察和分子鉴定为东方醋杆菌(Acetobacterorientalis)。2)菌株X8P适宜产酶发酵条件为溶菌肉汤(LB)培养基中37 ℃发酵4 d,1%橄榄油和1%葡萄糖明显促进菌株产酶,而1%可溶性淀粉明显抑制菌株产酶。3)该菌株胞外粗酶催化适宜pH和温度分别为6.5和45 ℃,且表现出一定pH稳定性,但在有机溶剂中不稳定,仅甘油中可保留全部活性,在二甲基亚砜(50%)中活性可保留66%。吐温(Tween)-20(1 mmol/L)、Tween-80(1 mmol/L)和聚乙二醇辛基苯基醚(1和10 mmol/L)可使菌株X8P粗酶活性提高3%~35%。金属离子钾离子(K+)、锰离子(Mn2+)(1和10 mmol/L)可使菌株X8P粗酶活性提高2%~20%。由此可见,菌株X8P具有一定的产角质酶潜力和应用前景,可进一步深入研究。
角质;角质酶;角质降解菌;发酵条件优化;酶学性质
植物叶片和籽实表面均覆盖有角质层,厚度约为0.1 μm[1-2]。角质层主要组成成分为角质,此外还含有约0.6%蜡质、0.9%果胶、1.3%蛋白质、2.0%非纤维多糖、灰尘及杂质等组分[3]。角质层化学性质稳定,且耐酸碱、耐氧化,这可能使反刍动物瘤胃中和猪、兔等单胃动物后肠微中生物及其酶与饲料原料纤维的有效接触减少,也可能使黏附在植物纤维颗粒上的微生物数量减少,从而影响动物消化道对植物纤维材料的降解[4]。近年来,食品加工副产品如酒糟、麸皮、玉米皮等越来越多用于猪、禽饲粮中。这些原料富含角质,可能是限制动物尤其是单胃动物后肠微生物对纤维降解的主要障碍之一。破坏植物角质层,会使其渗透性增加,机械强度降低[5]。
角质降解菌产生的角质酶可水解角质层屏障,利于其侵染植物。经角质酶处理的植物性饲料亦同样利于动物消化道内微生物及酶快速与植物内部组织结合,增加表面微生物及酶的活性,提高纤维降解速率。因此,采用生物技术手段破坏植物角质层可能是提高饲料植物纤维消化利用的关键之一。目前,人们对真菌角质酶的研究最为广泛,来自镰刀菌属(Fusarium)、炭疽菌属(Colletotrichum)、链核盘菌属(Monilinia)等14属20多种真菌的角质酶已得到深入研究[6]。其中茄病镰孢菌(Fusariumsolanipisi)角质酶研究最为透彻,且其三维结构已解析[7]。相反,人们对细菌和放线菌角质酶了解较少[8],且对细菌来源角质酶编码基因信息了解也十分有限[4]。目前仅对假单胞菌(Pseudomonas)和嗜热裂胞菌(Thermobifida)来源的角质酶进行了纯化和生化特征分析,并获得其角质酶编码信息[9]。因此,本研究拟通过对角质降解菌X8P种属鉴定、发酵条件优化和酶学性质研究,以探讨其所产酶特点及在畜牧业中应用潜质。
1 材料与方法
1.1 试验材料
1.1.1 菌株来源
菌株X8P为本实验室分离保存。
1.1.2 培养基
溶菌肉汤(LB)培养基:酵母提取物5 g,胰蛋白胨10 g,氯化钠10 g,去离子水1 000 mL,自然pH,121 ℃灭菌20 min。
发酵培养基:橄榄油10 g,硫酸铵5 g,牛肉膏5 g,酵母粉5 g,蛋白胨10 g,氯化钠10 g,去离子水1 000 mL,自然pH,121 ℃灭菌20 min。
1.1.3 试剂
α-乙酸萘酯(α-naphthyl acetate)、2-(N-吗啡啉)乙磺酸[2-(N-morpholino) ethanesulfonic acid,MES],购自Sigma公司。
1.2 试验方法
1.2.1 菌株鉴定
形态特征:将菌株X8P划线于LB平板培养基上培养,观察单菌落形态。
16S rDNA序列测定和系统发育分析:提取菌株基因组DNA,采用16S rDNA扩增通用引物(27 F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492 R:5′-GGTTACCTTGTTACGACTT-3′),扩增菌株16S rDNA。PCR纯化产物测序由博迈德科技发展有限公司完成。将测序结果在NCBI上用BLAST程序与GenBank中16S rDNA序列进行同源性分析,用MEGA5.2中的邻接(neighbor-joining)法构建系统发育树。
1.2.2 菌株发酵条件优化
1.2.2.1 制种
将甘油保存的菌株X8P在LB培养基上划线活化后,从平板上挑取单菌落到种子培养基中,振荡培养制备种子液。
1.2.2.2 碳源对菌株产酶的影响
以LB培养基为对照,分别研究1%橄榄油、碱处理角质、角质、麸皮、玉米芯、秸秆、蔗糖、葡萄糖和可溶性淀粉等碳源对菌株X8P胞外酶活性影响。在30 ℃、150 r/min下,发酵培养4 d,获得粗酶液。
1.2.2.3 氮源对菌株产酶的影响
在LB培养基和最佳碳源基础上,分别研究0.5%胰蛋白胨、酵母粉、牛肉膏、酪蛋白、氯化铵和硫酸铵等氮源对菌株X8P胞外酶活性影响。在30 ℃、150 r/min下,发酵培养4 d,获得粗酶液。
1.2.2.4 发酵温度对菌株产酶的影响
在LB培养基添加最佳碳源和最佳氮源基础上,分别研究不同发酵温度(25、30、37、40和45 ℃)对菌株X8P胞外酶活性的影响。150 r/min发酵培养4 d,获得粗酶液。
1.2.2.5 发酵时间对菌株产酶的影响
在单一因素优化基础上,研究发酵时间(1、2、3、4、5和6 d)对菌株X8P胞外酶活性影响。在37 ℃、150 r/min下培养获得粗酶液。
上述发酵条件优化每个处理均为3个重复。
1.2.3 菌株X8P胞外酯酶酶学性质
1.2.3.1 菌株X8P胞外粗酶液制备及粗纯化
将菌株X8P发酵粗酶液经超滤浓缩、硫酸铵沉淀和透析除盐,获得该菌株角质酶粗酶。
1.2.3.2 菌株X8P胞外粗酶适宜pH和pH稳定性
适宜pH测定:在不同pH(pH 2.5~9.5,每隔0.5设1个测试点)测定菌株粗酶活性,反应温度50 ℃。
pH稳定性测定:将菌株X8P粗酶液按1∶9的比例与不同pH(pH 2.5~9.5,每隔0.5设1个测试点)缓冲液稀释混匀,将稀释粗酶液于50 ℃水浴处理30 min后,迅速冰水冷却(30 min),测定稀释液酶活性。
1.2.3.3 菌株X8P胞外粗酶适宜温度和温度稳定性
适宜温度测定:将菌株X8P粗酶液适当稀释于50 mmol/L、pH 6.5 MES缓冲液后,分别在30~80 ℃(每隔5 ℃为1个测试点)下测定酶活性。
温度稳定性测定:将菌株X8P粗酶液分别在不同温度(0~80 ℃,每隔10 ℃为1个测试点)处理30 min,缓冲液为50 mmol/L、pH 6.5 MES缓冲液,冰水浴30 min,测定残余酶活性。
1.2.3.4 有机试剂对菌株X8P胞外粗酶活性影响
将甲醇、乙醇、甘油、异丙醇、丙酮、二甲基亚砜、乙腈等有机试剂分别以50%(v/v)和80%(v/v)终浓度与菌株X8P粗酶液在30 ℃保温60 min后,迅速冰水浴30 min,测定残余酶活性。以未加有机试剂的对照酶活性为100%。
1.2.3.5 表面活性剂和金属离子对菌株X8P胞外粗酶活性影响
表面活性剂影响:将吐温(Tween)-20、Tween-80、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、聚乙二醇辛基苯基醚(Triton-100)等表面活性剂(1和10 mmol/L)和菌株X8P粗酶液在30 ℃保温60 min后,迅速冰水浴30 min,测定残余酶活性,以未加表面活性剂对照酶活性为100%。
金属离子影响:将溶于50 mmol/L、pH 6.5 MES缓冲液的1和10 mmol/L金属离子[钠离子(Na+)、镁离子(Mg2+)、锰离子(Mn2+)、钙离子(Ca2+)、钡离子(Ba2+)、二价铁离子(Fe2+)、锌离子(Zn2+)、铜离子(Cu2+)、钾离子(K+)、镍离子(Ni2+)、三价铁离子(Fe3+)]与菌株粗酶液在30 ℃保温60 min,冰水浴30 min,测定残余酶活性。以未加金属离子对照酶活性为100%。
上述酶学性质试验结果取3次平均值。
1.2.4 酯酶活性测定方法
酯酶活性测定参照刘春红等[10]方法,并进行少许改进:移取50 μL酶液, 加入pH 6.5缓冲液800 μL,然后加入50 μL α-乙酸萘酯溶液,50 ℃恒温水浴反应10 min,加入50 μL 3%SDS水溶液终止反应,再加入50 μL 0.03%固兰B盐溶液显色,混匀计时30 s后,再加入50 μL 1∶1(v/v)盐酸溶液混匀使其显色稳定,将酶液换为蒸馏水作为空白对照,检测并记录535 nm吸光度数据,酶活性(U)定义为在以上条件下,每分钟反应生成1.0 μmol/L α-乙酸萘酚所需要酶量。
1.3 数据统计与分析
试验验数据使用Excel 2007统计软件进行初步整理和统计,并用绘图软件Graphpad Prism 5绘制折线图和柱状图。
2 结 果
2.1 菌株鉴定
菌株X8P单菌落形态:圆形点状凸起,颜色微黄,黏稠,边缘平滑,有光泽,不透明,表面光滑无褶皱。菌株16S rDNA Blast结果显示菌株X8P与东方醋杆菌(Acetobacterorientalis)21F-2同源性可达99%,通过菌株菌落形态特征、遗传距离初步判定并命名为AcetobacterorientalisX8P。
菌株X8P 16S rDNA序列测序结果如下:

菌株X8P系统发育树见图1。
2.2 菌株X8P产酯酶发酵条件优化
2.2.1 碳源对菌株X8P产酯酶的影响
由图2可知,1%橄榄油、碱处理角质、角质、葡萄糖和蔗糖促进菌株X8P产酶,橄榄油促进作用最明显,使活性提高11倍左右。1%玉米芯、麸皮和秸秆对菌株X8P产酶影响不大,而1%可溶性淀粉对菌株X8P产酶有明显抑制作用。菌株X8P以橄榄油为适宜碳源。
2.2.2 氮源对菌株X8P产酯酶的影响
由图3可知,在LB培养基和适宜碳源基础上,再添加无机氮和有机氮均明显抑制菌株X8P产酶。
2.2.3 发酵温度对菌株X8P产酯酶的影响
由图4可知,菌株X8P在37 ℃发酵产酶量最大,室温不利于产酶,超过适宜温度后,产酶量急剧下降。
2.2.4 发酵时间对菌株X8P产酯酶的影响
由图5可知,菌株X8P在第1~2天发酵产酶量较少,自第3天开始产酶量急剧增加,至第4天时达到最高,此后酶活性呈下降趋势。因此,菌株X8P适宜发酵时间为4 d。

图1 菌株X8P系统发育树

图2 碳源对菌株X8P产酯酶的影响
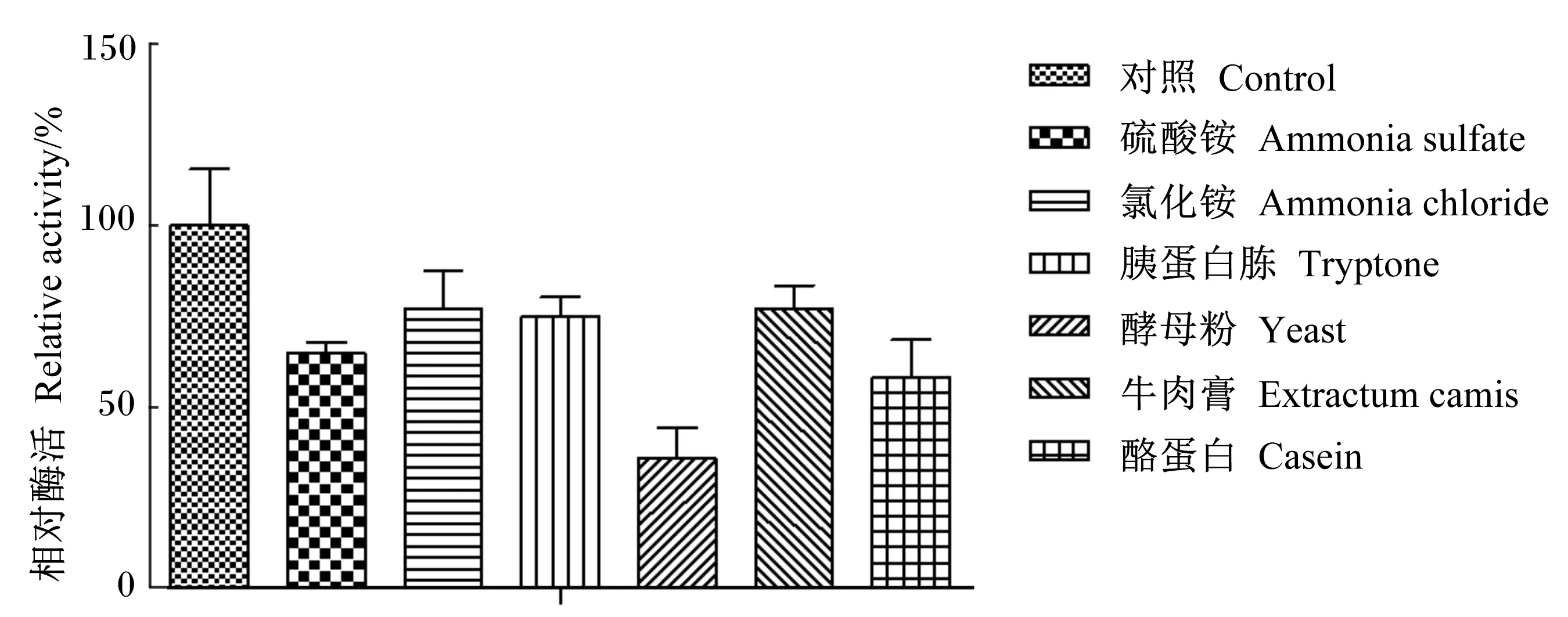
图3 氮源对菌株X8P产酯酶的影响
2.3 菌株X8P胞外酯酶粗酶酶学性质
2.3.1 菌株X8P胞外酯酶粗酶适宜pH和pH稳定性
由图6可知,菌株胞外粗酶适宜pH 6.5,在pH 4.0以下,酶活性几乎全部丧失。在碱性环境时,酶活性急剧丧失。具有一定的pH稳定性,在pH 6.5~7.5内30 min,活性可保留60%以上。
2.3.2 菌株X8P胞外酯酶粗酶适宜温度和温度稳定性
由图7可知,菌株酶活性在45 ℃时最高,动物体温下酶活性约为适宜温度的80%,具有较好的温度适应性,在30~65 ℃有较高活性(50%以上),超过65 ℃时,酶活性急剧下降(残余活性10%左右)。在20~45 ℃处理30 min,酶活性保留50%以上。
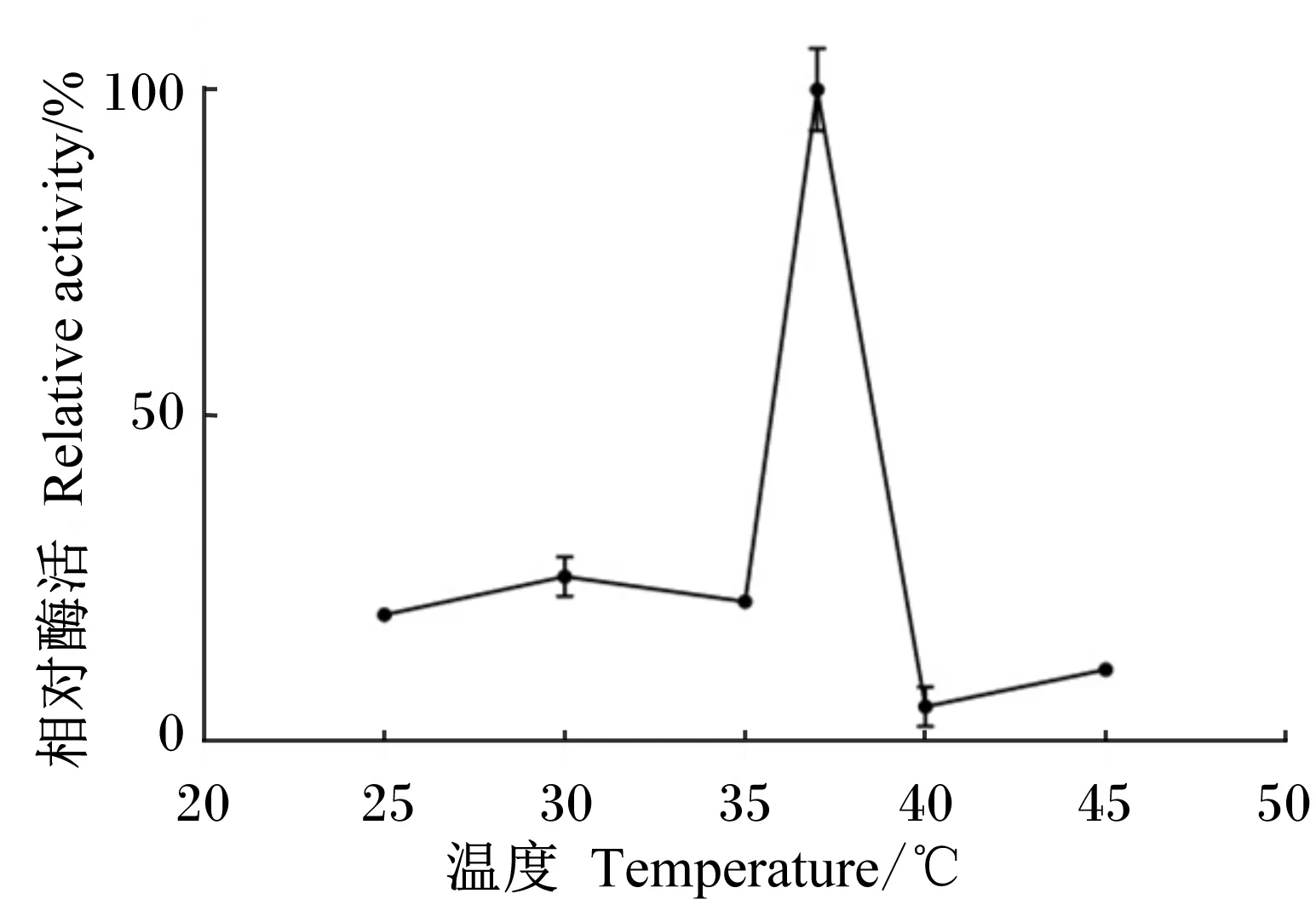
图4 发酵温度对菌株X8P产酯酶的影响
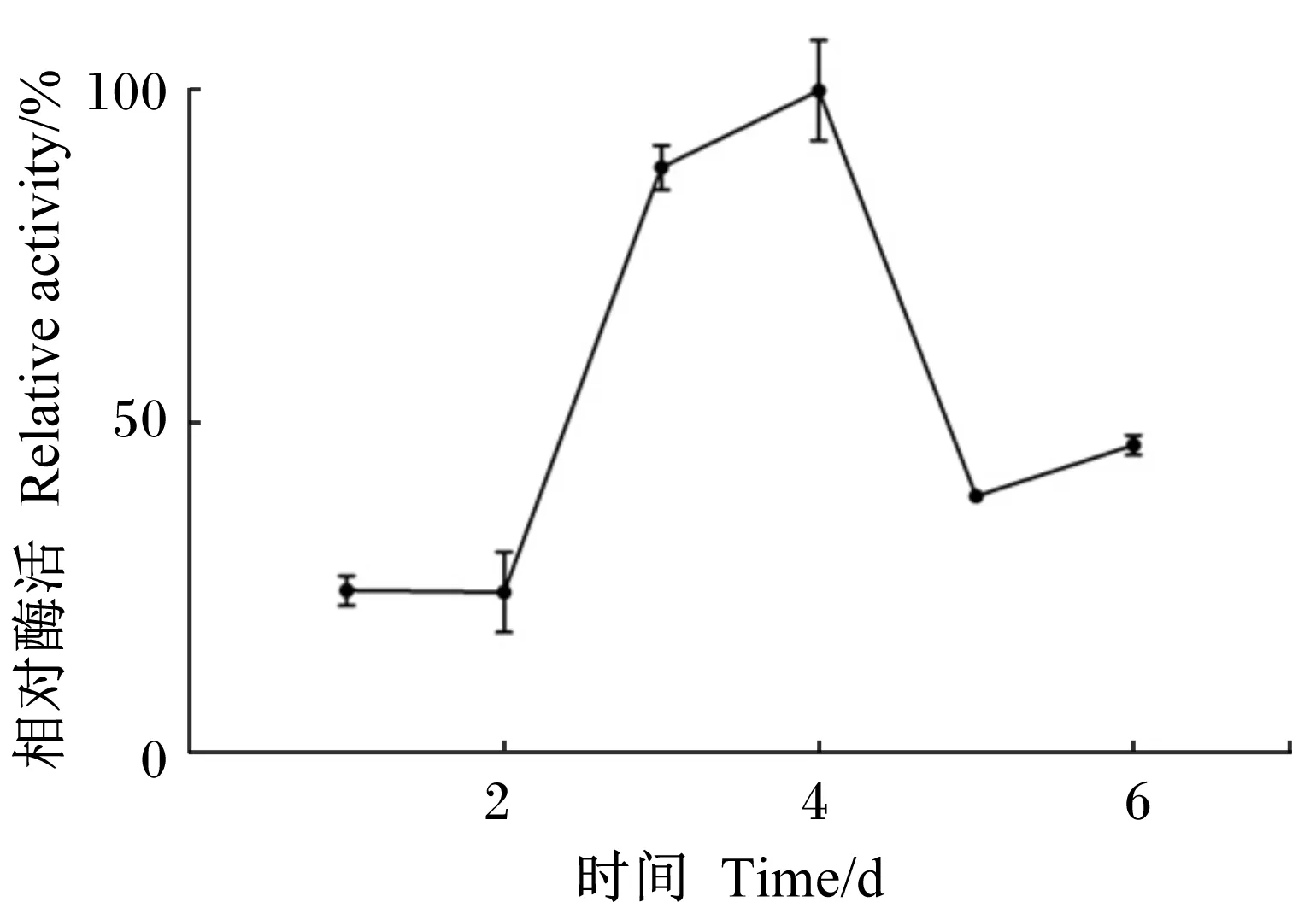
图5 发酵时间对菌株X8P产酯酶的影响
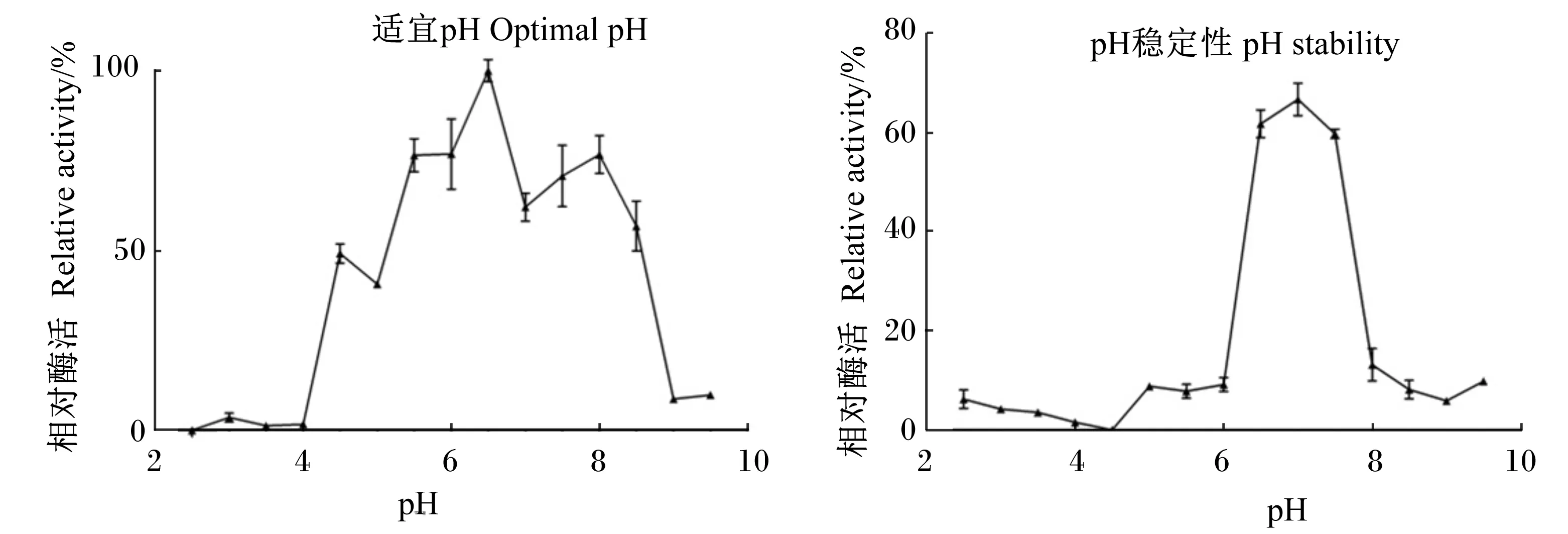
图6 pH对菌株X8P胞外酯酶粗酶活性的影响及pH稳定性

图7 温度对菌株X8P胞外酯酶粗酶活性的影响及温度稳定性
2.3.3 有机试剂对菌株X8P胞外酯酶粗酶活性影响
由图8可知,菌株X8P粗酶仅在甘油(50%和80%)中保留全部活性,在二甲基亚砜(DMSO)(50%)中活性可保留66%,在其他有机溶剂中,活性均丧失。
2.3.4 表面活性剂对菌株X8P胞外酯酶粗酶酶活性影响
由图9可知,SDS强烈抑制菌株酶活性,浓度越高,抑制作用越明显。Tween-20(1 mmol/L)和Tween-80(1 mmol/L)使菌株酶活促进2%~3%,而Tween-20(10 mmol/L)和Tween-80(10 mmol/L)抑制酶活性。Triton-100(1和10 mmol/L)使酶活性提高30%~35%。
2.3.5 金属离子对菌株X8P胞外酯酶粗酶活性的影响
由图10可知,K+、Mn2+(1和10 mmol/L)使菌株酶活性提高2%~20%,Fe2+和Ni2+对酶活性影响不大。Zn2+明显抑制酶活性。Mg2+、Ca2+、Ba2+、Na+、Fe3+、Cu2+(1 mmol/L)使酶活性提高10%~20%,Mg2+、Ca2+、Ba2+、Na+、Fe3+、Cu2+(10 mmol/L)对酶活性有抑制作用。

图8 有机溶剂对菌株X8P胞外酯酶粗酶活性的影响
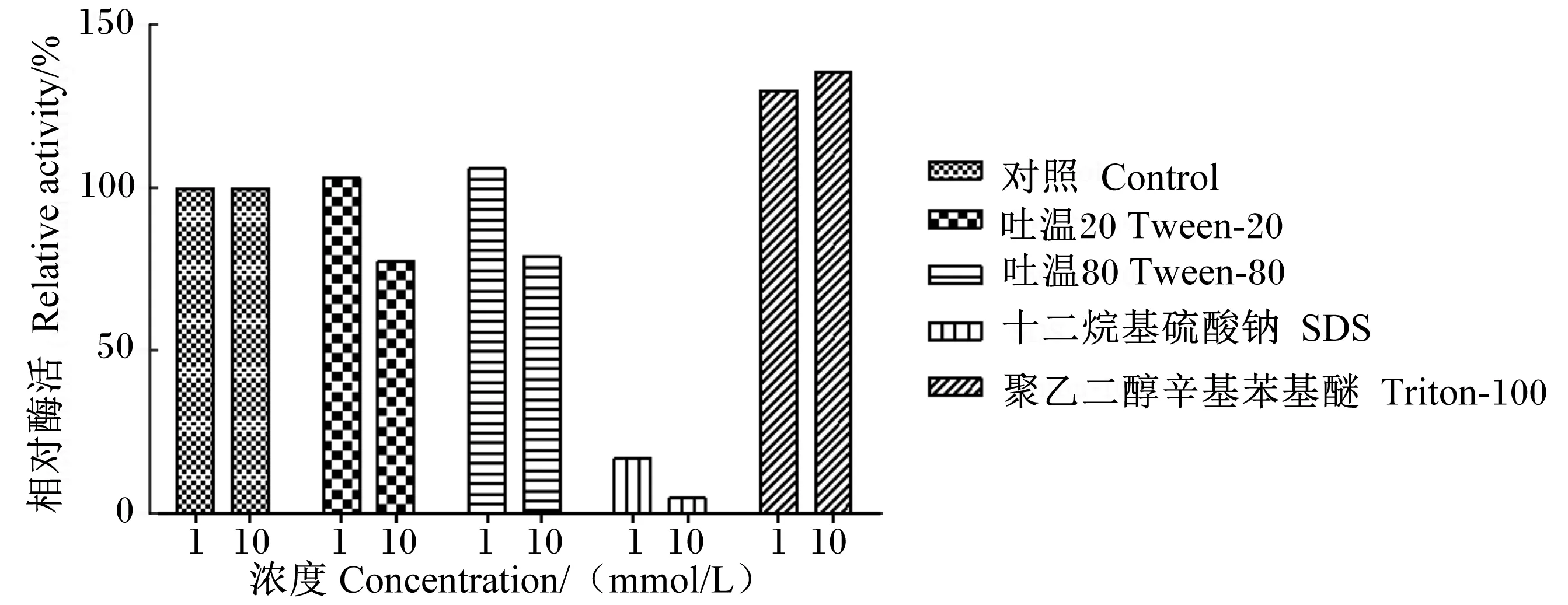
图9 表面活性剂对菌株X8P胞外酯酶粗酶活性的影响
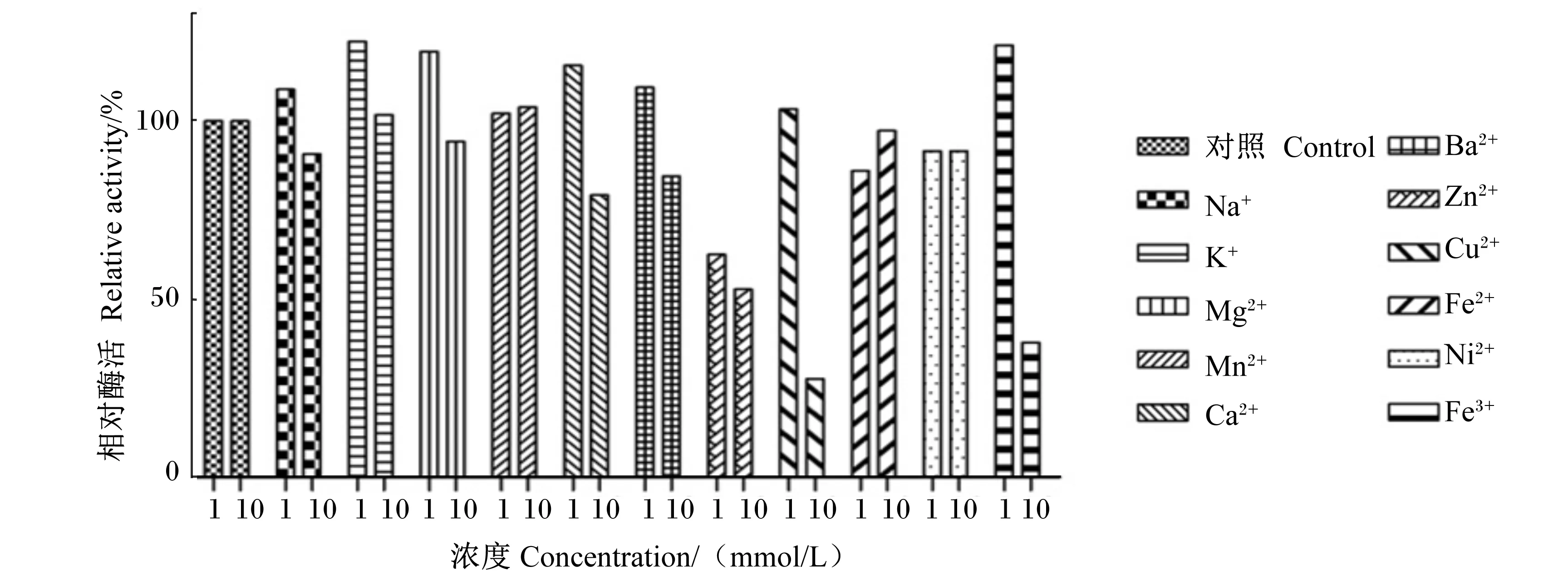
图10 金属离子对菌株X8P胞外酯酶粗酶活性的影响
3 讨 论
目前,已知植物角质降解菌来源有真菌、放线菌和细菌。角质降解真菌研究最为广泛,而角质降解细菌了解不多。本实验室筛选获得1株细菌,经鉴定命名为AcetobacterorientalisX8P,目前尚无关于醋酸杆菌产角质降解酶的报道。
角质降解菌所产角质酶为高度诱导酶[11],其产酶量受发酵条件和培养基成分影响较大[5,12]。在本试验中发现,菌株X8P在37 ℃发酵4 d,酶活性达到最高,这与前人研究结果[5,12-13]一致。Yang等[13]研究发现,太瑞斯梭孢壳(Thielaviaterrestris)CAU709适宜产酶温度50 ℃。Fett等[5]研究的铜绿假单胞菌(Pseudomonasaeruginosa)1499A和DAR41352发酵24~48 h达到最大活性。这与本试验结果不同,可能是菌株差异所致。油脂常被用作发酵产酯酶的碳源[14-15]。橄榄油作为碳源可强烈诱导菌株X8P产酶,其酯酶活性增加11倍左右。可溶性淀粉抑制菌株X8P产酶,这与之前报道结果[16]一致。葡萄糖促进菌株X8P产酶,这与以往多数报道结果[11,15-16]不同。Sebastian等[17]发现,在发酵过程中补充添加葡萄糖不会抑制谷氨酸棒杆菌(Corynebacteriumsp)产角质酶,说明葡萄糖是否抑制菌株产酯酶仍需探讨。此外,角质水解产物可诱导菌株X8P产酶,这与真菌类似[11,17-18]。添加无机氮和有机氮均对菌株X8P产酶有明显抑制作用。Kleeberg等[16]发现,矿物质培养基中添加蛋白胨时,嗜热放线菌(Thermobifidafusca)DSM 43793生物量增加,但聚酯膜降解酶未增加。所以添加无机氮和有机氮抑制菌株X8P产酶的可能原因是LB培养基中氮源物质已可满足菌株X8P发酵产酶,额外添加的氮源使菌株X8P持续生长传代,使同时期时处于产酶阶段微生物量减少,从而导致酶产量降低。
酶蛋白适宜pH和pH稳定性是其重要性质之一。目前,文献报道的大部分角质酶适宜pH均在6.0~10.0内[7,18-20]。本研究发现,菌株X8P胞外粗酶适宜pH 6.5,这与来源于Thermobifidafusca和花粉角质酶适宜pH一致[16-17],在pH 4.5~8.5之间,菌株X8P酶活性可保留50%以上。此外,菌株X8P胞外粗酶在pH 6.5~7.5内30 min,酶活性可保留60%以上。菌株X8P胞外粗酶适宜温度45 ℃,与已知角质酶适宜温度一致[7,19-20],在30~60 ℃均有较高活性(50%以上),在0~50 ℃处理30 min,酶活性保留60%以上。不同来源角质酶温度稳定性存在一定差异。Fett等[11]发现通高温放线菌(Thermoactinomycesvulgaris)NRRL B-16117角质酶在50~60 ℃条件下1 h,酶活性几乎不变,在70 ℃半衰期30 min,而真菌Fusariumsolanipisi角质酶在40 ℃条件下85 h、60 ℃条件5 min,活性丧失50%[20]。这说明角质酶的温度稳定性与菌种来源存在较大关系。
本试验中,菌株X8P粗酶在甘油(50%和80%)中可保留全部活性,在DMSO(50%)中活性保留66%,在其他有机溶剂中,活性全部丧失,这与已有文献报道结果[15,21]一致。SDS强烈抑制菌株X8P粗酶活性,这与已有文献报道结果[21-22]一致。酶蛋白活性易受金属离子影响。本研究发现,K+、Mn2+(1和10 mmol/L)使菌株X8P粗酶活性提高2%~20%,Fe2+和Ni2+对粗酶活性影响不大。Zn2+明显抑制粗酶活性。Mg2+、Ca2+、Ba2+、Na+、Fe3+、Cu2+(1 mmol/L)使粗酶活性提高10%~20%,Mg2+、Ca2+、Ba2+、Na+、Fe3+、Cu2+(10 mmol/L)对粗酶活性有抑制作用。Sebastian等[23]研究表明,Ca2+、Mg2+和Cu2+等金属离子及螯合物不会影响细菌和真菌角质酶的活性,而会影响花粉角质酶的活性[17]。
4 结 论
① 角质降解菌X8P经鉴定为AcetobacterorientalisX8P,其适宜发酵条件为37 ℃、发酵4 d,1%橄榄油强烈促进菌株X8P产酶,1%可溶性淀粉抑制菌株X8P产酶。
② 菌株胞外粗酶适宜温度45 ℃,适宜pH 6.5,且具有一定的pH稳定性,在甘油(50%和80%)中可保留全部活性,而在DMSO(50%)中活性可保留66%,Triton-100、K+、Mn2+(1和10 mmol/L)及Mg2+、Ca2+、Ba2+、Na+、Fe3+、Cu2+(1 mmol/L)对菌株X8P粗酶活性有部分促进作用。
[1] LIN T S,KOLATTUKUDY P E.Isolation and characterization of a cuticular polyester (cutin) hydrolyzing enzyme fromPhytopathogenicfungi[J].Physiological Plant Pathology,1980,17(1):1-15.
[2] KOLATTUKUDY P E.Biopolyester membranes of plants:cutin and suberin[J].Science,1980,208(4447):990-1000.
[3] DEGANI O,GEPSTEIN S,DOSORETZ C G.Potential use of cutinase in enzymatic scouring of cotton fiber cuticle[J].Applied Biochemistry and Biotechnology,2002,102/103(1/2/3/4/5/6):277-289.
[4] INGLIS G D,YANKE L J,SELINGER L B.Cutinolytic esterase activity of bacteria isolated from mixed-plant compost and characterization of a cutinase gene fromPseudomonaspseudoalcaligenes[J].Canadian Journal of Microbiology,2011,57(11):902-913.
[5] FETT W F,GERARD H C,MOREAU R A,et al.Screening of nonfilamentous bacteria for production of cutin-degrading enzymes[J].Applied and Environmental Microbiology,1992,58(7):2123 -2130.
[6] 张效宁,冉琴琴,张学俊.角质酶的研究与应用进展[J].中国酿造,2013,32(11):11-17.
[7] KOSCHORRECK K,LIU D,KAZENWADEL C,et al.Heterologous expression,characterization and site-directed mutagenesis of cutinase CUTAB1 fromAlternariabrassicicola[J].Applied Microbiology and Biotechnology,2010,87(3):991-997.
[8] FETT W F,GÉRARD H C,MOREAU R A,et al.Cutinase production byStreptomycesspp[J].Current Microbiology,1992,25(3):165-171.
[10] 刘春红,冯志彪.以α-乙酸萘酯为底物植物酯酶活力测定条件的优化[J].食品工业科技,2008(6):145-147,151.
[11] FETT W F,WIJEY C,MOREAU R A,et al.Production of cutinolytic esterase by filamentous bacteria[J].Letters in Applied Microbiology,2000,31(1):25-29.
[12] KLEEBERG I,HETZ C,KROPPENSTEDT R M,et al.Biodegradation of aliphatic-aromatic copolyesters byThermomonosporafuscaand other thermophilic compost isolates[J].Applied and Environmental Microbiology,1998,64(5):1731-1735.
[13] YANG S Q,XU H B,YAN Q J,et al.A low molecular mass cutinase ofThielaviaterrestrisefficiently hydrolyzes poly(esters)[J].Journal of Industrial Microbiology & Biotechnology,2013,40(2):217-226.
[14] SHARMA R,CHISTI Y,BANERJEE U C.Production,purification,characterization,and applications of lipases[J].Biotechnology Advances,2001,19(8):-662.
[15] CASTRO-OCHOA D,PEA-MONTE C,GONZLEZ-CANTO A,et al.Ancut2,an extracellular cutinase fromAspergillusnidulansinduced by olive oil[J].Applied Biochemistry and Biotechnology,2012,166(5):1275-1290.
[16] KLEEBERG I,WELZEL K,VANDENHEUVEL J,et al.Characterization of a new extracellular hydrolase fromThermobifidafuscadegrading aliphatic-aromatic copolyesters[J].Biomacromolecules,2005,6(1):262-270.
[17] SEBASTIAN J,CHANDRA A K,KOLATTUKUDY P E.Discovery of a cutinase-producing Pseudomonas sp. cohabiting with an apparently nitrogen-fixingCorynebacteriumsp. in the phyllosphere[J].Journal of Bacteriology,1987,169(1):131-136.
[18] FETT W F,WIJEY C,MOREAU R A,et al.Production of cutinase byThermomonosporafuscaATCC 27730[J].Journal of Applied Microbiology,1999,86(4):561-568.
[19] KWON M A,KIM H S,YANG T H,et al.High-level expression and characterization ofFusariumsolanicutinase inPichiapastoris[J].Protein Expression and Purification,2009,68(1):104-109.
[20] CHENG S,TONG X,WOODARD R W,et al.Identification and characterization of bacterial cutinase[J].The Journal of Biological Chemistry,2008,283(38):25854-25862.
[21] OUYANG L M,LIU J Y,QIAO M,et al.Isolation and biochemical characterization of two novel metagenome-derived esterases[J].Applied Biochemistry and Microbiology,2006,169(1) :15-28.
[22] PARK Y,CHOI S,LEE H.A carboxylesterase from the thermoacidophilic archaeonSulfolobussolfataricusP1;purification,characterization,and expression[J].Biochimica et Biophysica Acta (BBA):General Subjects,2006,1760(5):820-828.
[23] SEBASTIAN J,KOLATTUKUDY P E.Purification and characterization of cutinase from a fluorescentPseudomonasputidabacterial strain isolated from phyllosphere[J].Archives of Biochemistry and Biophysics,1988,263(1):77-85.
*Corresponding author, associate professor, E-mail: zhty999@163.com
(责任编辑 武海龙)
Identification, Fermentation Conditions Optimization and Enzymatic Properties of Cutin Degrading Bacteria
LIANG Zhengwen1ZHANG Tieying1*LI Shuang1LIU Junli2
(1. State Key Laboratory of Animal Nutrition, Institute of Animal Science, Chinese Academy of Agricultural Science, Beijing 100193, China; 2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730070, China)
The present study was designed to identify the cutin degrading strain X8P, their fermentation conditions and enzymatic properties were also explored, to investigate the degradation of plant cuticular surface, and to improve the possible new schemes for the utilization of plant fiber. The strain X8P was identified by morphology observation and 16S rDNA sequencing, and the optimal fermentation conditions of carbon source, nitrogen source, fermentation temperature and fermentation time for enzyme production were investigated. After precipitating crude extracellular enzyme protein by ammonium sulfate, we studied the optimum pH and pH stability and temperature and temperature stability of crude extracellular enzyme, and the effect of organic solvents, surfactants and metal ions on crude enzyme. The results showed as follows: 1) the strain X8P was successfully identified asAcetobacterorientalisby colony morphological characteristic observing and 16S rDNA sequencing. 2) The optimal fermentation conditions of the strain X8P were temperature 37 ℃ and fermentation time for 4 days in the lysogeny broth (LB) medium. The LB medium supplemented with 1% olive oil and glucose was significantly promoted enzyme production, and supplemented with 1% soluble starch inhibited the enzyme production. 3) The optimum temperature and pH of the strain X8P’s extracellular esterase with good pH stability were 45 ℃ and pH 6.5. In tested organic solvents, the enzyme exhibited part of cutinolytic esterase activity only in dimethyl sulfoxide (DMSO)(50%). Tween-20 (1 mmol/L), Tween-80 (1 mmol/L) and Triton-100 (1 and 10 mmol/L) could improve the extracellular enzyme activity as 3% to 35%. Metal ions such as K+, Mn2+(1 and 10 mmol/L) could improve extracellular enzyme activity as 2% to 20%. Therefore, the strain X8P has certain enzyme potential and application prospects, worthy of further study.[ChineseJournalofAnimalNutrition, 2016, 28(11):3567-3575]
cutin; cutinase; cutin degrading bacteria; fermentation conditions optimization; enzymatic properties
2016-05-01
梁争文(1991—),男,河南洛阳人,硕士研究生,动物营养与饲料科学专业。E-mail: 13126664873@163.com
*通信作者:张铁鹰,副研究员,硕士生导师,E-mail: zhty999@163.com
10.3969/j.issn.1006-267x.2016.11.025
S811.6
A
1006-267X(2016)11-3567-09

