一个金黄色葡萄球菌蛋白磷酸酯酶基因的克隆表达及酶活性测定
吕茂利,于立权,秦学功,崔玉东
(黑龙江八一农垦大学生命科学技术学院,大庆163319)
一个金黄色葡萄球菌蛋白磷酸酯酶基因的克隆表达及酶活性测定
吕茂利,于立权,秦学功,崔玉东
(黑龙江八一农垦大学生命科学技术学院,大庆163319)
金黄色葡萄球菌是一种引起人畜多种感染的主要病原菌,开发治疗金黄色葡萄球菌感染的新药途径之一是药物寻靶。研究克隆了一个金黄色葡萄球菌基因,并进行了蛋白诱导表达和酶活性测定。结果表明,该基因编码的蛋白具有丝氨酸/苏氨酸蛋白磷酸酯酶活性。实验结果为进一步挖掘该蛋白作为药物靶标的潜在功能奠定了基础。
金黄色葡萄球菌;蛋白磷酸酯酶;活性测定
金黄色葡萄球菌(Staphylococcus aureus,S.aureus)是一个能引起奶牛乳房炎和子宫内膜炎等疾病的致病微生物,同时也能引起广泛的医院内和社区内感染重要致病微生物,包括食物中毒、假膜性肠炎、烫伤样皮肤综合症、毒素休克综合症、化脓性炎症和败血症等[1]。近年来,随着金黄色葡萄球菌耐药菌株频现和多重耐药性增加,养殖业的疫病防控压力也随之加大,同时也给人类健康造成了极大的威胁[2]。
研究表明,从原核生物到真核生物,由蛋白激酶和磷酸酶共同调节的蛋白可逆性磷酸化在进化上高度保守[3]。在原核生物中,信号感知和信息传递主要是由组氨酸激酶感应蛋白和效应调节蛋白组成的双组分信号转导系统来完成的[4]。但越来越多的研究证明,细菌和古菌也存在着多种类型的类真核丝氨酸/苏氨酸蛋白激酶(ESTK)和蛋白磷酸酯酶(ESTP)[5]。一些包括金黄色葡萄球菌在内的致病菌,它们中的类真核丝氨酸/苏氨酸磷酸酶调控着压力胁迫感应、生物膜形成、细胞壁合成、芽孢生成等许多细胞过程,并与毒力密切相关[6-8]。
为揭示蛋白磷酸酯酶在金黄色葡萄球菌可逆性蛋白磷酸化信号转导通路中的功能和寻找新药靶标,实验克隆表达了一种金黄色葡萄球菌蛋白磷酸酯酶并进行了活性测定分析。研究工作为后续研发抗金黄色葡萄球菌有效药物提供了基础。
1 材料与方法
1.1 菌株、质粒及试剂
金黄色葡萄球菌菌株Newman、大肠杆菌DH5α和BL21、质粒pET32a为实验室保存。PMD18-T和T4 DNA连接酶购自大连宝生物公司,Taq DNA聚合酶购自北京全式金生物技术有限公司,限制性内切酶购自Thermo scientific公司,基因组提取试剂盒、质粒小量提取试剂盒及胶回收试剂盒购自Axygen公司,丝氨酸/苏氨酸蛋白磷酸酯酶测定试剂盒购自Promega公司。
1.2 生物信息学分析
利用生物信息学网站http://smart.embl-heidelberg.de/smart,对该蛋白酶基因编码的氨基酸序列进行在线分析。
1.3 引物设计
参考Pubmed数据库,利用Primer5软件设计引物(下划线标注为外加酶切位点):0140F:5′-GCCGGATCCTCAAACATAGCATTTTATGTCG-3′(BamH I)和0140R:5′-GCGGTCGACCTTTTCAACTTTAAAATCAAC-3′(Sal I)。引物由苏州金唯智生物科技有限公司合成。
1.4 基因组DNA提取及PCR扩增
按照基因组提取试剂盒上操作说明,提取基因组DNA。以提取的S.aueus Newman基因组DNA为模板,用上述引物进行PCR扩增。反应条件为:95℃5 min预变性,95℃30 s,65℃30 s,72℃1.5 min,共30个循环,末次循环后72℃延伸5 min。反应结束后,PCR产物进行1%琼脂糖凝胶电泳分析。
1.5 重组表达质粒的构建及鉴定
将TA克隆测序正确的重组质粒pMD18T-0140和载体pET32a分别进行BamH I/Sal I双酶切,回收纯化后进行连接转化。用酶切和PCR方法鉴定阳性克隆。
1.6 蛋白诱导表达
将过夜培养的重组菌以1∶100稀释接种于含有100 μg·mL-1氨苄的LB液体培养基中震摇。当菌液OD600达到0.5时,加入终浓度为1 mM·L-1的IPTG诱导不同时间,离心收集菌体后超声破碎裂解。若蛋白以包涵体形式存在,则用含8 M尿素的缓冲液溶解,再缓慢稀释至溶液中尿素终浓度为2 mol·L-1,4℃12 000 rpm·min-1离心15 min,SDS-PAGE电泳分析。
1.7 蛋白酶活性测定
按照丝氨酸/苏氨酸蛋白磷酸酯酶测定试剂盒进行。设7组,分别是:酶、底物、酶+底物、酶+底物+氯化镁、酶+底物+氯化镁+氟化钠、酶+底物+氯化锰、酶+底物+氯化锰+氟化钠。每组样品加入缓冲液后37℃反应3 min,随后加入终止液室温作用15 min。酶标仪测定OD600nm值,根据标准曲线换算成磷酸根浓度。实验重复三次。
2 结果
2.1 目的蛋白结构域
经过在线SMART分析,目标基因编码的蛋白具有一个丝氨酸/苏氨酸蛋白磷酸酯酶结构域(PP2C结构域),该结构域位于蛋白N端(4-278AA)(图1)。
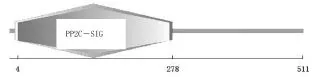
图1 目的基因的SMART分析Fig.1Analysis of SMART of target gene
2.2 重组表达质粒的构建
从Newman菌株中PCR扩增得到约1 536 bp的目的条带(图2),测序结果显示序列全长为1 536 bp,其核苷酸序列与Pubmed数据库上Newman菌株对应的核苷酸序列同源性达99%,编码511个氨基酸,阅读框正确无误。从转化平板上挑取单菌落,小量培养后提取质粒,用0140F/0140R引物对进行PCR扩增,显示一约1 536 bp大小条带,用BamH I/Sal I双酶切,获得约1.5 kb和约5.9 kb大小两条条带,与预期结果一致(图2),说明重组质粒构建成功。

图2 目的基因的分子克隆Fig.2Molecular cloning of target gene
2.3 重组蛋白的诱导表达
按照常规转化方法,将构建好的重组质粒pET32a-0140转化大肠杆菌表达菌株BL21,以1 M浓度的IPTG进行诱导表达。同时设空菌BL21和转入表达载体pET32的BL21做对照。通过不同时间(1 h,2 h,3 h和4 h)诱导,重组蛋白均得到良好诱导表达,且随着时间的延长,重组蛋白表达量没有显著提高(图3)。菌体诱导表达后,超声裂解菌体,SDSPAGE电泳上清液和菌体沉淀发现,重组蛋白以包涵体的形式存在(结果未显示)。
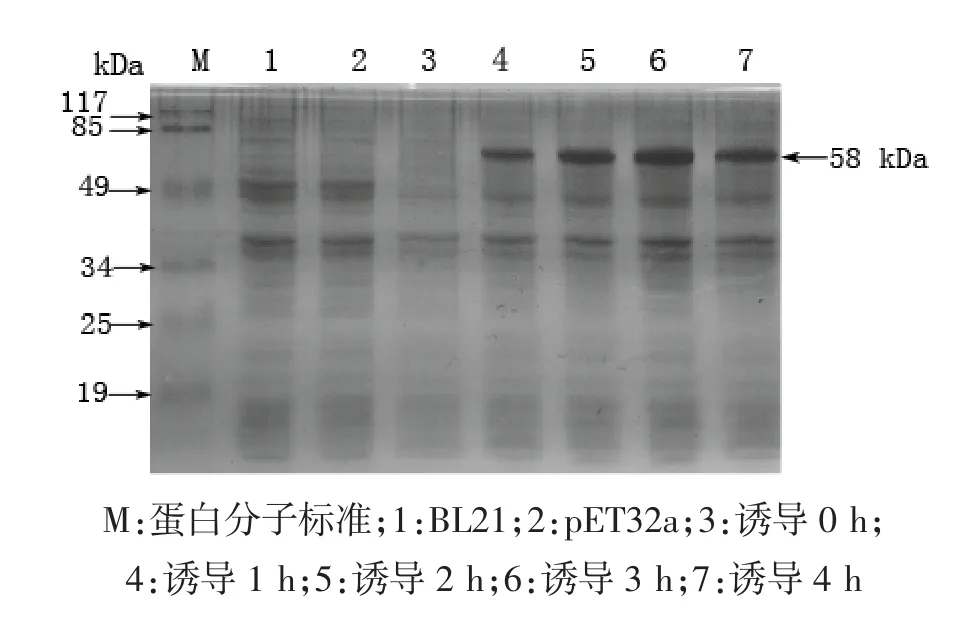
图3 重组蛋白的表达Fig.3Expression of recombinant protein
2.4 重组蛋白的酶活性测定
应用商品化试剂盒,对合适浓度的目标蛋白进行了磷酸酶活性测定。结果显示,当仅仅加入酶或/和底物时,反应体系中游离磷酸的含量非常低。但加入Mg2+或Mn2+后,酶与底物寡肽反应释放的游离磷酸量显著增高,分别达到约28%和35%。同时在加入丝氨酸/苏氨酸蛋白磷酸酯酶特异性抑制剂NaF后,反应体系中的蛋白磷酸酯酶活性受到抑制(图4)。以上结果说明,实验诱导表达的重组蛋白具有蛋白丝氨酸/苏氨酸磷酸酯酶活性,且这种去磷酸化活性受到Mg2+或Mn2+的激活和NaF抑制。
3 讨论
细菌感染的蔓延和耐药性菌株的出现,需要一种新的治疗手段和治疗药物[8,9,10]。蛋白磷酸酯酶是细胞中催化可逆磷酸化反应的关键酶,在生物进化中高度保守[9,11]。目前,金黄色葡萄球菌可逆磷酸化信号途径中关键分子特别是蛋白磷酸酯酶的鉴定识别已成为研究热点。国外文献已经发现并报道了金黄色葡萄球菌类真核丝/苏氨酸蛋白磷酸酯酶(STP1)参与细菌细胞壁的生物合成,对细菌毒力有调节作用,△STP1对万古霉素的敏感性发生变化[12,13]。但对于其他金黄色葡萄球菌假定编码的丝氨酸/苏氨酸蛋白磷酸酯酶基因及其功能研究,国内外尚无报道[2]。研究通过生物信息学分析,发现研究基因编码蛋白具有丝氨酸/苏氨酸蛋白磷酸酯酶结构域(PP2C结构域),并进行了分子克隆和蛋白表达。酶活性测定表明,该基因编码的蛋白具有丝氨酸/苏氨酸蛋白磷酸酯酶活性。研究结果为后续开展基于蛋白磷酸酯酶的抗金黄色葡萄球菌感染治疗药物靶点筛选工作奠定了基础。

图4 重组蛋白的酶活性测定Fig.4Enzyme assay of recombinant protein
[1]唐俊妮,龙飞,史贤明,等.金黄色葡萄球菌基因组DNA提取方法的比较研究[J].中国卫生检验杂志,2008,118(8):1467-1469.
[2]Cameron D R,Ward D V,Kostoulias X,et al.Serine/Threonine Phosphatase Stp1 Contributes to Reduced Susceptibility to Vancomycin and Virulence in Staphylococcus aureus[J].The Journal of Infectious Diseases,2012,205:1677-1687.
[3]Kennelly P J.Archeal protein kinases and protein phosphatases-insights from genomics and biochemistry[J]. The Biochemical Journal,2003,370:373-389.
[4]Macek B,Gnad F,Soufi B,et al.Phosphoproteome analysisof E.coli reveals evolutionary conservationof bacterial Ser/Thr/Tyr phosphorylation[J].Molecular&cellular proteomics,2008(7):299-307.
[5]张皓,田金华,朴明淑,等.气肿疽梭菌鞭毛基因克隆载体的构建[J].延边大学农学学报,2015,37(2):91.[6]Shah I M,Laaberki M H,Popham D L,et al.A eukaryoticlike Ser/Thr kinase signals bacteria to exit dormancy in response to peptidoglycan fragments[J].Cell,2008,135:486-496.
[7]Burnside K,Lembo A,Reyes M,et al.Regulation of Hemolysin Expression and Virulence of Staphylococcus aureus by a Serine/Threonine Kinase and Phosphatase[J].PLoS ONE,2010,5(6):11071.
[8]Liebeke M,Meyer H,Donat S,et al.A Metabolomic View of Staphylococcus aureus and Its Ser/Thr Kinase and Phosphatase Deletion Mutants:Involvement in Cell Wall Biosynthesis[J].Chemistry&Biology,2010,27:17820-81730.
[9]王超,曲晓军,崔艳华.cDNA-AFLP技术及其在基因差异表达中的应用[J].安徽农业大学,2014,42(21):6937-6940.
[10]代建,樊自尧,杨轩,等.定点突变阻止金黄色葡萄球菌α-溶血素溶血活性[J].黑龙江八一农垦大学学报,2014,26(2):44-49.
[11]杜骁杰,潘秀珍.真核样丝氨酸苏氨酸激酶在链球菌中的研究进展[J].中国病原生物学杂志,2014(3):282-285.
[12]于立权.白念珠菌CaPTC6和CaHXT5基因及酿酒酵母ScATP16基因的功能研究[D].天津:天津大学,2010.
[13]Débarbouillé M,Dramsi S,Dussurget O,et al.CharacterizationofaSerine/ThreonineKinaseInvolvedin Virulence of Staphylococcus aureus[J].Journal of Bacteriology,2009,191(13):4070-4081.
Cloning,Expression and Enzyme Assay of Staphylococcus aureus Protein Phosphatase Gene
Lv Maoli,Yu Liquan,Qin Xuegong,Cui Yudong
(College of Life Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
Staphylococcus aureus was an important pathogen causing various infections of human and livestock.Targeting of a drug was a new approach of developing new drugs against S.aureus.A S.aureus gene was cloned,then induced protein was expressed and enzyme assay was conducted.The results showed that the recombinant protein coded by the gene had serine/threonine protein phosphatase activity.This work provided a reference points for further investigating the protein as target for a drug.
Staphylococcus aureus;protein phosphatase;enzyme assay
Q933
A
1002-2090(2016)04-0072-03
10.3969/j.issn.1002-2090.2016.04.016
2015-03-19
黑龙江八一农垦大学“博士科研启动基金”(校启2011YB-15);国家自然基金面上项目(31072120)。
吕茂利(1976-),女,黑龙江八一农垦大学生命科学技术学院2012级硕士研究生。
秦学功,教授,硕士研究生导师,E-mail:flyylq@163.com;崔玉东,教授,博士研究生导师,cuiyudong@yahoo.com。

