白鲜皮多糖的提取及分子特性研究
曹荣安,李良玉,林剑,瞿东杨,张邢晨,贾建
(1.黑龙江八一农垦大学食品学院,大庆163319;2.国家杂粮工程技术研究中心/黑龙江八一农垦大学;3.龙游伊利乳业有限责任公司)
白鲜皮多糖的提取及分子特性研究
曹荣安1,李良玉2,林剑3,瞿东杨1,张邢晨1,贾建1
(1.黑龙江八一农垦大学食品学院,大庆163319;2.国家杂粮工程技术研究中心/黑龙江八一农垦大学;3.龙游伊利乳业有限责任公司)
以白鲜皮为原料提取多糖,优化提取参数,分析其分子特性。首先在单因素试验基础上,采用响应面法优化白鲜皮多糖的提取参数,最佳参数为液料比23.87(mL:g)、温度87.71℃、提取时间2.38 h,多糖得率为7.1%。白鲜皮多糖的化学组成为86.1%总糖、9.2%蛋白质和7.1%糖醛酸,单糖组成主要为85.5%葡萄糖,同时还含有5.2%半乳糖、4.7%阿拉伯糖、2.0%木糖、1.4%鼠李糖、1.1%甘露糖和0.1%岩藻糖。分子质量和分子质量分布情况研究表明,在RI色谱图洗脱时间44~53 min白鲜皮多糖存在一个对称峰,其分子质量为369.9×103u,回转半径为250.0 nm。
白鲜皮;多糖;提取;分子特性
白鲜(Dictamnus L.)是芸香科白鲜属多年生草本植物,有浓烈的特殊气味,主要分布在亚洲大陆,约有五种,我国有白鲜(Dictamnus L.)和新疆白鲜(Dictamnus angustifolius G.Don.)两种[1]。白鲜皮(Dictamnus dasycarpus Turcz)为白鲜的干燥根皮,为我国传统中草药,其味苦、性寒。《药性论》中曾经记载,白鲜皮治一切热毒风、恶风、风疮、疥癣赤烂、眉发脱脆、皮肌急、壮热恶寒,主解热黄、酒黄、急黄、谷黄、劳黄等。《中国药典》收载记录其功能主治有清热燥湿、祛风解毒,用于湿热疮毒、黄水淋漓、湿疹、风疹、疥癣疮癞、风湿热痹、黄疸尿赤[2]。现代研究表明白鲜皮的药理作用有抗氧化、抗菌、抗炎、抗癌、抗内毒素、抗过敏、杀虫、止血、保护神经和肝脏等作用[3-16],临床上主要用于治疗慢性支气管炎、皮肤脱皮症、风湿性关节炎、外出血、荨麻疹、湿疹等[17-18]。目前,从白鲜皮中分离得到的化学成分包括生物碱类、柠檬苦素类、倍半萜及其倍半萜昔类、香豆素类、黄酮类、挥发油类、甾体类及多糖化合物等[19-25],但对白鲜皮多糖的研究报道很少。试验以白鲜皮为原料提取多糖,研究提取参数,之后分析化学成分、单糖组成和分子量,为白鲜皮多糖的研究提供参考。
1 材料与方法
1.1 材料与试剂
白鲜皮(市购,产地黑龙江),蛋白质定量试剂盒(DC protein assay kit)购自美国Bio-Rad公司,单糖标准品、牛血清蛋白、明胶、葡萄糖醛酸购自美国Sigma-Aldrich公司,其他化学试剂均为分析纯。
1.2 仪器与设备
3802 UV/VZS分光光度计,美国Unico公司;TSK Gel色谱柱,日本TOSOH公司;2487紫外检测器,美国Waters公司;DAWN HELEOS多角度激光光散射检测器,美国Wyatt公司;2414示差折光检测器,美国Waters公司;6890N/MSD5973气质联用仪(GC-MS),美国Agilent公司。
1.3 白鲜皮多糖提取参数研究
1.3.1 提取工艺
原料挑选除杂烘干后研磨过40目筛,加入85%乙醇70℃加热回流搅拌2 h后室温搅拌12 h,离心后沉淀加入无水乙醇室温搅拌,离心去上清液后沉淀自然干燥。加入蒸馏水进行浸提,离心后收集提取液,残渣按照相同程序再提取一次,合并两次的提取液,真空浓缩后加入乙醇使最终乙醇的体积分数为80%,搅拌10 min后放入4℃冰箱中静置12 h,离心后弃去上清液,沉淀加入无水乙醇洗涤两次,离心后沉淀室温干燥。称重计算多糖得率,公式为:多糖得率/%=(提取得到的多糖质量/水提时原料质量)×100。
1.3.2 单因素试验
1.3.2.1液料比对多糖得率的影响:选取液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1(mL∶g),提取温度85℃,提取时间2 h,进行多糖的提取,研究液料比对多糖得率的影响。1.3.2.2提取温度对多糖得率的影响:液料比15∶1(mL∶g),选取提取温度分别为75、80、85、90、95℃,提取时间2 h,进行多糖的提取,研究提取温度对多糖得率的影响。
1.3.2.3提取时间对多糖得率的影响:液料比15∶1(mL∶g),提取温度85℃,选取提取时间分别为1、1.5、2、2.5、3 h,进行多糖的提取,研究提取时间对多糖得率的影响。
1.3.3 响应面优化试验方法
在单因素试验基础上,根据二次回归组合试验设计原理,以多糖得率为响应值,设计液料比、提取温度、提取时间三个因素的响应面分析试验,对提取参数进行优化。
1.4 化学成分分析
总糖含量测定参照Dubois等人的苯酚-硫酸法[26],葡萄糖为标准品;蛋白质含量测定采用Lowry法(福林酚法)[27],使用的是蛋白质定量试剂盒,牛血清蛋白为标准品;硫酸根含量测定采用Dodgson和Price的氯化钡-明胶浊度法[28],硫酸钾为标准品;糖醛酸含量测定采用Filisetti-Cozzi和Carpita的间羟基联苯法[29],葡萄糖醛酸为标准品。
1.5 单糖组成分析
参考Ciucanu的方法并稍作改动[30],样品和七种单糖标准品(鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖)分别加入三氟乙酸,100℃水解6 h,经过还原和乙酰化制得相应的糖醇乙酸酯衍生物。注入1 μL到GC-MS中进行分析,采用的是HP-5MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气,流速为1.2 mL·min-1。升温程序为160~210℃(10 min之内),之后10 min升温到240℃,速度为5℃·min-1,保持在250℃,进样口温度也保持在250℃。用电子轰击源分析,电子能量为70 eV,质量扫描范围为35~450 m·z-1。根据气谱出峰时间和质谱的离子峰与单糖标准品进行对比从而确定单糖组成。
1.6 分子质量和分子质量分布测定
多糖配置成质量浓度为2 mg·mL-1的溶液,60℃加热溶解,膜过滤后注入高效尺寸排阻色谱-紫外检测器-多角度激光光散射仪-示差折光检测器联用(HPSEC-UV-MALLS-RI)系统中检测,结果分析采用ASTRA 6.1软件(Wyatt Technology Corp)。
1.7 数据分析
试验重复三次,数据采用M±SD表示,采用Sigmaplot 12.0作图。应用SAS 8.2软件对数据进行统计分析,各试验组之间的显著性差异分析采用单因素方差分析(one-way ANOVA)和邓肯氏复极差法。
2 结果与分析
2.1 白鲜皮多糖提取参数
2.1.1 单因素试验结果分析
对影响白鲜皮多糖得率的三个因素液料比、提取温度、提取时间进行单因素试验,结果见图1。可知在液料比10∶1~25∶1(mL∶g)范围内,随着液料比的增大多糖得率呈显著上升趋势(P<0.05),当液料比为25∶1(mL∶g)时多糖得率最高为6.69%,之后随着液料比的升高,多糖得率呈现下降趋势,因此,实验选择响应面优化液料比范围为以25∶1为中心,20∶1到30∶1之间。在提取温度75~90℃范围内,随着温度升高多糖得率显著增加(P<0.05),当提取温度为90℃时多糖得率最高为6.72%,之后提取温度升高到95℃,多糖得率呈现下降趋势,因此,实验选择响应面优化提取温度范围为以90℃为中心,85℃到90℃之间。而提取时间对于多糖得率的影响呈现不同的趋势,在1.0~3.0 h范围内,多糖得率一直升高,2.5 h后趋于平稳,实验选择响应面优化提取时间范围为以2 h为中心,1.5 h到3 h之间。

图1 单因素试验结果Fig.1The results of single factor experiment
2.1.2 响应面试验结果与分析
基于单因素试验结果确定的取值范围,以液料比、提取温度和提取时间这三个因素为自变量(分别以X1、X2、X3表示),以多糖得率为响应值设计3因素共17个试验点的三元二次回归旋转组合试验,保证实验点最少前提下提高多糖得率。因素水平编码表见表1,试验结果见表2。

表1 因素水平编码表Table1Coding table of factor levels
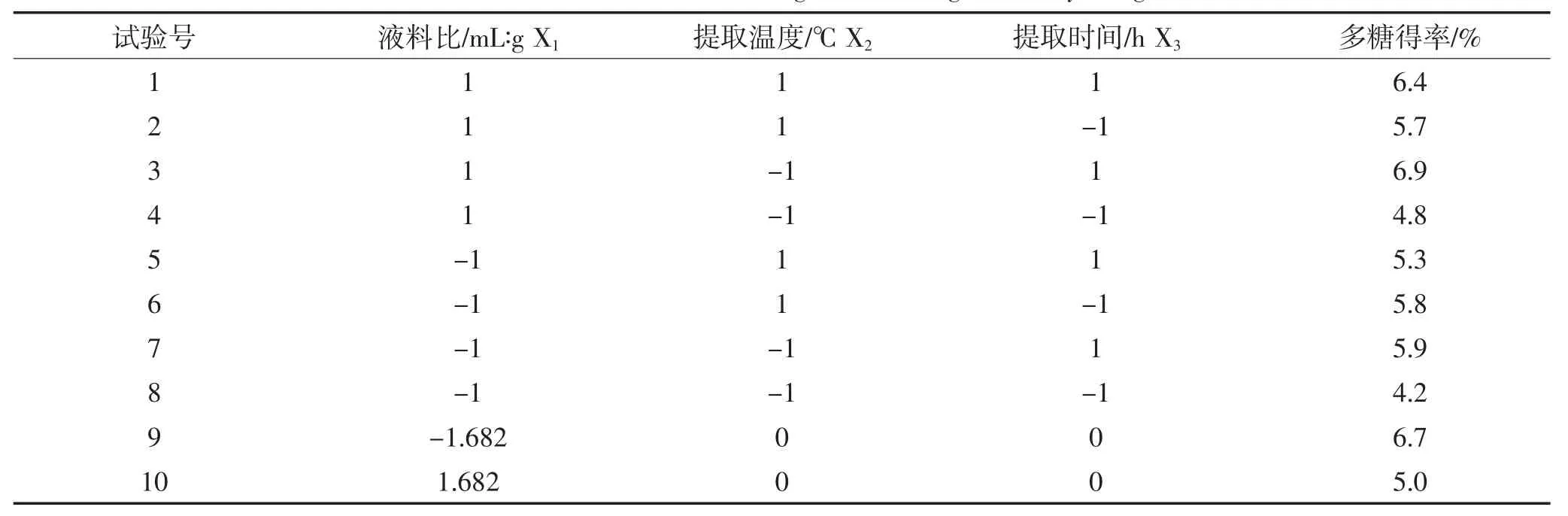
表2 试验安排表以及试验结果Table 2Scheme and results of regression orthogonal rotary design

续表2试验安排表以及试验结果Continued table 2Scheme and results of regression orthogonal rotary design
2.1.2.1 多因素组合优化试验分析
对优化试验进行响应面回归分析(RSREG),回归方程以及回归方程各项的方差分析结果见表3,二次回归参数模型数据见表4。
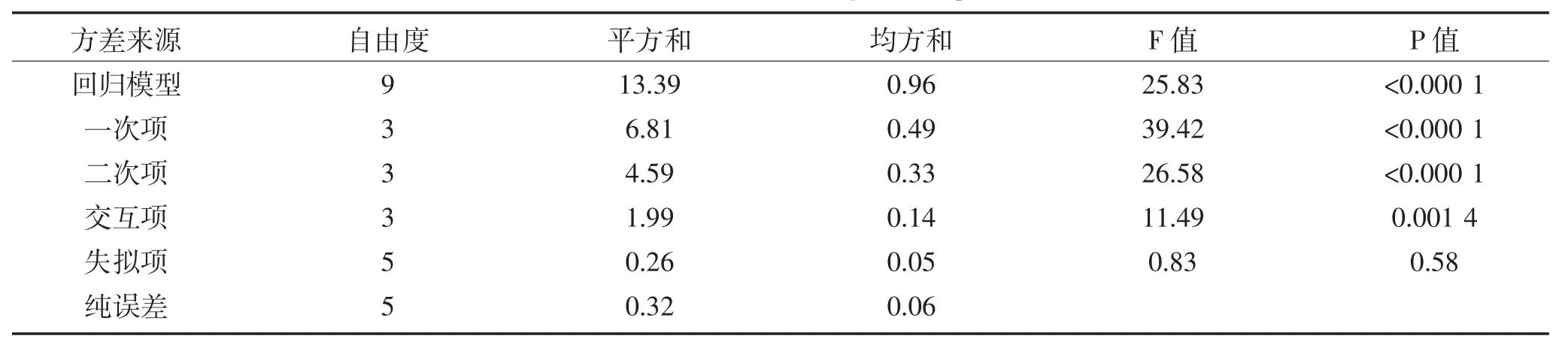
表3 回归方程的方差分析表Table 3The ANOVA of regession equation
由表3可知,二次回归模型的F值为25.83,P<0.05,大于在0.05水平上的F值,而失拟项的F值为0.83,小于在0.05水平上的F值,说明该模型拟和结果好。一次项、二次项和交互项的F值均大于0.05水平上的F值,说明其对多糖得率影响显著。根据表4的参数,以多糖得率为Y值,得出液料比、提取温度、提取时间的编码值为自变量的三元二次回归方程为:


表4 二次回归模型参数表Table 4The parameters of quadratic regression
2.1.2.2 最优提取条件确定
为了进一步确证最佳点的值,对试验模型进行响应面典型分析,以获得最大得率时的条件,结果见表5。

表5 最优提取条件及多糖得率Table 5The optimization extraction condition and yield
由表5可以看出,液料比为23.87、温度87.71℃、提取时间2.38 h,多糖的得率最大,理论最大得率为7.2%。
2.1.2.3 验证试验
按照最优提取条件进行试验,重复三次,白鲜皮多糖得率为7.1±0.4%,试验值与模型的理论值非常接近,试验条件重现性良好,该模型可以较好的反映出提取白鲜皮多糖的条件。李淑惠等报道的白鲜皮粗多糖收率为9.7%,高于实验的多糖得率,其总糖含量为79.20%,而实验提取的多糖总糖含量为86.1%,同时多糖得率的差异也与选取的原材料和提取参数不同有关[25]。同时也有利用响应面法优化蒲公英多糖工艺研究,提高了提取率[31]。
2.2 白鲜皮多糖的化学成分和单糖组成
对白鲜皮多糖的化学成分和单糖组成进行了测定,结果见表6。白鲜皮多糖主要由86.1%总糖、9.2%蛋白质和7.1%糖醛酸组成,同时未检测出硫酸根。李淑惠等报道的白鲜皮粗多糖中总糖含量为79.20%[25],低于本实验的总糖含量,这也是为何本实验的多糖得率低于其多糖得率的原因。同时由图2和表6可知,白鲜皮多糖的主要单糖为葡萄糖(85.5%),还含有少量的半乳糖(5.2%)、阿拉伯糖(4.7%)、木糖(2.0%)、鼠李糖(1.4%)、甘露糖(1.1%)和微量的岩藻糖(0.1%)。
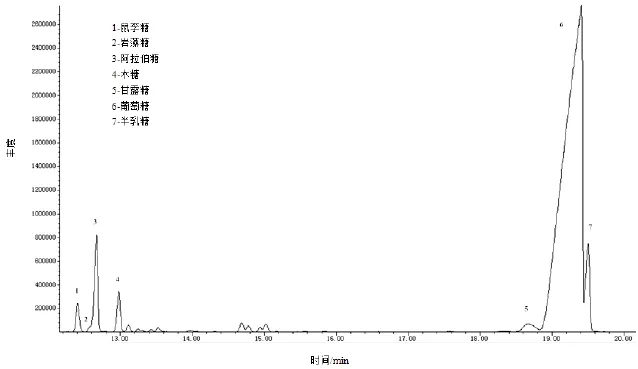
图2 白鲜皮多糖糖醇乙酸酯衍生物的总离子流色谱图Fig.2Chromatogram of total ion current spectra for the alditol acetates derivatives of polysaccharides from Dictamnus dasycarpus Turcz

表6 白鲜皮多糖的化学成分和单糖组成Table 6Chemical and monosaccharide compositions of the polysaccharide from Dictamnus dasycarpus Turcz
2.3 白鲜皮多糖的分子质量和分子质量分布
采用HPSEC-UV-MALLS-RI联机系统对白鲜皮多糖的分子质量和分子质量分布情况进行了研究,RI和UV色谱图见图3。白鲜皮多糖RI检测曲线在洗脱时间44~53 min存在一个峰形对称的峰,说明其是均一多糖。同时也存在较小的UV检测峰,这与前面化学组成中蛋白质含量是相互吻合的。同时利用ASTRA 6.1软件进行分析,得到分子质量(Mw)和回转半径(Rg)的数值,由表7可知Mw为369.9×103μ,Rg为250.0 nm。

图3 白鲜皮多糖的RI和UV色谱图Fig.3RI and UV chromatograms of the polysaccharide from Dictamnus dasycarpus Turcz

表7 白鲜皮多糖的分子质量和回转半径Table 7Molecular weight and radius of gyration for thepolysaccharide from Dictamnus dasycarpus Turcz
3 结论
通过响应面法优化了白鲜皮多糖的提取条件,最佳提取参数为液料比23.87(mL∶g)、温度87.71℃、提取时间2.38 h,多糖的得率为7.1%。之后对提取得到的白鲜皮多糖进行了分子特性研究,其总糖含量为86.1%,同时含有一定量的蛋白质和糖醛酸,单糖组成主要为葡萄糖,同时还含有少量的其他单糖。在RI色谱图中存在一个对称峰,分子质量和回转半径分别为369.9×103μ和250.0 nm。通过研究明确了白鲜皮多糖的提取参数和分子特性,这为下一步的纯化和生物活性研究奠定了基础。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1997.
[2]国家药典委员会.中华人民共和国药典[M].北京:中药医药科技出版社,2010.
[3]张红晶.白鲜皮中化学成分的提取分离及活性评价研究[D].长春:吉林农业大学,2011.
[4]Wu X X,Wu L M,Fan J J,et al.Cortex Dictamni extract induces apoptosis of activated hepatic stellate cells via STAT1 and attenuates liver fibrosis in mice[J].Journal of Ethnopharmacology,2011,135(1):173-178.
[5]艾丹.白鲜皮抗炎有效部位的研究[D].哈尔滨:黑龙江中医药大学,2010.
[6]Yoon J S,Jeong E J,Yang H,et al.Inhibitory alkaloids from Dictamnus dasycarpus root barks on lipopolysaccharide-induced nitric oxide production in BV2 cells[J]. Journal of Enzyme Inhibition&Medicinal Chemistry,2012,27(4):490-494.
[7]赵青青.中药白鲜皮中化学成分的分离与结构鉴定[D].西安:西北大学,2015.
[8]郭毅斌.白鲜皮抗内毒素的物质基础及其作用机制研究[D].重庆:第三军医大学,2007.
[9]唐忠芬.白鲜皮提取物抗过敏作用的实验研究以及在湿疹中的运用[D].成都:成都中医药大学,2006.
[10]Jiang S,Nakano Y,Rahman M R,et al.Effects of a Dictamnus dasycarpus T.extract on allergic models in mice[J].Bioscience Biotechnology&Biochemistry,2008,72(3):660-665.
[11]郭静.白鲜皮提取物止血作用及其机理研究[D].成都:成都中医药大学,2006.
[12]徐明亮,王丽丽,李琳,等.白鲜皮水提物对大鼠心肌缺血再灌注损伤的保护作用[J].中国实验动物学报,2013,21(1):47-52.
[13]杨东,张瑛,郑新川,等.白鲜皮生物碱抗内毒素活性的研究[J].第三军医大学学报,2012,34(20):2097-2100.
[14]丛欢,郭丽娜,杨莹.白鲜皮化学成分分离及其抑菌活性实验[J].齐齐哈尔医学院学报,2013,34(6):853-854.
[15]王殷东,孙璐,范佳红,等.白鲜皮提取物外用抗炎作用实验研究[J].辽宁中医药大学学报,2015,17(6):50-53.
[16]王丽丽,吕新勇,李琳,等.白鲜皮水提物对ApoE-/-小鼠动脉粥样硬化晚期病变形成的影响[J].中国药理学通报,2014,30(3):64-69.
[17]白媛媛,唐文照,王晓静.白鲜皮化学成分研究[J].中药材,2014,37(2):93-95.
[18]张文娟.白鲜皮提取物治疗慢性湿疹的实验研究[D].长沙:湖南中医药大学,2011.
[19]Zhao W,Wolfender J L,Hostettmann K,et al.Antifungal alkaloids and limonoid derivatives from Dictamnus dasy-carpus[J].Phytochemistry,1998,47(1):7-11.
[20]Chen J,Tang J S,Tian J,et al.Dasycarine,a new quinoline alkaloid from Dictamnus dasycarpus[J].Chinese Chemical Letters,2000,11(8):707-708.
[21]么乃琦.白鲜皮的保肝活性成分研究[D].延边:延边大学,2012.
[22]多力坤·克尤木,杜平,张军.HPLC-MSMS测定白鲜皮中酮的含量[J].农产品加工:学刊,2010(7):96-97.
[23]Souleles C.Flavonoids from Dictamnus albus[J].Planta Medica,1989,55(4):402.
[24]李翔,邓赟,唐灿,等.GC-MS分析白鲜皮的挥发油成分[J].华西药学杂志,2006,21(6):556-558.
[25]李淑惠,纪耀华,崔玉辉,等.白鲜皮粗多糖提取与总糖含量测定[J].时珍国医国药,2000,11(1):14.
[26]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[27]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagents[J].The Journal of Biological Chemistry,1951,193:265-275.
[28]Dodgson K S,Price R G.A note on the determination of the ester sulphate content of sulphated polysaccharides[J].Biochemical Journal,1962,84:106-110.
[29]Filisetti-cozzi T M C C,Carpita N C.Measurement of uronic acids without interference from neutral sugars[J]. Analytical Biochemistry,1991,197:157-162.
[30]Ciucanu I,Kerelk F.A simple and rapid method for the permethylation of carbohydrates[J].Carbohydrate Research,1984,131:209-217.
[31]郭希娟,马萍,刘远洋.响应面法优化微波辅助提取蒲公英多糖工艺的研究[J].黑龙江八一农垦大学学报,2014,26(3):40-44.
Extraction and Molecular Characterization Research of the Polysaccharide from Dictamnus dasycarpus Turcz
Cao Rong’an1,Li Liangyu2,Lin Jian3,Qu Dongyang1,Zhang Xingchen1,Jia Jian1
(1.College of Food Science,Heilongjiang Bayi Agricultural University,Daqing 163319;2.National Coarse Cereals Engineering Research Center,Heilongjiang Bayi Agricultural University;3.Longyou Yili Dairy CO.,LTD)
DictamnusdasycarpusTurczasasrawmaterials,theoptimizationoftheextractionparametersandmolecular characterization of the polysaccharide were investigated.The extraction parameter were as follows,the ratio of liquid to material 23.87(mL:g),temperature 87.71℃,extraction time 2.38 h,with the yield of 7.1%,which was analyzed by the response surface experiments on basis of the results of single factor experiment.The chemical composition of the polysaccharide was mainly composed of 86.1%total carbohydrate,9.2%protein and 7.1%uronic acid.The major monosaccharide of the polysaccharide was glucose(85.5%),along with limited amounts of galactose(5.2%),arabinose(4.7%),xylose(2.0%),rhamnose(1.4%),mannose(1.1%)and fucose(0.1%).According to the analysis of molecular weight and molecular weight distribution,there was a symmetrical peak during the elution time of 44~53 min in the RI chromatogram with the molecular weight 369.9×103u and radius of gyration 250.0 nm.
Dictamnus dasycarpus turcz;polysaccharide;extraction;molecular characterization
TS201.1
A
1002-2090(2016)04-0065-07
10.3969/j.issn.1002-2090.2016.04.015
2015-04-20
黑龙江八一农垦大学学成、引进人才科研启动计划(XDB2015-30);黑龙江八一农垦大学2014年度校内培育课题(XZR2014-08);2015年黑龙江省大学生创新创业训练计划项目(201510223010)。
曹荣安(1980-),男,讲师,韩国江陵原州大学毕业,现主要从事生物活性天然产物方面的研究工作。

