液相色谱–串联质谱法测定甘蓝中4-羟基百菌清的残留量
吴成,任海雷,赵志强,王蕾
(1.山东省农业环境保护和农村能源总站,济南 250100; 2.沂源县农业检测中心,山东沂源 256100)
液相色谱–串联质谱法测定甘蓝中4-羟基百菌清的残留量
吴成1,任海雷2,赵志强1,王蕾1
(1.山东省农业环境保护和农村能源总站,济南 250100; 2.沂源县农业检测中心,山东沂源 256100)
建立液相色谱–串联质谱法测定甘蓝中4-羟基百菌清残留的方法。以乙腈提取样品中的4-羟基百菌清,采用电喷雾负离子源(ESI–)和多重反应监测(MRM)模式测定,基质匹配标准工作曲线法定量。结果表明,甘蓝中4-羟基百菌清的质量浓度与其色谱峰面积呈良好的线性关系(r=0.999),线性范围为1.0~100 µg/L,方法检出限为0.31 μg/kg,定量限为1.0 μg/kg。在5,10,50 μg/kg 3个添加水平下,方法的回收率为88.0%~91.4%,测定结果的相对标准偏差为4.6%~7.2%(n=6)。该法简单、准确、快速、灵敏,符合法规残留限量监测要求。
液相色谱–串联质谱法;4-羟基百菌清;甘蓝
百菌清是一种广谱高效保护性杀菌剂,主要用于防治蔬菜、大田作物和果树真菌病害[1–3]。4-羟基百菌清是百菌清主要降解产物,其毒性比百菌清强,对人类健康影响比百菌清重[4–8]。美国、加拿大、澳大利亚和国际食品法典委员会(CAC)等农药残留限量标准中百菌清残留定义为百菌清及4-羟基百菌清之和,以百菌清计[9–12]。目前,文献报道的4-羟基百菌清检测方法有高效液相色谱法(带紫外检测器)[13–14]和甲基化–气相色谱法(带电子捕获检测器)[15–16],这些方法操作繁琐,易受干扰,灵敏度低。甘蓝是百菌清用药较多的蔬菜,笔者用液相色谱–串联质谱法(LC–MS/MS)测定甘蓝中4-羟基百菌清残留量,该方法简单、准确、快速、灵敏,符合法规残留限量监测要求。
1 实验部分
1.1 主要仪器与试剂
液相色谱–串联质谱仪:LCMS–8040型,配电喷雾离子源(ESI),日本Shimadzu公司;
离心机:LDZ5–2型,北京京立离心机公司;食品加工机:k600型,荷兰Philips公司;均质器:T18型,德国IKA公司;
天平(1):JY2001型,感量为0.1 g,上海精密仪器公司;
天平(2):BT25 s型,感量为0.01 mg,德国赛多利斯公司;
4-羟基百菌清标准品:纯度不小于98%,加拿大TRC公司;
乙腈和甲醇:色谱纯,德国Merck公司;
甲酸、乙酸铵和氯化钠:分析纯,上海化学试剂有限公司;
甘蓝:市售,用本实验方法检测确保为无4-羟基百菌清残留的空白样品;
实验用水为超纯水(电阻率为18.2 MΩ·cm)。
1.2 标准溶液配制
用天平(1)准确称取100.00 mg的4-羟基百菌清标准品,用甲醇逐级稀释配制成100 mg/L的标准储备液,置于–20.0℃冰箱保存,使用时用甲醇水(1+1)稀释至所需浓度。
1.3 仪器工作条件
1.3.1 液相色谱
色谱柱:Shim-pack XR–ODSⅢ柱(75 mm×2.0 mm,1.6 μm,日本Shimadzu公司);柱温:40℃;流动相:甲醇–0.1%甲酸水溶液(体积比为75∶25,含5 mmol/L乙酸铵);流量:0.4 mL/min;等度洗脱;进样体积:1 μL;信号采集时间:13.0 min。
1.3.2 质谱
电喷雾正离子源(ESI+)接口电压:4.5 kV;电喷雾负离子源(ESI–)接口电压:–3.5 kV;雾化气:氮气,流量为3.0 L/min;干燥气:氮气,流量为15.0 L/min;碰撞气:氩气,压力为230 kPa;脱溶剂管温度:250℃;加热模块温度:400℃;扫描模式:多反应监测(MRM);驻留时间:10 ms;延迟时间:3 ms;监测离子对质谱参数见表1。
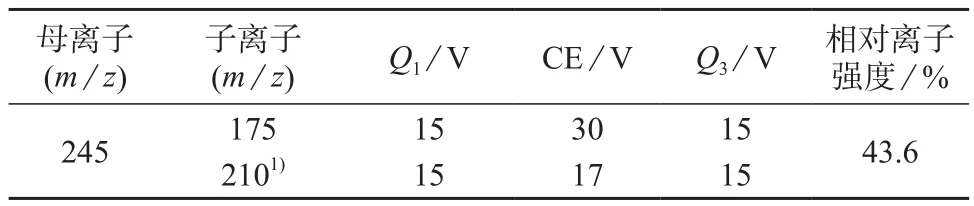
表1 4-羟基百菌清监测离子对及质谱参数
1.4 样品处理
按GB/T 8855–2008 《新鲜水果和蔬菜取样方法》 抽取甘蓝样品,取可食部分[17],缩分、切碎、混匀,放入食品加工机中粉碎,制成待测样,置于–20.0℃冰箱保存。用天平(2)称取样品15.0 g于50 mL具塞离心管,加入30.0 mL乙腈,用均质器以12 000 r/min均质2 min,加入5.0 g氯化钠,剧烈振摇2 min,以5 000 r/min离心5 min,取上清液1.5 mL过0.22 µm有机滤膜,待测。
2 结果与讨论
2.1 提取溶剂的选择
乙腈是蔬菜、水果农药多残留标准分析方法的首选提取溶剂[18–19],乙腈与水部分互溶,加入氯化钠后,盐析、分层和除杂效果明显,因此实验选取乙腈作甘蓝中4-羟基百菌清的提取溶剂。
2.2 质谱条件的优化
分别采用ESI+和ESI–模式扫描4-羟基百菌清母离子。结果发现,对于母离子扫描信号强度,ESI–模式远高于ESI+模式;ESI–模式下,4-羟基百菌清减氢峰离子信号较强且稳定,以相应离子作母离子,利用岛津LCMS–8040 Optimizer软件对子离子、四极杆预杆偏置电压(Q1和Q3)、碰撞电压(CE)等参数进行优化,优化的MRM参数见表1。
用优化的色谱质谱条件,在MRM模式下,进0.1 mg/L 4-羟基百菌清标液1.0 μL,得监测离子对提取离子流图见图1。计算定性参考离子与定量离子信号强度比(相对离子强度,为43.6%)。依据欧盟2002/657|EC 文件[20]规定的质谱技术中相对离子强度的最大允许限度范围,结合样品色谱峰保留时间和扣背景质谱图,可确证样品中4-羟基百菌清的存在。

图1 4-羟基百菌清监测离子对提取离子流图
2.3 净化条件的选择
甘蓝的乙腈提取液色素含量低,若用传统固相萃取柱净化,则效率低,操作繁琐。样品前处理采取盐析、乙腈提取、离心和过有机滤膜,能有效去除样品提取溶液中的色素。并且当前LC–MS/MS仪器结构性能得到改进,抗基质干扰能力强,清洗方便。另外,4-羟基百菌清为弱极性化合物,杂质对其电喷雾离子化影响较小,样品基质对分析物测定的干扰可忽略不计。本实验样品前处理方法,操作简单,回收率高、快速和经济,特适合大批量样品农药多残留检测,是农业部蔬菜质量安全农药残留例行监测和风险评估推荐的LC–MS/MS样品前处理方法。
2.4 方法的特异性
用LC–MS/MS检测4-羟基百菌清,选取信号响应值高,特异性强的离子进行监测,辅之色谱分离,基质干扰已减至最低,可忽略不计。4-羟基百菌清纯溶剂标样与基质标样,不含干扰离子对,对方法的特异性无影响。
2.5 线性范围及定量限
用甘蓝空白基质液配制4-羟基百菌清1~100 µg/L系列标准工作溶液,在1.3仪器工作条件下测定4-羟基百菌清。以被测组分的色谱峰面积(y)对其质量浓度(x,µg/L)作标准工作曲线,分别以3倍和10倍信噪比(S/N)计算方法检出限和定量限,结果见表2。由表2可知,4-羟基百菌清的色谱峰面积与其质量浓度呈良好的线性关系(r=0.999),方法检出限为0.31 μg/kg,定量限为1.0 μg/kg。说明该方法检测灵敏度符合残留检测方法的要求[21]。

表2 线性范围、回归方程、相关系数、检出限及定量限
2.6 精密度试验
在甘蓝空白样品中添加3个水平的4-羟基百菌清标准溶液5,10,50 μg/kg,在1.3仪器工作条件下,每个水平重复6次,结果列于表3。由表3可知,测定结果的相对标准偏差为4.6%~7.2%,说明该方法精密度符合食品中农药残留分析要求[21]。
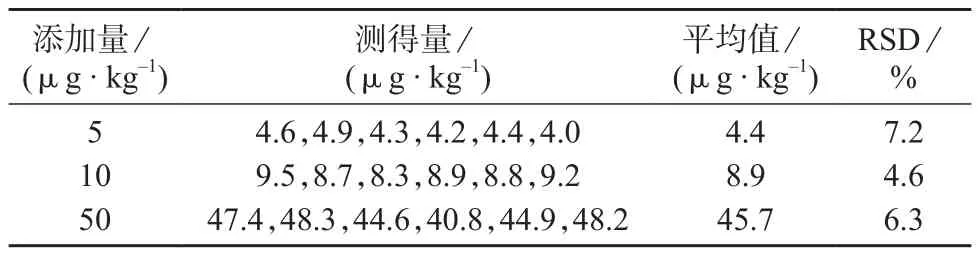
表3 精密度试验结果(n=6)
2.7 回收试验
在甘蓝空白样品中添加3个水平的4-羟基百菌清标准溶液5,10,50 μg/kg,进行加标回收试验,结果见表4。由表4可知,甘蓝中4-羟基百菌清3个水平添加平均回收率为88.0%~91.4%,说明该方法的加标回收率符合食品中农药残留分析要求[21]。
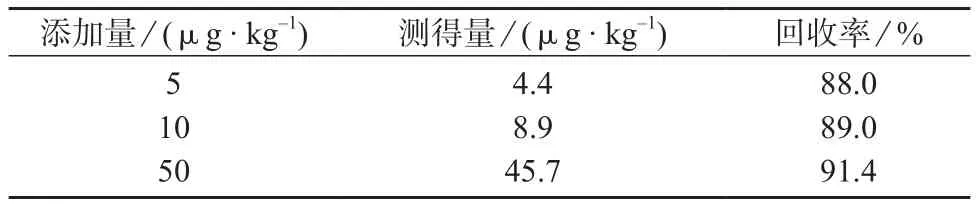
表4 加标回收试验结果(n=6)
3 结语
以乙腈作提取剂,经液相色谱–串联质谱法分析,建立了甘蓝中4-羟基百菌清残留的检测方法。该方法简单、快速、灵敏度高,确证性和实用性强,可作为甘蓝中4-羟基百菌清残留的确证定性和定量检测。
[1] 吴祥为. 百菌清重复施用在土壤中的残留特征及其土壤生态效应[D]. 杭州:浙江大学,2014.
[2] 汤宇恋. 百菌清和毒死蜱在设施作物中的分布与消解研究[D].杭州:浙江工业大学,2011.
[3] 黄慧俐. 几种农药在绿叶类和番茄类作物上的残留消解规律及残留量外推法研究[D]. 南宁:广西大学,2015.
[4] Chao Meng, Qin He, Junwei Huang, et al. Degradation of chlorothalonil through a hydrolytic dehalogenase secreted from Bacillus subtilis WB800[J]. International Biodeterioration & Biodegradation, 2015,104: 97–104.
[5] Malay Chaudhuri, Hafizi Zuhali, Augustine Chioma Affam. Degradation of pesticide chlorothalonil by visible light–responsive photocatalyst ferrioxalate and H2O2under solar irradiation[J]. International Journal of Photoenergy, 2013,2013(2): 101–107.
[6] Augustine Chioma Affam, Malay Chaudhuri. Degradation of pesticides chlorpyrifos, cypermethrin and chlorothalonil in aqueous solution by TiO2photocatalysis[J]. Journal of Environmental Management, 2013,130: 160–165.
[7] 李瑛,李学德,花日茂,等. 百菌清的生态环境效应及降解转化研究进展[J]. 安徽农业科学,2005,33(4): 703–704.
[8] Putnam R A, Nelson J O, Clark J M. The persistence and degradation of chlorothaonil and chlorpyrifos in a cranberry bog[J]. J. Agric Food Chem, 2003,51(1): 170–176.
[9] EPA–738–F–99–008 EPA R.E.D. FACTS Chlorothaonil[S/OL]. [2016–04–16]. https://www3.epa.gov/pesticides/chem_ search/reg_actions/reregistration/fs_PC–081901_1–Apr–99.pdf.
[10] Proposed Maximum Residue Limit PMRL2014–10, Chlorothalonil[S/OL]. [2016–09–13]. http://www.hc–sc.gc.ca/cps-spc/pest/ part/consultations/_pmrl2014–10/pmrl2014–10–eng.php.
[11] Agricultural and Veterinary Chemicals Code Instrument No.4 (MRL Standard) 2012[S/OL]. [2016–04–16]. https://www. legislation.gov.au/Details/F2014C01255.
[12] CODEX Alimentarius: Pesticide Detail[S/OL]. [2016–04–16]. http://www.fao.org/fao-who-codexalimentarius/standards/pestres/ pesticide-detail/en/?p_id=81.
[13] 纪淑娟,郭乃菲,齐小辉,等. 高效液相色谱法检测蔬菜中百菌清及其代谢产物的方法研究[J]. 食品工业科技,2011,32(7): 397–399.
[14] Kazos E A, Nanos C G, Stalikas C D, et al. Simultaneous determination of chlorothalonil and its metabolite 4-hydroxychlorothalonil in greenhouse air: dissipation process of chlorothalonil[J]. Chemosphere,2008,72(10): 1 413–1 419.
[15] Doorn C V, Vink M, Poll J M V D. Gas chromatographicdetermination of chlorothalonil and its metabolite 4-hydroxy-2,5,6-trichloroisophtalonitrile (HTI) in water[J]. Chromatographia, 1995,40(7–8): 458–462.
[16] Irani Mukherjee, Madhuban Gopal. Methodology for the estimation of chlorothalonil and its metabolite in mustard crop by gas liquid chromatography[J]. Fresenius' Journal of Analytical Chemistry, 1995,351(6): 590–591.
[17] GB/T 8855–2008 新鲜水果和蔬菜取样方法[S].
[18] GB/T 20769-2008 水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱–串联质谱法[S].
[19] AOAC Official Method 2007.01 Pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate[S/OL]. http://www.doc88.com/p–739755759078.html.
[20] European Communities. Implementing Council Directive 96/23/EC, Concerning the performance of analytical methods and the interpretation of results[J]. Official Journal of the European Communities, 2002,(L221): 8–36.
[21] GB/T 27404–2008 实验室质量控制规范食品理化检测[S].
Determination of 4-Hydroxychlorothalonil Residues in Cabbage by Liquid Chromatography–Tandem Mass Spectrometry
Wu Cheng1, Ren Hailei2, Zhao Zhiqiang1, Wang Lei1
(1. Shandong Station of Agro-environment Protection and Rural Energy, Jinan 250100, China;2. Yiyuan Agricultural Inspection and Testing Center, Yiyuan 256100, China)
The method for determination of 4-hydroxychlorothalonil residue in cabbage by liquid chromatography–tandem mass spectrometry was established. The sample was extracted with acetonitrile, electrospray negative ion source(ESI–), multiple reaction monitoring mode (MRM), matrix–matched and standard curve method were applied to samples analysis. The results showed that there was the good linear relationship(r=0.999) between chromatographic peak area and mass concentration of 4-hydroxychlorothalonil residue in cabbage, the linear range was 1.0–100 µg/L, the detection limit was 0.31 μg/kg,the quantification limit was 1.0 μg/kg. The method validation was carried out at 5,10,50 μg/kg, the recoveries were from 88.0% to 91.4%, and the relative standard deviations of determination results were from 4.6% to 7.2%(n=6). The methods is simple, accurate, rapid, sensitive and suitable for monitoring the maximum residue limit of 4-hydroxychlorothalonil in cabbage.
liquid chromatography–tandem mass spectrometry; 4-hydroxychlorothalonil; cabbage
O657.63
A
1008–6145(2016)06–0071-04
10.3969/j.issn.1008–6145.2016.06.017
联系人:吴成;E-mail: wucheng7745@sina.com
2016–09–21

