丹黄通脉方对大鼠颈动脉粥样硬化斑块稳定性的影响
齐 婧,王永刚,郑 刚,陈敏娜,罗 瑜,钟 伟,尚俊平
(1. 陕西中医药大学,陕西 咸阳 712046;2. 陕西中医药大学第二附属医院,陕西 咸阳 712000;3. 陕西省榆林市中医医院,陕西 榆林 719000)
论 著
丹黄通脉方对大鼠颈动脉粥样硬化斑块稳定性的影响
齐 婧1,2,王永刚1,2,郑 刚1,2,陈敏娜1,2,罗 瑜3,钟 伟1,2,尚俊平1,2
(1. 陕西中医药大学,陕西 咸阳 712046;2. 陕西中医药大学第二附属医院,陕西 咸阳 712000;3. 陕西省榆林市中医医院,陕西 榆林 719000)

目的 观察丹黄通脉方对颈动脉粥样硬化模型大鼠斑块稳定性的影响。方法将30只SD大鼠随机分为空白组、模型组、丹黄通脉方组,每组10只。空白组给予普通饲料喂养,模型组、丹黄通脉方组给予高脂复合饲料喂养,持续整个实验。除空白组外,其余2组在饲养1周后给予腹腔注射维生素D3制作模型。于第8周开始,丹黄通脉方组给予丹黄通脉方[10 mL/(kg·d)]灌胃,空白组及模型组给予等量蒸馏水灌胃,每天灌胃2次,连续6周。实验结束后,观察各组颈动脉病理形态学变化,测定内膜/中膜面积比及巨噬细胞阳性率。结果 光镜下观察结果显示,模型组血管内膜明显增厚,泡沫样细胞堆积,弹力纤维层不同程度破坏、断裂;丹黄通脉方组血管内膜稍增厚,可见少量泡沫样细胞形成,弹力纤维层稍紊乱,程度较模型组轻。丹黄通脉方组大鼠内膜/中膜面积比及巨噬细胞阳性率均明显低于模型组(P均<0.05)。结论 丹黄通脉方能够减少巨噬细胞在血管内膜的浸润,抑制血管内膜的增生,达到调控颈动脉粥样硬化形成和稳定斑块的作用。
丹黄通脉方;颈动脉粥样硬化;组织形态学;内膜/中膜面积比;巨噬细胞
动脉粥样硬化常可累及多处血管,如颈动脉、冠状动脉、主动脉、肾动脉等,是心脑血管疾病产生的病理基础,有20%~35%的颈动脉粥样硬化可导致缺血性脑中风的发生,颈动脉粥样硬化已严重危害人类的生命与健康;且颈动脉不稳定斑块脱落可导致患者快速致残致死,风险远远大于引起的颈动脉狭窄[1]。研究表明,斑块局部的巨噬细胞聚集促进了病变部位的炎性反应,增加斑块破裂和血栓形成的风险[2]。笔者前期研究表明丹黄通脉方防治颈动脉粥样硬化临床疗效确切[3]。本研究通过建立颈动脉粥样硬化大鼠模型,观察丹黄通脉方对颈动脉内膜增殖及粥样硬化中巨噬细胞的影响,以期进一步明确丹黄通脉方调控颈动脉粥样硬化形成和稳定斑块的作用机制。
1 实验资料
1.1 实验动物 清洁级雄性SD大鼠30只,体质量(120±10)g,购于第四军医大学动物实验中心,动物合格证号:SCXK-(军)2015-0014。适应性喂养1周(普通饲料,自由饮水),保持室温20~25 ℃。
1.2 药品与试剂 维生素D3注射液(上海通用药业股份有限公司,批号:121125);丙基硫氧嘧啶(广东华南药业集团有限公司,批号:120501);高脂复合饲料配方:76.5%基础饲料、10%蛋黄粉、8%猪油、4.8%食盐、0.5%胆盐、0.2%丙硫氧嘧啶(第四军医大学动物实验中心)。
1.3 丹黄通脉方制备 丹黄通脉方由陕西中医药大学第二附属医院药剂科制备。丹参、黄连、葛根、三七配比为2∶2∶1∶0.5,常规水煎煮,制备成含生药量1 g/mL的药液,备用。
1.4 分组及给药 将上述30只适应性喂养1周大鼠编号,采用随机数字表分为空白组、模型组、丹黄通脉方组,每组10只。空白组给予普通饲料喂养,模型组、丹黄通脉方组给予高脂复合饲料喂养,持续整个实验。除空白组外,其余2组参照文献[4]方法制作颈动脉粥样硬化模型,即在高脂复合饲料喂养当天给予腹腔注射维生素D360万IU/kg ,随后于第3,6,7周首日分别给予维生素D3腹腔注射10万IU/kg ,自由饮水。于第7周末,模型组、丹黄通脉方组各处死1只大鼠,取颈动脉行HE染色,镜下见内膜明显增厚,提示造模成功。于第8周开始,丹黄通脉方组给予丹黄通脉方[10 mL/(kg·g)]灌胃,空白组及模型组给予等量蒸馏水灌胃,每天灌胃2次,连续6周。
1.5 观察指标
1.5.1 组织病理形态学表现及内膜/中膜面积比 实验结束后,分别处死各组大鼠,立即取颈动脉置于4%多聚甲醛中固定24 h。经梯度乙醇脱水、二甲苯透明、常规石蜡包埋,备用。标本5 μm厚度连续切片,常规HE染色,中性树胶封片,光镜下观察。利用Quantiment520型计算机图像分析仪分别测量血管内膜和中膜横断面的面积,并计算内膜/中膜面积比。
1.5.2 巨噬细胞阳性率 标本切片常规脱蜡入水后,利用Envision法进行颈动脉巨噬细胞免疫组化染色,棕黄色染色为巨噬细胞阳性细胞,对每个样本中黄染最明显的部位进行细胞计数,计算阳性细胞率。

2 结 果
2.1 组织病理学表现 空白组血管内膜无增厚,内皮细胞紧贴弹力纤维层,弹力纤维层完整,中膜平滑肌细胞核呈梭形,见图1。模型组血管内膜明显增厚,泡沫样细胞堆积,弹力纤维层不同程度破坏、断裂,见图2。丹黄通脉方组血管内膜稍增厚,可见少量泡沫样细胞形成,弹力纤维层稍紊乱,程度较模型组轻,见图3。
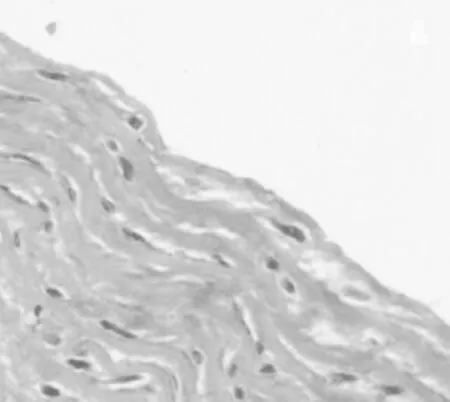
图1 空白组颈动脉HE染色表现(×200)

图2 模型组颈动脉HE染色表现(×200)
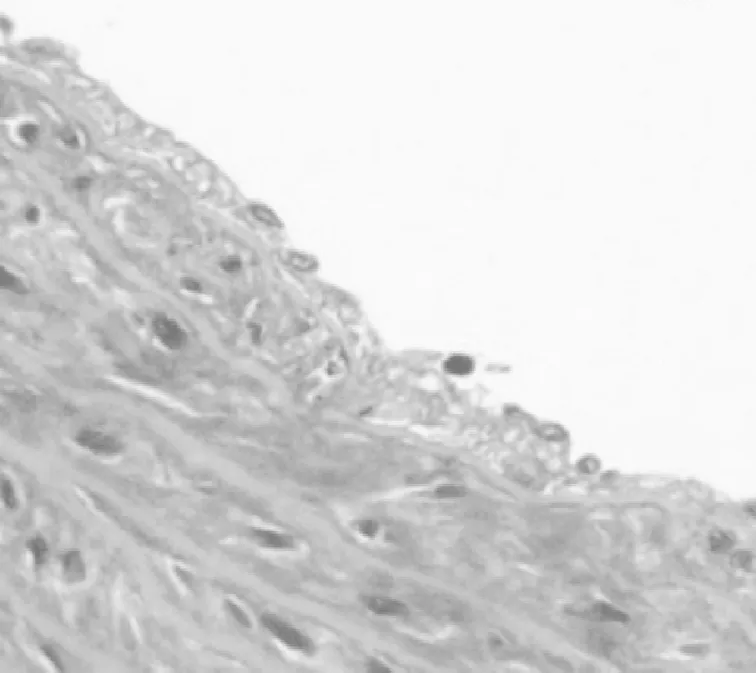
图3 丹黄通脉方组颈动脉HE染色表现(×200)
2.2 颈动脉内膜/中膜面积比 空白组内膜/中膜面积比为0,模型组为1.73±0.21,丹黄通脉方组为0.68±0.11。丹黄通脉方组内膜/中膜面积比明显低于模型组(P<0.05)。
2.3 巨噬细胞阳性率 空白组颈动脉内膜和中膜未见棕黄色的巨噬细胞,模型组及丹黄通脉方组血管内膜及中膜可见大量的阳性细胞。空白组巨噬细胞阳性率为0,模型组巨噬细胞阳性率为(67.39±2.53)%,丹黄通脉方组巨噬细胞阳性率为(32.12±3.29)%,丹黄通脉方组巨噬细胞阳性率明显低于模型组(P<0.05)。
3 讨 论
动脉粥样硬化(atherosclerosis ,AS)不仅是脂质的紊乱,同时也是一种慢性炎症性疾病[4]。在AS形成的最早期,由于机体摄取了大量的胆固醇引起血管内皮细胞受损,使循环血液中单核细胞受局部产生的化学趋附分子的吸引,迁移到血管内膜下,进而分化成巨噬细胞,巨噬细胞吞噬被氧化修饰的低密度脂蛋白转化成泡沫细胞,大量泡沫细胞聚集就形成了脂纹,进而引起内膜增厚[5]。因此,单核细胞源性巨噬细胞的聚集和增殖在AS发生、发展中起到重要作用,贯穿于整个疾病过程,已成为干预AS形成的重要作用途径和靶点[6]。研究表明,易损斑块与巨噬细胞有着非常密切的关系:一是巨噬细胞分泌基质金属蛋白酶(matrix metalloproteinase,MMPs)和趋化因子诱导MMPs表达,可降解和削弱帽状腱膜基质,导致斑块的不稳定[7-9];二是在多种趋化因子的作用下,使斑块局部的巨噬细胞聚集,促进了病变部位的炎性反应,增加斑块破裂和血栓形成的风险[10];三是活化巨噬细胞和趋化因子刺激多种生长因子如VEGF和PDGF的表达上调,使血管外膜的滋养管侵入内膜,导致内膜血管新生,使易损斑块的稳定性进一步降低[11-12]。
颈动脉粥样硬化属中医学中本虚标实、虚实夹杂之证,痰浊、瘀血、毒邪贯穿于该病的始末。颈动脉粥样硬化病位在血脉,痰浊停聚日久,阻碍经络、气血运行,血行滞涩,日久“毒”损脉络,进而阻痹脉管,形成粥样硬化斑块。近年来,中医药在动脉粥样硬化的防治领域取得了较大的进展[13-14]。有实验证实,中药能够一定程度减少粥样斑块中巨噬细胞数目,从而干预颈动脉粥样硬化的形成[15]。
丹黄通脉方由丹参、黄连、葛根、三七组成,具有活血解毒、消斑通脉的功效,能够降低颈动脉粥样硬化模型大鼠血清Hcy、CRP、TNF-α、ICAM-1及LDL-C水平,具有调节血脂代谢和抗炎作用[16-17]。本实验中,模型组内膜明显增厚,可见泡沫细胞堆积,丹黄通脉方组内膜增殖受到抑制,可见少量泡沫细胞,且内膜/中膜面积比明显低于模型组;模型组大鼠颈动脉内膜可见大量的巨噬细胞,丹黄通脉方干预后,巨噬细胞阳性表达率明显低于模型组。表明丹黄通脉方能够抑制血管内膜的增生,减少泡沫细胞数量及巨噬细胞在血管内膜的浸润,达到调控颈动脉粥样硬化形成和稳定斑块的作用。
[1] Daskalopoulou SS,Daskalopoulos ME,Perrea D,et al. Carotid artery atherosclerosis:what is the evidence for drug action?[J]. Curr Pharm Des,2007,13(11):1141-1159
[2] Nakagawa K,Chen YX,Ishibashi H,et al. Angiogenesis and its regulation:roles of vascular endothelial cell growth factor[J]. Semin Thromb Hemost,2000,26(1):61-66
[3] 王永刚,齐婧,郑刚,等. 丹黄通脉胶囊治疗颈动脉粥样硬化性狭窄的临床研究[J]. 中西医结合心脑血管病杂志,2012,10(4):445-447
[4] Hansson GK,Libby P. The immune response in atherosclerosis:a double-edged sword[J]. Nat RevImmunol,2006,6(7):508-519
[5] Mangge H,Hubmann H,Pilz S,et al. Beyond cholesterolinflammatory cytokines, the key mediators in atherosclerosis[J]. Clin Chem Lab Med,2004,42(5):467-474
[6] Choudhury RP,Lee JM,Greaves DR. Mechanisms of disease:macrophage-derived foam cells emerging as therapeutic targets in atherosclerosis[J]. Nat Clin Pract Cardiovasc Med,2005,2(6):309-315
[7] Gerszten RE,Mach F,Sauty A,et al. Chemokines,leukocytes,and atherosclerosis[J]. J Lab Clin Med,2000,136(2):87-92
[8] Heo SH,Cho CH,Kim HO,et al. Plaque rupture is a determinant of vascular events in carotid artery atherosclerotic disease:involvement of matrix metalloproteinases 2 and 9[J]. J Clin Neurol,2011,7(2):69-76
[9] Galis ZS,Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis:the good,the bad,and the ugly[J]. Circ Res,2002,90(3):251-262
[10] Newby AC. Matrix metalloproteinases regulate migration,proliferation,and death of vascular smooth muscle cells by degrading matrix and non-matrix substrates[J]. Cardiovasc Res,2006,69(3):614-624
[11] Pelisek J,Well G,Reeps C,et al. Neovascularization and angiogenic factors in advanced human carotid artery stenosis[J]. Circ J,2012,76(5):1274-1282
[12] 齐婧,王永刚,郑刚. 颈动脉粥样硬化性狭窄中医证候调查分析[J]. 陕西中医学院学报,2011,34(6):6-8
[13] 陈文强,黄小波,王宁群,等. 陈皮半夏对颈动脉硬化家兔血管细胞黏附分子-1及基质金属蛋白酶-9表达的影响[J]. 中国中医药信息杂志,2013,20(11):34-36
[14] 霍煜,梁卓,韩雅玲,等. 冠心舒通胶囊对ApoE-/-小鼠动脉粥样硬化斑块内MMP-9和TIMP-1表达的影响[J]. 中国动脉硬化杂志,2014,22(5):463-466
[15] 何国厚,艾志兵,刘勇,等. 小檗碱对兔颈动脉粥样硬化中内膜增生和巨噬细胞趋化作用的影响[J]. 中风与神经疾病杂志,2006,23(1):94-96
[16] 王永刚,齐婧,郑刚,等. 丹黄通脉方对颈动脉粥样硬化性狭窄模型大鼠脑血流量的影响[J]. 中医药导报,2012,18(10):16-18
[17] 王永刚,齐婧,车红磊,等. 丹黄通脉方对大鼠颈动脉粥样硬化性狭窄模型炎性反应的影响[J]. 陕西中医学院学报,2012,35(5):62-65
Effects of Dan Huang Tong Mai decoction on stability of plaques of carotid atherosclerosis in rats
QI Jing1,2, WANG Yonggang1,2, ZHENG Gang1,2, CHEN Minna1,2, LUO Yu3,ZHONG Wei1,2, SHANG Junping1,2
(1. Shaanxi University of Traditional Chinese Medicine, Xianyang 712046, Shaanxi, China;2. The Second Affiliated Hospital of Shaanxi University of Traditional Chinese Medicine,Xianyang 712000, Shaanxi,China;3. Yulin Hospital of Traditional Chinese Medicine,Yulin 719000, Shaanxi, China)
Objective It is to observe the effects of Dan Huang Tong Mai (DHTM) Decoction on stability of plaque of carotid atherosclerosis (AS)rats. Methods Thirty SD rats were randomly divided into blank group, model group and DHTM group, each group had 10 rats. The model group and DHTM group were established AS model through high-fat diet combined with intraperitoneal injection of vitamin D3, for 7 weeks to induce AS. The medication was carried out from the 8th week of the experiment and lasted for 6 weeks. At the end of the experiment,the pathological morphology of carotid artery, I/M and the ratio of macrophage were observed. Results Light microscope showed that the foam cells and endometrial were increased obviously, elastic fiber layer was damaged more or less in the model group compared with the blank control group, and the pathological changes were improved in the DHTM group. Compared with model group, I/M and the positive ratio of macrophage were lower in DHTM group(P<0.05). Conclusion Dan Huang Tong Mai Decoction may control carotid atherosclerosis progression, stabilizing vulnerable plaque, which may be associated with decrease the ratio of macrophage in intima and inhibit angiogenesis.
Dan Huang Tong Mai Decoction;carotid atherosclerosis;histomorphology;I/M;macrophage cell
齐婧,女,主治医师,从事中西医结合防治心脑血管病的临床和基础研究。
郑刚,E-mail:zhenggang2283@163.com
陕西省教育厅科学研究项目(14JK1192);陕西省中医药管理局中医药科研专项项目(13-JC001);陕西省科技统筹创新工程计划项目(2013KTCQ03-05);陕西省科技厅项目(2015JM8384)
10.3969/j.issn.1008-8849.2016.31.001
R-332
A
1008-8849(2016)31-3421-03
2016-05-05

