ADC值在子宫内膜癌与子宫粘膜下肌瘤鉴别诊断中的价值
刘建雄,林雅芳,江 敏,尚 祥
(福建医科大学附属宁德市医院放射科,福建 宁德 352100)
ADC值在子宫内膜癌与子宫粘膜下肌瘤鉴别诊断中的价值
刘建雄,林雅芳,江 敏,尚 祥
(福建医科大学附属宁德市医院放射科,福建 宁德 352100)
目的 探讨表观扩散系数(ADC)对子宫内膜癌与子宫粘膜下肌瘤鉴别诊断的价值。方法 对经手术病理证实的19例子宫内膜癌和7例子宫粘膜下肌瘤的ADC图像进行回顾性分析,全部病例均行扩散加权成像(DWI)、常规磁共振成像(MRI)平扫,17例子宫内膜癌和5例子宫粘膜下肌瘤行增强扫描,ADC值测定将感兴趣区(ROI)置于DWI呈高信号且在ADC图上呈相对低信号部位,取病灶最小ADC值,对同一病例于髂腰肌处以同样大小ROI测量3个ADC值,取其平均值。相对ADC值(rADC)取病灶最小ADC值与髂腰肌平均ADC值的比值,对两组病例的ADC值和rADC值分别行两独立样本近似t检验和t检验。结果 子宫内膜癌测得的最小ADC值范围为0.54~0.88×10-3mm2/s[(0.72±0.09)×10-3mm2/s〗,rADC值范围为0.36~0.68(0.55±0.10);子宫粘膜下肌瘤测得的最小ADC值范围为1.00~1.40×10-3mm2/s[(1.18±0.16)×10-3mm2/s],rADC值范围为0.61~1.12(0.92±0.17)。子宫内膜癌与子宫粘膜下肌瘤最小ADC值范围没有重叠。子宫内膜癌与子宫粘膜下肌瘤间的最小ADC值及rADC值差异均有统计学意义(t值分别为-7.301、-6.925,均P=0.000)。结论 ADC值的测量可以准确鉴别子宫内膜癌与子宫粘膜下肌瘤。
表观扩散系数;子宫内膜癌;子宫肌瘤;鉴别诊断
子宫内膜癌为女性生殖系统常见三大恶性肿瘤之一,国内发病率仅次于宫颈癌,在我国北京、广州等地区,已经跃居女性生殖系统恶性肿瘤发病率的首位[1]。在西方发达国家,该病位于妇科恶性肿瘤的首位。子宫肌瘤是女性生殖系统中最常见的良性肿瘤。子宫内膜癌与子宫粘膜下肌瘤均可表现为阴道出血等相似的临床症状,不易鉴别。但两者具有不同的治疗方式及截然不同的预后。即使是I期子宫内膜癌也必须行全子宫加双侧附件切除术[2]。随着宫腔镜的应用,不需要开腹手术就能切除子宫粘膜下肌瘤。因此术前对两种疾病做出准确的诊断对于手术方式的选择并减少手术的创伤及预后具有重要意义。磁共振成像(magnetic resonance imaging,MRI)对于鉴别子宫腔内良恶性肿瘤具有重要的作用,本研究对经病理证实的19例子宫内膜癌和7例子宫粘膜下肌瘤进行回顾性分析,通过比较两者的表观扩散系数(apparent diffusion coefficient,ADC)值与相对ADC(relative apparent diffusion coefficient,rADC)值,探讨其对两种疾病的诊断价值。
1材料与方法
1.1临床资料
子宫内膜癌19例,年龄47~80岁,平均年龄57.60岁,绝经后16例,未绝经3例,单纯平扫2例,平扫加增强17例,其中动态增强6例。子宫粘膜下肌瘤7例,年龄40~73岁,平均53.10岁,绝经后2例,未绝经5例,单纯平扫2例,平扫加增强5例,其中动态增强2例。
1.2磁共振成像检查设备及方法
采用GE 3.0T超导型临床医用磁共振扫描仪;平扫常规行横断位T1加权成像(T1WI)、脂肪抑制T2加权成像(T2WI)及扩散加权成像(diffusion weighted imaging,DWI),矢状位T2WI,冠状位脂肪抑制T2WI;增强扫描行横断位、冠状位及矢状位T1WI,造影剂采用上海博莱科莫迪司,剂量0.10mmol/kg,动态增强采用三维容积快速多期动态扫描(liver acquisition volume acceleration,LAVA)序列矢状位脂肪抑制T1WI。
1.3表观扩散系数值的测量及统计学分析
应用GE工作站行后处理,ROI避开病灶出血坏死区,置于DWI高信号且在ADC图上呈相对低信号部位,b值取800s/mm,ROI选择40~50mm2,分别测得病灶最小ADC值,在相同层面以同样大小感兴趣区(region of interest,ROI)测量正常髂腰肌得到3个ADC值,取其平均值。子宫粘膜下肌瘤组的ADC值和rADC值分别行两独立样本近似t检验和t检验。
2结果
2.1不同病变的磁共振成像平扫及增强表现
常规MRI上子宫内膜癌T1WI主要呈等信号,1例出现高信号,1例呈低信号,T2WI以稍高信号为主(图1c),1例呈等信号,1例呈低信号,脂肪抑制T2WI以高信号为主,2例呈等信号,动态增强呈速升速降型(图1e);子宫粘膜下肌瘤T1WI主要呈等信号,1例呈低信号,5例T2WI及脂肪抑制T2WI呈高低混杂信号(图2c),低信号和等信号各1例,动态增强呈速升平台型(图2e)。
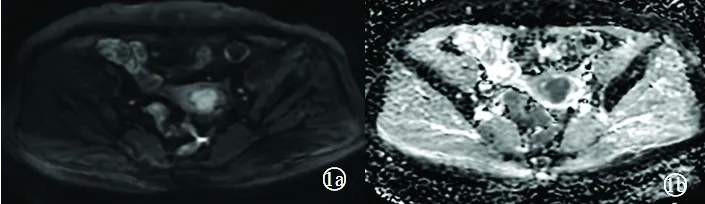
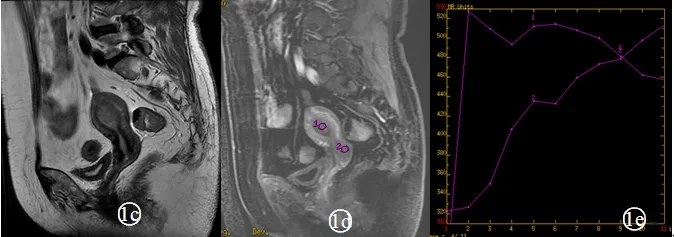
注:图1a DWI病灶呈高信号;图1b ADC病灶呈明显低信号;图1c 矢状位T2WI病灶呈稍高信号;图1d、1e为动态增强扫描,曲线为速升速降型。
图1 子宫内膜癌磁共振成像平扫及增强表现
Fig.1 MRI scan and enhanced performance of endometrial carcinoma
2.2扩散加权成像及表观扩散系数表现
子宫内膜癌DWI呈高信号(图1a),ADC图呈明显低信号(图1b),子宫粘膜下肌瘤DWI呈等/稍高信号(图2a),ADC图呈等/稍高信号(图2b),两者ADC值见表1。子宫内膜癌与子宫肌瘤的ADC值和rADC值分别行两独立样本近似t检验和t检验,均P=0.000;两组病例的ADC值及rADC值差异均有统计学意义(均P<0.05),见表1。
表1 子宫内膜癌与子宫肌瘤ADC值/rADC值比较

Table 1 Comparison of ADC and rADC values between endometrial carcinomas and submucous myomas
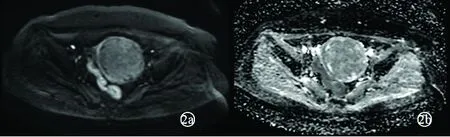

注:图2a DWI病灶呈等/稍高信号;图2b ADC病灶呈等/稍高信号;图2c 矢状位T2WI示病灶呈稍高/稍低信号;图2d、2e为动态增强扫描,曲线为速升平台型。
图2 子宫粘膜下肌瘤扩散加权成像及表观扩散系数表现
Fig.2 DWI and ADC performance of submucous myomas
3讨论
扩散加权成像(DWI)是目前检测活体组织中水分子扩散运动的最理想方法[3],能从分子水平上反映出与组织的含水量改变有关的形态学和生理学的早期改变。以往主要应用于运动因素影响较小的头部。随着磁共振技术的发展,DWI在腹盆腔的应用日益广泛。DWI在活体组织的扩散系数受温度、体液流动、细胞渗透性、毛细血管灌注和细胞膜通透性方向等许多微循环因素的影响,DWI信号中包含着T2穿透效应,单纯从DWI信号不能真正反映出活体组织的扩散受限情况,因此临床应用中常用ADC来替代扩散系数,ADC图不仅能消除T2穿透效应对信号的影响,真正反应水分子运动受限,而且通过ADC值的测量得到一个量化的标准。
3.1扩弥散加权成像及表观扩散系数与肿瘤的病理相关性
子宫内膜癌是妇科最常见的恶性肿瘤之一,来源于子宫内膜上皮。通常恶性肿瘤细胞生长旺盛,肿瘤细胞密集,核浆比高,细胞外间隙少,导致肿瘤内水分子扩散运动明显受限,在DWI图像上呈高信号[4]。肿瘤细胞核浆比是决定ADC值的一个主要因素,因为高核浆比限制了细胞内成份运动,因子宫内膜癌瘤细胞密集且核浆比高,同时细胞生物膜的限制和大分子物质如蛋白质对水分子的吸附作用也增强,这些因素造成细胞内外水分子弥散均受限,DWI上多呈高信号,相应ADC值较低[5]。
子宫肌瘤是女性生殖系统中最常见的良性肿瘤,按发生部位最常见为肌壁间肌瘤,再依次为粘膜下肌瘤和浆膜下肌瘤。镜下是由梭形的平滑肌细胞和纤维结缔组织所组成,排列成漩涡状或栅栏状,其细胞排列较子宫内膜癌疏松,核浆比低,因此细胞内外水分子弥散受限明显轻于子宫内膜癌,DWI多为等信号,相应ADC值较高。
3.2表观扩散系数值对子宫内膜癌和子宫粘膜下肌瘤鉴别诊断的价值
子宫内膜癌与子宫粘膜下肌瘤患者具有相似的临床表现,且两者在发病年龄上具有很大的重叠,超声常作为妇科疾病的首选检查方法,但因操作人员的经验水平不同而常不能对此两种病变作出明确的诊断,电子计算机断层扫描(computed tomography,CT)因其对软组组分辨率低的缺点,目前已不作为子宫疾病的常规检查方法,而MRI对软组织的分辨率高,且可多序列、多方位成像,与CT及超声相比具有明显优势。本组病例子宫膜内膜癌在T2WI大部分呈稍高信号,子宫粘膜下肌瘤在T2WI大部分呈高、低混杂信号,似乎可以将两者鉴别开来,但是仅肉眼观察两者的信号区别,不同人可能会得出不同的结论,且不同的窗宽、窗位亦会影响信号的观察,而ADC测量得到具体数值,能获得一个量化的标准,对两者的鉴别更加准确。
国内学者刘长宏等[6]测量32例子宫内膜癌和19例子宫良性病变的ADC平均值分别为(0.978±0.185)×10-3mm2/s和(1.423±0.189)×10-3mm2/s,王琨华[7]测得的29例子宫内膜癌和9例子宫内膜良性病变患者的ADC平均值分别为(0.96±0.22)×10-3mm2/s和(1.33±0.18)×10-3mm2/s;国外学者Karakas等[8]测量10例子宫内膜癌和15例子宫粘膜下肌瘤的ADC平均值分别为(0.734±0.154)×10-3mm2/s和(1.102±0.243)×10-3mm2/s。本研究中子宫内膜癌和子宫粘膜下肌瘤测得的ADC值范围分别为0.54~0.88×10-3mm2/s[(0.72±0.09)×10-3mm2/s]和1.00~1.40×10-3mm2/s[(1.18±0.16)×10-3mm2/s],ADC平均值均明显低于国内文献报道,与Karakas等[8]报道相仿。Fujii等[9]研究发现,当选取ADC值为1.15×10-3mm2/s,其鉴别子宫腔内良恶性肿瘤的敏感度、特异度和准确率分别为84.6%、100%和92%。如果按Fujii等的标准,本组只有3例子宫内膜癌达到诊断标准,准确率只有43%。本研究测得的ADC值小于国内研究,考虑与本研究是取最小ADC值而国内学者是测量多个位置的ADC值并取平均值进行统计有关。本研究所得两种肿瘤最小ADC值范围没有重叠,取ADC值0.89~1.00×10-3mm2/s之间为界值,对于鉴别两种肿瘤的准确性为100%。本研究测得的子宫内膜癌和子宫粘膜下肌瘤的rADC值范围分别为0.36~0.68(0.55±0.10)和0.61~1.12(0.92±0.17),两者间有重叠,但仍有统计学意义(P<0.05)。
本研究的不足之处在于子宫粘膜下肌瘤样本量少,对不同分期的子宫内膜癌没有进一步进行分期比较。总之,磁共振扩散加权成像作为检测活体组织中水分子扩散运动的最理想方法,通过ADC值的测量可以准确鉴别子宫内膜癌与子宫粘膜下肌瘤,是一种可靠与简便易行的定量方法,值得在临床上推广应用。
[1]黄平,向群,刘媛玲.子宫内膜采集器在液基细胞学联合组织学筛查子宫内膜癌中的应用[J] .中国妇幼健康研究,2016,27(5):631-633.
[2]陆欣怡,倪观太.早期子宫内膜癌的外科治疗[J].国际妇产科学杂志,2015,42(6):612-615.
[3]刘建雄,曹代荣,邢振,等.ADC值在后颅窝髓母细胞瘤与室管膜瘤鉴别诊断中的价值研究[J].中国CT和MRI杂志,2011,9(3):5-7.
[4]Rechichi G,Galimberti S,Signorelli M,etal.Endometrial cancer: correlation of apparent diffusion coefficient with tumor grade, depth of myometrial invasion, and presence of lymph node metastases[J].AJR Am J Roentgenol,2011,197(1):256-262.
[5]邓凯,王文文,张成琪,等.磁共振扩散加权成像在鉴别子宫内膜良恶性病变中的价值[J].中国医疗设备,2014,29(2):161-163.
[6]刘长宏,汪俊萍,张云亭,等.MR扩散加权成像对宫腔良恶性病变的鉴别诊断价值[J].放射学实践,2011,26 (11):1193-1196.
[7]王琨华,郭启勇.正常子宫内膜和子宫内膜癌的扩散加权成像特点[J].医学影像学杂志,2012, 22 (3):440-444.
[8]Karakas O, Karakas E,Dogan F,etal.Diffusion-weighted MRI in the differential diagnosis of uterine endometrial cavity tumors[J].Wien Klin Wochenschr,2015,127(7-8):266-273.
[9]Fujii S,Matsusue E,Kigawa J,etal.Diagnostic accuracy of the apparent diffusion coefficient in differentiating benign from malignant uterine endometrial cavity lesions:initial results[J].Eur Radiol,2008,18(2):384-389.
[专业责任编辑:安瑞芳]
Value of ADC on differential diagnosis of endometrial carcinoma from submucous myomas
LIU Jian-xiong, LIN Ya-fang, JIANG Min, SHANG Xiang
(Department of Image, the Affiliated Ningde Municipal Hospital of Fujian Medical University, Fujian Ningde 352100, China)
Objective To evaluate the value of apparent diffusion coefficient (ADC) on differential diagnosis of endometrial carcinoma from submucous myomas. Methods The ADC images of 19 cases of endometrial carcinomas and 7 cases of submucous myomas histologically proved were reviewed retrospectively. All patients were examined with diffusion weighted imaging (DWI) and conventional MRI, and 17 endometrial carcinomas and 5 submucous myomas examined with enhanced MRI . Through ADC value detecting, region of interest (ROI) were set in DWI with high signal and located at relatively low signal regions in ADC map. The minimum ADC value of the lesion was sampled. The average of three ADC values measured with the same size of ROI at psoas of the same case was recorded. The relative ADC value (rADC) was the ratio between the minimum ADC value and average ADC value at psoas. The ADC values and rADC values in two groups were compared with independent samples by usingt’-test andt-test. Results The range of minimum ADC values on endometrial carcinomas and submucous myomas were 0.54-0.88×10-3mm2/s [(0.72±0.09)×10-3mm2/s] and 1.00-1.40×10-3mm2/s[(1.18±0.16)×10-3mm2/s] respectively, and the range of rADC values were 0.36-0.68(0.55±0.10) and 0.61-1.12 (0.92±0.17) respectively. There was no overlap in minimum ADC values between endometrial carcinomas and submucous myomas. ADC and rADC values were statistically different between endometrial carcinomas and submucous myomas (tvalue was -7.301 and -6.925, respectively, bothP=0.000). Conclusion Assessment of ADC values can differentially diagnose endometrial carcinomas from submucous myomas accurately.
apparent diffusion coefficient (ADC); endometrial carcinoma; uterine myomas; differential diagnosis
2016-06-08
刘建雄(1975-),男,副主任医师,硕士,主要从事医学影像与介入治疗研究。
10.3969/j.issn.1673-5293.2016.10.037
R711.7
A
1673-5293(2016)10-1278-03

