Skp2和PTEN在上皮性卵巢肿瘤组织中的表达及临床意义
张 芳,唐 密,王建辉
(湖南省妇幼保健院,湖南 长沙 410008)
Skp2和PTEN在上皮性卵巢肿瘤组织中的表达及临床意义
张 芳,唐 密,王建辉
(湖南省妇幼保健院,湖南 长沙 410008)
目的 研究S期激酶相关蛋白2(Skp2)和PTEN蛋白在上皮性卵巢肿瘤组织中表达,探讨其临床病理学意义及在肿瘤发生发展中作用。方法 收集129例上皮性卵巢肿瘤石蜡标本(良性35例、交界性32例、恶性62例),免疫组化法检测Skp2 及PTEN蛋白的表达水平,分析两者表达、临床病理参数关系及其相互关系。结果 ①Skp2在良性及交界性肿瘤中表达阴性,分别为(0/35,0/32),在卵巢癌中阳性率40.32%(25/62),其在卵巢癌表达水平明显高于良性和交界性肿瘤(χ2值分别为8.25、6.72,均P<0.05);②PTEN蛋白在良性及交界性肿瘤阳性率分别为82.86%(29/35)、59.38%(19/32),在卵巢癌阳性率40.32%(25/62),明显低于良性和交界性肿瘤(χ2值分别为11.15、9.23,均P<0.05);③Skp2、PTEN蛋白在卵巢癌的表达在不同年龄、是否绝经及不同组织学类型中无显著性差异(χ2值分别为1.01、0.04、0.21,P>0.05)。Skp2在卵巢癌Ⅲ~Ⅳ期、中低分化组及有淋巴结转移组表达明显高于Ⅰ~Ⅱ期、高分化组及无淋巴结转移组(χ2值分别为10.05、11.21、8.54,均P<0.05),PTEN在卵巢癌Ⅲ~Ⅳ期、中低分化组及有淋巴结转移组表达低于Ⅰ~Ⅱ期、高分化组及无淋巴结转移组(χ2值分别为8.23、12.15、7.65,均P<0.05);④Skp2和PTEN蛋白在卵巢癌中的表达呈负相关(r=-0.321,P<0.05)。结论 Skp2表达上调与PTEN下调可能在上皮性卵巢肿瘤的发生、发展中起重要作用。检测Skp2和PTEN表达水平可能对卵巢癌预后分析有一定指导意义。
S期激酶相关蛋白2;PTEN蛋白;上皮性卵巢癌组织;免疫组化
卵巢恶性肿瘤是女性生殖器官最常见肿瘤之一,由于病因不明,缺乏早期症状及特异性肿瘤标志物,故难以早发现、早治疗,死亡率一直高居妇科恶性肿瘤之首。近年随着肿瘤分子遗传学和分子生物学的发展,研究发现基因变异、蛋白表达异常是肿瘤发生、发展的基础。本实验应用免疫组化方法研究S期激酶相关蛋白2(s.phaseklnase-associatedprotein-2,Skp2)和PTEN(phosphatase and tensin homolog deleted on chromosometen,PTEN)蛋白在卵巢上皮性肿瘤(良性、交界性、恶性)的表达,分析其表达水平与卵巢癌临床病理参数之间的关系,探讨两者在上皮性卵巢癌发生发展中的作用及相互间关系。
1材料与方法
1.1临床资料
选取湖南省妇幼保健院2008年1月至2013年9月上皮性卵巢肿瘤标本存档蜡块129例,患者年龄21~71岁,中位年龄54岁,术前未行化疗、放疗,术后经病理确诊。其中良性肿瘤35例(浆液性囊腺瘤21例,粘液性囊腺瘤14例),交界性肿瘤32例(交界性浆液性囊腺瘤23例,交界性粘液性囊腺瘤9例),上皮性卵巢癌62例。按国际妇产科联盟(international fedration of gynecology and obstetrics,FIGO)分期世界卫生组织(World Health Organization,WHO)分化标准:Ⅰ期9例,Ⅱ期10例,Ⅲ期36例,Ⅳ期7例,其中浆液性囊腺癌39例(G1:19例,G2:16例,G3或G 4: 4例),粘液性囊腺癌10例(G1:4例,G2:4例,G3或G 4:2例),子宫内膜样癌7例(G1:2例,G2:3例,G3或G 4: 2例), 透明细胞癌6例(G1:2例,G2:3例,G3或G 4:1例),常规固定、包埋,行苏木精-伊红染色(hematoxylin-eosin staining,HE)和免疫组织化学染色。
1.2主要试剂
一抗Skp2鼠抗人单克隆抗体(浓度为1:50)购自美国Zymed公司, PTEN鼠抗人单克隆抗体(浓度为1:100)、DAB显色液购自上海瑞奇生物科技有限公司。
1.3方法
采用S-P 免疫组化,操作严格按说明书进行。阴性对照以PBS代替一抗作空白对照,阳性对照用己知阳性片为对照。判断标准为Skp2和PTEN均以细胞核出现棕黄色或黄褐色颗粒为阳性。病变处随机选取至少5;(+):阳性细胞数5%~49%;(++):阳性细胞数≥50%,由两位有经验病理医师双盲法进行评估。
1.4统计学方法
使用SPSS 16.0统计软件进行统计学分析。率的比较采用χ2检验和Fisher精确概率法,相关性采用Spearman等级相关分析,以P<0.05认为差异有统计学意义。
2结果
2.1S期激酶相关蛋白2、PTEN蛋白在良性、交界性、上皮性卵巢癌组织中表达
Skp2在良性及交界性肿瘤中表达阴性,在卵巢癌中阳性率40.32%(25/62),表达水平显著高于良性(χ2=8.25,P<0.05)和交界性肿瘤(χ2=6.72,P<0.05)。良性、交界性及卵巢癌组中PTEN蛋白阳性表达率分别为82.86%(29/35)、59.38%(19/32)和40.32%(25/62)。卡方检验组间差异有统计学意义(χ2=16.626,P=0.00),见图1、图2和表1。
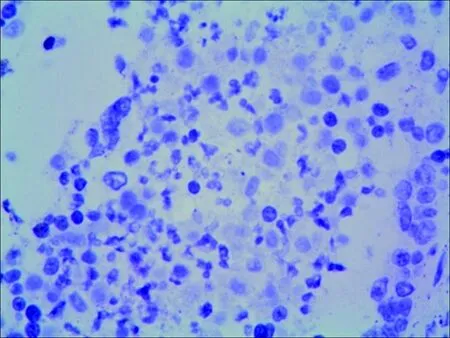
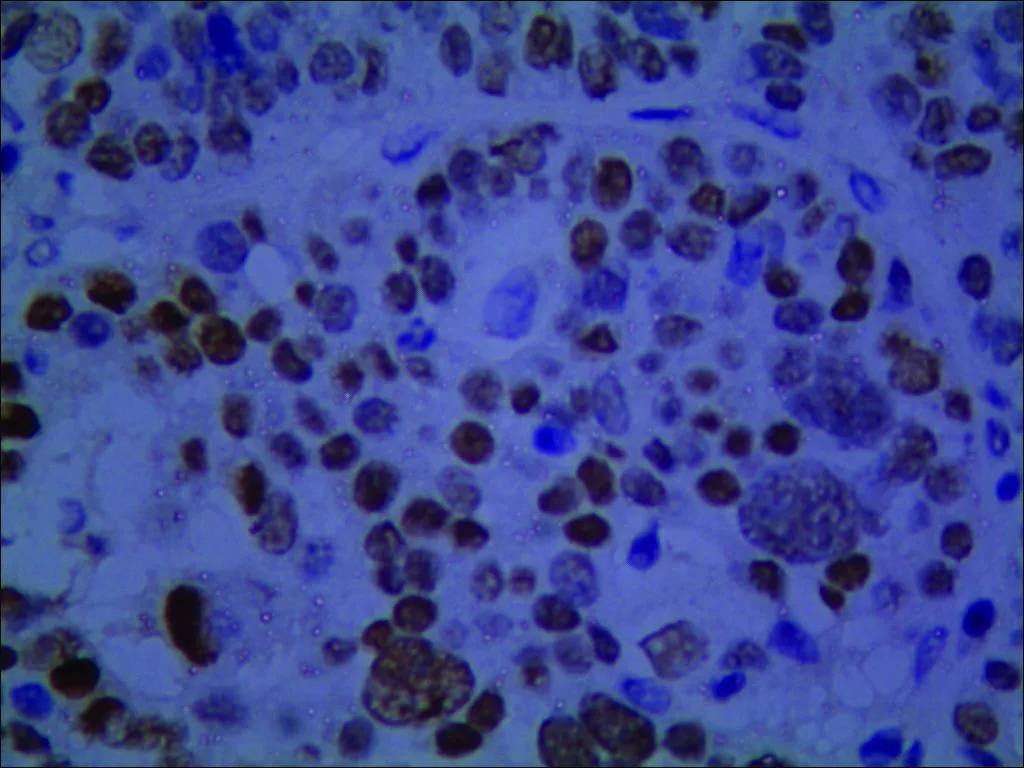
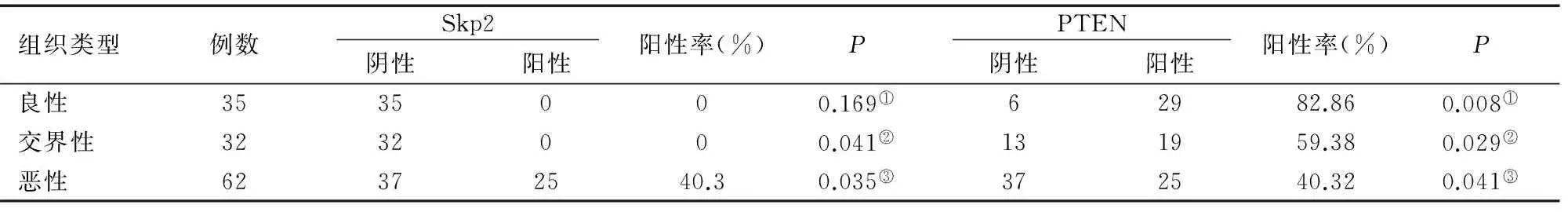
组织类型例数 Skp2 阴性阳性阳性率(%)P PTEN 阴性阳性阳性率(%)P良性3535000.169①62982.860.008①交界性3232000.041②131959.380.029②恶性62372540.30.035③372540.320.041③
注:①表示良性卵巢肿瘤与交界性上皮性卵巢肿瘤比较;②表示交界性上皮性卵巢肿瘤和卵巢上皮性癌比较;③表示卵巢上皮性癌与良性卵巢肿瘤比较。
2.2 S期激酶相关蛋白2、PTEN蛋白表达与上皮性卵巢癌临床病理关系
Skp2、PTEN在卵巢癌中表达与患者年龄、是否绝经及组织类型无明显关系(χ2值分别为1.01、0.04、0.21,均P>0.05),而与分期、组织分化程度及有无淋巴结转移有显著相关性(χ2值分别为12.05、9.65、7.98,均P<0.05),Skp2在Ⅲ~Ⅳ期、中低分化组及有淋巴结转移组阳性率分别(55.81%,74.29%,68.75%),明显高于I~II期、高分化组及无淋巴结转移组(21.05%,37.03%,47.73%)(χ2值分别为10.05、11.21、8.54,均P<0.05)。而PTEN则相反,在Ⅲ~Ⅳ期、中低分化组及有淋巴结转移组阳性率(39.53%,31.43%,43.75%)明显低于Ⅰ~Ⅱ期、高分化组及无淋巴结转移组(68.42%,44.44%,59.09%)(χ2值分别为8.23、12.15、7.65,均P<0.05),见表2。
表2 Skp2 PTEN蛋白表达与上皮性卵巢癌临床病理的关系(n)
Table 2 Expressions of Skp2 and PTEN and their clinicopathologic relationship with epithelial ovarian cancer(n)
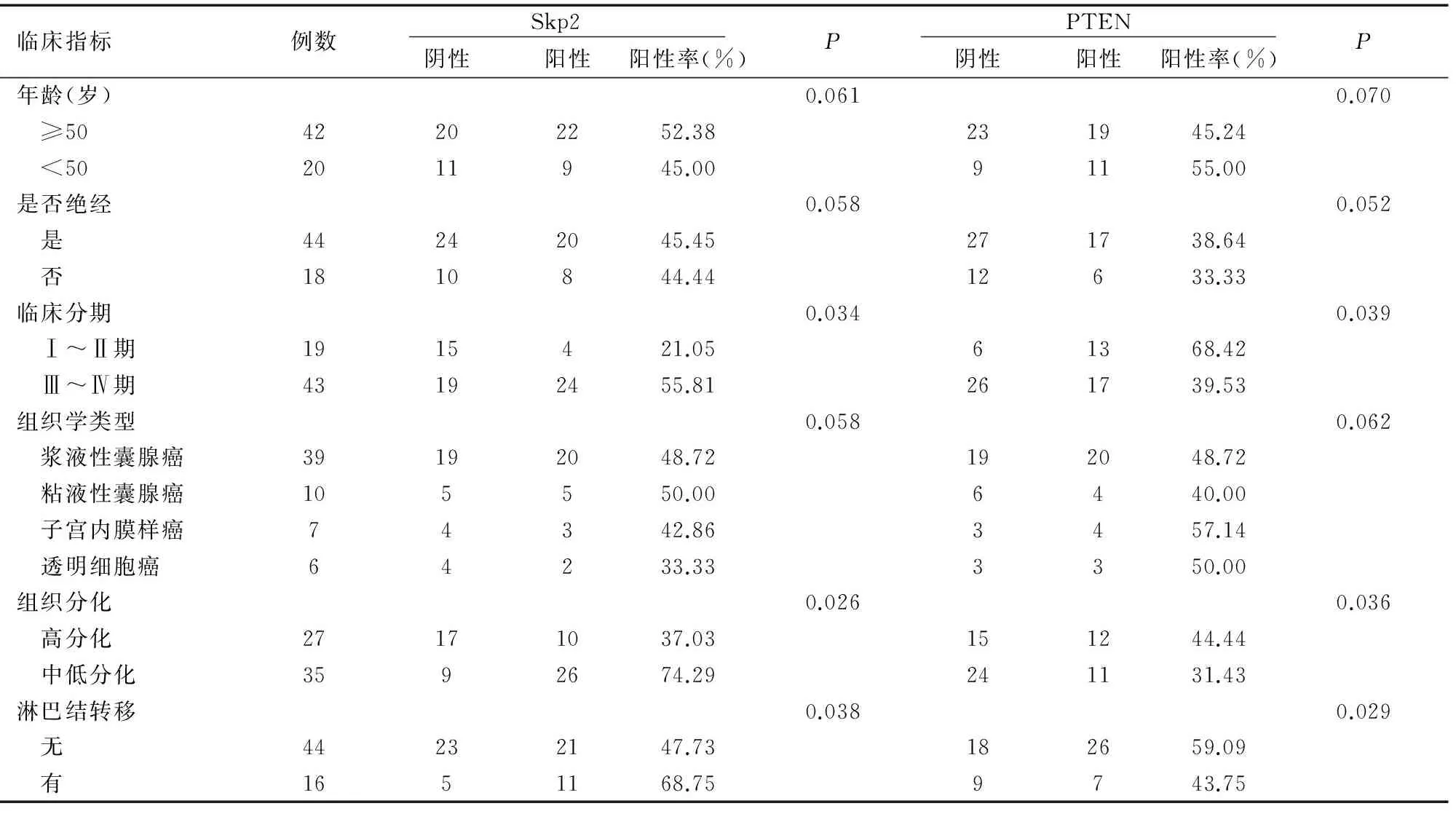
临床指标例数 Skp2 阴性阳性阳性率(%)P PTEN 阴性阳性阳性率(%)P年龄(岁)0.0610.070 ≥5042202252.38231945.24 <502011945.0091155.00是否绝经0.0580.052 是44242045.45271738.64 否1810844.4412633.33临床分期0.0340.039 Ⅰ~Ⅱ期1915421.0561368.42 Ⅲ~Ⅳ期43192455.81261739.53组织学类型0.0580.062 浆液性囊腺癌39192048.72192048.72 粘液性囊腺癌105550.006440.00 子宫内膜样癌74342.863457.14 透明细胞癌64233.333350.00组织分化0.0260.036 高分化27171037.03151244.44 中低分化3592674.29241131.43淋巴结转移0.0380.029 无44232147.73182659.09 有1651168.759743.75
2.3 S期激酶相关蛋白2、PTEN蛋白表达在卵巢上皮性癌中的相关性
对62例卵巢上皮性癌中Skp2和PTEN的表达率进行相关分析,结果显示Skp2与PTEN的表达呈显著负相关(r=-0.321,P<0.05)。
3讨论
随着分子生物学、细胞信号传导通路的深入研究,认为肿瘤发生均为细胞周期调控机制紊乱,细胞恶性克隆。本研究通过免疫组化方法,检测卵巢上皮性肿瘤的Skp2和PTEN蛋白表达,分析两者与临床病理因素间关系及表达相关性,探讨其在卵巢癌发生进展过程中的作用。
3.1 S期激酶相关蛋白2在卵巢上皮性癌中的表达及意义
F-box蛋白Skp2由zhang等1995年首次克隆,发现胞内注射P45抗体或反义寡核酸能阻断P45功能,阻止细胞进入S期,因其可与细胞周期蛋白CyclinA相互作用,从而被命名为Skp2。Skp2基因定位于人5号染色体短臂上,由436个氨基酸残基构成。
细胞周期指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为五期:即G0期(静息期),G1(DNA合成前期),S(DNA合成期),G2(DNA合成后期),M(有丝分裂期)。控制细胞分裂过程主要有两个限制点,即G1/S点(控制细胞从G1期进入S期,)和G2/M点(细胞一分为二的控制点)。Skp2正常表达时,细胞在分裂时的G1/S期CKI-P27kipl泛素化降解过程可正常进行[1-2]。但若Skp2蛋白过度表达,则细胞无限制通过G1/S期“限制点”,导致细胞无限制分裂, 最终形成恶性克隆。因此,Skp2过度表达与癌发生密切相关。
本研究结果显示在卵巢良性、交界性肿瘤组中,Skp2表达均为阴性,而在恶性组中却有不同程度的表达(25/62),两者比较有显著差异。其次,Skp2表达与年龄、组织学分型无显著性相关(P>0.05),却与卵巢癌的病理分级、临床分期有密切关系。在不同临床分期、组织分化及有无淋巴结转移组中,Ⅲ~Ⅳ期、中低分化组及有淋巴结转移组明显高于Ⅰ~Ⅱ期、高分化组及无淋巴结转移组(P<0.05)。提示临床期别越晚,组织分化越差,Skp2过度表达,细胞分裂无限制通过“限制点”,形成恶性增殖,最终促进卵巢癌的发生与进展。
3.2PTEN在上皮性卵巢癌中的表达及意义
Li等于1997年研究原发性乳腺癌第10q23染色体的同源性丢失区,分离得到一种新的基因,命名为PTEN。PTEN全长约200kb,含有9个外显子和8个内含子。研究发现PTEN可使PIP3脱3`磷酸,丧失PIP3第二信使作用,抑制PI3K/AKT信号传导通路,使细胞有丝分裂阻滞在Gl期,因此与肿瘤发生、进展关系密切[3]。Schondorf等2003年对20例原发卵巢癌及复发病例进行研究,结果显示,PTEN随卵巢癌病理分级、临床分期,表达水平逐渐下降,提示PTEN表达与细胞分化程度密切相关。Martins等[4]研究也得出同样结论。本实验通过测定PTEN表达,发现正常卵巢组织中阳性表达率显著高于癌组织。推测这种表达缺失可能是卵巢癌发生发展的分子基础。本实验显示PTEN在Ⅲ~Ⅳ期、中低分化组及有淋巴结转移组阳性率(39.53%,31.43%,43.75%)明显低于I~II期、高分化组及无淋巴结转移组(68.42%,44.44%,59.09%)(P<0.05),考虑与PTEN对肿瘤细胞增殖抑制作用有关,说明PTEN基因表达降低使其抑制细胞恶性克隆的能力下降,从而促进卵巢癌的发生。有淋巴结转移卵巢癌组织中PTEN蛋白阳性表达率显著降低,显示PTEN表达水平下降与肿瘤细胞浸润、转移有关。
3.3卵巢上皮性癌中S期激酶相关蛋白2与PTEN蛋白表达的相关性
Lotan 等[5]对108例前列腺癌进行研究,发现抑癌基因PTEN与Skp2明显负相关,推测PTEN对Skp2表达有负调节作用。本实验中卵巢癌Skp2与PTEN表达呈负相关(P<0.05),研究结论与上述文献一致,Skp2表达越高,则PTEN表达相应降低,推测卵巢癌Skp2表达升高与PTEN表达缺失及突变有关,可能Skp2过度表达促进了p27的泛素化降解,使p27表达降低,从而失去对细胞周期的调控,二者共同作用促进了卵巢癌的发生和发展。
总之,Skp2高表达和PTEN的低表达在卵巢上皮性癌的发生、发展中发挥重要作用。PTEN和Skp2蛋白联合检测有助于临床判断卵巢癌恶性程度。但Skp2与PTEN的表达之间是否还存在分子细胞水平调控还有待深入研究。近年有学者提出,可将抑制Skp2、同时上调PTEN蛋白表达作为肿瘤治疗的新靶点,但其能否有效用于临床治疗还有待于进一步探索、研究。
[1]Chan C H,Morrow J K,Li,C F,etal.Pharmacological inactivation of Skp2 SCF ubiquitin ligase restricts cancer stem cell traits and cancer progression[J].Cell,2013,154(3):556-568.
[2]Nogueira V,Sundararajan D,Kwan J M,etal.Akt-dependent Skp2 mRNA translation is required for exiting contact inhibition,oncogenesis,and adipogenesis[J].EMBO J,2012,31(5):1 134-1 146.
[3]Wu K L,Wu C A,Wu C W,etal.Redox-sensitive oxidation and phosphorylation of PTEN contribute to enhanced activation of PI3K/Akt signaling in rostral ventrolateral medulla and neurogenic hypertension in spontaneously hypertensive rats[J].Antioxid Redox Signal,2013,18(1):36-50.
[4]Martins F C,Santiago Id, Trinh A,etal.Combined image and genomic analysis of high-grade serous ovarian cancer reveals PTEN loss as a common driver event and prognostic classifier[J].Genome Biol,2014,15(12): 526.
[5]Lotan T L, Gurel B, Sutcliffe S,etal.PTEN protein loss by immunostaining: analytic validation and prognostic indicator for a high risk surgical cohort of prostate cancer patients[J].Clin Cancer Res,2011,17(20):6563-6573.
[专业责任编辑:张冠军]
Expressions of Skp2 and PTEN in epithelial ovarian tumors and their clinical significance
ZHANG Fang, TANG Mi, WANG Jian-hui
(Maternal and Child Health Hospital of Hunan Province, Hunan Changsha 410008, China)
Objective To investigate the expressions of Skp2 and PTEN in epithelial ovarian tumors and explore their clinicopathologic significance as well as the role in genesis of tumor. Methods Skp2 and PTEN protein expressions were examined by immunohistochemistry in 129 epithelial ovarian tumors (35 cases of adenomas, 32 cases of tumors of borderline, and 62 cases of denocarcinomas. The expressions of two, clinicopathologic parameters and their relationship were analyzed. Results Positive rate of Skp2 both in ovarian adenoma and borderline adenoma was 0 (0/35, 0/32), and the positive rate in ovarian adenocarcinoma was 40.32% (25/62), which was significantly higher than in ovarian adenoma and borderline adenoma (χ2value was 8.25 and 6.72, respectively, bothP<0.05). Positive rate of PTEN in ovarian adenoma and borderline adenoma was 82.86% (29/35) and 59.38% (19/32), respectively, and that in ovarian adenocarcinoma was 40.32% (25/62), which was significantly lower than in ovarian adenoma and borderline adenoma (χ2value was 11.15 and 9.23, respectively, bothP<0.05). The expression levels of Skp2 and PTEN were independent of age, menopause and histological type (χ2value was 1.01, 0.04 and 0.21, respectively, allP>0.05). The expression of Skp2 was remarkably higher in ovarian cancer at Ⅲ-Ⅳ stage, moderately and poorly differentiated group and lymph node metastasis group than in ovarian cancer at Ⅰ-Ⅱ stage, higher differentiated group and no lymph node metastasis group (χ2value was 10.05, 11.21 and 8.54, respectively, allP<0.05), but PTEN was lower (χ2value was 8.23, 12.15 and 7.65, respectively, allP<0.05). The expression of Skp2 was negatively correlated with that of PTEN (r=-0.321,P<0.05). Conclusion Up-regulation of Skp2 and down-regulation of PTEN may play an important role in the genesis and development of epithelial ovarian tumors. Detecting the expression levels of Skp2 and PTEN might have value on analyzing the prognosis of ovarian cancer.
s.phaseklnase-associatedprotein-2 (Skp2); phosphatase and tensin homolog deleted on chromosometen (PTEN); epithelial ovarian cancer; immunohistochemistry
2016-08-22
张 芳(1973-),女,副主任医师,硕士,主要从事妇科临床工作。
10.3969/j.issn.1673-5293.2016.10.017
R711.7
A
1673-5293(2016)10-1217-04

