脂质体阿霉素治疗非霍奇金淋巴瘤的临床疗效与安全性研究
林志兰
【摘要】 目的:探究脂质体阿霉素治疗非霍奇金淋巴瘤的临床效果与安全性。方法:选取2015年1月-2016年5月本院收治的非霍奇金淋巴瘤患者182例作为研究对象,随机分为对照组91例和试验组91例,对照组采用阿霉素治疗,试验组采用静脉滴注脂质体阿霉素治疗。治疗6周后,比较两组临床疗效与不良反应情况。结果:试验组临床疗效高于对照组,不良反应发生率低于对照组,比较差异均有统计学意义(P<0.05)。结论:脂质体阿霉素在非霍奇金淋巴瘤的治疗中具有较好的临床效果,患者不良反应出现率较低,安全性较好。
【关键词】 脂质体阿霉素; 非霍奇金淋巴瘤; 临床疗效; 安全性
【Abstract】 Objective:To explore the clinical efficacy and safety of liposome Doxorubicin in the treatment of patients with non-hodgkin lymphoma cancer.Method:From January 2015 to May 2016,182 cases of non-hodgkin lymphoma cancer in our hospital were selected as the research objects,they were randomly divided into 91 cases of the control group and 91cases of the experimental group,the control group were treated with intravenous drip of Doxorubicin and the experimental group were treated with intravenous drip of liposome Doxorubicin.After 6 weeks of treatment,the clinical efficacy and adverse reactions of two groups were compared.Result:The clinical efficacy of the experimental group was higher than that of the control group,the incidence of adverse reaction was lower than that of the control group,the differences were statistically significant(P<0.05).Conclusion:There is a high clinical efficacy of liposome Doxorubicin in the treatment of non-hodgkin lymphoma cancer,has low adverse reaction rate and good security.
【Key words】 Liposome Doxorubicin; Non-hodgkin lymphoma cancer; Clinical efficacy; Safety
First-authors address:The First Peoples Hospital of Huizhou City,Huizhou 516000,China
doi:10.3969/j.issn.1674-4985.2016.30.025
非霍奇金淋巴瘤属于淋巴系统类疾病,该疾病会引起淋巴系统的恶性增殖,严重影响着患者的生命健康安全,且该病症具有较高的死亡率[1-2]。目前临床上,脂质体阿霉素是用于治疗非霍奇金淋巴瘤病症的一线药物,但同时发现该药物在使用过程中对患者具有较强的毒副作用,因此脂质体阿霉素的安全性是否能够保证仍值得探讨[3-4]。本研究通过采用不同药物对非霍奇金淋巴瘤患者进行治疗,研究其临床疗效与安全性,旨在为非霍奇金淋巴瘤的临床治疗提供借鉴资料,现报道如下。
1 资料与方法
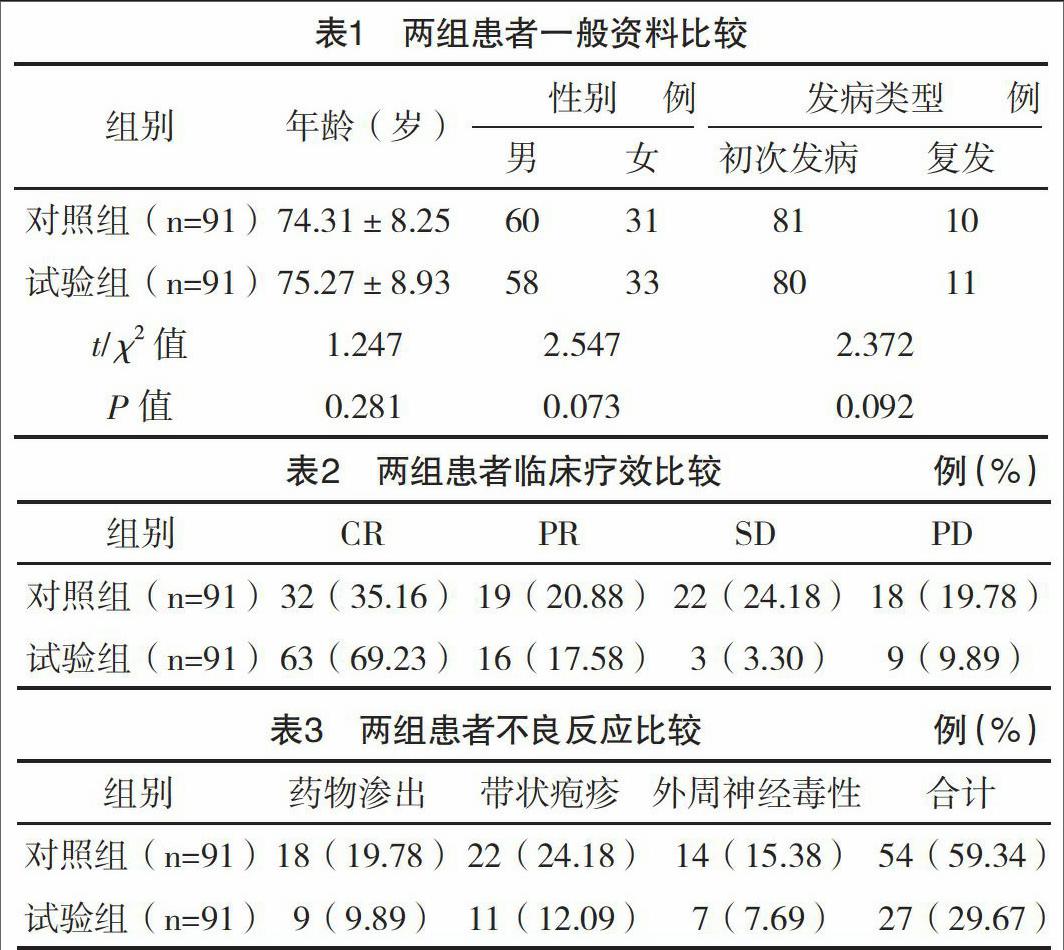
1.1 一般资料 选取2015年1月-2016年5月本院收治的非霍奇金淋巴瘤患者182例作为研究对象,对所有患者进行病理类型分类,包括T细胞性14例,黏膜相关淋巴组织性37例,弥漫大B细胞性伴T细胞表达41例,弥漫大B细胞性90例。所有患者白细胞和血小板计数均正常。随机将其分为对照组91例和试验组91例,两组平均年龄、性别及发病类型比较差异均无统计学意义(P<0.05),具有可比性,见表1。所有患者均对本研究知情并已签署知情同意书。
1.2 方法 在两组患者进行用药治疗前观察患者的口腔、皮肤等清洁情况,确定无异常后试验组采用静脉滴注脂质体阿霉素(先灵葆雅公司)进行治疗,注射液为盐酸多柔比星脂质体,剂量为20 mg/(m2·次),2~3次/周;对照组采用阿霉素治疗。进行静脉滴注时对患者进行心电监测,观察其血压等情况。
1.3 疗效判定标准 两组患者均于治疗6周后采用国际抗癌联盟疗效判断标准对疗效进行评定,分为完全缓解、部分缓解、稳定、进展4个分级,(1)完全缓解(CR):所有淋巴结及肿块缩小至正常,影像学可发现的疾病及与疾病相关的症状、生化异常全部消失;(2)部分缓解(PR):淋巴结肿块SPD缩小≥50%,其他部位淋巴结不增大,无新病灶;(3)稳定(SD):缩小未达PR,但不是进展;(4)进展(PD):任何治疗前明确异常的淋巴结在PR或无效时的SPD最小值基础上增加≥50%[5]。总有效率=(CR例数+PR例数)/总例数×100%。
1.4 不良反应的护理情况 (1)药物渗出:针对患者的渗出部位进行封闭处理,处理时采用盐酸利多卡因,封闭处理后对处理部位进行冷敷,后用硫酸镁进行湿敷。根据患者渗出的具体情况进行穿刺,进而稀释渗出药物。(2)带状疱疹:采用静脉滴注阿昔洛韦的方式进行抗病毒治疗,剂量为0.5 g/次,2~3次/d,期间根据患者不良反应的严重程度区别性使用阿昔洛韦软膏进行局部外涂,同时医护人员提醒患者切勿对病症部位抓挠以防感染。
1.5 统计学处理 使用SPSS 19.0软件对所得数据进行统计学分析,计量资料以(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较 试验组的总有效率为86.81%(79/91),明显高于对照组的总有效率56.04%(51/91),差异有统计学意义( 字2=4.876,P=0.032),见表2。
2.2 两组患者不良反应比较 不良反应方面:对照组患者在治疗过程中共有54例(59.34%)患者出现不良反应症状,试验组治疗过程中共有27例(29.67%)患者出现不良反应症状,试验组的不良反应出现率明显低于对照组,差异有统计学意义( 字2=7.832,P=0.007),见表3。
3 讨论
非霍奇金淋巴瘤在老年人群中的发病率较高,且由于老年人群身体机能退化等因素,该类病发人群的治疗风险较大[6-8]。因此寻找具有较好临床疗效且无明显副作用的治疗非霍奇金淋巴瘤的药物具有重要意义。本研究通过记录脂质体阿霉素和阿霉素两种药物在治疗非霍奇金淋巴瘤中的疗效及引起的不良反应,发现该药物具有较高的临床疗效及较好的安全性。
本研究结果表明,试验组总有效率为86.81%(79/91),明显高于对照组的56.04%(51/91),比较差异有统计学意义(P<0.05),可以看出脂质体阿霉素具有较好的临床疗效。分析其原因,研究表明脂质体阿霉素是一种新型的化疗药物,其具有较好的抗癌靶向性,改进了游离类的阿霉素药物会对心脏产生较大毒性的缺陷,且对癌症的治疗效果得以保留,进而药物可以直接作用于患者的肿瘤部位,其药性得到了较为充分且及时的发挥,因此治疗效果得以增强[9-14];其次,在不良反应方面:对照组在治疗过程中共有54例(59.34%)患者出现不良反应症状,试验组治疗过程中共有27例(29.67%)患者出现不良反应症状,说明脂质体阿霉素与阿霉素相比具有较高的安全性,原因首先可能是脂质体阿霉素在进入人机体后的释放速度较阿霉素更为缓慢,起半衰期约为50~70 h,并且可以透过血睾屏障和血脑屏障,减少药物渗出;其次,血浆中的93%以上的阿霉素以脂质体的形式存在,因此脂质体阿霉素对肌体正常的组织(皮肤毛囊组织、心肌细胞等)的不良反应较少,这一理论与本研究结果一致。有研究表明,采取以脂质体阿霉素为基础,行R-CHOP的治疗方案对非霍奇金淋巴瘤患者进行治疗时,所有接受治疗的患者中有53%的治疗效果为完全缓解,31%部分缓解,总有效率高达84%,且该研究中仅有1例患者出现了WHOⅡ级的毒副作用,无Ⅲ~Ⅳ级的毒副作用出现[15-16]。本研究中部分患者出现贫血、白细胞及血小板数量减少及其他不良反应,在对出现不良反应的患者进行对症治疗后,病症均得以控制,说明对患者而言,脂质体阿霉素的毒副作用是可以耐受的,且本研究中药物治疗的总有效率为86.81%,与文献[17-20]研究结果一致。
综上所述,脂质体阿霉素在非霍奇金淋巴瘤的治疗中具有较好的临床疗效,患者不良反应发生率较低,安全性较好。
参考文献
[1]马军,朱军,石远凯,等.脂质体阿霉素治疗恶性淋巴瘤及多发性骨髓瘤的中国专家共识[J].中国肿瘤临床,2014,41(24):1550-1555.
[2]刘俊茹,李娟,陈媚,等.硼替佐米+脂质体阿霉素+地塞米松方案治疗多发性骨髓瘤临床观察[J].实用医院临床杂志,2011,8(4):18-21.
[3]郭智,陈惠仁,杨凯,等.脂质体阿霉素联合COP化疗方案治疗骨原发性淋巴瘤的临床研究[J].中国医药,2015,10(9):1330-1332.
[4]薛丽霞,晋利华.脂质体阿霉素逆转肿瘤多药耐药的活性和机制研究[J].中国基层医药,2012,19(10):1476-1477.
[5] Orlowski R Z,Voorhees P M,Garcia R A,et al.Phase I trial ofthe proteasome inhibitor bortezomib and pegyLated liposomal doxorubi-ein in patients with advanced hematologic malignancies[J].Blood,2005,105(8):3058-3065.
[6]张玉山,平娟,张永州,等.阿霉素脂质体的制备及其体外抗肿瘤活性的初步研究[J].现代生物医学进展,2014,14(26):5054-5057.
[7]李飞阳,崔纯莹,王玉记,等.阿霉素脂质体的制备及抗肿瘤活性研究[J].首都医科大学学报,2015,35(2):157-160.
[8]贾晋斌,韦青燕.阿霉素脂质体的研究进展[J].中国肿瘤,2011,20(5):372-377.
[9]刘青青,王振光,王楠,等.非霍奇金淋巴瘤与广泛淋巴结转移癌的18F-FDG PET/CT淋巴结影像特征比较[J].中华核医学与分子影像杂志,2016,36(2):142-145.
[10]杜建伟,魏旭东.非霍奇金淋巴瘤治疗现状[J].临床荟萃,2015,30(10):1110-1119.
[11]陈昌海.癌性抑制因子在非霍奇金淋巴瘤肝转移组织中的表达及其临床意义[J].检验医学与临床,2016,16(3):307-308.
[12]杨磊,王景文,宁丰,等.非霍奇金淋巴瘤患者外周血CD4+ CD25 high Treg细胞的变化及临床意义[J].癌症进展,2011,8(5):569-572.
[13] Visani G,Guiducci B,D Adamo F,et al.Cyclophosphamide,pegylated liposome doxorubicin,vincristine and prednisone(GDOP) plusrituximab is effective and well tolerated in poor performancestatus elderly patients with Non-Hodgkin lymphoma[J].Leukemia lymphoma,2005,46(3):477-479.
[14]张静敏,马捷,石群立,等.同时性双原发非霍奇金淋巴瘤合并上皮性癌五例临床病理分析[J].中华肿瘤防治杂志,2011,18(14):1127-1130.
[15]马燕,赵建美.P27 kip1、Jab1、Skp2的生物学功能及其与非霍奇金淋巴瘤发生、发展关系的研究进展[J].山东医药,2015,58(28):108-110.
[16]王雅琦,王美鉴,邱志敏,等.P-糖蛋白在非霍奇金淋巴瘤组织中的表达及意义[J].实用癌症杂志,2012,27(6):583-585.
[17] Illidge T,Specht L,Yahalom J,et al.Modern radiation therapy for nodal non-hodgkin lymphoma-target definition and dose guidelines from the international lymphoma radiation oncology group[J].Int J Radiat Oncol Biol Phys,2014,89(1):49-58.
[18] Strobbe L,Van der Schans,S A,Heijker S,et al.Evaluation of a panel of expert pathologists:review of the diagnosis and histological classification of Hodgkin and non-Hodgkin lymphomas in a population-based cancer registry[J].Leukemia and lymphoma,2014,55(5):1018-1022.
[19] Hagemeister F B,Rodriguez M A,Deitcher S R,et al.Long term results of a phase 2 study of vincristine sulfate liposome injection(Marqibo) substituted for non-liposomal vincristine in
cyclophosphamide,doxorubicin,vincristine,prednisone with or without rituximab for patients with untreated aggressive non-Hodgkin lymphomas[J].Blood,2013,122(21):3033.
[20] Deng Z,Yan F,Jin Q,et al.Reversal of multidrug resistance phenotype in human breast cancer cells using doxorubicin-liposome-microbubble complexes assisted by ultrasound[J].
J Control Release,2014,174(1):109-116.
(收稿日期:2016-08-02) (本文编辑:李颖)

